吗啡对P2Y12受体拮抗剂药代及药效动力学的影响
2017-07-25张严娇李慕鹏阳勇龙陈小平
张严娇,李慕鹏,阳勇龙,陈小平
(1. 中南大学湘雅医院临床药理研究所,湖南 长沙 410008; 2.中南大学临床药理研究所,遗传药理学湖南省重点实验室,湖南 长沙 410078; 3.中南大学湘雅医学院附属海口医院药学部,海南 海口 570311)
吗啡对P2Y12受体拮抗剂药代及药效动力学的影响
张严娇1,2,李慕鹏1,2,阳勇龙3,陈小平1,2
(1. 中南大学湘雅医院临床药理研究所,湖南 长沙 410008; 2.中南大学临床药理研究所,遗传药理学湖南省重点实验室,湖南 长沙 410078; 3.中南大学湘雅医学院附属海口医院药学部,海南 海口 570311)
吗啡联合P2Y12受体拮抗剂常用于急性心肌梗死患者的治疗。P2Y12受体拮抗剂能快速、强效抑制血小板活性,并降低再发栓塞风险,吗啡为心绞痛治疗的常规用药。既往有研究指出,吗啡能降低急性冠脉综合征患者氯吡格雷的血药浓度、减弱其抗血小板作用,并可能导致较差的预后。基于健康受试者和急性心肌梗死患者的随机试验也证实,吗啡与新型P2Y12受体拮抗剂替格瑞洛与普拉格雷同样存在类似的药物相互作用。尽管心肌梗死患者的治疗中仍存在吗啡合用P2Y12受体拮抗剂,然而,目前综述两药物相互作用的报道较少。因此,该文基于既往实验性、观察性和随机临床研究,概述吗啡与P2Y12受体拮抗剂之间的药物相互作用。
吗啡;P2Y12受体拮抗剂;氯吡格雷;替格瑞洛;普拉格雷;药物相互作用
急性冠状动脉综合征(acute coronary syndrome,ACS)包括不稳定型心绞痛(unstable angina, UA)、非ST段抬高型心肌梗死(non-ST elevation myocardial infarction, NSTEMI)和ST段抬高心肌梗死(ST elevation myocardial infarction, STEMI),其病理基础是动脉粥样硬化斑块破裂或侵蚀,引发血小板活化与聚集,形成血栓。血小板在ACS血栓形成中起关键作用。P2Y12受体拮抗剂联用阿司匹林的双联疗法是ACS治疗的主要策略。氯吡格雷作为常用的P2Y12受体拮抗剂,其疗效存在较大个体差异,约30%的患者在接受常规剂量的氯吡格雷治疗后,血小板仍未得到有效抑制。因此,最新指南推荐更有效的方法是替格瑞洛或普拉格雷用于经皮冠状动脉介入(percutaneous coronary intervention,PCI)术患者的治疗[1]。
吗啡常用于缓解疼痛症状,尽管目前尚无随机对照临床试验评估吗啡在心肌梗死患者中的疗效和安全性,然而,临床指南推荐使用吗啡作为STEMI患者的常用镇痛药物[1]。急性心肌梗死伴有急性肺水肿患者静脉使用吗啡可以缓解疼痛与呼吸困难[2]。由于吗啡可减慢胃肠蠕动,延缓P2Y12受体拮抗剂的吸收,进而减弱其疗效,导致患者不良的预后[3]。因此,指南对于吗啡的推荐仅基于专家共识,而非临床试验证据。本综述基于实验性、观察性和随机临床研究的结果,探讨口服P2Y12受体拮抗剂和吗啡之间的药物相互作用,给予临床用药指导性的建议,以使药物治疗达到更好的效果。
1 吗啡的药理作用及其在ACS患者中的应用
吗啡属于阿片类受体激动剂,通过模拟内源性阿片样活性物质的作用,激活中枢神经阿片受体而产生强大的镇痛作用;此外,吗啡还具有明显的镇静作用[4]。然而,吗啡可兴奋胃肠道平滑肌,提高其张力,使胃蠕动减慢和排空延迟,并抑制消化腺的分泌,降低口服药物的吸收及其血药浓度峰值,进而降低药效,见Fig 1。吗啡可通过降低中枢交感张力,扩张阻力血管及容量血管,引起直立性低血压;可促进内源性组胺释放,抑制血管运动中枢,引起心动过缓。吗啡可抑制呼吸,使体内二氧化碳蓄积,扩张脑血管,进而增高颅内压[5]。因此,吗啡可引起ACS患者呼吸、心率、血液动力学的改变,进而可能影响治疗效果及预后[6]。
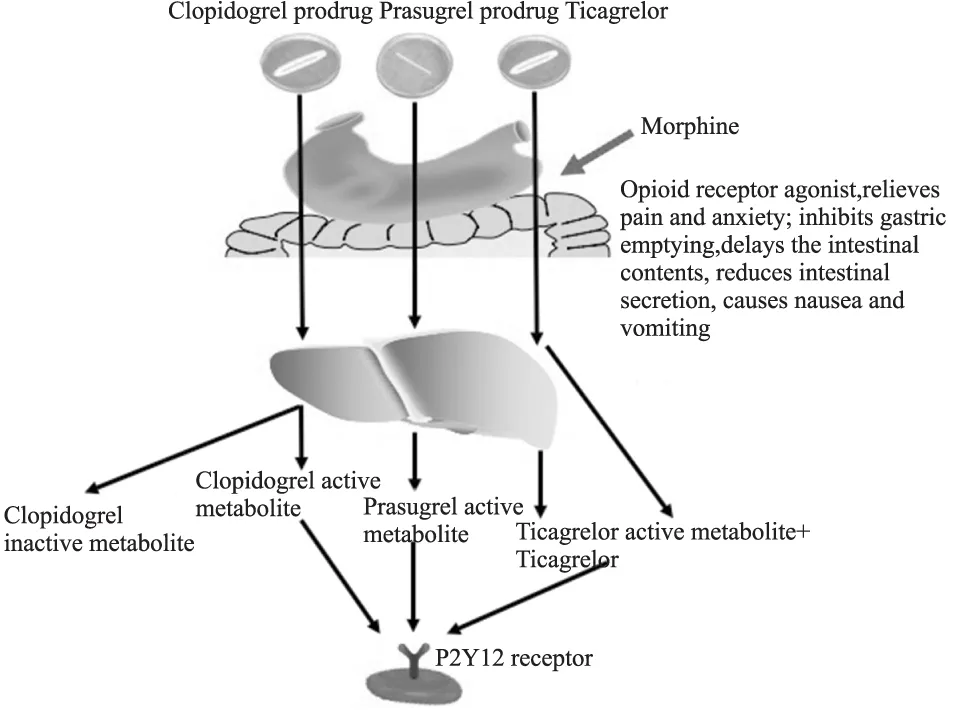
Fig 1 The possible route of interaction between morphine and P2Y12 receptor inhibitors
此外,吗啡具有对抗心肌缺血/再灌注损伤的作用。在一项纳入96例STEMI患者的单中心随机研究中[7],与远端缺血预处理组相比,吗啡注射合并远端缺血预处理组具有较高比率的ST段回落及较低的肌钙蛋白I峰值。吗啡预处理的心脏保护作用可被阿片受体拮抗剂纳洛酮预处理所对抗[8]。CRUSADE研究表明[9],即使在倾向性评分匹配、基线资料校正后,单用吗啡或吗啡合用硝酸甘油的NSTE-ACS患者,死亡率均较高。目前尚无研究确证吗啡可改善心肌梗死患者的临床结局,因此,吗啡对ACS患者短期和长期预后的影响仍然不明确[10]。
2 P2Y12受体拮抗剂的药理作用及其在ACS患者中的应用
P2Y12受体拮抗剂通过抑制血小板P2Y12受体,干扰ADP介导的血小板活化,抑制血小板聚集,用于预防动脉粥样硬化血栓形成事件。按其化学结构可分为噻吩吡啶类和非噻吩吡啶类药物。
2.1 噻吩吡啶类 氯吡格雷是第2代噻吩吡啶类前体药物,需经肝脏细胞色素P450酶代谢形成活性代谢物,导致其起效缓慢,它与P2Y12受体呈不可逆结合而导致血小板功能恢复时间延长,并且存在较大个体差异[11-12]。
普拉格雷是第3代噻吩吡啶类前体药物,同样需经肝药酶代谢转变为活性产物而发挥抗血小板效应。与氯吡格雷相比,普拉格雷的抗血小板作用更快、更持续、更强。TRITON-TIMI 38试验表明,普拉格雷组的主要终点事件 (心源性死亡、非致死性心肌梗死、非致死性脑卒中) 发生率明显低于氯吡格雷组,但致死性出血风险较高[13]。
2.2 非噻吩吡啶类 替格瑞洛为新型的环戊基三唑嘧啶类P2Y12受体拮抗剂。与氯吡格雷相比,替格瑞洛本身为活性药物,无需经肝酶代谢活化,故起效迅速,与P2Y12受体呈可逆性结合,故血小板功能恢复较快。替格瑞洛可明显降低主要终点事件(心血管死亡、心肌梗死或脑卒中)的发生率,但其非CABG 相关的出血高于氯吡格雷,且可能引起呼吸困难、室性心律失常等不良反应[14]。
3 吗啡对氯吡格雷药代及药效动力学的影响
CRUSADE研究中,共纳入57 039例接受氯吡格雷治疗的NSTE-ACS高危患者,其中17 003例患者在住院后24 h内接受吗啡静脉注射治疗[9]。吗啡治疗组的不良心血管事件发生率高于对照组(包括心肌梗死、死亡、死亡或心肌梗死的复合终点);在基线资料校正后,吗啡治疗组不良心血管事件发生风险仍然高于对照组;在倾向评分匹配后,所有亚组的死亡风险均较高。该研究对其可能的原因进行了分析:静脉注射吗啡多用于持续胸痛或充血性心力衰竭的重症患者,吗啡可能仅能减弱心绞痛的疼痛程度,而并未从病理生理机制上阻断心绞痛的发生。此外,吗啡可引起直立性低血压、心动过缓、呼吸抑制,减弱心肌供氧并增加二氧化碳潴留,加剧心肌缺血,最终增加NSTE-ACS的死亡率[9]。
不同亚型的ACS具有类似的病理生理机制,在STEMI患者给予吗啡也会导致不良结局。在一项观察性研究中,De Waha等[15]对STEMI患者的研究表明,与对照组相比,吗啡治疗组的心肌梗死面积较大、微血管阻塞程度较高、心肌挽救指数较低。该发现与CRUSADE研究结果一致,推测阿片类受体制剂可能通过抑制胃排空,延迟氯吡格雷的吸收,并降低其血药峰浓度。
一项基于24例健康志愿者的随机双盲安慰剂对照试验进一步证实了吗啡对氯吡格雷药代及药效动力学的影响。研究发现吗啡可延迟氯吡格雷的达峰时间,降低活性代谢物的峰浓度,使活性代谢物的药时曲线下面积降低34%,延迟血小板聚集抑制率的达峰时间,吗啡注射后1~4 h内的残余血小板聚集率保持较高[16]。一项双盲随机前瞻性的ETAMI研究表明,在31例接受氯吡格雷治疗的STEMI患者中,注射吗啡组氯吡格雷负荷剂量后的血小板反应性指数较对照组高[17]。
然而,也有不一致的报道。Iakobishvili等[18]纳入STEMI患者和NSTE-ACS患者,其中部分接受静脉注射麻醉药(intravenous narcotics,IVNs)治疗。作者发现STE-ACS患者中IVNs治疗组30 d死亡率较对照组低;而NSTE-ACS患者中IVNs治疗组30 d死亡率跟对照组相比,差异无统计意义。据此作者认为静脉注射麻醉剂是安全的,甚至可能是有益的。
这些研究结果表明,吗啡通过影响氯吡格雷的药代动力学进而影响其药效动力学,最终导致不良预后。因此,Hobl等[16]建议尽可能避免吗啡与氯吡格雷合用,如果需要注射吗啡,可以选择更有效的P2Y12拮抗剂(替格瑞洛或普拉格雷),但仍需进一步评估它们与吗啡的药物相互作用。
4 吗啡对普拉格雷/替格瑞洛药代及药效动力学的影响
Parodi等[19]纳入了50例行首次PCI术的STEMI患者,给予180 mg替格瑞洛或60 mg普拉格雷,部分接受吗啡治疗。作者发现吗啡是服药后2 h血小板高反应性的独立预测因素。在随后的研究中,作者发现即使给予360 mg替格瑞洛或常规60 mg的普拉格雷,吗啡仍是服药后1 h血小板高反应性的独立预测因素[20]。作者推测吗啡的延迟效应可能与胃肠道平滑肌活动受抑制引起的呕吐或者药物吸收减少有关,但并未得到证实。
为了证实吗啡是否能延迟普拉格雷或替格瑞洛的起效时间,多项基于STEMI患者的观察性研究对此进行了探讨。其中一项纳入300例行首次PCI术的STEMI患者的研究发现,吗啡是服药后2 h时高残留血小板反应性HRPR(PRU ≥ 208)的独立预测因素,并且这一比率在替格瑞洛或普拉格雷两组间没有差异[21]。这一发现与Zeymer等[17]的结论一致:接受普拉格雷治疗的STEMI患者中,合用吗啡组2 h后的血小板反应指数PRI高于对照组,但这一差异在服药4 h后消失。
最近一项前瞻性随机试验探讨了吗啡对不同负荷剂量的替格瑞洛药代及效动力学的影响。作者发现合用吗啡使替格瑞洛及其活性代谢产物AR-C124910XX的血药浓度达峰延迟;同时,吗啡能增加负荷剂量后2 h的PRU,而并不影响负荷剂量后4~24 h的PRU;VASP测定法观察到同样的结果[22]。
一项多中心随机双盲的ATLANTIC研究纳入了1 862例STEMI患者,比较了行急诊PCI的STEMI患者在救护车与在导管室应用替格瑞洛的有效性与安全性[23]。在救护车给予替格瑞洛且未接受吗啡注射的患者主要终点事件(ST段回落超过70%)明显优于对照组。考虑到该研究有一半患者应用了吗啡,作者推测吗啡可能通过延迟替格瑞洛的吸收,从而影响其疗效[24]。然而,该研究并未阐明吗啡延迟替格瑞洛起效时间的具体机制。另一项ATLANTIC子研究,即PRIVATE-ATLANTIC研究纳入了37例STEMI患者,其中22例在PCI术前接受吗啡注射。作者发现吗啡组PCI术后1 h与6 h的PRI明显高于对照组,这提示吗啡能延迟替格瑞洛的起效时间[24]。
最近一项交叉研究将普拉格雷治疗的STEMI患者随机分配接受5 mg吗啡或生理盐水静脉注射。作者发现负荷剂量后30~120 min吗啡组的血小板活性明显高于生理盐水注射的对照组,普拉格雷血小板抑制的达峰时间也长于对照组。药代动力学参数也表明吗啡能延迟普拉格雷的吸收。因此,静脉注射抗血小板药物可能是降低合并吗啡治疗STEMI患者支架内再栓风险的必要条件[25]。
以上研究均表明吗啡与替格瑞洛或普拉格雷之间存在药物相互作用,这一现象在随后的基于AMI患者的随机药代、药效动力学研究中得到了证实[26-28]。IMPRESSION研究是一项单中心、随机、双盲、安慰剂对照试验[26]。35例AMI患者在180 mg替格瑞洛服用前静脉注射5 mg吗啡,其余35例患者同时注射安慰剂[28]。吗啡使服药后12 h内的替格瑞洛药时曲线下面积降低36%,使AR-C124910XX的药时曲线下面积降低37%;延迟替格瑞洛血浆浓度的达峰时间;降低替格瑞洛的峰浓度。多重回归分析表明,吗啡是AUC0-12降低的独立预测因子。此外,3种血小板活性测定方法均发现吗啡组血小板抑制效果更差。因此,吗啡通过延迟替格瑞洛的吸收、降低替格瑞洛及其活性代谢产物水平,降低替格瑞洛的峰浓度,进而延缓、减弱替格瑞洛的抗血小板作用[28]。对IMPRESSION研究进一步分析表明,吗啡可能并不影响替格瑞洛向AR-C124910XX转化,AR-C124910XX暴露量降低可能由替格瑞洛吸收减少导致[27]。
最近一项基于24例健康受试者随机对照交叉试验证实了IMPRESSION研究的部分结果。研究表明,吗啡注射明显降低替格瑞洛及AR-C124910XX血浆浓度、药时曲线下面积。但是,吗啡并未影响替格瑞洛的抗血小板作用[29]。另一项在健康志愿者中探究吗啡与普拉格雷相互作用的实验显示,吗啡只是降低普拉格雷活性代谢产物的达峰浓度[30]。这两项健康人试验并不能真正评估心肌梗死患者的药物环境以及血小板状态,进而不能完全评判吗啡对P2Y12受体拮抗剂的影响效果。
5 吗啡与P2Y12受体拮抗剂相互作用的临床意义
多个临床试验均证实吗啡与P2Y12受体拮抗剂存在药物相互作用(Tab 1),因此,有必要在急性心肌梗死患者中开展大型随机临床研究。考虑到这种相互作用可能导致不利的临床后果,目前已有研究证实某些措施能降低其不良影响。最近的一项研究根据是否使用吗啡和阿昔单抗,将32例接受60 mg普拉格雷治疗的STEMI患者分为4组,与未接受吗啡/阿昔单抗治疗的患者相比,吗啡组普拉格雷服药后2 h的血小板聚集率明显升高。然而,合用阿昔单抗后,吗啡升高血小板聚集的作用消失。合用吗啡且未合用阿昔单抗组HTPR发生率高达88%,而其他3组HTPR发生率仅有17%~20%。该研究提示在合用吗啡和普拉格雷的STEMI患者中,加用糖蛋白(GP)IIb/IIIa受体抑制剂阿昔单抗能立即、有效地抑制血小板[31]。此外,有必要开展大型随机临床研究以评估克服或减少吗啡负面影响的其他替代策略,例如使用坎格雷洛、合并使用其他糖蛋白IIb/IIIa受体拮抗剂、使用甲氧氯普胺等胃肠动力药、使用破碎的替格瑞洛片或者用短效止痛剂阿芬太尼替代吗啡[31-35]。
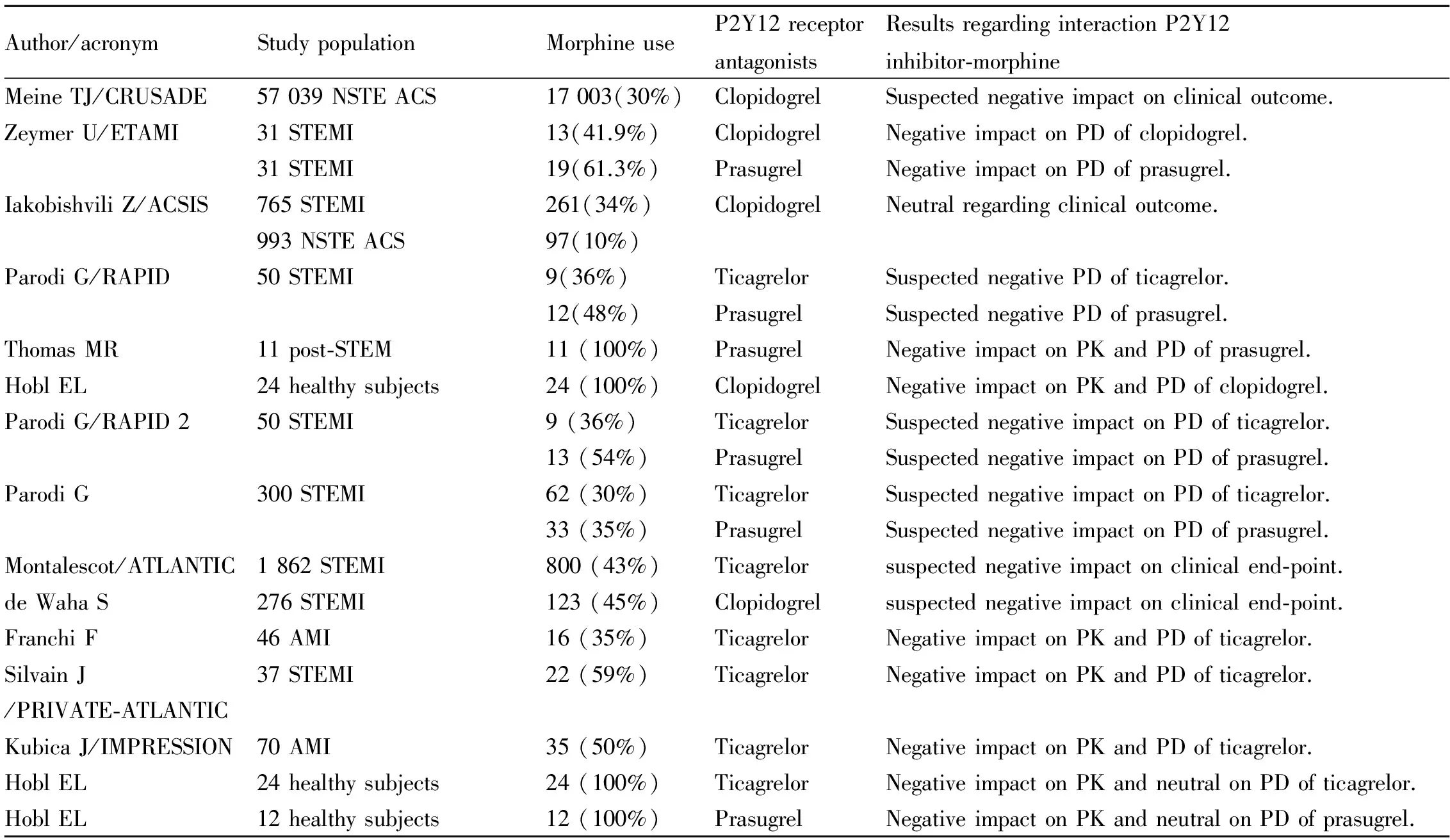
Tab 1 Studies regarding morphine-P2Y12 receptor antagonists’ interaction[9-30]
ACS: acute coronary syndromes; AMI: acute myocardial infarction; NSTE: ACS non-ST elevation acute coronary syndrome; NSTEMI: non-ST elevation myocardial infarction; STEMI: ST elevation myocardial infarction; PK: pharmacokinetics; PD: pharmacodynamics.
6 结语
大量研究已证实吗啡能影响口服P2Y12受体拮抗剂的药代及药效动力学。吗啡可能通过抑制胃肠蠕动,减弱、延缓P2Y12受体拮抗剂的吸收,降低其血药浓度峰值,进而减弱其抗血小板作用,最终影响患者预后,而吗啡的不良反应可能加剧了这种不良影响。尽管吗啡具有不良影响,然而,在具有充分效力的随机对照试验完成之前,还不能建议取消吗啡的常规使用。如必须合用吗啡与P2Y12受体拮抗剂,加用阿昔单抗、促胃肠动力药或者将吗啡更换为其他短效镇痛药,可能会改善吗啡的不良影响;而这些策略是否可行,仍需要进一步的临床试验证据的支持。
[1] Roffi M, Patrono C, Collet J P, et al. 2015 ESC guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation: task force for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation of the European Society of Cardiology (ESC) [J].EurHeartJ, 2016, 37(3): 267-315.
[2] Ellingsrud C, Agewall S. Morphine in the treatment of acute pulmonary oedema--Why[J]?IntJCardiol, 2016, 202(1): 870-3.
[3] Luca A D, Coupar I M. Insights into opioid action in the intestinal tract [J].PharmacolTher, 1996, 69(2): 103-15.
[4] Al-hasani R, Bruchas M R. Molecular mechanisms of opioid receptor-dependent signaling and behavior [J].Anesthesiology, 2011, 115(6): 1363-81.
[5] Sverrisdottir E, Lund T M, Olesen A E, et al. A review of morphine and morphine-6-glucuronide’s pharmacokinetic-pharmacodynamic relationships in experimental and clinical pain [J].EurJPharmSci, 2015, 74(10): 45-62.
[6] Holzer P. Opioid receptors in the gastrointestinal tract [J].RegulPept, 2009, 155(1-3): 11-7.
[7] Rentoukas I, Giannopoulos G, Kaoukis A, et al. Cardioprotective role of remote ischemic periconditioning in primary percutaneous coronary intervention: enhancement by opioid action [J].JACCCardiovascInterv, 2010, 3(1): 49-55.
[8] Shimizu M, Tropak M, Diaz R J, et al. Transient limb ischaemia remotely preconditions through a humoral mechanism acting directly on the myocardium: evidence suggesting cross-species protection [J].ClinSci(Lond), 2009, 117(5): 191-200.
[9] Meine T J, Roe M T, Chen A Y, et al. Association of intravenous morphine use and outcomes in acute coronary syndromes: results from the CRUSADE Quality Improvement Initiative [J].AmHeartJ, 2005, 149(6): 1043-9.
[10] Puymirat E, Lamhaut L, Bonnet N, et al. Correlates of pre-hospital morphine use in ST-elevation myocardial infarction patients and its association with in-hospital outcomes and long-term mortality: the FAST-MI (French Registry of Acute ST-elevation and non-ST-elevation Myocardial Infarction) programme [J].EurHeartJ, 2016, 37(13): 1063-71.
[11] Jiang X L, Samant S, Lesko L J, et al. Clinical pharmacokinetics and pharmacodynamics of clopidogrel [J].ClinPharmacokinet, 2015, 54(2): 147-66.
[12] 范 岚, 张 伟, 周宏灏,等. 抗血小板药物的遗传药理学研究进展[J]. 中国药理学通报, 2010, 26(4): 421-4.
[12] Fan L, Zhang W, Zhou H H, et al. Advancement in the pharmacogenetics of antiplatelet drugs[J].ChinPharmacolBull, 2010, 26(4): 421-4.
[13] Wiviott S D, Desai N, Murphy S A, et al. Efficacy and safety of intensive antiplatelet therapy with prasugrel from TRITON-TIMI 38 in a core clinical cohort defined by worldwide regulatory agencies [J].AmJCardiol, 2011, 108(7): 905-11.
[14] Cannon C P, Harrington R A, James S, et al. Comparison of ticagrelor with clopidogrel in patients with a planned invasive strategy for acute coronary syndromes (PLATO): a randomised double-blind study [J].Lancet, 2010, 375(9711): 283-93.
[15] De Waha S, Eitel I, Desch S, et al. Intravenous morphine administration and reperfusion success in ST-elevation myocardial infarction: insights from cardiac magnetic resonance imaging [J].ClinResCardiol, 2015, 104(9): 727-34.
[16] Hobl E L, Stimpfl T, Ebner J, et al. Morphine decreases clopidogrel concentrations and effects: a randomized, double-blind, placebo-controlled trial [J].JAmCollCardiol, 2014, 63(7): 630-5.
[17] Zeymer U, Mochmann H C, Mark B, et al. Double-blind, randomized, prospective comparison of loading doses of 600 mg clopidogrel versus 60 mg prasugrel in patients with acute ST-segment elevation myocardial infarction scheduled for primary percutaneous intervention: the ETAMI trial (early thienopyridine treatment to improve primary PCI in patients with acute myocardial infarction) [J].JACCCardiovascInterv, 2015, 8(1): 147-54.
[18] Iakobishvili Z, Porter A, Battler A, et al. Effect of narcotic treatment on outcomes of acute coronary syndromes [J].AmJCardiol, 2010, 105(7): 912-6.
[19] Parodi G, Valenti R, Bellandi B, et al. Comparison of prasugrel and ticagrelor loading doses in ST-segment elevation myocardial infarction patients: RAPID (rapid activity of platelet inhibitor drugs) primary PCI study [J].JAmCollCardiol, 2013, 61(15): 1601-6.
[20] Parodi G, Bellandi B, Valenti R, et al. Comparison of double (360 mg) ticagrelor loading dose with standard (60 mg) prasugrel loading dose in ST-elevation myocardial infarction patients: the rapid activity of platelet inhibitor drugs (RAPID) primary PCI 2 study [J].AmHeartJ, 2014, 167(6): 909-14.
[21] Parodi G, Bellandi B, Xanthopoulou I, et al. Morphine is associated with a delayed activity of oral antiplatelet agents in patients with ST-elevation acute myocardial infarction undergoing primary percutaneous coronary intervention [J].CircCardiovascInterv, 2015, 8(1): 1-6.
[22] Franchi F, Rollini F, Cho J R, et al. Impact of morphine on pharmacokinetic and pharmacodynamic profiles of ticagrelor in patients with ST-segment elevation myocardial infarction undergoing primary percutaneous coronary intervention[J].JAmCollCardiol, 2015, 65(10S): A1751.
[23] Montalescot G, van’t Hof A W, Lapostolle F, et al. Prehospital ticagrelor in ST-segment elevation myocardial infarction [J].NEnglJMed, 2014, 371(11): 1016-27.
[24] Silvain J, Storey R F, Cayla G, et al. P2Y12 receptor inhibition and effect of morphine in patients undergoing primary PCI for ST-segment elevation myocardial infarction. The PRIVATE-ATLANTIC study [J].ThrombHaemost, 2016, 116(2): 369-78.
[25] Thomas M R, Morton A C, Hossain R, et al. Morphine delays the onset of action of prasugrel in patients with prior history of ST-elevation myocardial infarction [J].ThrombHaemost, 2016, 116(1): 96-102.
[26] Kubica J, Adamski P, Ostrowska M, et al. Influence of morphine on pharmacokinetics and pharmacodynamics of ticagrelor in patients with acute myocardial infarction (IMPRESSION): study protocol for a randomized controlled trial [J].Trials, 2015, 16: 198.
[27] Adamski P, Ostrowska M, Sroka W D, et al. Does morphine administration affect ticagrelor conversion to its active metabolite in patients with acute myocardial infarction? A sub-analysis of the randomized, double-blind, placebo-controlled IMPRESSION trial [J].FoliaMedicaCopernicana, 2015, 3(3): 100-6
[28] Kubica J, Adamski P, Ostrowska M, et al. Morphine delays and attenuates ticagrelor exposure and action in patients with myocardial infarction: the randomized, double-blind, placebo-controlled IMPRESSION trial [J].EurHeartJ, 2016, 37(3): 245-52.
[29] Hobl E L, Reiter B, Schoergenhofer C, et al. Morphine decreases ticagrelor concentrations but not its antiplatelet effects: a randomized trial in healthy volunteers [J].EurJClinInvest, 2016, 46(1): 7-14.
[30] Hobl E L, Reiter B, Schoergenhofer C, et al. Morphine interaction with prasugrel: a double-blind, cross-over trial in healthy volunteers [J].ClinResCardiol, 2016, 105(4): 349-55.
[31] Siller-matula J M, Specht S, Kubica J, et al. Abciximab as a bridging strategy to overcome morphine-prasugrel interaction in STEMI patients [J].BrJClinPharmacol, 2016, 82(5): 1343-50.
[32] Wang Z Y, Chen M, Zhu L L, et al. Pharmacokinetic drug interactions with clopidogrel: updated review and risk management in combination therapy [J].TherClinRiskManag, 2015, 11: 449-67.
[33] Kubica J, Kozinski M, Navarese E P, et al. Cangrelor: an emerging therapeutic option for patients with coronary artery disease [J].CurrMedResOpin, 2014, 30(5): 813-28.
[34] Parodi G, Xanthopoulou I, Bellandi B, et al. Ticagrelor crushed tablets administration in STEMI patients: the MOJITO study [J].JAmCollCardiol, 2015, 65(5): 511-2.
[35] Flierl U, Zauner F, Sieweke J T, et al. Efficacy of prasugrel administration immediately after percutaneous coronary intervention in ST-elevation myocardial infarction [J].ThrombHaemost, 2017, 117(1): 99-104.
Effect of morphine on pharmacokinetics and pharmacodynamics of P2Y12 receptor antagonists
ZHANG Yan-jiao1,2, LI Mu-peng1,2, YANG Yong-long3, CHEN Xiao-ping1,2
(1.DeptofClinicalPharmacology,XiangyaHospital,CentralSouthUniversity,Changsha410008,China; 2.InstituteofClinicalPharmacology,CentralSouthUniversity,HunanKeyLabofPharmacogenetics,Changsha410078,China; 3.DeptofPharmacy,HaikouPeople'sHospitalandAffiliatedHaikouHospitalofXiangyaMedicalSchool,CentralSouthUniversity,Haikou570311,China)
P2Y12 receptor antagonists and morphine are often recommended in patients with acute myocardial infarction. P2Y12 receptor antagonists can rapidly and potently reduce the platelet activity and prevent future thrombotic events. Meanwhile, combined morphine is used to relieve symptoms of angina. A number of studies have confirmed that morphine can decrease plasma concentrations of clopidogrel and impair its anti-platelet activity, which may lead to poor response in clopidogrel-treated patients with acute coronary syndrome. The randomized trials in healthy volunteers and patients with acute myocardial infarction also confirmed the similar drug-drug interaction between morphine and ticagrelor or prasugrel. Although the P2Y12 receptor antagonists combined with morphine are still used for myocardial infarction patients, there are few report on the objective evaluation of this drug interaction. This review, based on the findings of experimental as well as observational and randomized clinical studies, summarizes completely the drug interactions between oral P2Y12 receptor antagonists and morphine.
morphine; P2Y12 receptor antagonists; clopidogrel; ticagrelor; prasugrel; drug interaction
2017-05-15,
2017-06-10
国家科技部“重大新药创制”科技重大专项资助项目(No 2013ZX09509107);国家自然科学基金资助项目(No 81373489,81422052,81403018);湖南省杰出青年基金资助项目(No 13JJ1010)
张严娇(1991-),女,硕士生,研究方向:药物基因组学与个体化医学,E-mail:zhangyj287112687@163.com; 陈小平(1974-),女,博士,研究员,博士生导师,研究方向:药物基因组学与个体化医学,通讯作者,E-mail:chenxp74@hotmail.com
时间:2017-7-7 11:04 网络出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20170707.1104.004.html
10.3969/j.issn.1001-1978.2017.08.002
A
1001-1978(2017)08-1041-05
R392.11;R542.22;R969.2;R971.2;R973
