基于质量风险管理的生物制药工艺验证策略
2017-07-20丁满生代虎
丁满生+代虎


摘 要 目的:根据美国、欧盟等药品监管部门以及ICH提出的基于生命周期的工艺验证方法,将风险管理运用到整个工艺验证的生命周期。方法:本文采用风险管理的方法对工艺设计阶段、工艺确认阶段以及持续工艺验证阶段进行了探讨。结果:证明基于风险的工艺开发和验证合并将产生更可靠、更持续可行的工艺,从而确保持续稳定地生产出符合预定用途和注册要求的药品。结论:通过符合更好的工艺实践,生物制药将进一步推动制药行业的发展。
关键词 风险管理 工艺验证 生物制药
中图分类号:TQ460.63 文献标识码:C 文章编号:1006-1533(2017)13-0048-04
A risk-based approach for biopharmaceutical process validation
DING Mansheng, DAI Hu*
(Shanghai Benemae Pharmaceutical Corporation, Shanghai 201321, China)
ABSTRACT Objective: Risk management can be applied throughout the process validation cycle according to a riskbased approach for the life cycle of process validation established by drug regulatory departments in the United States, the European Union and ICH. Methods: The methods for risk management used in process design, process qualification, as well as continuous process verification are discussed in this article. Results: The combination of the process development and validation based on the risk will be confirmed to produce more reliable, sustainable and feasible process to ensure stable production of drugs in line with the intended use and drug registration requirements. Conclusion: Biological pharmaceutical will further promote the development of the pharmaceutical industry by better process practice.
KEY WORDS risk management; process validation; biopharmaceutical
生產工艺应通过科学严谨的方法进行验证,并且要通过良好的记录来证明所使用的工艺和设备能够始终如一地生产出满足其质量标准要求的可靠产品[1]。在FDA公布的工艺验证指导原则(1987年)中,工艺验证现在被看作是一个连续的活动,而不是进行一次性的活动,以确保生产工艺始终在其合格的设计空间范围内生产质量符合的产品。 因此必须采取持续的生命周期方法来开展工艺验证,这种转变满足生产工艺持续改进的需要,符合质量源于设计(QbD)的原则[2-6]。在FDA的工艺验证指南(2011年)中是将整个产品生命周期的生产工艺验证分为三个阶段:工艺设计、工艺性能确认和持续工艺确认。
生物制药因为工艺过程中使用了生物细胞和生物性原材料,引入了大量的外源性生物杂质,这就需要去除杂质和污染物,包括内毒素、病毒、细胞膜、核酸、蛋白质、培养基成分、中间体,从层析介质脱离的配体,以及产品的修饰物、聚合物和其它非活性物质。因此生物制药的工艺过程的复杂性和不确定性较传统化学制药更为艰巨,这就需要有一个好的工具或方法进行过程分析,以识别工艺过程中的风险因素,并予以采取有效措施进行控制[7]。
基于这个现实,在生物制药工艺验证开展有效的质量风险管理能够降低这种风险发生。质量风险管理包括风险控制、风险评审和风险评估,其中风险评估是工艺验证的关键。风险评估将分析工艺中使用的所有物料的来源和质量的信息,以及评估工艺中使用的每一种物料或操作对最终产品的质量、功效和安全的影响。同时风险评估运用到整个产品生命周期,从工艺设计开始,到持续的商业化生产操作[8-10]。
1 质量风险管理的开展
风险评估方法最初用在确定产品的关键质量属性(CQAs),包括风险排序和初步危害分析(PHA)。这些在单克隆抗体(A-Mab)生物工艺研发案例(2009年)中已有阐明[11],包括在验证中结合QbD和生命周期的方法。其它风险评估方法包括工艺风险评估(PRA),失效模式影响分析(FMEA),故障模式危害性分析(FMECA)和危害分析与关键控制点(HACCP)。
随着产品工艺的成熟化和更多的工艺知识的累积,风险评估和风险分析将更加充分,将有助于判断更微小的生产工艺变化对产品质量带来的潜在影响。 例如,针对重组蛋白的糖基化过程,糖基化的程度与细胞代谢和代谢通量的效率相关。考虑到糖基化的程度对生物制药产品的药代动力学,疗效和免疫原性有显著的影响,因此,评估生物反应器的工艺参数和任何可能影响产品糖基化因素的风险是相当重要的。
原材料、工艺设备和生产工艺对生物制药产品质量的潜在风险也应该是评估的一部分。应当确定这些风险的关键性程度,同时采取方法或策略用于消除、减轻或控制这些风险。
按照QbD的质量风险管理思路,不可能只是通过最终产品的测试来实现产品质量保证。应采用适当的风险评估来识别产品的CQAs,在工艺开发和早期生产阶段进行确认,并在产品的整个生命周期中仔细控制和监测影响这些CQAs的CPPs。进一步通过建立产品的CQAs,定义与CQAs关联的每步工艺的设计空间和CPPs的可接受范围,并在生产中控制这些CPPs。只要在设计空间的参数范围内,允许对生产工艺进行优化或改变,同时内可以不需要重新进行生产工艺验证。
在进行初步的风险评估时,可以采用石川或鱼骨图,这个工具可以用来识别一个事件发生所有可能的原因。这种分析在评估不同的工艺参数对工艺性能的影响非常有帮助。在A-Mab案例(2009年)研究提到[11],鱼骨图是用来识别可能对单克隆抗体产品的质量构成重大风险的因素,包括设备设计、控制参数、工艺条件,及产品生物反应器及其种子反应器所用的起始物料等等。这种分析,有助于评估每个工艺参数对产品产量和细胞存活率的潜在影响(图1)。同时它还决定了目的产品中可溶性聚合物含量,变异的糖基化、脱酰胺程度,以及宿主细胞蛋白或DNA的残留值。
2 基于生命周期的工艺验证
随着设计和质量风险管理观念的引入,工艺验证已经从传统定期开展转变到采取生命周期的方法,以促进工艺的持续改进。
FDA的工艺验证指南(2011年)指出,传统的工艺验证通常是开展连续三个批次的验证活动,而开展生命周期的方法,将采用更加科学有序的计划对产品上市后的活动进行持续监测[4]。
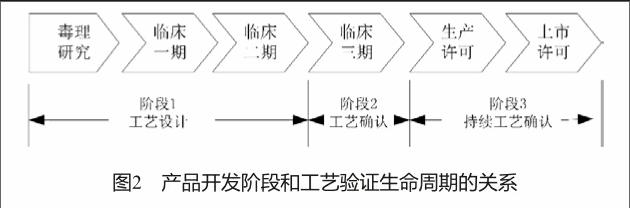
生物制药产品的临床开发和商业化的各个阶段之间的关系和工艺验证(工艺设计,工艺确认和持续工艺确认)的三个阶段如图2所示。在产品临床开发过程中,应增大对产品的安全性和有效性的知识及对其生产工艺的知识的掌握。
产品的生产工艺、CPPs和CQAs最早在验证过程阶段1和2中确定,在阶段3中需持续监控和验证,并且这种持续的工艺验证的要求体现在整个产品的商业生命周期中。
2.1 阶段1—工艺设计
包括生产工艺的开发和确定,然后扩大到商业水平。在阶段1工艺设计活动中,应识别产品CQAs和定义生产过程的关键和重要的工艺参数[12]。通常许多工艺设计和工艺开发工作可以采用按比例缩小的工艺模型和高通量的开发技术来完成。FDA建议使用统计方法设计实验来研究不同工艺参数的相互作用,例如使用多变量参数实验[4]。表1展示了工艺设计过程中通常执行的典型活动及需交付的资料。
2.2 阶段2—工艺确认
包括了很多针对工艺点进行控制的方法,与阶段1的主要区别是设定了接受标准来满足产品的注册要求,并包含了对阶段1中工艺设计的评价,以确保在常规的商业生产中,生产工艺能够可靠地生产符合所有放行标准的产品。阶段2工艺确认中定义的放大生产工艺是指在商业化生产工厂,由经过培训的人员采用预先确认的设备在符合cGMP条件下有计划地进行运行。
在工艺确认之前,表2列出必须完成的一系列相关活动(I~IV),以确保工艺确认的成功。这些活动包括中控和放行检测方法的验证、生产工艺的放大以及相关设备确认和工艺验证。工艺确认中的每一批生物制药产品使用经过验证的中控检测和成品检测方法,来证明工艺的每个CPP在预先批准的范围内,并且产品符合预定标准和内控接收标准。
2.3 阶段3—持续工艺验证
在阶段1和2完成后,应使用经验证合格的工艺检验方法对产品进行生产和检测,以保证生产工艺可控且产品持续满足所有CQAs。在阶段3进行的持续工艺验证是监视整个产品生命周期的工艺,表明生产工艺的持续可控,其策略应取决于在阶段2收集的信息,并根据收集日常的生产数据来设定合适的警戒限和行动限。持续工艺验证策略根据工艺有所不同,但一般包含额外的过程采样和除批记录以外的参数监测。
由于生物制药产品的生产批次在工艺确认完成时(阶段2)可能是很少的,因此要考虑到在商业化初期日常生产中所需要的取样和中控检测的数量可能要比商业化后期大。收集的数据应足以充分统计证明所有的CPPs都在可接受的范围,且CQAs没有出现不利的趋势。一旦有足够的数据,并通过统计学进行分析确认过程可控,那么相应的监测程序可作相应调整,一些常规测试可能会被取消或调整。同样相比监管部门过去简单地追求产品年度质量回顾更为严格。但如果工艺已经比较稳定且有适当的理由,一些在持续工艺验证过程中进行的額外检验和工艺监控可能会被停止。
3 举例
在A-Mab案例(2009年)同样提供了风险评估在工艺验证策略的有效应用。在工艺设计阶段,QbD的关键要素和新工艺的验证标准是就是针对CQAs和CPPS,这些可以在工艺设计的早期阶段通过最初的风险分析来识别,除此之外需要增加的CPPs可以在产品生命周期的任何时间通过连续工艺监控来识别。在工艺确认阶段,为每个工艺参数建立二个叠加控制范围的相关性,最广的是可接受范围(PAR),在此范围内所生产的产品始终符合其预期放行标准和关键质量属性。超出此范围,工艺将失败,产品可能无法满足其所需的关键质量属性,PAR范围是法规监管和需要验证的范围,需要开展验证测试,并且通过产品注册申请。其次是正常的操作范围,体现在主批记录中规定的参数范围,同样属于需要接受法规监管。在持续工艺验证阶段,确认商业化生产收集的数据应足以提供强有力的统计证据,确保所有的CPPs都在可接受的范围,且没有趋势表明CQAs朝着OOT方向发展,保证产品在生命周期内的质量、安全和有效。
4 结语
目前越来越多的新的生产技术平台和产品出现,特别是单克隆抗体生产,高通量自动化技术加快了高产、可靠、稳健工艺的发展。同时随着生物制药分析方法的持续进展,包括在线监控过程分析技术的发展和实施,提高和促进了工艺确认和持续工艺验证的进行[13-15]。
在未来一段时间内,随着验证从传统的针对工艺点的验证到基于产品生命周期方法的转变,QbD和工艺验证的两个概念将越来越有机结合,验证的方式可能随着监管部门确定的新举措的要求而更加灵活。然而,从长远来看,将科学的基于风险的工艺开发和验证合并将产生更可靠、更持续可行的工艺,减少了工艺失败和关键药物的潜在短缺的风险。最终通过符合更好的工艺实践,生物制药将进一步推动制药行业的发展,为世界各地的患者带来福音。
参考文献
[1] FDA. Guideline on General Principles of Process Validation[EB/OL]. (1987-05-01). htpp://www.fda-consultant. com/provalid.html.
[2] FDA. Pharmaceutical CGMPs for the 21st Century-A RiskBased Approach: Final Report[EB/OL]. (2004-09-01). htpp:// www.fda.gov/downloads/Drugs/Development Approval Process/Manufacturing/Questions and Answer Current Good Manufacturing Practices cGMP for Drugs/ UCM176374.pdf.
[3] ICH. ICH Harmonised Tripartite Guideline Q9 Quality Risk Management[EB/OL]. (2005-11-09). www.ich.org/fileadmin/ Public_Web_Site/ ICH_Products/Guidelines/Quality/Q9/ Step4/Q9_Guideline.pdf.
[4] FDA. Guidance for Industry. Process Validation: General Principles and Practices Revision1[EB/OL]. (2011-01-24). www.fda.gov/downloads/Drugs/Guidances/UCM070336.pdf.
[5] EMA. Guideline on Process Validation[EB/OL]. (2012-03-29). www.ema.europa.eu/ema/pages/includes/document/ open_document.jsp?webContentId=WC500125399.
[6] 中華人民共和国卫生部. 药品生产质量管理规范[EB/OL].(2011-02-12). http://www.sfda.gov.cn/WS01/CL0053/58500. html.
[7] 何国强. 制药流体工艺实施手册[M]. 北京: 化学工业出版社, 2013: 297-324.
[8] 黄雪, 梁毅. 风险管理在药品生产工艺验证中的应用[J].现代制造, 2016(11): 10-13.
[9] 贾晓燕, 祁飞. 浅析工艺验证中的持续工艺确认执行策略[J]. 现代制造, 2016(32): 12-14.
[10] 顾飞军. 药品研发阶段的工艺验证[J]. 中国医药工业杂志, 2012, 43(6): 509-512.
[11] CMC Bio Working Group. A-Mab: A case study in bioprocess development version 2.1 [EB/OL]. (2009-10-30). www.ispe. org/pqli/a-mab-case-study-version-2.1.
[12] Nosal R, Shultz T. PQLI definition of criticality[J]. J Pharm Innov, 2008, 3(2): 69-78.
[13] Zhu QL, Liu S, Gao P, et al. High-throughput sequencing technology and its application[J]. J Northeast Agr U, 2014, 21(3): 84-96.
[14] Rameez S, Mostafa SS, Miller C, et al. High-throughput miniaturized bioreactors for cell culture process development: reproducibility, scalability, and control[J]. Biotechnol Prog, 2014, 30(3): 718-727.
[15] Bhambure R, Kumar K, Rathore AS. High-throughput process development for biopharmaceutical drug substances[J]. Trends Biotechnol, 2011, 29(3): 127-135.
