苯并芘激活ERK1/2信号通路促进气道平滑肌细胞外基质蛋白沉积对气道重塑的影响
2017-07-18袁雅璐程远雄赖文岩蔡开灿
袁雅璐,程远雄△,曹 静,赖文岩,蔡开灿
(南方医科大学南方医院:1.呼吸科;2.心血管内科;3.心胸外科,广州 510515)
论著·基础研究
苯并芘激活ERK1/2信号通路促进气道平滑肌细胞外基质蛋白沉积对气道重塑的影响
袁雅璐1,程远雄1△,曹 静1,赖文岩2,蔡开灿3
(南方医科大学南方医院:1.呼吸科;2.心血管内科;3.心胸外科,广州 510515)
目的 探讨苯并芘对人气道平滑肌细胞(HASMC)细胞外基质(ECM)蛋白沉积的影响及相关通路机制。方法 原代培养HASMC,将2~6代细胞用于实验。用实时荧光定量PCR和Western Blot法分别检测ECM的基因及蛋白的表达量;用Western Blot法分析ERK1/2的磷酸化水平。结果 苯并芘可以诱导HASMC胶原蛋白Ⅰα1(P<0.01)及ECM蛋白(包括胶原蛋白Ⅰα1、多功能蛋白聚糖、纤连蛋白、层粘连蛋白α2)mRNA表达增加(P<0.05)。苯并芘可引起ERK1/2磷酸化水平快速增高(P<0.01);ERK通路抑制剂PD98059能显著抑制苯并芘诱导的胶原蛋白Ⅰα1(P<0.01)及ECM蛋白(包括胶原蛋白Ⅰα1、纤连蛋白、多功能蛋白聚糖、层粘连蛋白α2)mRNA表达增加(P<0.01)。结论 苯并芘通过激活ERK1/2通路诱导HASMC中ECM蛋白沉积,阻断ERK1/2信号通路可以抑制苯并芘诱导的气道重塑。
肌细胞,平滑肌;细胞外基质;苯并芘;ERK信号通路;气道重塑
近几年来,我国多个地区都曾遭受雾霾天气的危害,细颗粒物(PM2.5)作为大气污染物的主要来源已成为各领域专家学者们的研究热点。已有多篇临床研究表明,PM2.5及生物燃料烟雾的暴露会增加多种慢性气道疾病如慢性阻塞性肺疾病(COPD)、支气管哮喘等的危险性[1-3]。
目前全球共有3亿余名COPD患者,流行病学数据表明COPD排在全球死因第4位,并将在2030年上升到第3位[4]。COPD 是一种以持续性、进行性发展的气流受限为特征的慢性气道疾病,患者病情的反复和病程的进展与长期暴露于香烟烟雾及有害颗粒物环境中相关。气道重塑是多种慢性炎症性气道疾病的重要病理特征,在COPD患者中其主要表现为上皮细胞增生、黏液腺增生、气道壁细胞外基质(ECM)组分及数量的改变及血管增生等[5]。研究表明ECM的过度沉积在COPD患者病程末期气道壁的纤维化中占有重要地位[6-7]。人气道平滑肌细胞(HASMC)可通过表达和分泌不同类型的ECM蛋白,调节细胞外基质蛋白的动态平衡。因此,研究HASMC分泌ECM蛋白的机制,对控制气道重塑,延缓COPD病程而言具有十分重要的意义。
苯并芘是一种多环芳烃化合物,人类每天都会通过各种途径比如吸烟,接触污染的空气、食物及水源等摄入一定量的苯并芘。苯并芘除了其备受关注的致癌毒性作用外,新近研究表明其在肺部炎症和损伤性疾病进程中同样发挥作用[8]。因此,本文将探讨PM2.5和香烟烟雾中的代表成分苯并芘在气道平滑肌细胞ECM蛋白沉积中的作用,明确经典的ERK信号通路是否是其下游调节通路,为进一步研究大气污染对COPD的影响提供实验依据,为气道重塑的防治提供新的可能。
1 材料与方法
1.1 材料 胎牛血清(Gibco)、DMEM(Hyclone)、PBS(Hyclone)、胰蛋白酶(Gibco);苯并芘(Aladdin)、TGF-β1(Prospec);PD98059(Sigma-Aldrich)、BCA100蛋白定量试剂盒和全蛋白提取试剂盒(上海碧云天生物技术研究所);Trizol(Sigma-Aldrich)、反转录试剂盒(TOYOBO)、SYBR®Premix Ex TaqTM及PrimeScript®RtreagentKit(TOYOBO);小鼠抗平滑肌肌动蛋白(α-SMA)(上海碧云天生物技术研究所)、小鼠抗GAPDH抗体(北京博奥森生物技术有限公司)、兔抗胶原蛋白Ⅰα1(北京博奥森生物技术有限公司)、兔抗ERK1/2(CST)、兔抗p-ERK1/2(CST)、FITC-山羊抗小鼠(上海碧云天生物技术研究所)、山羊抗兔、小鼠IgG-HRP二抗(上海碧云天生物技术研究所);DAPI(Sigma-Aldrich);ECL化学发光染色液(Merck Millipore)。
1.2 方法
1.2.1 原代人气道平滑肌细胞的培养与鉴定 采用组织块贴壁法原代培养HASMC,具体方法同本课题组已发表文献[9-10]。实验前征得患者及其家属同意签署知情同意书后,取南方医院胸外科肺叶切除术手术标本,于超净台中分离叶、段支气管中膜平滑肌层,在青霉素小瓶中剪成约1 mm3大小,吸取组织转移至含20%FBS的完全培养基中,均匀分散尽可能布满培养瓶瓶底,置于37 ℃、5% CO2孵箱中培养。每3~5天换液,镜下观察细胞从组织块周围爬出,待其生长融合后传代,下调完全培养基中FBS浓度至10%,取第2~6代对数期细胞用于本研究。采用细胞免疫荧光α-SMA特异性染色法鉴定平滑肌细胞。
1.2.2 Western Blot检测蛋白表达量及磷酸化水平 待细胞生长至85%左右接种于6 cm培养皿中,饥饿12 h后进行分组。(1)胶原蛋白Ⅰα1。①对照组:不加任何刺激剂;②苯并芘刺激浓度梯度(0.1、0.5、1.0、1.5 μmol/L)组;③苯并芘刺激时间梯度(12、24、48、72 h)组;④阳性对照TGF-β1(2 ng/mL)组。(2)ERK及p-ERK。①对照组:不加任何刺激剂;②苯并芘刺激时间梯度(0、0.5、1、3、6 h)组。(3)胶原蛋白Ⅰα1+ERK及p-ERK。①对照组:不加任何刺激剂;②PD98059(10 μmol/L)组;③苯并芘(1.0 μmol/L)组;④PD98059+苯并芘组,提前30 min加入PD98059。培养相应时间后用4 ℃预冷的PBS洗2~3次,加入蛋白裂解混合液(含RIPA、PMSF及磷酸酶抑制剂,比例为100∶1∶1),置于4 ℃摇床充分裂解30 min,用细胞刮刮取细胞,收集至EP管,提前预冷离心机至4 ℃,设置条件:12 000×g离心20 min。吸取上清液弃沉淀,BCA法测定总蛋白浓度。加入5×loading buffer(体积比为4∶1),100 ℃变性7 min。取20 μg总蛋白以10%聚丙烯酰胺凝胶电泳,湿转至PVDF膜,以5%BSA室温下封闭1~2 h后,分别加入相应一抗:兔抗胶原蛋白Ⅰα1(1∶500稀释)、ERK1/2(1∶1 000稀释)、p-ERK1/2(1∶1 000稀释),小鼠抗GAPDH(1∶1 000稀释),4 ℃摇床中孵育过夜。次日加入相应二抗:山羊抗兔、鼠IgG-hRP二抗(1∶5 000稀释),置于室温摇床上孵育1 h,采用ECL化学发光法显示结果。用Gel-Pro-Analyzer图像分析软件分析各条带灰度值,以目的蛋白与GAPDH条带灰度值之比表示相应蛋白表达水平;p-ERK1/2与ERK1/2条带灰度值之比表示ERK1/2磷酸化水平。
1.2.3 qRT-PCR检测mRNA表达量 待细胞生长至85%左右接种于3.5 cm培养皿中,饥饿12 h后进行分组。(1)对照组:不加任何刺激剂;(2)PD98059(10 μmol/L);(3)苯并芘(1.0 μmol/L);(4)PD98059+苯并芘组,提前30 min加入PD98059。经相应处理培养6 h后,使用Trizol试剂冰上提取细胞总RNA,经TOYOBO反转录试剂盒于Thermo Fisher反转录仪中反转录为cDNA,选用GAPDH作为内参基因,采用实时荧光定量法检测ECM蛋白基因的相对表达量。各基因编号及引物序列详细见下:
GAPDH(NM_002046):5′-GCA CCG TCA AGG CTG AGA A-3′,5′-TGG TGA AGA CGC CAG TGG A-3′;胶原蛋白Ⅰα1(NM_000088):5′-AGC CAG CAG ATC GAG AAC AT-3′,5′-TCT TGT CCT TGG GGT TCT TG-3′;纤连蛋白(NM_212482):5′-TCGA GGA GGA AAT TCC AAT G-3′,5′-ACA CAC GTG CAC CTC ATC AT-3′;多功能蛋白聚糖(NM_004385):5-GGA ACC TGG TGA AGA AAC A-3′,5′-CTT CCA CAG TGG GTG GTC TT-3′;核心蛋白多糖(NM_001920):5′-AAT TGA AAA TGG GGC TTT CC-3′,5′-GCC ATT GTC AAC AGC AGA GA-3′;层粘连蛋白α2(NM_000426):5′-GCC TTC TTC TCG GTG ACT TG-3′,5′-CCC TCT GCC AGC TGA ATA AG-3′。
按照TOYOBO逆转录试剂盒操作手册设定程序如下:37 ℃变性15 min,98 ℃退火5 min,逆转录为cDNA。应用Roche Light Cycler 480进行PCR反应:第一阶段:95 ℃预变性60 s;第二阶段:95 ℃变性15 s,60 ℃延伸45 s;第三阶段:95 ℃变性15 s,65 ℃退火15 s,95 ℃复温,0 s,重复40个循环,冷却至40 ℃,30 s。观察各组基因的溶解曲线有无明显“双峰”,扩增曲线到达平台期时的CT值等,并且以2-△△CT值为指标计算各组目的基因的相对表达水平。
1.3 统计学处理 应用SPSS13.0软件统计,采用One-Way ANOVA法,先进行方差齐性检验,确定方差齐且组间差异有统计学意义后进一步采用LSD法进行多重比较。以P<0.05为差异有统计学意义。
2 结 果
2.1 原代HASMC培养与鉴定 显微镜下观察到,正常的HASMC呈长梭形,细胞核呈卵圆形位于中央,生长融合后的HASMC呈现出典型“峰谷征”,见图1A;细胞经免疫荧光处理后,特异性α-SMA染色阳性并且均匀分布于胞质内,鉴定为平滑肌细胞,见图1B。
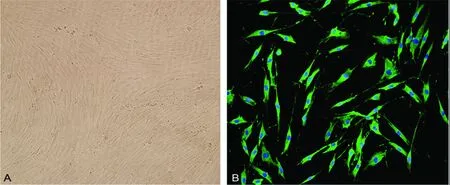
A:普通光可见“峰谷征”;B:免疫荧光染色可见α-SMA为绿色荧光。
图1 原代培养的HASMC形态及表型鉴定(×100)
2.2 苯并芘诱导HASMC胶原蛋白Ⅰα1及ECM蛋白基因表达增加 用递增浓度的苯并芘(0.1~1.5 μmol/L)刺激细胞24 h,不同浓度的苯并芘均能引起ECM蛋白中的重要代表胶原蛋白Ⅰα1表达量增加,且与对照组相比差异均有统计学意义(P<0.01,图2A)。另外,0.5~1.5 μmol/L的苯并芘刺激效应显著高于阳性对照TGF-β1组,选取1.0 μmol/L作为苯并芘的最适刺激浓度;用1.0 μmol/L的苯并芘刺激细胞不同时间(12~72 h),胶原蛋白Ⅰα1在一定时间范围内(12~48 h)表达增加,且与对照组相比差异均有统计学意义(P<0.01,图2B),并在24 h到达峰值,在72 h表达较前有所下降,选取24 h作为最适刺激时间;用苯并芘(1.0 μmol/L)刺激细胞6 h,胶原蛋白Ⅰα1、多功能蛋白聚糖、纤连蛋白mRNA表达均显著增加(P<0.01),层粘连蛋白α2表达增加(P<0.05),而核心蛋白多糖mRNA表达与对照组无明显差异,见图2C。
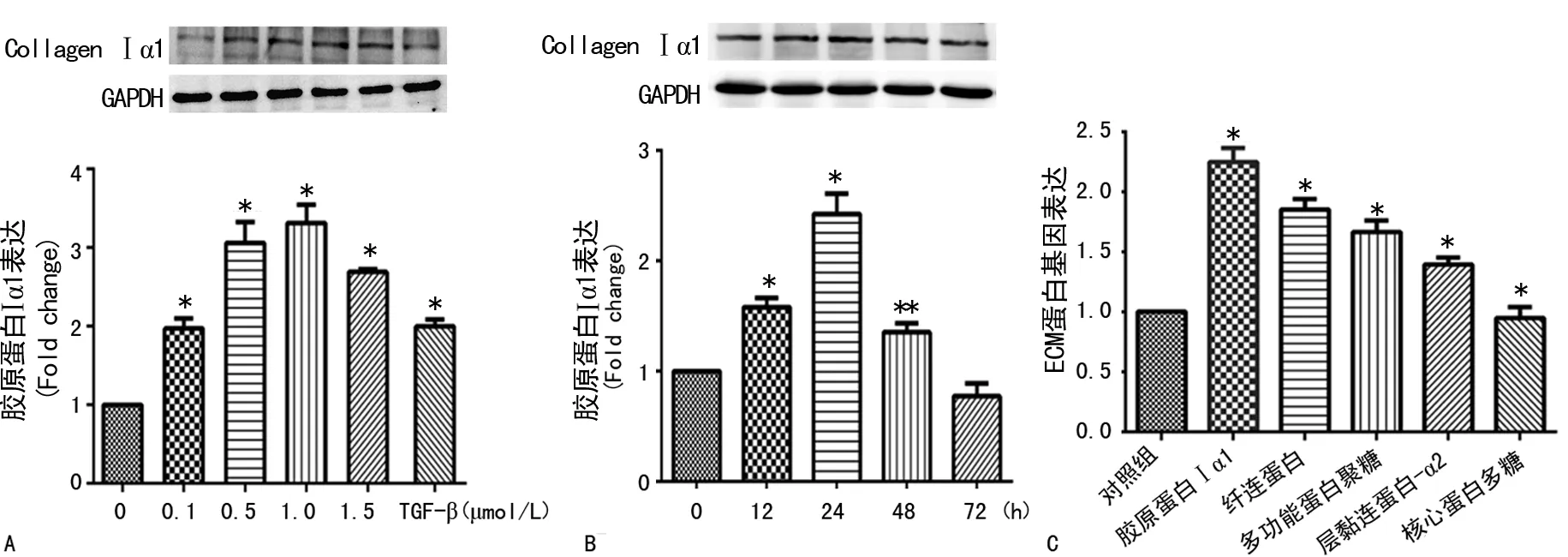
A:苯并芘诱导HASMC胶原蛋白Ⅰα1表达增加的浓度梯度;B:苯并芘诱导HASMC胶原蛋白Ⅰα1表达增加的时间梯度;C:苯并芘诱导HASMC ECM蛋白基因表达增加。**:P<0.01、*:P<0.05。
图2 苯并芘诱导HASMC胶原蛋白Ⅰα1及ECM蛋白基因表达增加
2.3 苯并芘引起ERK1/2磷酸化 用苯并芘(1.0 μmol/L)刺激细胞不同时间(0~6 h),p-ERK1/2表达量在0.5~6 h内明显增加,且在3 h达到峰值(P<0.01),说明苯并芘可引起ERK1/2快速活化,见图3。
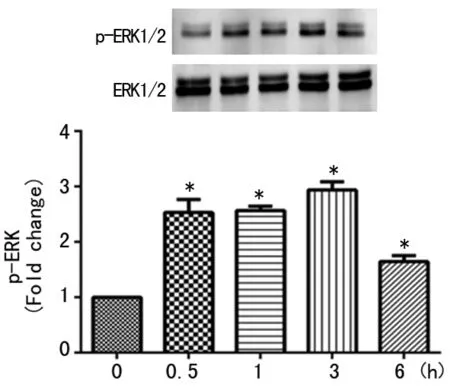
*:P<0.01,与0 h比较。
图3 苯并芘刺激HASMC不同时间ERK1/2蛋白磷酸化水平的改变
2.4 ERK1/2信号通路在苯并芘诱导的胶原蛋白表达中的作用 苯并芘(1.0 μmol/L)刺激细胞24 h后胶原蛋白Ⅰα1表达量明显增加(P<0.01),见图2;而用ERK激酶抑制剂PD98059(10 μmol/L)提前干预细胞30 min,可显著抑制苯并芘诱导的胶原蛋白Ⅰα1表达(P<0.01),见图4。
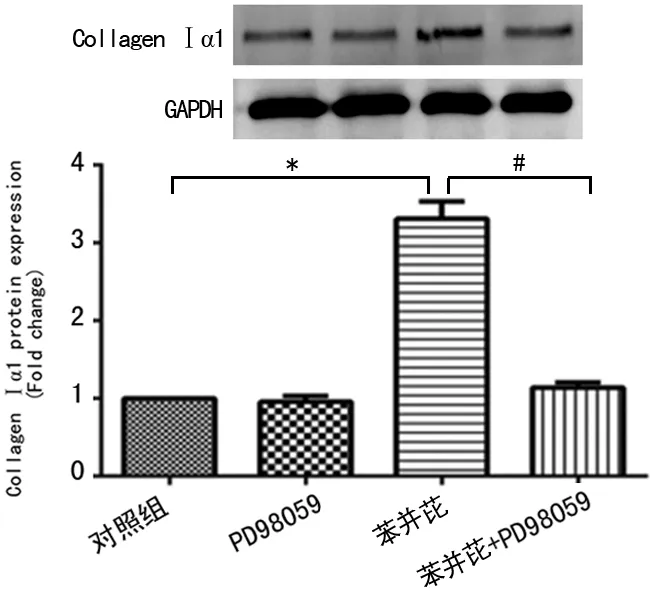
*:P<0.01,与对照组比较;#:P<0.01,与苯并芘+PD98059组比较。
图4 PD98059对苯并芘诱导的胶原蛋白表达的抑制作用
2.5 ERK1/2信号通路在苯并芘诱导ECM基因表达中的作用 苯并芘(1.0 μmol/L)刺激细胞6 h后,ECM基因mRNA表达量明显增加,见图2C;而用ERK激酶抑制剂PD98059(10 μmol/L)提前干预30 min后,胶原蛋白Ⅰα1、多功能蛋白聚糖和纤连蛋白mRNA的表达增加受到了显著抑制(P<0.01),见图5。
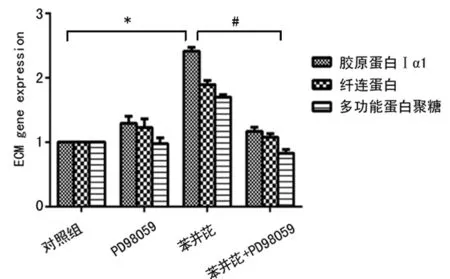
*:P<0.01,与对照组比较;#:P<0.01,与苯并芘+PD98059组比较。
图5 PD98059对苯并芘诱导的ECM基因表达的抑制作用
3 讨 论
气道重塑是COPD的重要病理特征,是导致患者肺功能持续性、进行性下降的主要原因。关于COPD的药物治疗尽管有较多选择,但从目前的临床数据来看,这些药物对患者的疗效并不尽如人意,其具体机制尚缺乏明确报道,有文献认为COPD患者气道重塑末期的纤维化可能限制了药物的作用效果[6]。
目前大气污染是全社会高度关注的研究热点,苯并芘作为香烟烟雾及PM2.5中代表性的有毒化学物质,广泛存在于各类化工业尾气和生活污染物中。既往对苯并芘的研究主要集中在致癌及对神经、免疫系统的毒性作用上,其主要通过中间代谢物反氏二氢二醇环氧苯并芘-DNA 和氧自由基的形成实现其致癌性[11]。近年来,有研究表明苯并芘还与某些增生性疾病有关,如动脉粥样硬化等[12]。目前认为苯并芘在气道重塑中也起着重要作用,例如其可以促进上皮细胞分泌黏蛋白[11]、促进肺成纤维细胞分泌IL-8等[13-14]。另外,有文献报道苯并芘可通过诱导上皮细胞分泌IL-8进而促进上皮下ASMC的增殖和迁移[15]。本研究从基因和蛋白两个水平证实了苯并芘可以刺激HASMC异常分泌ECM蛋白(图2),这与以上苯并芘促进气道重塑的研究结果相一致。另外,本研究验证了1.0 μmol/L的苯并芘刺激HASMC培养24 h能达到异常分泌ECM蛋白的最大效应,与文献[11]报道的苯并芘促进上皮细胞分泌黏蛋白的最适刺激浓度及时间基本相符。虽然在时间梯度实验中在苯并芘刺激细胞72 h小时后胶原蛋白Ⅰα1表达量较前有所下降,并与对照组无明显差异,这可能与细胞持续长时间无营养状态下胶原蛋白降解及刺激耐受有关。
ERK通路是一条促进细胞增殖与分化的经典的信号传导途径[9]。ERK 在气道平滑肌上广泛分布,与气道重塑中的各种炎症介质和细胞因子诱导的细胞内信号转导过程相关,参与COPD的发生发展。本研究结果(图3~5)证实了苯并芘通过激活ERK1/2信号通路促进气道平滑肌细胞外基质蛋白沉积,这与Pera等[16]有关香烟提取物可通过ERK通路促进HASMC增殖的研究结果相辅相成,说明ERK通路在苯并芘诱导的气道重塑中发挥着重要作用。目前的研究显示,苯并芘主要通过激活芳香烃受体进而发挥其致癌及致毒性作用,那么该受体在苯并芘诱导气道重塑中是否同样发挥着重要作用将是本课题组未来的研究方向。
临床上,无论COPD还是支气管哮喘,常规的糖皮质激素吸入治疗只能达到控制症状的效果,文献表明激素并不能充分抑制ECM蛋白沉积导致的气道重塑[10]。因此,本研究的结论可为寻找阻止或延缓气道重塑的疗法提供实验依据。
综上所述,在大气污染日益严重的当前环境下,苯并芘暴露的增加可诱导HASMC激活ERK1/2信号通路异常分泌ECM蛋白,阻断ERK1/2通路可作为抑制气道重塑的新靶点。同时,为减少大气污染相关的肺功能受损,COPD患者在规范化药物治疗的基础之上,应尽量减少在雾霾天气的外出,降低污染物暴露的机会,帮助提高自我的生活质量、延缓病程的进展。
[1]Jiang XQ,Mei XD,Feng D.Air pollution and chronic airway diseases:what should people know and do?[J].J Thorac Dis,2016,8(1):31-40.
[2]Song Q,Christiani DC,Xiao RW,et al.The global contribution of outdoor air pollution to the incidence,prevalence,mortality and hospital admission for chronic obstructive pulmonary disease:a systematic review and meta-analysis[J].Int J Environ Res Public Health,2014,11(11):11822-11832.
[3]Hu G,Zhong N,Ran P.Air pollution and COPD in China[J].J Thorac Dis,2015,7(1):59-66.
[4]López-Campos JL,Tan W,Soriano JB.Global burden of COPD[J].Respirology,2016,21(1):14-23.
[5]Chung KF.The role of airway smooth muscle in the pathogenesis of airway wall remodeling in chronic obstructive pulmonary disease[J].Proc Am Thorac Soc,2005,2(4):347-354.
[6]Kranenburg AR,Willems-Widyastuti A,Moori WJ,et al.Enhanced bronchial expression of extracellular matrix proteins in chronic obstructive pulmonary disease [J].Am J Clin Pathol,2006,126(5):725-735.
[7]Annoni R,Lancas T,Yukimatsu Tanigawa R,et al.Extracellular matrix composition in COPD [J].Eur Respir J,2012,40(6):1362-1373.
[8]Qamar W,Khan AQ,Khan R,et al.Benzo(a)pyrene-induced pulmonary inflammation,edema,surfactant dysfunction,and injuries in rats:alleviation by farnesol[J].Exp Lung Res,2012,38(1):19-27.
[9]牛毅,程远雄,李宁,等.ERK信号通路在血管紧张素Ⅱ诱导的人气道平滑肌细胞增殖中的作用[J].广东医学,2013,34(3):352-355.
[10]霍雅婷,程远雄,赖文岩,等.Wnt/β-连环蛋白信号通路在诱导气道平滑肌细胞外基质蛋白沉积中的作用[J].重庆医学,2015,44(35):4897-4899.
[11] Mannová L,Machala M,Topinka J,et al.Benzo[a]pyrene and t μmol/Lor necrosis factor-α coordinately increase genotoxic damage and the production of proinflammatory mediators in alveolar epithelial type Ⅱ cells[J].Toxicol Lett,2011,206(2):121-129.
[12]Knaapen AM,Curfs DM,Pachen DM,et al.The environmental carcinogen benzo[a]pyrene induces expression of monocyte-chemoattractant protein-1 in vascular tissue:a possible role in atherogenesis[J].Mutat Res,2007,621(1/2):31-41.
[13]Chiba T,Uchi H,Tsuji G,et al.Arylhydrocarbon receptor (AhR) activation in airway epithelial cells induces MUC5AC via reactive oxygen species (ROS) production[J].Pulm Pharmacol Ther,2011,24(1):133-140.
[14]Dreij K,Rhrissorrakrai K,Gunsalus KC,et al.Benzo[a]pyrene diol epoxide stimulates an inflammatory response in normal human lung fibroblasts through a p53 and JNK mediated pathway[J].Carcinogenesis,2010,31(6):1149-1157.
[15]Kuo PL,Hsu YL,Tsai MJ,et al.Pterostilbene suppresses benzo[a]pyrene-induced airway remodeling[J].J Agric Food Chem,2011,59(14):8028-8035.
[16]Pera T,Gosens R,Lesterhuis AH,et al.Cigarette smoke and lipopolysaccharide induce a proliferative airway smooth muscle phenotype[J].Respir Res,2010,11(1):1-12.
Benzopyrene activates ERK1/2 signal pathway to promote extracellular matrix protein deposition of airway smooth muscle cells on airway remodeling*
YuanYalu1,ChengYuanxiong1△,CaoJing1,LaiWenyan2,CaiKaican3
(1.DepartmentofRespiration;2.DepartmentofCardiology;3.DepartmentofCardiothoracicSurgery,NanfangHospital,SouthernMedicalUniversity,Guangzhou,Guangdong510515,China)
Objective To investigate the influence of benzopyrene on extracellular matrix(ECM) protein deposition of human airway smooth muscle cells(HASMC) and the related pathway mechanism.Methods HASMC were primarily cultured and the 2-6 generations cells were applied in this experiment.The expression amount of ECM gene and protein was detected by real time PCR and Western Blot the phosphorylation level was analyzed by using the Western Blot method.Results Benzopyrene could to increase the expression of HASMC collagenⅠα1 protein (P<0.01) and ECM protein (including collagen Ⅰα1,versican,fibronectin,laminin α2) mRNA(P<0.05).Benzopyrene could induce the rapid increase of ERK1/2 phosphorylation level (P<0.01).Furthermore,the ERK pathway inhibitor PD98059 could significantly inhibit the increase of benzopyrene-induced collagenⅠα1(P<0.01)and ECM protein(including collagen Ⅰα1,versican,fibronectin,laminin α2) mRNA expression(P<0.01).Conclusion Benzopyrene induces the ECM protein deposition of HASMC by activating the ERK1/2 pathway,blocking the ERK1/2 signal pathway can inhibit the benzopyrene-induced airway remodeling.
myocytes,smooth muscle;extracellular matrix;benzopyrene;ERK1/2 pathway;airway remodeling
10.3969/j.issn.1671-8348.2017.16.005
广东省自然科学基金资助项目(s2012010009036);南方医院院长基金资助项目(2014A001)。 作者简介:袁雅璐(1991-),在读硕士,主要从事慢性气道疾病研究。△
,E-mail:drchengyx@126.com。
R563
A
1671-8348(2017)16-2174-04
2017-01-10
2017-03-14)
