86例子宫内膜样腺癌附件转移患者的临床病理特征分析
2017-07-07吴令英
佐 晶,程 敏,宋 艳,李 卓,张 蓉,李 斌,吴令英
国家癌症中心 中国医学科学院 北京协和医学院 肿瘤医院 1妇瘤科 2病理科,北京 100021
·论 著·
86例子宫内膜样腺癌附件转移患者的临床病理特征分析
佐 晶1,程 敏1,宋 艳2,李 卓2,张 蓉1,李 斌1,吴令英1
国家癌症中心 中国医学科学院 北京协和医学院 肿瘤医院1妇瘤科2病理科,北京 100021
目的 分析86例子宫内膜样腺癌附件转移患者的临床病理特征。方法 回顾性总结2000年1月至2015年12月在中国医学科学院肿瘤医院妇科接受手术治疗的86例子宫内膜样腺癌附件转移患者的临床病理资料,比较大体转移和隐匿性转移患者间的临床病理特征。结果 86例患者占同期子宫内膜样腺癌患者总人数的5.4%(86/1592),平均年龄58.1岁,其中,未绝经13例(15.1%),40岁以下2例(2.3%);手术探查发现附件存在大体转移47例(54.7%),术后病理证实隐匿性转移39例(45.3%);卵巢转移34例(39.5%),输卵管和卵巢转移19例(22.1%),单纯输卵管转移33例(38.4%)。大体转移组和隐匿性转移组患者的雌激素受体(χ2=8.086,P=0.042)和孕激素受体(PR)(χ2=9.149,P=0.026)表达水平差异有统计学意义;其余临床病理特征两组间差异均无统计学意义(P均>0.05)。非条件Logistic回归分析结果显示,与无表达组相比,PR低表达组的隐匿性转移发生率是大体转移的6.375倍(P=0.005,95%CI:1.768~22.976),PR高表达组的隐匿性转移发生率是大体转移的3.719倍(P=0.048,95%CI:1.009~13.702)。结论 子宫内膜样腺癌附件大体转移患者的PR表达水平明显低于隐匿性转移患者。
子宫内膜样腺癌;附件;隐匿性转移;雌激素受体;孕激素受体
ActaAcadMedSin,2017,39(3):389-395
子宫内膜癌发病率居女性恶性肿瘤第4位,约占全部恶性肿瘤的7%,2017年美国预计新发病例为61 380例[1];2011年中国新发病例为31 475例,发病率为9.31/105[2]。子宫内膜癌患者绝大多数为绝经后妇女,仅5%的患者发病年龄小于40岁[3- 4],但年轻患者通常为激素依赖型,肿瘤分化较好,期别较早,预后较好,5年生存率可达93%[5]。子宫内膜癌最主要的病理类型为子宫内膜样腺癌,分期标准为手术分期,标准手术方案为全面腹腔探查+全子宫双卵巢输卵管切除术+盆腔及腹主动脉旁淋巴结清扫术。可是对于年轻患者,切除卵巢会出现激素水平减退导致的近期和远期症状。有研究显示,保留早期子宫内膜癌患者的卵巢并不影响预后[6- 7]。因此,对于年龄小于40岁且术前检查提示肿瘤局限于子宫的Ⅰ期患者,目前推荐保留卵巢。然而,保留卵巢最大的风险是存在附件转移,术前影像学检查及术中探查只可发现附件部位的大体转移肿瘤,对于隐匿性的镜下转移肿瘤则难以在术前及术中做出诊断,需依赖于术后的病理学检查,从而为保留卵巢留下隐患。本研究回顾性总结了86例子宫内膜样腺癌附件转移患者的临床病理资料,比较了大体转移和隐匿性转移患者间的临床病理特征。
资料和方法
资料来源 选取2000年1月至2015年12月在中国医学科学院肿瘤医院妇科接受手术治疗的子宫内膜样腺癌附件转移的患者。纳入标准:(1)接受子宫内膜癌分期手术:子宫切除术(包括广泛子宫切除术、次广泛子宫切除术或全子宫切除术)+双侧输卵管卵巢切除术+淋巴结切除术(系统性淋巴结清扫术或淋巴结活检术),术后无肿瘤残存;(2)术后病理诊断为子宫内膜原发内膜样腺癌,并伴有卵巢和/或输卵管转移。排除标准:(1)病理证实为卵巢癌及子宫内膜癌双原发的患者;(2)手术病理证实卵巢癌子宫内膜转移的患者,(3)手术病理证实为国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)子宫内膜癌2014年分期的Ⅳ期患者;(4)术前曾接受过放疗、化疗及外院行分期手术的患者。
子宫内膜样腺癌附件转移的诊断标准 参考Scully等[8]于1998年提出的诊断标准,具体为:(1)肿瘤在组织病理学上高度相似;(2)子宫内膜肿瘤相对较大,卵巢肿瘤相对较小;(3)内膜伴有非典型性增生;(4)深肌层受侵:直接侵犯附件,肌层可见血管间隙受侵;(5)内膜样腺癌的典型转移模式;(6)卵巢肿瘤为多结节性,绝大多数双卵巢均可见肿瘤;(7)卵巢门处可见肿瘤、血管间隙受侵、表面种植或结合出现;(8)无卵巢子宫内膜异位症表现;(9)肿瘤的DNA拷贝数相似均为非整倍体或二倍体;(10)分子遗传学上相似或存在相同的染色体异常。
资料收集 查阅病历获得临床资料,包括病史、术前辅助检查结果(CA125水平、影像学资料)、手术资料(术中探查情况、手术切除范围、大体肿瘤情况)。由2名专门的病理科医生复阅手术病理切片,进一步明确诊断并核实手术标本的各项病理特征。肿瘤分化程度根据国际标准分为G1、G2和G3。
雌孕激素受体表达应用抗雌激素受体及孕酮受体的兔单克隆抗体进行免疫组织化学检测,表达结果判定标准:(1)无表达:无肿瘤细胞着色或小于1%的肿瘤细胞着色;(2)低表达:小于25%的肿瘤细胞着色且弱着色;(3)高表达:大于25%的肿瘤细胞染色且中等及强着色。
妇科肿瘤医生根据手术病理结果,参照2014年FIGO子宫内膜癌分期标准进行分期,将存在附件转移的患者按照手术记录卵巢情况描述分为:(1)大体转移:术中探查发现卵巢增大、质地变硬、卵巢表面和/或实质可见肿瘤结节或肿瘤种植;输卵管扭曲变粗、变硬,输卵管剖开可见肿瘤结节。(2)隐匿性转移:附件外观及剖视标本均未发现肿瘤受侵证据,而术后病理证实存在镜下子宫内膜样腺癌附件转移。
统计学处理 采用SPSS 22.0统计软件,计数资料以频数及百分比表示,计量资料以均数±标准差表示,组间计数资料的比较采用χ2检验及Fisher精确检验,多因素分析采用非条件Logistic回归,P<0.05为差异有统计学意义。
结 果
一般情况 共有86例患者(FIGO Ⅲ期)纳入本研究,占同期子宫内膜癌患者的5.4%(86/1592)。所有患者的平均年龄为58.1岁(28~84岁),其中未绝经13例(15.1%),40岁以下2例(2.3%);术前影像学检查(盆腔超声联合CT或MRI)发现附件肿物的病例占30.2%(26/86),未发现附件肿物的病例占69.8%(60/86),术前血清CA125水平<35 U/ml的病例占44.2%(38/86),CA125水平≥35 U/ml的病例占55.8%(48/86)。手术探查发现附件存在大体转移47例(54.7%),术后病理证实隐匿性转移39例(45.3%);术后病理证实卵巢转移34例(39.5%),输卵管和卵巢转移19例(22.1%),单纯输卵管转移33例(38.4%);病理分期G1期7例(8.1%),G2期36例(41.9 %),G3期43例(50.0%);手术分期ⅢA期37例(43.0%),ⅢB期4例(4.7%),ⅢC1期26例(30.2%),ⅢC2期19例(22.1%);无宫体下段受累75例(87.2%),有宫体下段受累11例(12.8%);肌层受侵≤1/2 33例(38.4%),>1/2 53例(61.6%);存在淋巴血管间隙受侵(lymph-vascular space invasion,LVSI)30例(34.9%),无LVSI 56例(65.1%);有宫颈间质受侵49例(57.0%),无受侵37例(43.0%);有宫旁受侵17例(19.8%),无受侵69例(80.2%);原发肿瘤直径≤2 cm 5例(5.8%),>2 cm 81例(94.2%);腹腔细胞学阳性64例(74.4%),阴性22例(25.6%);有腹主动脉旁淋巴结转移19例(22.0%),无转移67例(78.0%);有盆腔淋巴结转移40例(46.5%),无转移46例(53.5%);雌激素受体(estrogen receptor,ER)无表达23例(26.7%),低表达28例(32.5%),高表达35例(40.7%);孕激素受体(progesterone receptor,PR)无表达21例(24.4%),低表达35例(40.7%),高表达30例(34.9%);有盆腔子宫外受侵15例(17.4%),无受侵71例(82.6%);有阴道转移3例(3.5%),无转移83例(96.5%)。
附件大体转移组和隐匿转移组临床病理因素的比较 附件大体转移组的ER(χ2=8.086,P=0.042)和PR(χ2=9.149,P=0.026)高表达比例明显低于隐匿转移组(表1)。
多因素分析结果 采用非条件Logistic回归,调整肿瘤分化、FIGO分期、肌层受侵情况、淋巴结转移情况等因素后结果显示,与无表达组相比,PR低表达组的隐匿转移发生率是大体转移的6.375倍(P=0.005,95%CI:1.768~22.976),PR高表达组的隐匿转移发生率是大体转移的3.719倍(P=0.048,95%CI:1.009~13.702)(表2)。
讨 论
年轻的子宫内膜癌患者术中保留卵巢所面临的最大风险是附件(输卵管/卵巢)存在恶性肿瘤。子宫与卵巢同时出现恶性肿瘤有以下两种情况:(1)子宫内膜、卵巢子宫内膜样腺癌双原发癌;(2)原发子宫的子宫内膜癌发生输卵管卵巢转移。双原发癌与子宫内膜癌附件转移无论从病因学、病理特征、肿瘤期别到预后均存在较大差异,因此需在诊断时进行严格区分。双原发癌约占原发子宫内膜癌的5%[9],其与子宫内膜样腺癌附件转移在病理上的鉴别目前主要参考Scully等[8]的诊断原则:双原发肿瘤组织学上不相似;子宫肿瘤无明显深肌层受侵及血管间隙受侵;无子宫肿瘤外侵的证据;卵巢原发肿瘤绝大多数为单侧;卵巢原发肿瘤位于实质;存在卵巢子宫内膜异位症的证据。双原发癌患者相对年轻,绝经前患者比例较高,多为早期患者,肿瘤分化较好,预后较好,中位无瘤生存期约为120个月[10- 11],10年生存率为61.3%[12]。
子宫内膜样腺癌附件转移的发病率低。Creasman等[13]研究显示,术前临床分期Ⅰ期(肿瘤局限于宫体)的患者有约5%存在附件转移。目前报道的卵巢转移比例为1.7%~8%[14- 17]。Lin等[14]研究发现,卵巢微小转移仅占子宫内膜样腺癌患者的0.8%。本组资料显示,Ⅲ期患者发生附件转移者占同时期全部内膜癌手术患者的5.4%。子宫内膜样腺癌附件转移患者年龄较大,大部分为绝经后患者,文献报道的平均年龄为52~53岁,其中小于50岁的患者占27%[14- 15],与本组患者的年龄分布相似。

表 1 附件大体转移组和隐匿转移组临床病理因素的比较
LVSI:淋巴血管间隙受侵;ER:雌激素受体;PR:孕激素受体
LVSI:lymph-vascular space invasion;ER:estrogen receptor;PR:progesterone receptor
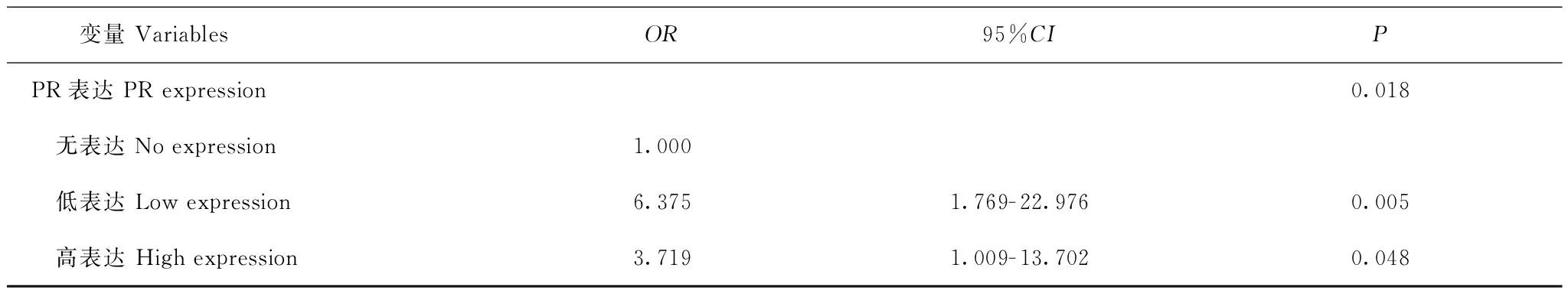
表 2 附件转移肿瘤大小Logistic回归多因素分析结果
子宫内膜癌发生附件转移时,FIGO分期至少为ⅢA期,预后相对较差。Bese等[12]研究显示,10年生存率约为36.6%,因子宫内膜癌卵巢转移的病理类型不同,5年无病生存率波动在30%~70%间[18]。Lan等[19]将附件仅存在镜下转移的患者进行了分析,结果发现其预后较大体转移好,5年无复发生存率为89.6%。
由于发生率较低,各中心对于子宫内膜样腺癌附件转移病理特征的相关回顾性研究结论不尽相同,但主要集中在原发子宫肿瘤的情况及是否存在子宫肿瘤向外侵犯两个方面。子宫内膜癌原发肿瘤深肌层受侵及肿瘤中-低分化是附件转移患者最常合并的危险因素,比例高达80%~100%[14- 17]。本组患者中,子宫深肌层受侵的比例达61.6%,中-低分化占91.8%,与文献报道相似。另外多个临床病理学研究提示,卵巢转移与腹腔细胞学阳性、宫颈受侵、浆膜受侵、输卵管受侵、腹膜后淋巴结转移等子宫外受侵的因素密切相关,其中宫颈受侵、浆膜受侵、输卵管受侵、淋巴结转移是独立的危险因素[7、16- 17]。本研究单因素及多因素分析结果发现,大体转移组与隐匿转移组在病理危险因素中不存在明显差异,今后将扩大样本量在Ⅰ~Ⅲ期患者中进行分析,进一步明确附件转移的病理特征。
子宫内膜癌的子宫外病变在术前主要通过盆腔MRI以及CA125、HE4等血清学标记物进行评估。有研究提示单独或联合应用以上辅助检查可有效预测深肌层受侵、宫颈间质受侵及以淋巴结转移为主的子宫外受侵[20- 23],但缺乏在术前对附件受侵情况进行预测研究,对附件的隐匿性转移更是缺乏有效的评价手段。本研究入组的子宫内膜样腺癌患者术前影像学检查(盆腔超声联合CT或MRI)结果显示发现附件肿物的病例仅占30%,术前CA125水平小于35 U/ml的患者比例也仅为44.2%。有研究将CA125水平上限下调至20 U/ml及30 U/ml,虽然有利于提高预测附件转移的敏感性,但特异性均呈现不同程度的下降[21- 23]。本研究在进行统计学分析后未发现常规临床病理因素对于附件隐匿性转移的预测价值,亟待引入新的评价手段来进行预测。
子宫内膜样腺癌被公认为激素依赖型肿瘤,ER及PR与子宫内膜样腺癌的临床病理特征及预后存在着一定的关系:研究发现,ER的表达仅与肿瘤分化及肌层受侵相关[24- 25],而与附件转移无明显相关性。相比之下,PR在附件转移中发挥了更为重要的作用。病理学研究发现,附件镜下转移一般是附件多结节肉眼转移的前驱状态。Kim等[26]研究也证实PR表达与附件转移存在明显相关性。Ballester等[27]通过子宫内膜样腺癌淋巴结转移预测模型发现淋巴结转移的患者PR表达明显下降;Singh等[28]通过分析GOG119中的晚期及转移性患者发现,PR表达水平与肿瘤分化呈负相关。Huvila等[29]及Jongen等[25]分别通过回顾早期内膜样腺癌病例,发现PR表达的缺失是早期内膜癌复发的独立危险因素。Zhang等[30]研究发现PR的表达随肿瘤分期的升高而显著下降,ER、PR表达水平与患者预后呈正相关,且PR比ER能更好地预测预后[24,30]。本研究结果显示,附件大体转移及隐匿性转移患者ER和PR表达水平存在显著差异,进一步非条件Logistic回归分析结果提示,大体转移患者的PR表达水平明显低于隐匿性转移患者。
综上,本研究总结了86例子宫内膜样腺癌附件转移患者的临床病理资料,结果发现大体转移患者的PR表达水平明显低于隐匿性转移患者,在未来的研究中我们将纳入子宫内膜样腺癌早期患者进入研究,与附件转移患者比较临床病理情况,以期进一步探讨PR在附件隐匿性转移预测方面可能扮演的角色。
[1]Siegel RL,Miller KD,Jemal A.Cancer Statistics,2017[J].CA Cancer J Clin,2017,67(1):7- 30.
[2]Chen W,Zheng R,Zeng H,et al. Annual report on status of cancer in China,2011[J].Chin J Cancer Res,2015,27(1):2- 12.
[3]Zivanovic O,Carter J,Kauff ND,et al. A review of the challenges faced in the conservative treatment of young women with endometrial carcinoma and risk of ovarian cancer[J].Gynecol Oncol,2009,115(3):504- 509.
[4]Duska LR,Garrett A,Rueda BR,et al. Endometrial cancer in women 40 years old or younger[J].Gynecol Oncol,2001,83(2):388- 393.
[5]Kalogiannidis I,Agorastos T.Conservative management of young patients with endometrial highly-differentiated adenocarcinoma[J].J Obstet Gynaecol,2011,31(1):13- 17.
[6]Wright JD,Jorge S,Tergas AI,et al. Utilization and outcomes of ovarian conservation in premenopausal women with endometrial cancer[J].Obstet Gynecol,2016,127(1):101- 108.
[7]Lee TS,Kim JW,Kim TJ,et al. Avarian preservation during the surgical treatment of early stage endometrial cancer:a nation-wide study conducted by the Korean Gynecologic Oncology Group[J].Gynecol Oncol,2009,115(1):26- 31.
[8]Scully RE,Young RH,Clement PB.Tumors of the ovary,maldeveloped gonads,fallopian tube,and broad ligament.Atlas of tumorpathology[M].Bethesda,MD:Armed Forces Institute of Pathology,1998.
[9]Zaino R,Whitney C,Brady MF,et al. Simultaneously detected endometrial and ovarian carcinomas- a prospective clinicopathologic study of 74 cases:a gynecologic oncology group study [J].Gynecol Oncol,2001,83(2):355- 362.
[10]Sozen H,Vatansever D,Iyibozkurt AC,et al. Clinicopathologic and survival analyses of synchronous primary endometrial and epithelial ovarian cancers[J].J Obstet Gynaecol Res,2015,41(11):1813- 1819.
[11]Soliman PT,Slomovitz BM,Broaddus RR,et al. Synchronous primary cancers of the endometrium and ovary:a single institution review of 84 cases[J].Gynecol Oncol,2004,94(2):456- 462.
[12]Bese T,Sal V,Kahramanoglu I,et al. Synchronous primary cancers of the endometrium and ovary with the same histopathologic type versus endometrial cancer with ovarian metastasis:a single institution review of 72 cases[J].Int J Gynecol Cancer,2016,26(2):394- 406.
[13]Creasman WT,Morrow CP,Bundy BN,et al. Surgical pathologic spread patterns of endometrial cancer:a gynecologic oncology group study[J].Cancer,1987,60(8 Suppl):2035- 2041.
[14]Lin KY,Miller DS,Bailey AA,et al. Ovarian involvement in endometrioid adenocarcinoma of uterus[J].Gynecol Oncol,2015,138(3):532- 535.
[15]Gilani Modaress M,Cheraghi F,Zamani N.Ovarian metastasis in endometriod type endometrial cancer[J].Int J Fertil Steril,2011,5(3):148- 151.
[16]Pan Z,Wang X,Zhang X,et al. Retrospective analysis on coexisting ovarian cancer in 976 patients with clinical stage I endometrial carcinoma[J].J Obstet Gynaecol Res,2011,37(4):352- 358.
[17]Sun C,Chen G,Yang Z,et al. Safety of ovarian preservation in young patients with early-stage endometrial cancer:a retrospective study and meta-analysis[J].Fertil Steril,2013,100(3):782- 787.
[18]Williams MG,Bandera EV,Demissie K,et al. Synchronous primary ovarian and endometrial cancers:a population-based assessment of survival[J].Obstet Gynecol,2009,113(4):783- 789.
[19]Lan C,Huang X,Huang Y,et al. The outcome and efficacy of adjuvant chemotherapy alone in patients with stage ⅢA endometrial carcinoma with solitary adnexal involvement:a retrospective single-institution study[J].Gynecol Oncol,2014,135(3):446- 450.
[20]Koplay M,Dogan NU,Erdogan H,et al. Diagnostic efficacy of diffusion-weighted MRI for pre-operative assessment of myometrial and cervical invasion and pelvic lymph node metastasis in endometrial carcinoma[J].J Med Imaging Radiat Oncol,2014,58(5):538- 546.
[21]Nicklin J,Janda M,Gebski V,et al. The utility of serum CA- 125 in predicting extra-uterine disease in apparent early-stage endometrial cancer[J].Int J Cancer,2012,131(4):885- 890.
[22]Jiang T,Huang L,Zhang S.Preoperative serum CA125:a useful marker for surgical management of endometrial cancer[J].BMC Cancer,2015,15:396.doi:10.1186/s12885- 015- 1260- 7.
[23]Antonsen SL,Høgdall E,Christensen IJ,et al. HE4 and CA125 levels in the preoperative assessment of endometrial cancer patients:a prospective multicenter study(ENDOMET)[J].Acta Obstet Gynecol Scand,2013,92(11):1313- 1322.
[24]Fukuda K,Mori M,Uchiyama M,et al. Prognostic significance of progesterone receptor immunohistochemistry in endometrial carcinoma[J].Gynecol Oncol,1998,69(3):220- 225.
[25]Jongen V,Bri⊇t J,Jong RD,et al. Expression of estrogen receptor-alpha and-beta and progesterone receptor-A and-B in a large cohort of patients with endometrioid endometrial cancer[J].Gynecol Oncol,2009,112(3):537- 542.
[26]Kim JJ,Chapman-Davis E.Role of progesterone in endometrial cancer[J].Semin Reprod Med,2010,28(1):81- 90.
[27]Ballester M,Canlorbe G,Cortez A,et al. Histological and immunohistochemical profiles predict lymph node status in women with low-intermediate risk endometrial cancer[J].Gynecol Oncol,2013,130(3):457- 462.
[28]Singh M,Zaino RJ,Filiaci VJ,et al. Relationship of estrogen and progesterone receptors to clinical outcome in metastatic endometrial carcinoma:a Gynecologic Oncology Group Study[J].Gynecol Oncol,2007,106(2):325- 333.
[29]Huvila J,Talve L,Carpén O,et al. Progesterone receptor negativity is an independent risk factor for relapse in patients with early stage endometrioid endometrial adenocarcinoma[J].Gynecol Oncol,2013,130(3):463- 469.
[30]Zhang Y,Zhao D,Gong C,et al. Prognostic role of hormone receptors in endometrial cancer:a systematic review and meta-analysis[J].World J Surg Oncol,2015,13:208.doi:10.1186/s12957- 015- 0619- 1.
Clinicopathological Features Analysis of 86 Endometrial EndometrioidAdenocarcinoma Patients with Adnexal Involvement
ZUO Jing1,CHENG Min1,SONG Yan2,LI Zhuo2,ZHANG Rong1,LI Bin1,WU Lingying1
1Department of Gynecologic Oncology,2Department of Pathology,National Cancer Center/Cancer Hospital,CAMS and PUMC,Beijing 100021,ChinaCorresponding author:WU Lingying Tel/Fax:010- 87788996,E-mail:wulingying@csco.org.cn
Objective:To investigate the clinicopathological features of endometrial endometrioid adenocarcinoma(EEA)with adnexal involvement.Methods The clinicopathological data of 86 EEA patients who underwent surgical treatment at our center from January 2000 to December 2015 were analyzed retrospectively.The clinicopathological features were compared between patients with occult adnexal involvement and those with gross adnexal involvement.Results A total of 86 EEA patients with adnexal involvement(mean age:58.1 years)were included in this study,accounting for 5.4%(86/1592)of the EEA patients during the same period.Among these 86 patients,there were 13 premenopausal patients(15.1%)including 2 premenopausal patients aged under 40 years.Gross adnexal involvement was found in 47 patients(54.7%),while occult adnexal involvement was found in 39 patients(45.3%)in pathology evaluation.Ovarian metastasis was found in 34 patients(39.5%),followed by both ovarian and tubal metastasis in 19 patients(22.1%)and tubal metastasis in 33 patients(38.4%).The expressionss of estrogen receptor(χ2=8.086,P=0.042)and progesterone receptor(PR)(χ2=9.149,P=0.026)were significantly different between gross adnexal involvement group and occult adnexal involvement group,whereas no significant difference was found in other clinicopathological features(allP>0.05).The non-conditional Logistic regression analysis showed that,compared with PR no-expression group,the rate of occult microscopic adnexal involvement in PR low-expression group was 6.375 times of that of the gross adnexal involvement(P=0.005,95%CI:1.768- 22.976),and the rate of occult microscopic adnexal involvement in the PR high-expression group was 3.719 times of that of gross adnexal involvement(P=0.048,95%CI:1.009- 13.702). Conclusion PR expression level is remarkably lower in EEA patients with gross adnexal involvement than those with occult adenxal involvement.
endometrial endometrioid adenocarcinoma;adnexal;occult involvement;estrogen receptor;progesterone receptor
吴令英 电话/传真:010- 87788996,电子邮件:wulingying@csco.org.cn
R737.33
A
1000- 503X(2017)03- 0389- 07
10.3881/j.issn.1000- 503X.2017.03.015
2017- 03- 02)
