电针“委中”对大鼠腰多裂肌损伤后LIF、IL-17表达的影响
2017-06-21邹德辉卢宗孝晏珺陈玉佩刘通陈冬荔张佳怡许玥白玉琢张莉霍则军
邹德辉 卢宗孝 晏珺 陈玉佩 刘通 陈冬荔 张佳怡 许玥 白玉琢 张莉 霍则军
电针“委中”对大鼠腰多裂肌损伤后LIF、IL-17表达的影响
邹德辉 卢宗孝 晏珺 陈玉佩 刘通 陈冬荔 张佳怡 许玥 白玉琢 张莉 霍则军
目的 观察电针“委中”对大鼠腰多裂肌损伤后组织形态学变化以及对骨骼肌肌肉因子白血病抑制因子(leukemia inhibitory factor,LIF)、骨骼肌损伤前炎症因子白介素17(interleukin,IL-17)表达含量的影响。 方法 将90只雄性SD大鼠随机分为空白组、模型组、模型对照组、电针委中组、电针肾俞组,每组18只。每组再随机分为1天、3天、7天三个时间点。麻醉后于双侧L4-5多裂肌注射0.5%布比卡因溶液复制多裂肌损伤模型,通过光镜观察分析造模后多裂肌形态结构的变化。通过ELISA和免疫组化观察1天、3天、7天多裂肌LIF、IL-17表达含量的动态时相变化。 结果 造模后,与空白组比较,模型组不同时间点的LIF及IL-17表达含量均明显增加(P<0.01);与模型组比较,电针委中和电针肾俞组的IL-17表达含量有所降低(P<0.01),而LIF的表达含量有所增加(P<0.01);与电针肾俞组比较,电针委中组在1天后下调IL-17的表达含量更明显(P<0.05),在3天、7天后上调LIF的作用更显著(P<0.05)。结论 电针委中可促进IL-17的表达下调,减轻炎症反应的程度,同时可增加LIF的表达含量,促进骨骼肌中葡萄糖的摄取,利于骨骼肌修复。
多裂肌; 损伤修复; 炎症因子; 白血病抑制因子; 白介素17
多裂肌是位于脊柱最内侧且附着面积最大的椎旁肌,腰骶段的多裂肌对腰椎的动力性稳定起到80%以上的重要作用[1]。一旦腰多裂肌发生损伤、萎缩及功能紊乱,就可能导致腰椎失稳引发腰痛。骨骼肌损伤后需经历炎症(坏死)、修复与再生等3个病理阶段[2]。早期的炎症反应过程与骨骼肌的修复和再生密切相关。骨骼肌损伤后肌细胞能够分泌上百种分泌蛋白,包括几十种生长因子、细胞因子和金属肽酶等,这些蛋白质能有效调节骨骼肌细胞及其他组织和细胞的功能[3-4]。 Pedersen等[5]将这些由骨骼肌细胞产生、分泌到细胞外并具有内分泌功能的细胞因子、肽等称为肌肉因子。已往的研究发现一些肌肉因子与骨骼肌自身的损伤修复和再生有关,如胰岛素样生长因子1、机械生长因子、肌肉抑制素、白介素6等都参与了骨骼肌的损伤修复和再生[6-9]。白血病抑制因子(leukaemia inhibi-tory factor,LIF)也是一种肌肉因子[10-11],在骨骼肌的损伤修复和再生中发挥着重要的作用[12-13]。因此,本实验拟从骨骼肌损伤后的前炎症因子白介素17(interleukin,IL-17)和骨骼肌肌肉因子LIF表达含量变化的角度进一步探讨电针“委中”穴对多裂肌的损伤修复作用。
1 材料与方法
1.1 实验动物与分组
清洁级健康成年雄性SD大鼠90只,体质量280~320 g,由维通利华实验动物中心提供,许可证号:SCXK(京)2012-0001。所有大鼠按体质量分层,采用随机数字表法分为空白组、模型组、模型对照组、电针委中组、电针肾俞组,每组18只。每组大鼠再随机分为1天、3天、7天三个时间点,每个时间点6只大鼠。
1.2 主要仪器和试剂
半自动化石蜡切片机(RM2245,德国莱卡仪器有限公司);电热恒温鼓风干燥箱(SKP-02.600,黄石市恒丰医疗器械有限公司);正置智能型显微镜及采集系统(BX53,奥林巴斯,中国有限公司);韩式电针仪(HANS-200A,北京思盛达医疗器械中心)。
布比卡因(美国Sigma,生产批号:B5274-1G);10%水合氯醛(北京欧北生物科技有限公司,生产批号:OB12365);40%多聚甲醛溶液(北京兰博利德,生产批号:P4500);大鼠白血病抑制因子酶联免疫试剂盒、大鼠白介素17酶联免疫试剂盒(北京鼎国生物科技有限责任公司,生产批号:CSB-E07432r、CSB-EL011601RA);大鼠白血病抑制因子抗体、白介素17抗体(美国Santa,生产批号:N-18、E-19)。
1.3 动物模型制备
模型组大鼠适应性喂养1周后,10%水合氯醛(350 mg/kg)腹腔注射麻醉,选择脊柱L4、L5水平两旁的4个点,使用一次性4号针头注射器抽取0.5 %布比卡因肌肉注射400 μL(100 μL×4),针头紧贴棘突旁进入肌肉,直到接触关节突和乳突所在的骨面回抽套管1 mm无血,表明针头已到达多裂肌,各点分别注射布比卡因100 μL,时间不得小于3秒,以利于药物的吸收。单次注射完成造模。模型对照组采用同样方法注射生理盐水,空白组不做任何处理。
1.4 干预方法
空白组不做任何处理。模型对照组、模型组:与电针组同步抓取、固定,不进行针刺干预。参照《实验针灸学》[14]常用实验动物穴位图谱,电针委中组:选取双侧“委中”(膝关节背面正中);电针肾俞组:选取双侧“肾俞”(第2腰椎旁开7 mm)。将大鼠固定后,暴露后肢。采用华佗牌0.30×15 mm一次性针灸针,直刺进针后连接韩式电针仪,选用疏密波,频率2/10 Hz,电流强度 1~2 mA,持续20分钟,每天1次,3个亚组分别治疗1天、3天、7天。
1.5 取材方法
各组分别在造模后的第1天、3天、7天同步取材6只。10 %水合氯醛(350 mg/kg)腹腔注射麻醉后,剔除背部皮毛、筋膜,充分暴露腰部肌肉,剥离最长肌和髂肋肌,锐性切取L4和L5水平多裂肌组织,左侧多裂肌置于40 g/L多聚甲醛溶液固定,取右侧约1 mm×1 mm×1 mm多裂肌迅速置于液氮固定,操作过程保证无菌。
1.6 样本处理
1.6.1 HE染色 左侧多裂肌经40 g/L多聚甲醛溶液固定满意之后,常规梯度乙醇脱水,石蜡包埋,连续切片,然后对切片进行二甲苯脱蜡,梯度乙醇水洗;苏木精染色5分钟,自来水冲洗;盐酸乙醇分化10秒,自来水冲洗10分钟,置于伊红液2分钟,经苏木精-伊红染色后,再脱水、透明,封固。光镜下观察组织结构变化。
1.6.2 免疫组化法及酶联免疫吸附法检测大鼠多裂肌LIF、IL-17的表达 免疫组化:60℃烤片6小时,常规二甲苯脱蜡、梯度乙醇脱水,热修复抗原,PBS冲洗,过氧化氢封闭10分钟,滴加一抗,4℃孵育16小时,加二抗,DAB显色,显微镜下观察,出现棕黄色后即把切片放入自来水冲洗终止反应,复染,脱水透明,中性树胶封片。显微镜下观察、采集图像,采用Imageprofessional Plus 6.0软件进行图像分析。LIF、IL-17的结果判读方法:LIF、IL-17的阳性染色模式为胞浆着色,呈现黄色或棕黄色颗粒;染色判断标准:阴性胞浆未见着色,弱阳性胞浆内颗粒较细,呈淡黄色,显色高于背景,强阳性胞浆内阳性颗粒粗而多,呈棕黄色甚至棕褐色,显色明显高于背景。光镜下,全视野无偏采样方法,每张切片选取5个视野,进行图像分析,测量每个视野中LIF、IL-17阳性表达区域的平均光密度值(mean optical density,MOD),取平均值为该样本MOD值。酶联免疫吸附法:多裂肌上清液采用双抗体夹心ELISA方法,参照试剂盒说明书进行。
1.7 统计学处理
2 结果
2.1 组织形态学变化
空白组:纵切面可见排列紧密、规律的纵向肌纤维,肌纤维粗细均匀,肌间隙大小基本一致,可见有若干个胞核分布于每个肌纤维膜下。横切面可见肌细胞呈较为规则的多边形,大小均匀,排列整齐,肌间隙大小一致,一个或数个胞核位于细胞的边缘。见图1AB。
模型对照组:纵切面和横切面观察均与空白组类似,偶见细胞间质轻微水肿,肌纤维排列仍整齐,形态未见明显异常。见图1CD。
模型组:纵切面可见肌纤维有断裂,排列不齐,肌细胞出现少量损伤坏死,肌间隙有炎细胞浸润。横切面可见肌细胞大小不一,形态各异,有明显的坏死,肌间隙有大量的炎细胞分布。见图1EF。
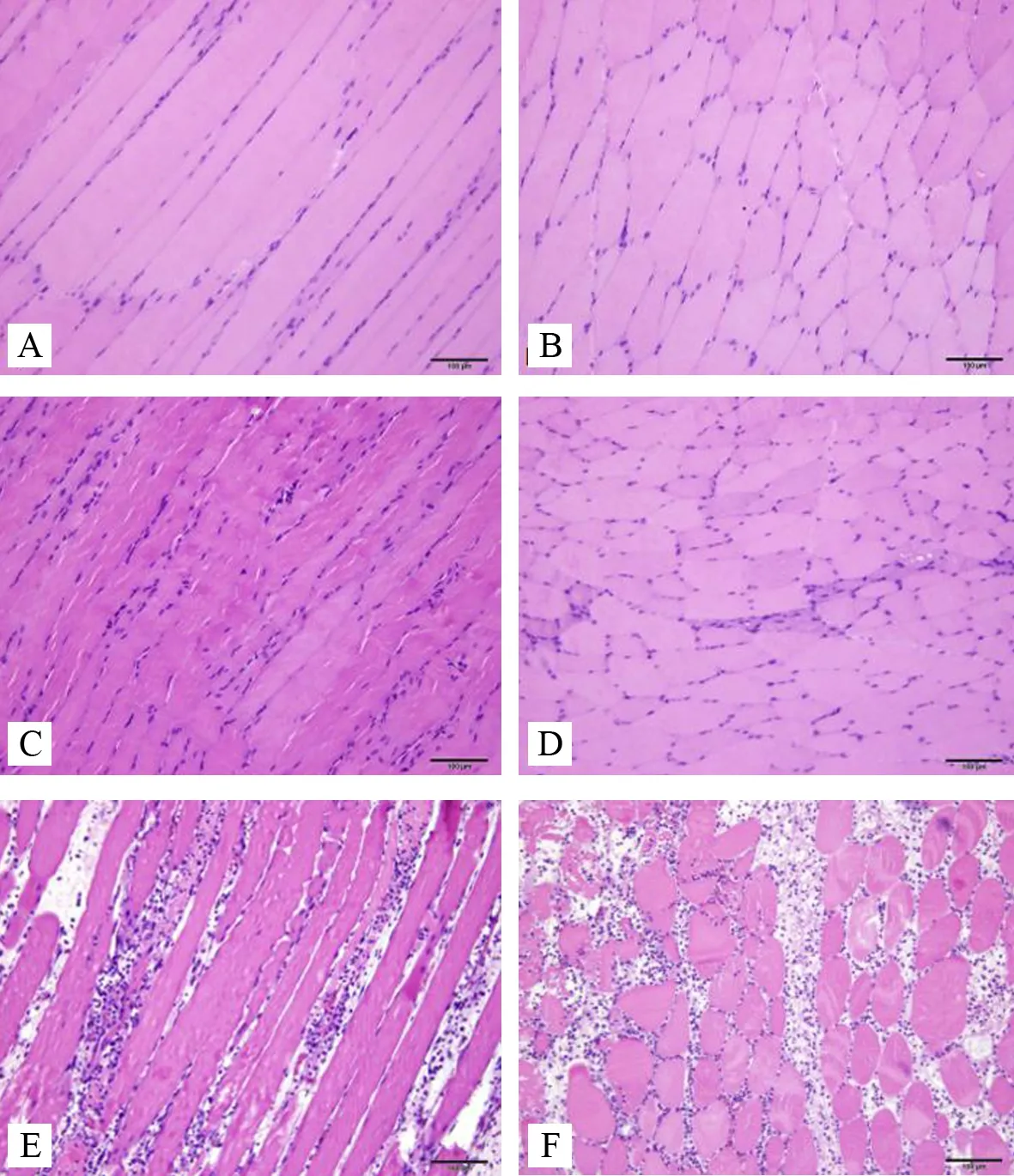
注: A.空白组(纵切面);B.空白组(横切面); C.模型对照组(纵切面);D.模型对照组(横切面); E.模型组(纵切面);F.模型组(横切面)
图1 各组大鼠腰多裂肌1天HE染色(×100)
2.2 免疫组化法检测大鼠多裂肌IL-17及LIF的表达
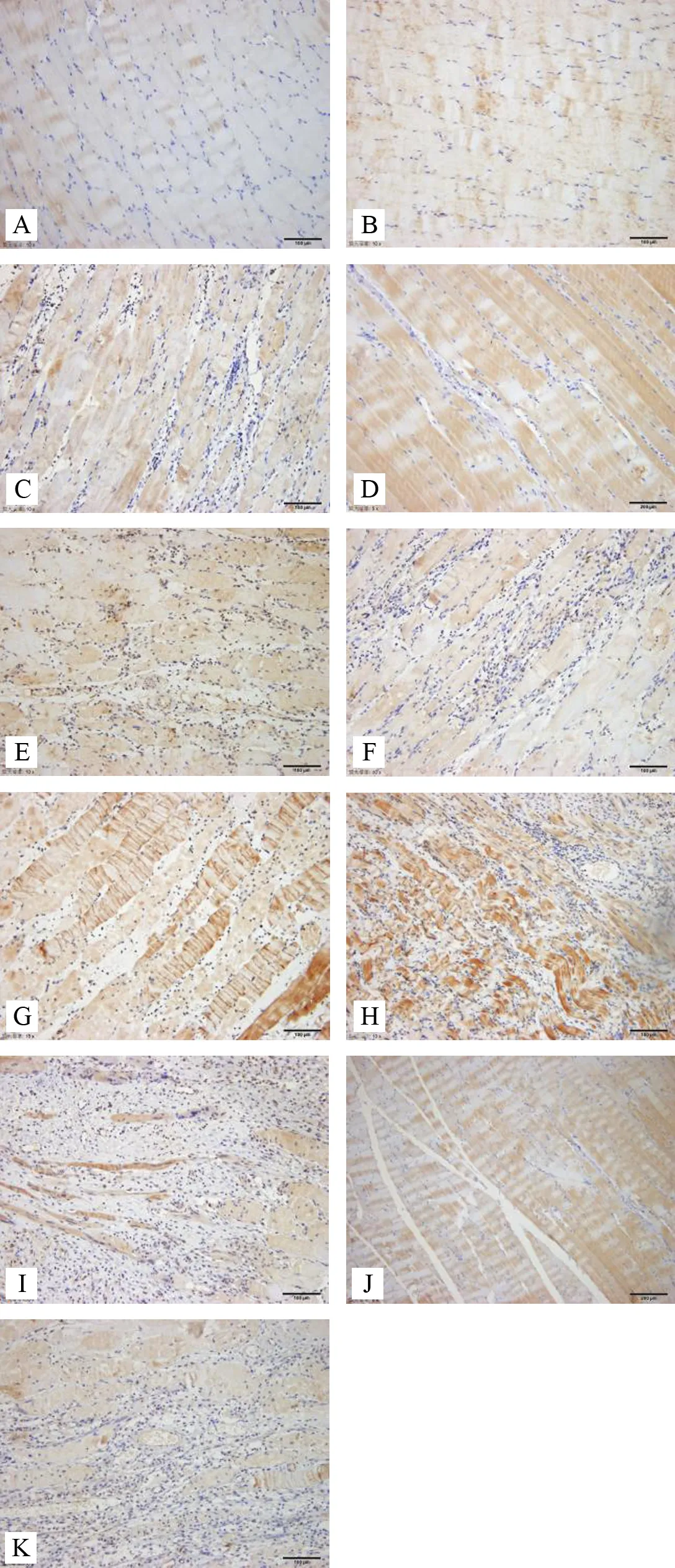
结果如表1所示,针刺1天:与模型组比较,委中组、肾俞组IL-17表达含量减少(P<0.01);与电针肾俞组比较,委中组表达含量减少,差异有统计学意义(P<0.05);针刺3天:与模型组比较,委中组、肾俞组 IL-17表达含量减少(P<0.01,P<0.05);与电针肾俞组比较,委中组表达含量减少,但差异无统计学意义(P>0.05);针刺7天:与模型组比较,模型对照、委中、肾俞组IL-17表达含量减少(P<0.01);与电针肾俞组比较,委中组表达含量减少,但差异无统计学意义(P>0.05)。各组大鼠不同时段腰多裂肌IL-17表达免疫组化染色结果见图2。
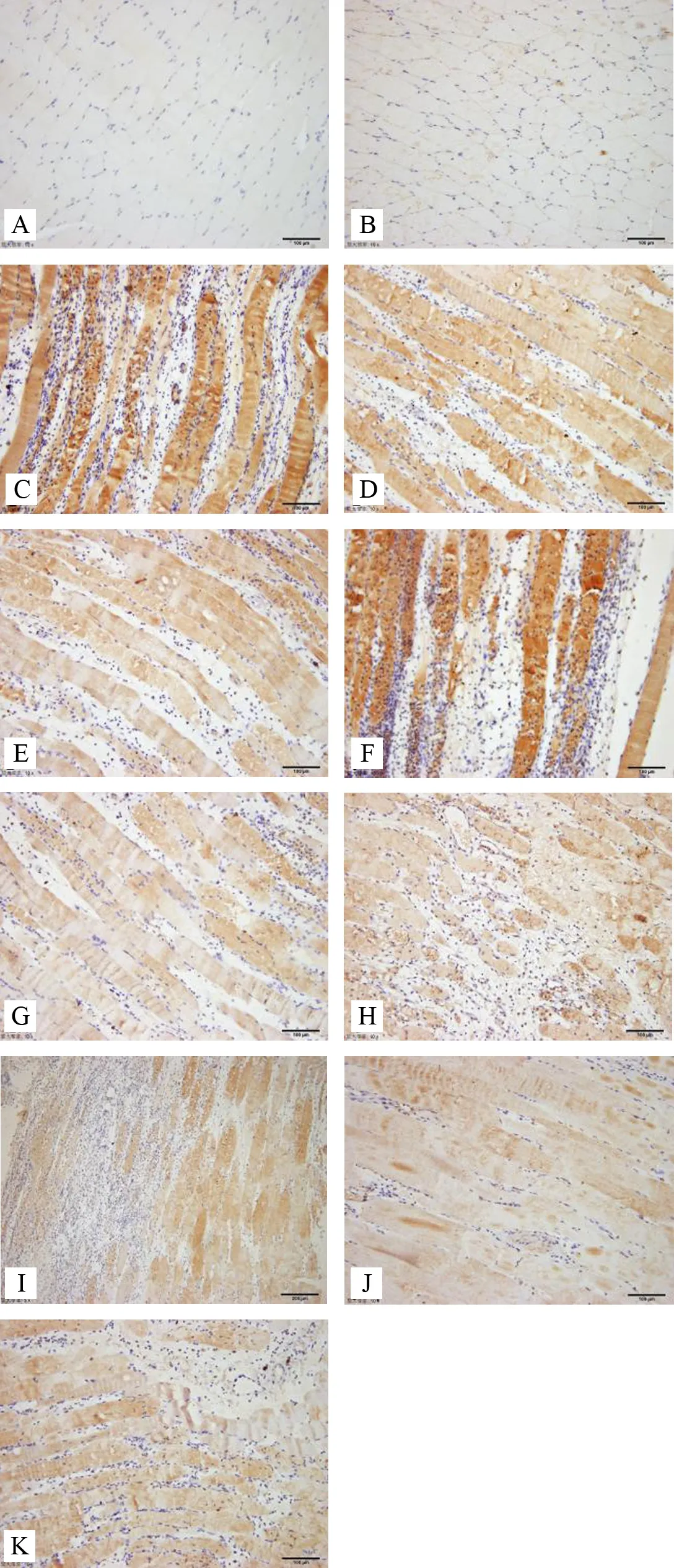
注:A.空白组;B.模型对照组;C.模型组1天;D.电针委中组1天;E.电针肾俞组1天;F.模型组3天;G.电针委中组3天; H.电针肾俞组3天;I.模型组7天;J.电针委中组7天; K.电针肾俞组7天
图2 各组大鼠不同时段腰多裂肌IL-17表达免疫组化染色(×100)
表1 各组大鼠不同时段多裂肌IL-17表达MOD值比较
注: 与空白组比较,aP<0.01;与模型组比较,bP<0.01,cP<0.05;与电针肾俞组比较,dP<0.05。
结果如表2显示,针刺1天:与空白组比较,模型组、委中组、肾俞组LIF表达含量迅速增加(P<0.01),模型对照组表达含量有所升高,但差异无统计学意义(P>0.05);与模型组比较,委中组、肾俞组LIF表达含量增加(P<0.01);与电针肾俞组比较,委中组表达含量升高,但差异无统计学意义(P>0.05);针刺3天:与空白组比较,模型组、委中组、肾俞组LIF表达含量增加(P<0.01),模型对照组表达含量增加,但差异无统计学意义(P>0.05);与模型组比较,委中组LIF表达含量升高(P<0.01),肾俞组表达含量降低,差异有统计学意义(P<0.05);与电针肾俞组比较,委中组表达含量升高(P<0.01);针刺7天:与空白组比较,对照、模型、委中、肾俞组LIF表达含量增加(P<0.01);与模型组比较,委中组LIF表达含量增加(P<0.01),肾俞组表达含量降低,差异无统计学意义(P>0.05);与电针肾俞组比较,委中组表达含量升高,差异有统计学意义(P<0.01)。各组大鼠不同时段腰多裂肌LIF表达免疫组化染色结果见图3。
表2 各组大鼠不同时段多裂肌LIF表达MOD值比较
注: 与空白组比较,aP<0.01;与模型组比较,bP<0.01,cP<0.05;与电针肾俞组比较,dP<0.05。
2.3 酶联免疫吸附法检测大鼠多裂肌IL-17和LIF的表达
注:A.空白组;B.模型对照组;C.模型组1天;D.电针委中组1天;E.电针肾俞组1天;F.模型组3天;G.电针委中组3天; H.电针肾俞组3天;I.模型组7天;J.电针委中组7天; K.电针肾俞组7天
图3 各组大鼠不同时段腰多裂肌LIF表达免疫组化染色(×100)
结果如表3所示,针刺1天:与空白组比较,模型组、肾俞组IL-17表达含量增加(P<0.01);与模型组比较,模型对照组、委中组IL-17表达含量减少(P<0.01);与电针肾俞组比较,委中组表达含量减少(P<0.05);针刺3天:与空白组比较,模型对照组、模型组、肾俞组IL-17表达含量增加(P<0.01);委中组IL-17(P<0.05);与模型组比较,委中组IL-17表达含量减少(P<0.01);与电针肾俞组比较,委中组表达含量减少,但差异统计学意义(P>0.05);针刺7天:与空白组比较,模型对照、模型、委中、肾俞组IL-17表达含量增加(P<0.01);与模型组比较,模型对照、委中、肾俞组IL-17表达含量减少(P<0.01);与电针肾俞组比较,委中组表达含量减少,但差异无统计学意义(P>0.05)。
表3 各组大鼠不同时段多裂肌IL-17表达量比较
注: 与空白组比较,aP<0.01,bP<0.05;与模型组比较,cP<0.05;与电针肾俞组比较,dP<0.05。
结果如表4所示,针刺1天:与空白组比较,模型组、委中组、肾俞组LIF表达含量迅速升高(P<0.01),模型对照组表达含量有所升高,但差异无统计学意义(P>0.05);与模型组比较,委中组、肾俞组LIF表达含量升高(P<0.01、P<0.05);与电针肾俞组比较,委中组表达含量升高,但差异无统计学意义(P>0.05);针刺3天:与空白组比较,模型组、委中组、肾俞组LIF表达含量增加(P<0.01),模型对照组表达含量增加,差异无统计学意义(P>0.05);与模型组比较,委中组LIF表达含量升高(P<0.01),肾俞组表达含量降低(P>0.05);与电针肾俞组比较,委中组表达含量升高(P<0.01);针刺7天:与空白组比较,对照、模型、委中、肾俞组LIF表达含量增加(P<0.01);与模型组比较,委中组LIF表达含量增加(P<0.01),肾俞组表达含量降低(P>0.05);与电针肾俞组比较,委中组表达含量升高,差异有统计学意义(P<0.01)。
表4 各组大鼠不同时段多裂肌LIF表达量比较
注: 与空白组比较,aP<0.01;与模型组比较,bP<0.01,cP<0.05;与电针肾俞组比较,dP<0.01,eP<0.05。
3 讨论
骨骼肌损伤后,炎性坏死组织的降解和吸收以及肌纤维的修复和再生是“祛邪”“生新”的过程,针刺能疏通经络、行气活血、祛瘀生新,促进组织的修复和再生。电针是临床上治疗骨骼肌损伤的重要手段,在辅助针刺镇痛和促进骨骼肌损伤修复中疗效较佳。委中和肾俞是临床治疗腰痛使用频率最高的前两位效穴[15]。“腰背委中求”是《四总穴歌》对委中治疗腰痛特异性疗效的经典总结。作为膀胱经的下合穴,委中穴在临床上多用来治疗急性腰扭伤、脊柱强直、坐骨神经痛、腰椎间盘突出症等急性腰背痛;而肾俞穴是治疗腰痛的局部取穴,也是肾的背俞穴,多用来治疗慢性腰肌劳损,肾虚腰痛、慢性疲劳综合征等慢性病症。
骨骼肌损伤后,首先在损伤的局部出现肌纤维结构的破坏、变性和坏死,之后炎症细胞和致炎因子浸润至损伤部位。IL-17是由TH17细胞分泌的一种强有力的前炎症细胞因子,具有强大的募集中性粒细胞及促进多种炎性细胞因子释放的作用,可以激活以及刺激巨噬细胞、成纤维细胞、上皮细胞、内皮细胞产生多种致炎因子,包括白介素-1、白介素-6、肿瘤坏死因子α、化学增活素、金属蛋酶和诱导型一氧化氮合成酶等[16],从而导致炎症的发生。本实验结果显示多裂肌损伤后模型组IL-17大量表达,且呈现不同时相的递增趋势,电针组可明显降低IL-17含量的表达,且电针委中组降幅最大,这说明电针委中组在骨骼肌损伤早期可能通过下调前炎症因子IL-17的过度表达,降低炎症反应的剧烈程度,缩短肌细胞坏死的进程,从而发挥“祛邪”“生新”的作用,促进骨骼肌修复。
骨骼肌是人体最大的内分泌器官,骨骼肌损伤后,其分泌的肌肉因子可通过自分泌或旁分泌的形式作用于骨骼肌或者其他的组织和器官[8-9]。目前发现的肌肉因子包括白介素-6、白介素-15、肌肉素、脑源性神经营养因子等[7,16]。作为白介素-6家族的重要成员,LIF在促进骨骼肌卫星细胞增殖[18]、促进骨骼肌中葡萄糖的摄取[19-20],以及促进骨骼肌损伤修复[11]和加速骨骼肌再生[17]方面有重要作用。
在完整未损伤的小鼠[21]和人类[22]骨骼肌中LIF mRNA的表达量非常低,在创伤和肌营养不良的肌肉中其表达量显著升高[23-24]。Srikuea等[25]发现wistar大鼠腓肠肌挫伤后3小时,LIF mRNA是非损伤对照组的7倍,LIF mRNA在腓肠肌挫伤后6 小时的表达量是非挫伤对照组的9倍,之后它的表达量缓慢下调。本实验结果显示:造模1、3、7天后,空白组LIF表达含量较低,而模型对照组、模型组、电针委中组、电针肾俞组的LIF表达含量出现先增高后缓慢下调的趋势与Srikuea的研究一致,其中电针组的LIF表达含量高于模型组,电针委中组高于电针肾俞组,说明电针委中和电针肾俞均可促进LIF含量的表达,参与肌肉的损伤修复,但电针委中组作用更佳。
综上,电针干预治疗可下调IL-17的过度表达,减轻炎症反应的剧烈程度,缩短骨骼肌坏死进程;电针干预可促进LIF的适度表达,促进骨骼肌中葡萄糖的摄取;电针委中在骨骼肌损伤早期可减轻肌纤维坏死程度,促进肌纤维的有序排列,加速损伤肌纤维的再生,这为骨骼肌损伤早期针刺远端取穴疗效优于局部取穴提供重要依据。
[1] Wagner H, Anders C, Puta C,et al.Musculoskeletal support of lumbar spine stability[J].Pathophysiology:the official journal of the International Society for Pathophysiology/ISP,2005,12(4):257-265.
[2] Tumer NJ,Badylak SF.Regeneration of skeletal muscle[J].Cell and Tissue Research,2012,347 (3):759-774.
[3] Henningsen J, Rigbolt KT, Blagoev B, et al. Dynamics of the skeletal muscle secretome during myoblast differentiation[J]. Mol Cell Proteomics, 2010, 9(11): 2482-2496.
[4] Stranska Z, Svacina S. Myokines-muscle tissuehormones[J]. Vnitrni lekarstvi, 2015, 61(4): 365-368.
[5] Pedersen BK, Steensberg A, Fischer C, et al.Searching for the exercise factor: is IL-6 a candidate?[J]. J Muscle Res Cell Motil, 2003, 24(2): 113-119.
[6] Pedersen BK, Febbraio MA. Muscles, exercise and obesity: skeletal muscle as a secretoryorgan[J]. Nat Rev Endocrinol, 2012, 8(8): 457-465.
[7] Pedersen BK. Muscles and theirmyokines[J]. J Exp Biol, 2011, 214(Pt 2): 337-346.
[8] Pedersen BK. Muscle as a secretoryorgan[J]. Compr Physiol, 2013, 3(3): 1337-1362.
[9] Pratesi A,Tarantini F,Di Bari M.Skeletal muscle:an endocrineorgan[J]. Clin Cases Miner Bone Metab, 2013, 10(1): 11-14.
[10] Stranska Z, Svacina S. Myokines-muscle tissuehormones[J]. Vnitrni lekarstvi, 2015, 61(4): 365-368.
[11] Broholm C, Laye MJ, Brandt C, et al. LIF is a contraction-induced myokine stimulatinghuman myocyte proliferation[J]. J Appl Physiol, 2011, 111(1): 251-259.
[12] Kurek JB, Bower JJ, Romanella M, et al. The role of leukemia inhibitory factor in skeletal muscle regeneration[J]. Muscle Nerve, 1997, 20(7): 815-822.
[13] Spangenburg EE, Booth FW. Leukemia inhibitory factor restores the hypertrophic response to increased loading in theLIF(-/-) mouse[J]. Cytokine, 2006, 34(3-4): 125-130.
[14] 李忠仁.实验针灸学[M].北京:中国中医药出版社,2003:316.
[15] 贾红玲,张学伟,张永臣.数据挖掘技术在针灸治疗腰痛古代文献中的应用[J].针灸临床杂志,2013,29(11):40-41.
[16] 陈昭品,陈志坚,曾秋棠,等.白细胞介素-17对大鼠心肌梗死后室性心律失常的影响[J].临床心血管病杂志,2012,28(6):422-426.
[17] Nicola NA, Babon JJ. Leukemia inhibitory factor (LIF)[J]. Cytokine Growth Factor Rev, 2015, 26(5): 533-544.
[18] Henningsen J, Rigbolt KT, Blagoev B, et al. Dynamics of the skeletal muscle secretome during myoblastdifferentiation[J]. Mol Cell Proteomics, 2010, 9(11): 2482-2496.
[19] Metcalf D. The unsolved enigmas of leukemia inhibitory factor[J]. Stem cells, 2003, 21(1): 5-14.
[20] Brandt N, O’Neill HM, Kleinert M, et al. Leukemia inhibitory factor increases glucose uptake in mouse skeletal muscle[J]. Am J Physiol Endocrinol Metab, 2015, 309(2):E412-E453.
[21] Brandt N, O’Neill H, Kleinert M, et al. Leukemia inhibitory factor stimulates muscle glucose uptake by a PI3-kinase dependent pathway that is maintained in white muscle in obesity[J]. The Faseb J, 2014, 28: 1162-1164.
[22] Brown MA,Metcalf D, Gough NM. Leukaemia inhibitory factor and interleukin 6 are expressed at very lowlevels in the normal adult mouse and are induced by inflammation[J]. Cytokine, 1994, 6(9): 300-309.
[23] Reardon KA, Kapsa RM, Davis J, et al. Increased levels of leukemia inhibitory factor mRNA in muscularstrophy and human muscletrauma[J]. Muscle Nerve, 2000, 23(6): 962-966.
[24] Kurek JB, Nouri S, Kannourakis G, et al. Leukemia inhibitory factor and interleukin-6 are produced by diseased and regenerating skeletalmuscle[J]. Muscle Nerve,1996, 19(10): 1291-1301.
[25] Srikuea R, Esser KA, Pholpramool C. Leukaemia inhibitory factor is expressed in rat gastrocnemius muscle after contusion and increases proliferation of rat L6 myoblastsvia c-Myc signalling[J]. Clin Exp Pharmacol Physiol, 2011,38(8): 501-509.
(本文编辑: 韩虹娟)
Effects of electroacupuncture “Weizhong” (BL 40) on the expression of LIF and IL-17 in rats with multifidus muscle injury
ZOUDehui,LUZongxiao,YANJun,etal.
Acupuncture-MoxibustionandTuina,BeijingUniversityofTraditionalChineseMedicine,Beijing100029,China
ZHANGLi,E-mail:zhangli1572@sina.com
Objective To observe the effect of electroacupuncture (EA) stimulate at “Weizhong”(BL 40) on the expression of leukaemia inhibi-tory factor(LIF)and interleukin-17(IL-17)in rats with multifidus muscle injury.Methods A total of 90 rats were randomly divided into blank group, model control group, model group, EA “Weizhong”(BL 40) group and a EA “Shenshu”(BL 23) group, 18 rats in each group. Each group was randomly divided into a 1-day subgroup, a 3-day subgroup and a 7-day subgroup again, 6 rats in each subgroup. Both sides of multifidus muscle (L4 and L5) were injected with 0.5% bupivacaine. The morphological and ultrastructural changes of multifidus muscle were observed and analyzed with light microscope at 1st, 3rd, 7th day after model establishment. The expression of leukaemia inhibi-tory factor(LIF)and interleukin-17(IL-17)was measured by immunohistochemical method and elisa method.Results After modeling, compared with the blank group, the expression of LIF and IL-17 in multifidus muscle of model group was significantly increased(P<0.01); Compared with the model group, the expression of the LIF were significantly increased(P<0.01) and the expression of IL-17 in multifidus muscle was significantly decreased(P<0.01) in the EA “Weizhong” group and EA “Shenshu” group. Compared with EA “Shenshu” group, the expression of the IL-17 in multifidus muscle was significantly decreased at 1th day; the expression of LIF was significantly increased at 3th day and 7th day. Conclusion EA “Weizhong”(BL 40) can increase the expression of LIF and decrease the expression of IL-17, and can reduce inflammatory reaction and promote skeletal muscle glucose uptake, so as to be beneficial to skeletal muscle repair.
Multifidus muscle; Damage respair; Inflammatory factor; Leukaemia inhibitory factor; Interleukin-17
国家自然科学基金面上项目(81574052)
100029 北京中医药大学针灸推拿学院[邹德辉(硕士研究生)、卢宗孝(硕士研究生)、晏珺(硕士研究生)、陈冬荔(硕士研究生)、张佳怡(硕士研究生)、许玥(硕士研究生)、陈玉佩(博士研究生)、白玉琢(博士研究生)、张莉];广东省第二中医医院(刘通);北京大学第三医院中医科(霍则军)
邹德辉(1989- ),2014级在读硕士研究生。研究方向:针灸临床作用机制研究。E-mail:1198916301@qq.com
张莉(1958- ),女,博士,教授。研究方向:针灸临床作用机制研究。E-mail:zhangli1572@sina.com
R245
A
10.3969/j.issn.1674-1749.2017.04.012
2016-10-19)
