急性单核细胞白血病患者分子遗传学特征分析
2017-06-20刘洁周民晁红颖姜乃可卢绪章
刘洁+周民+晁红颖+姜乃可+卢绪章
【摘要】 目的 綜合检测急性单核细胞白血病(AML-M5)患者DNMT3A、FLT3-ITD、NPM1等基因突变发生情况, 初步探讨AML-M5患者的分子遗传学特征。方法 采用基因组DNA-聚合酶链反应(PCR)扩增产物直接测序法检测NPM1基因12号外显子、c-KIT基因8、17号外显子、DNMT3A热点突变、CEBPA全部编码区及FLT3基因14、15号外显子中ITD的突变发生情况;荧光原位杂交(FISH)检测MLL重排发生情况;多重PCR检测29种常见白血病融合基因发生情况。结果 ①82例患者异常核型检出率为37.80%(31/82), 其中涉及11q23者占48.39%(15/31)。15例11q23异常患者经FISH检测均发现MLL重排阳性, 该组患者平均年龄47.1岁, 平均外周白细胞水平59.03×109/L, 经常规化疗方案诱导后完全缓解(CR)率40.00%(6/15)。其他异常核型占51.61%(16/31), 平均年龄32.3岁, 平均外周白细胞水平13.41×109/L, CR率为56.25%(9/16)。正常核型51例, 平均年龄43.3岁, 平均外周白细胞水平42.74×109/L, CR率为76.47%(39/51)。不管何种染色体核型异常CR率比较差异无统计学意义(P>0.05), 正常核型患者CR率高于11q23异常患者(P<0.05)。②70例进行基因突变检测的AML-M5患者中, 48.57%的患者具有一种及以上基因突变, 依次为FLT3-ITD(30.00%)、DNMT3A(24.29%)、NPM1(17.14%)、CEBPA(8.57%)、c-KIT(1.43%)。③正常核型中基因突变比例明显高于11q23重排患者, 差异具有统计学意义(P<0.05), 不同基因突变发生年龄、性别及CR率有一定的差异。结论 11q23是AML-M5患者最为常见的染色体核型异常, 伴此种异常者预后不良。基因突变的总发生率48.75%, 以FLT3-ITD突变多见, 而CEBPA、c-KIT基因突变则是AML-M5中较少见的基因异常, 突变在正常核型患者中常见, 其与临床特点及疗效有一定的相关性。
【关键词】 急性单核细胞白血病;突变基因;核型
DOI:10.14163/j.cnki.11-5547/r.2016.36.002
【Abstract】 Objective To comprehensively detect gene mutation of DNMT3A, FLT3-ITD and NPM1 in acute monocytic leukemia (AML-M5) patients, for preliminary discussion molecular genetic characteristics in AML-M5 patients. Methods Occurrence of gene mutation in exon 12 of NPM1 gene, exon 8 and exon 17 of c-KIT gene, hot spot mutation of DNMT3A, all coding regions of CEBPA, exon 14 and exon 15 of FLT3 gene were detected by genomic DNA-polymerase chain reaction (PCR) amplification product direct sequencing method. Occurrence of MLL rearrangement was detected by fluorescence in situ hybridization (FISH), and 29 kinds of common leukemia fusion gene were detected by multiple PCR detection. Results ①82 patients had abnormal karyotype detection rate as 37.80% (31/82), including 48.39% (15/31) of 11q23 cases. 15 patients with abnormal 11q23 all had detected MLL rearrangement by FISH, with average age as 47.1 years old, mean peripheral white blood cell level as 59.03×109/L, adn complete remission (CR) rate after induction of conventional chemotherapy regimens as 40.00% (6/15). The other abnormal karyotype accounted for 51.61% (16/31), wih average age as 32.3 years old, mean peripheral white blood cell level as 13.41×109/L, and CR rate as 56.25% (9/16). There were 51 normal karyotype cases, with average age as 43.3 years old, mean peripheral white blood cell level as 42.74×109/L, CR rate as 76.47% (39/51). There was no statistically significant difference in CR rate of all types of abnormal chromosome karyotype (P>0.05), and the normal karyotype patients had higher CR rate than abnormal 11q23 patients (P<0.05). ②Among 70 AML-M5 patients received gene mutations detection, 48.57% of patients had one or more than one kind of gene mutations, with FLT3-ITD (30.00%), DNMT3A (24.29%), NPM1 (17.14%), CEBPA (8.57%), and c-KIT (1.43%) in order. ③Normal karyotype had higher Gene mutation ratio than 11q23 rearrangement patients, and the difference had statistical significance (P<0.05). Different mutations had certain differences in age, sex and CR rate. Conclusion 11q23 is most common abnormal chromosome in AML-M5 patients, and always complicated with bad prognosis. Total incidence of gene mutations is 48.75%, of which FLT3-ITD is common, while CEBPA and c-KIT gene mutations are rare genetic abnormality in AML-M5. Mutations are normal in patients with normal karyotype, and it has correlation to clinical features and curative effect.
【Key words】 Acute monocytic leukemia; Mutant gene; Karyotype
急性单核细胞白血病(acute monocytic leukemia, AML-M5)是一种特殊类型的急性髓系白血病, 表现为外周血及骨髓原始和幼稚单核细胞增多, 常伴有髓外浸润及高白细胞, 复发率高, 病程凶险, 3年平均无病生存率低, 临床预后极差[1]。既往研究表明, 11q23是AML-M5亚型中最常见的的染色体核型异常, 但此类患者的预后仍存在异质性。近年, 随着高通量DNA测序技术的应用与推广, 一些热点基因突变逐渐被证实与患者临床特点及预后有较大相关性。本研究回顾性研究了近年来收治的82例AML-M5患者的染色体核型、MLL重排及DNMT3A、CEBPA、FLT3-ITD、NPM1、c-KIT等多基因突变与部分临床参数间的相关性, 初步探讨AML-M5患者的分子遗传学特征及预后价值, 现报告如下。
1 资料与方法
1. 1 一般资料 回顾性分析2006~2016年于常州市第二人民医院住院的82例AML-M5患者的临床资料。其中男41例, 女41例, 平均年龄42岁。诊断和疗效标准参照《血液病诊断及疗效标准》[2]。临床治疗采用常规化疗方案。
1. 2 细胞遗传学分析 染色体标本制备均采用常规方法, 部分采用直接法, 部分则同时采用直接法、24 h短期培养法。核型分析采用R显带技术, 平均每例分析中期分裂相20个。核型异常的描述按人类细胞遗传学国际命名体制ISCN(2009)[3]。
1. 3 MLL重排及融合基因检测 参考文献[4], 采用FISH双色探针进行MLL重排检测;参考文献[5], 采用多重PCR检测29种常见白血病融合基因。
1. 4 基因突变检测 取患者初诊时骨髓单个核细胞1.0×107个, 用DNA抽提试剂盒(美国Gentra公司产品)抽提基因组DNA, 根据吸光度(A)260确定DNA产物浓度, 用DNA稀释液将基因组DNA样品稀释至50 ng/μl。参照文献[6], 采用基因组DNA-PCR及琼脂糖电泳方法检测所有患者FLT3基因外显子14、15中ITD突变及20号外显子TKD突变, 阳性标本进一步测序证实;参照文献[7, 8], 分别扩增NPM1基因第12号外显子、DNMT3A热点突变及c-KIT基因8号和17号外显子, 擴增产物进行直接测序;参照文献[9], 采用PCR分段扩增CEBPA编码区后进行直接测序。测序由南京GenScrip有限公司完成, 结果与正常序列比对, 检出突变。
1. 5 统计学方法 采用SPSS18.0统计学软件处理数据。计数资料以率(%)表示, 采用χ2检验。P<0.05表示差异具有统计学意义。
2 结果
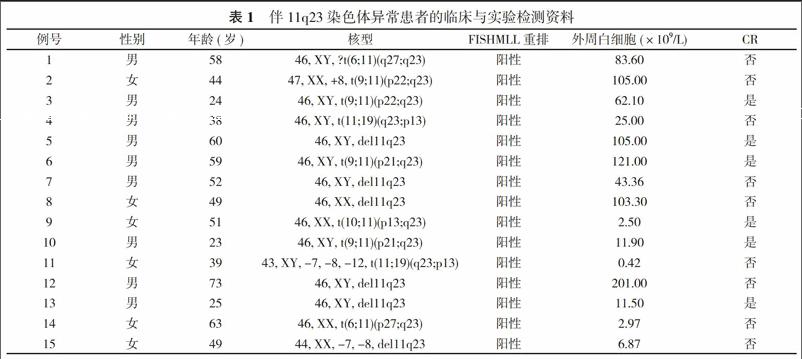
2. 1 染色体核型、MLL重排与部分临床参数间的相关性分析 82例患者异常核型检出率为37.80%(31/82), 其中涉及11q23者占48.39%(15/31)。15例11q23异常患者经FISH检测均发现MLL重排阳性, 该组患者平均年龄47.1岁, 平均外周白细胞水平59.03×109/L, 经常规化疗方案诱导后完CR率40.00%(6/15)。见表1。其他异常核型占51.61%(16/31), 平均年龄32.3岁, 平均外周白细胞水平13.41×109/L, CR率为56.25%(9/16), 其中1例伴Ph+染色体, 初次诱导治疗未达缓解, 最终死于重症感染, 另见1例t(8;16)(p11;p13)患者, 该患者有乳腺癌病史, 曾反复化疗, 考虑继发性急性单核细胞白血病, 两次诱导均未达缓解, 最终死于颅内出血, 总体生存时间仅2个月。正常核型51例, 平均年龄43.3岁, 平均外周白细胞水平42.74×109/L, CR率为76.47%(39/51)。不管何种染色体核型异常CR率比较差异无统计学意义(P>0.05), 正常核型患者CR率高于11q23异常患者(P<0.05)。
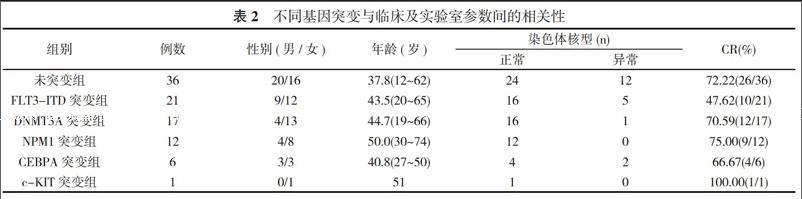
2. 2 多重PCR检测及DNMT3A、CEBPA、FLT3-ITD、NPM1、c-KIT基因突变分析 82例患者中75例进行了多重PCR检测, 异常检出率为32.00%(24/75), 伴MLL重排患者21例, 发生率28.00%(21/75), 另有1例检测到BCR/ABL融合基因。70例患者进行了基因突变检测, 总的突变发生率为48.57%(34/70)。其中, 15例伴有11q23/MLL重排者, 突变检出率为13.33%(2/15);16例其他异常核型患者突变发生率为43.75%(7/16);51例正常核型者突变检出阳性病例25例(49.02%)。正常核型患者基因突变发生率明显高于11q23重排患者(P<0.05)。突变发生率依次为FLT3-ITD(30.00%)、DNMT3A(24.29%)、NPM1(17.14%)、CEBPA(8.57%)、c-KIT(1.43%)。FLT3-ITD突变主要发生于正常核型组, 在首次化疗后获得完全缓解者10例。17例患者检出DNMT3A突变, 其中3例同时合并FLT3突变, 4例与NPM1突变共存, 4例同时具有DNMT3A、FLT3、NPM1突变。DNMT3A突变阳性患者染色体核型以正常核型为主(94.12%), 1例为单体核型, 所有11q23/MLL重排患者中均未检测到DNMT3A突变。12例患者检出NPM1突变阳性, 合并FLT3突变阳性者6例, 染色体核型均为正常核型, 其中9例患者早首次诱导化疗后获得完全缓解。6例患者具有CEBPA突变阳性, 正常核型伴CEBPA突变者4例, 1例为Ph+核型, 1例同时合并NPM1、DNMT3A突变阳性, 3例同时合并FLT3突变阳性。其中4例患者在首次诱导化疗后获得完全缓解。仅1例患者检测到c-KIT突变。见表2。
3 讨论
3. 1 细胞遗传学 细胞遗传学异常是决定AML患者临床特点和预后的重要指标之一。国外报道M5患者染色体核型异常率为48.8%~71.2%, 本组结果显示有染色体核型异常者占37.80%(31/82), 与报道相近。11q23异常导致MLL基因发生重排, 在M5中的发生率较高, 有该核型异常的恶性血液病完全缓解率低, 生存期短[10]。本组所有发生核型异常的患者与11q23相关的为48.39%(15/31), 国外文献报道80% 11q23异常的病例为M5, 进一步证实了这一点。本组伴11q23异常的完全缓解率40.00%(6/15), 低于所有患者的平均缓解率65.85%(54/82)。经统计学分析伴11q23缺失的患者CR率与核型正常患者比较差异有统计学意义(P<0.05), 进一步验证了伴11q23异常的患者预后较差。伴t(8;16)(p11;p13)易位的AML是一种非常罕见的白血病亚型, 发生率<1%, 总结国外文献发现[11, 12], 此类患者主要表现为急性粒-单核细胞白血病(AML-M4)或M5, 女性多见, 平均年龄约60岁, 大部分患者继发于单一实体肿瘤(57%), 其中以乳腺癌最多见, 常规化疗往往无效, 生存期短, 预后极差。与国外报道一致, 本组研究中发现1例该核型异常, 继发于乳腺癌, 为61岁中老年女性, 两次诱导均未达缓解, 最终死于颅内出血, 总体生存时间仅2个月。Ph染色体和BCR-ABL融合基因是CML患者的特征性异常, 既往文献报道也出现在0.9%~3.0% AML患者中[13], 本组研究中发现1例Ph+患者, 占1.22%, 与之前的报道相仿。Ph+AML缓解率低, 预后差, 生存期短, 治疗上尚无统一的方案, 目前认为化疗联合TKI, 并在CR后尽早行allo-HSCT是改善患者生存的唯一有效途径[14]。本组研究中该患者初次常规方案诱导未缓解, 最终死于重症感染, 需要更多样本、多中心的研究来进一步验证。
3. 2 分子生物学 AML的起病、发展及预后除了与染色体核型异常有关外, 还与一些基因突变有关, 如FLT3、NPM1、CEBPA等, 近年来发现越来越多的基因与预后具有相关性, 并将其应用到白血病的发病机制中。
NPM1和FLT3-ITD突变是AML患者中最常见的基因异常, 国内外学者研究结果[15-17]发现FLT3-ITD和NPM1在AML的发生率分别为20%~35%和1/3, 以M5多见, 正常核型中表达较高, 其中NPM1在女性患者中多见, 且FLT3-ITD突变和AML患者的较差的预后相关而NPM1突变通常与更好的预后相关。本研究检测到的FLT3和NPM1突变率为30.00%和17.14%, 核型均以正常核型多见, NMP1突变女性患者占66.67%(8/12), 与国内外报道一致。FLT3突变和NPM1突变患者初始诱导治疗后CR率比较差异无统计学意义(P>0.05), 因未作总体生存率(OS)和无病生存率(DFS)统计, 提示预后依据不足。
关于c-KIT, 其在AML中则有较高的表达, 阳性率在23%~87%[18], 本组研究仅检测到1例c-KIT突变, 远低于文献报道的范围, 但多数研究认为c-KIT表达以M5最低, 支持本次的结果。CEBPA突变则主要集中在正常核型的AML患者中, 多集中在M1、M2型, 本次检测到CEBPA总突变率8.57%(6/70), 在正常核型中的突变率为7.84%(4/51), 低于国内相关的报道, 但与国外大宗研究报道相近[19-21]。值得注意的是, 国外的研究显示CEBPA突变患者具有较高的OS和DFS, 作者同样发现其具有较高的CR率(66.67%), 但由于随访时间短以及部分失访, 未作OS和DFS统計。
AML患者中DNMT3A突变频率高于任何一种其他血液系统疾病, 而AML患者中又以M5频率最高, 在本研究中, 共发现17例DNMT3A突变患者, 突变频率24.29%, 与此前学者的研究结果相近。DNMT3A还与高龄、高白细胞、NPM1突变、FLT3突变及IHDI/2突变密切相关[22-25]。同时Ribeiro等[20]研究证实DNMT3A突变可作为提示AML患者预后不良的危险因素。但本次研究发现伴DNMT3A突变者初次诱导缓解后CR率达70.59%, 与未突变组相比CR率无明显差异, 反而较FLT3突变组CR率高。
本研究回顾性分析了AML-M5患者细胞遗传学及分子生物学特征, 其与临床特点及疗效有一定的相关性。基因突变在白血病包括AML-M5发生过程中起着重要作用, 需进一步研究和证实及寻找具有预后意义的基因, 从而制定更详细的危险分层及治疗方案, 进一步改善患者预后及生存。
参考文献
[1] 上海市白血病协作组. 高白细胞性急性白血病 244 例临床分析. 中华内科杂志, 1997(8):532-535.
[2] 张之南, 沈悌. 血液病诊断及疗效标准. 第3版. 北京:科学出版社, 2007:232-235.
[3] Shaffer L. An international system for human cytogenetic nomenclature. Cytogenetic & Genome Research, 1985, 21(4):241-244.
[4] 柳萍, 张闰, 刘娟, 等. MLL基因重排在成人急性白血病中的检测和临床特征研究. 中国实验血液学, 2012, 20(5):1110-1116.
[5] Pallisgaard N, Hokland P, Riish?j DC, et al. Multiplex reverse transcription-polymerase chain reaction for simultaneous screening of 29 translocations and chromosomal aberrations in acute leukemia. Blood, 1998, 92(2):574-588.
[6] Kiyoi H, Naoe T, Yokota S, et al. Internal tandem duplication of FLT3 associated with leukocytosis in acute promyelocytic leukemia. Leukemia Study Group of the Ministry of Health and Welfare (Kohseisho). Leukemia, 1997, 11(9):1447-1452.
[7] Quentmeier H, Martelli MP, DITks WG, et al. Cell line 0CI/AML3 bears eoxn-12 NPM gene mutation-A and cytoplasmic expression of nucleophosmin. Leukemia, 2005, 19(10):1760-1767.
[8] 李渭阳, 孙爱宁, 吴德沛, 等. 伴t(8;21)M2型急性髓系白血病患者c-kit和JAK2基因突变分析. 中华血液学杂志, 2008, 29(12):797-801.
[9] Smith ML, Cavenagh JD, Lister TA, et al. Mutation of CEBPA in familial acute myeloid leukemia. New England Journal of Medicine, 2004, 351(23):2403-2407.
[10] 周民, 岑岭, 陈涛, 等. 25例急性单核细胞白血病的临床与细胞遗传学分析. 中华医学遗传学杂志, 2007, 24(6):727-728.
[11] Haferlach T, Kohlmann A, Klein HU, et al. AML with translocation t(8;16)(p11;p13) demonstrates unique cytomorphological, cytogenetic, molecular and prognostic features. Leukemia, 2009, 23(5):934-943.
[12] Díaz-Beyá M, Navarro A, Ferrer G, et al. Acute myeloid leukemia with translocation (8;16)(p11;p13) and MYST3-CREBBP rearrangement harbors a distinctive microRNA signature targeting RET proto-oncogene. Leukemia, 2013, 27(3):595-603.
[13] Keung YK, Beatty M, Powell BL, et al. Philadelphia chromo-some positive myelodysplasia syndrome and acute myeloid leukemia-retrospective study and review of literature. Leuk Res, 2004, 28(6): 579-586.
[14] Bhatt VR, Akhtari M, Bociek RG, et al. Allogeneic stem cell transplantation for Philadelphia chromosome-positive acute myeloid leukemia. J Natl Compr Canc Netw, 2014, 12(7):963-968.
[15] Kiyoi H, Yanada M, Ozekia K. Clinical significance of FLT3 in leukemia. Int J Hematol, 2005, 82(2):85-92.
[16] 颜灵芝, 陈苏宁, 梁建英, 等. 急性髓系白血病患者NPM1基因突变分析. 中华血液学杂志, 2007, 28(5):289-293.
[17] Patel JP, Gonen M, Figueroa ME, et al. Prognostic relevance of integrated genetic profiling in acute myeloid leukemia. N Engl J Med, 2012, 366(12):1079-1089.
[18] Nomdedeu JF, Mateu R, Alets A, et al. Enhanced myeloid specificity of CD117 compared with CD13 and CD33. Leuk Res, 1999, 23(4): 341-347.
[19] Fasan A, Haferlach C, Frew M, et al. The role of different genetic subtypes of CEBPA mutated AML. Leukemia, 2013, 28(4):794-803.
[20] Ribeiro A, Pratcorona M, Erpelinckvers chueren CAJ, et al. Mutant DNMT3A: a marker of poor prognosis in acute myeloid leukemia. Blood, 2012, 119(24): 5824-5831.
[21] Ibrahem L, Mahfouz R, Elhelw L, et a1. Prognostic significance of DNMT3A mutations in patients with acute myeloid leukemia. Blood Cells Mol Dis, 2014, 54(1):84-89.
[22] 张广森, 彭宏凌, 戴崇文,等. 原位肝移植后发生急性单核细胞白血病:临床特点和分子遗传学改变及其意义. 中华医学杂志, 2005, 85(49):3504-3508.
[23] 程译帜, 金洁. 急性粒-单核及单核细胞白血病研究进展. 国际输血及血液学杂志, 2008, 31(3):243-246.
[24] 贺敏慧, 陈芳, 张男,等. 急性单核细胞白血病各亚型(M5a和M5b)免疫分型和细胞遗传学及临床特点分析. 现代肿瘤医学, 2013, 21(11):2552-2556.
[25] 仇紅霞, 吴汉新, 徐卫,等. 42例急性单核细胞白血病患者的临床特点及生存分析. 中华血液学杂志, 2008, 29(11):765-767.
