营养胁迫调控弯曲隐球酵母转化N-乙酰-D-葡萄糖胺生产油脂
2017-06-15高宁,刘洒洒,包汭琪,谢同舟,纪超凡,董秀萍,林心萍
高 宁, 刘 洒 洒, 包 汭 琪, 谢 同 舟, 纪 超 凡, 董 秀 萍, 林 心 萍
( 1.大连工业大学 食品学院, 辽宁 大连 116034;2.大连工业大学 国家海洋食品工程技术研究中心, 辽宁 大连 116034 )
营养胁迫调控弯曲隐球酵母转化N-乙酰-D-葡萄糖胺生产油脂
高 宁1,2, 刘 洒 洒1,2, 包 汭 琪1,2, 谢 同 舟1,2, 纪 超 凡1,2, 董 秀 萍1,2, 林 心 萍1,2
( 1.大连工业大学 食品学院, 辽宁 大连 116034;2.大连工业大学 国家海洋食品工程技术研究中心, 辽宁 大连 116034 )
以一株可利用N-乙酰-D-葡萄糖胺(GlcNAc)为唯一碳源的菌株——弯曲隐球酵母(CryptococcuscurvatusATCC 20509)为研究对象,分别采用磷元素限制和硫元素限制,考察对其油脂积累的影响,并对脂肪酸组分进行了分析。结果表明,磷、硫元素均可调控该酵母在氮源丰富条件下的油脂积累,油脂含量和油脂得率随碳磷摩尔比的增高而增高,随碳硫摩尔比的增高呈先上升后下降的趋势。脂肪酸组分分析表明,饱和脂肪酸含量随着碳磷摩尔比的增加先下降后上升,随着碳硫摩尔比的增加呈先上升后下降的趋势。
弯曲隐球酵母;油脂;营养胁迫

0 引 言
随着油脂需求量的日益增加,动植物油脂已经不足以满足人类的需求,开发微生物油脂迫在眉睫[1-2]。近年来,采取了多种油脂合成的调控策略,其中氮元素限制(即高n(C)/n(N))是现有最常用的调控策略[3-4]。除氮源外,磷、硫和金属元素等成分的改变也可对油脂合成产生影响[5-6]。Wu等[7]在氮源丰富的情况下,改变培养基中的n(C)/n(P),微生物中油脂的含量显著提高;而在培养基中加入低浓度的Na2SO4可促进油脂合成[8]。这些调控方式为自然界中富氮生物质的利用提供了灵活的策略。甲壳素是自然界中含量仅次于纤维素的一种多糖,是海洋中的第一大生物质。然而以甲壳素单体——N-乙酰-D-葡萄糖胺生产微生物油脂的报道较为少见[9-10],原因在于N-乙酰-D-葡萄糖胺中氮含量高,不适合于常规的氮限制调控策略。
本实验以前期筛选的一株可利用N-乙酰-D-葡萄糖胺为唯一碳源的弯曲隐球酵母为研究对象[10],分别采用硫元素限制和磷元素限制两种调控方式,探讨其在富氮培养基中积累油脂的能力,并分析不同培养条件下的脂肪酸组成成分,以期为富氮生物质为原料的微生物油脂工业化生产提供新思路。
1 材料与方法
1.1 材 料
1.1.1 菌 种
弯曲隐球酵母CryptococcuscurvatusATCC 20509,美国ATCC菌种保藏中心。
1.1.2 培养基
种子培养基(g/L):葡萄糖 20,蛋白胨 10,酵母粉 10,pH 6.0。
限磷培养基(g/L):GlcNCOOH 70,(NH4)2SO45.0,MgSO40.732,痕量元素溶液10 mL/L。以KH2PO4为磷元素的添加,质量浓度分别为3.6、0.5和0.01 g/L[7]。
限硫培养基(g/L):GlcNCOOH 70,MgCl2·6H2O 1.5,Na2HPO41.0,KH2PO41.0,痕量元素溶液10 mL/L。以Na2SO4为硫元素的添加,质量浓度分别为2.0、0.5和0.01 g/L[8]。
痕量元素溶液配方(g/L):CaCl2·2H2O 4.0, 水合柠檬酸 0.52, FeSO4·7H2O 0.55, MnSO4·H2O 0.076, ZnSO4·7H2O 0.10, 100 μL 18 mol/L H2SO4。
1.2 方 法
1.2.1 种子液制备
将活化的酵母菌接种于50 mL种子液,200 r/min,28 ℃培养25 h。7 800g离心8 min,0.9%无菌生理盐水清洗2次,再用50 mL的0.9%无菌生理盐水重悬。种子液以OD600=0.35取5 mL 接种于45 mL培养基,200 r/min,28 ℃培养,每24 h调pH至5.3~5.6,摇瓶培养121 h。
1.2.2 菌体生物量的测定
发酵液于7 800g离心8 min,105 ℃下菌体烘干至恒重,测定菌体生物量。
1.2.3 残糖的测定
采用Imoto的方法测定培养基中N-乙酰-D-葡萄糖胺剩余量。以N-乙酰-D-葡萄糖胺质量浓度为横坐标、吸光度为纵坐标,绘制标准曲线。公式为y=4.414x+0.003(R2=0.995)。
1.2.4 微生物脂质体生物成像分析
微生物积累油脂后其胞内存在的脂肪体 (lipid body) 可在光学显微镜下观测到,取发酵液于40倍物镜进行镜检并拍照。
1.2.5 油脂的提取
采用酸热法[11],以每升发酵液中含油脂的克数(g/L)表示油脂量;油脂含量为油脂量占生物量的质量分数;油脂得率为每克糖所生成的油脂质量。
1.2.6 菌油脂肪酸组分分析
脂肪酸甲酯化处理:取油脂约0.1 g,加入2 mL 0.5 mol/L KOH-CH3OH,60 ℃水浴2 h。冷却后用6 mol/L盐酸调pH小于1.0,10 mL正己烷萃取,氮吹至恒重,再加1 mL正己烷和2 mL 甲基化试剂,70 ℃水浴1 h,冷却后取出正己烷层水洗至中性,加入无水硫酸钠干燥过夜。
采用安捷伦6890N GC-5973 MSD气质联用仪分析。HP-5-MS毛细管柱(30 m×0.25 mm×0.25 μm),载气为氦气。分析条件:初始温度50 ℃,保持1 min;以50 ℃/min升至170 ℃;以4 ℃/min 升至300 ℃;以40 ℃/min升到320 ℃,保持3.6 min。选取Scan模式,分析采用EI源(70 eV),溶剂延迟4 min,扫描范围50~550m/z。
2 结果与讨论
2.1 磷元素限制调控对弯曲隐球酵母产油的影响
2.1.1 不同浓度的磷酸盐对弯曲隐球酵母生长及油脂量的影响
设置3种n(C)/n(P)的培养基,于培养基中加入不同量的KH2PO4,形成n(C)/n(P)为96、689、34 451三种培养环境,n(C)/n(P)=96为对照组。由表1可见,培养121 h后,随着n(C)/n(P) 的增大,生物量呈逐渐下降的趋势,其中对照组的生物量为22.9 g/L,说明在该环境中菌体营养丰富,生物量增长较快,然而油脂含量仅为10.4%,油脂生产量只有2.4 g/L,油脂得率为0.039 g/g,糖转化为油脂的效率低,说明碳源绝大部分应用于菌体合成,未用于油脂合成;实验组n(C)/n(P)=689和n(C)/n(P)=34 451组的生物量分别为10.6和8.0 g/L,较n(C)/n(P)=96组均较低,说明菌体可能由于缺乏磷元素处于生长不良的状态。实验组n(C)/n(P)=689中,虽然残糖剩余较多,但在相同的时间内,菌体油脂含量达到24.7%,油脂量也较对照组有所增长。实验组n(C)/n(P)=34 451中的菌体油脂含量增加到63.2%,油脂生产量为5.2 g/L,为n(C)/n(P)=96时的2.16倍,油脂得率也为对照组的2.48倍,说明当磷元素受到限制时,碳源绝大部分流向油脂合成途径。Wu等[9]采用弯曲隐球酵母发酵N-乙酰-D-葡萄糖胺,在120 h时,耗糖量约为65 g/L,胞内油脂质量分数达到45.4%。而在本实验中,弯曲隐球酵母消耗52.7 g/L的N-乙酰-D-葡萄糖胺,可积累超过细胞干重63.2% 的油脂。可见采用磷元素限制的调控策略能够使得N-乙酰-D-葡萄糖胺更多的流向油脂合成方向。
对发酵终点微生物菌体进行脂质体生物成像分析,结果如图1所示。在n(C)/n(P)为96(图1(a))的培养条件下,弯曲隐球酵母胞内含有较少的油脂;而当n(C)/n(P)提高到689和34 451(图1(b)、(c)),发酵终点的菌体中可观测到明显的油滴状物质,该结果与油脂含量分析的结果吻合。

表1 不同质量浓度的KH2PO4条件下弯曲隐球酵母生长及产油结果
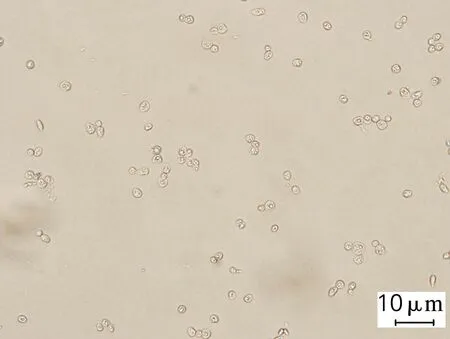
(a) ρ(KH2PO4)=3.6 g/L
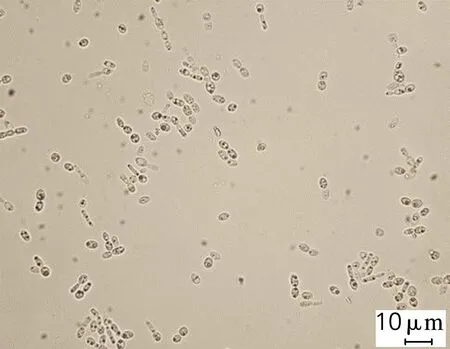
(b) ρ(KH2PO4)=0.5 g/L
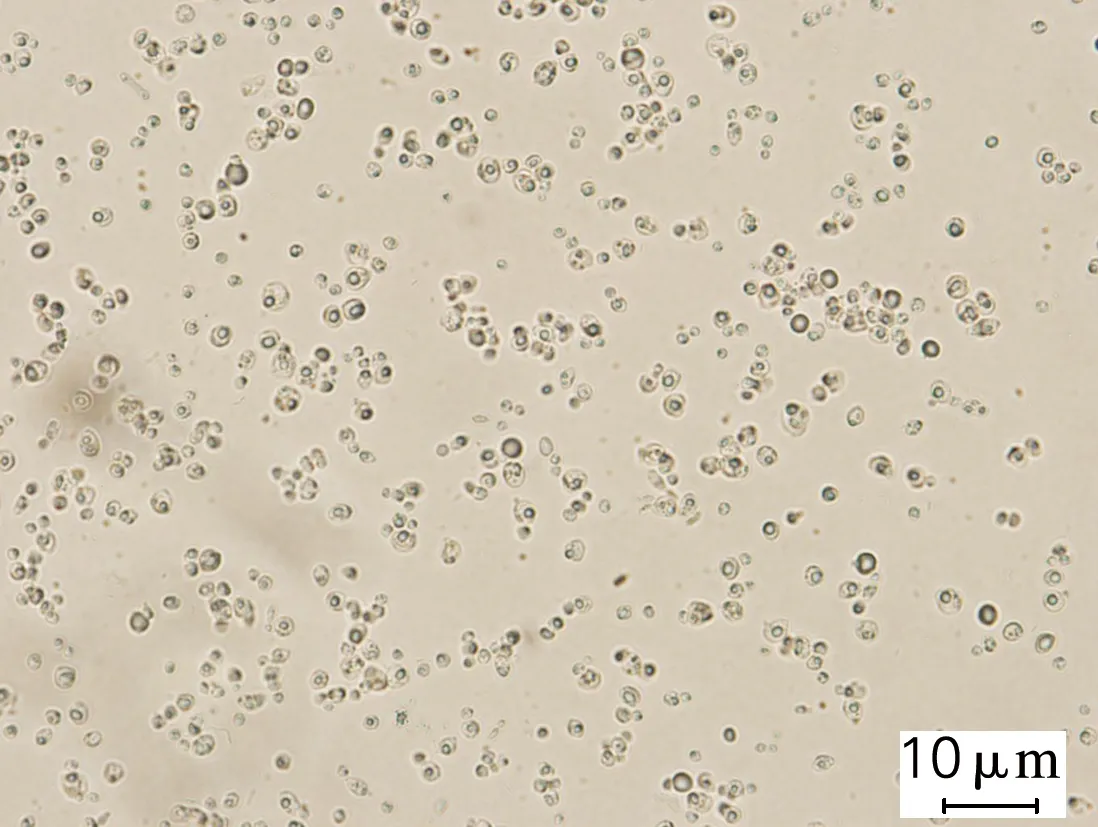
(c) ρ(KH2PO4)=0.01 g/L
图1C.curvatusATCC 20509在不同质量浓度的KH2PO4条件下微生物脂质体成像结果
Fig.1 Liposomes results ofC.curvatusATCC 20509 at different KH2PO4concentrations
结果表明,弯曲隐球酵母在含低浓度的KH2PO4培养基中生长时,糖代谢流能选择性地转向油脂生物合成,随着磷元素含量的降低,油脂量显著增加。因此,在氮元素丰富的情况下,较强的磷胁迫可用于调控微生物的油脂生产。
2.1.2 不同浓度的磷酸盐对弯曲隐球酵母油脂成分的影响
采用GC-MS对不同n(C)/n(P)下培养所得油脂样品进行分析,结果如表2所示,其中油酸(18∶1)含量最高,其次分别是棕榈酸(16∶0)和硬脂酸(18∶0),这3种脂肪酸含量之和占总脂肪酸含量90%以上,这与Liu等[12]的研究成果相似,也与Wu等[9]此前研究的在不限制磷元素条件下的脂肪酸组成相似。同时,磷元素营养限制对油脂的脂肪酸组成影响较大:随着n(C)/n(P)的增加,饱和脂肪酸含量呈先下降后升高的趋势,且变化显著,当n(C)/n(P)为96、689和34 451时,饱和脂肪酸质量分数分别为45.2%、38.8%和65.5%。因此,磷元素调控还可作为一种调控脂肪酸组成的有效手段。

表2 不同碳磷摩尔比下弯曲隐球酵母脂肪酸组分
2.2 硫元素限制调控对弯曲隐球酵母产油影响
2.2.1 不同浓度的硫酸盐对弯曲隐球酵母生长及油脂量的影响
设置3种n(C)/n(S)培养基,通过添加不同量的Na2SO4,形成n(C)/n(S)分别为180、719和35 958的培养环境,其中n(C)/n(S)=180为对照组。经过121 h培养,弯曲隐球酵母生物量分别为18.8、13.0和6.6 g/L,随着硫元素的减少,生物量呈逐渐下降的趋势,说明硫元素缺乏时,不利于菌体繁殖,该趋势与磷元素限制相类似。胞内油脂含量随着硫元素的减少呈上升趋势,从16.2%上升到56.4%,说明硫元素限制能够促进弯曲隐球酵母中油脂含量的积累。油脂生产量及油脂得率均呈先上升后下降的趋势,由3.0 g/L (n(C)/n(S)=180)上升到6.0 g/L (n(C)/n(S)=719)再下降到3.8 g/L (n(C)/n(S)=35 958),说明硫元素的适量限制可诱导菌体内的油脂生产,但是,过度的限制反而会对油脂的生产产生不良影响。
对发酵终点微生物菌体进行脂质体生物成像分析,结果如图2所示。在n(C)/n(S)为180(图2(a))的培养条件下,弯曲隐球酵母胞内含有较少的油脂,而随着n(C)/n(S)从719提高到35 958(图2(b)、(c)),微生物菌体内油滴状物质明显增多变大,该结果与油脂含量分析的结果吻合。
结果表明,弯曲隐球酵母在含低浓度Na2SO4的培养基中生长时,糖代谢流能选择性地转向油脂生物合成,然而过低浓度的硫元素限制不仅影响生物量的积累,还可能导致油脂生物合成途径中的必要条件受阻,影响油脂量积累及底物利用速率和效率。由此可知,在氮元素丰富的情况下,微弱的硫胁迫可作为一种有效调控油脂生产的方式。

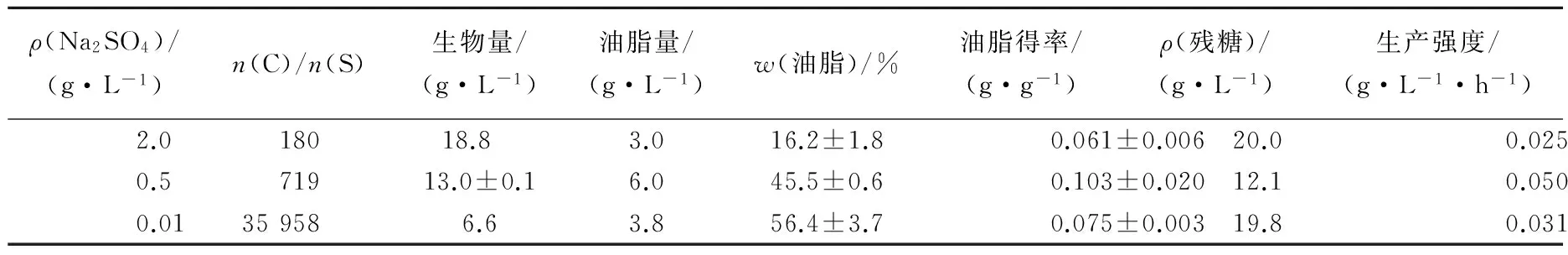
表3 不同质量浓度Na2SO4条件下弯曲隐球酵母生长及产油结果
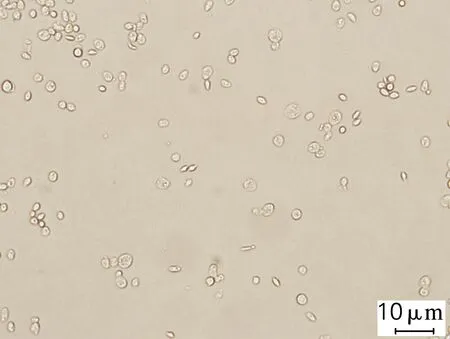
(a) ρ(Na2SO4)=2.0 g/L
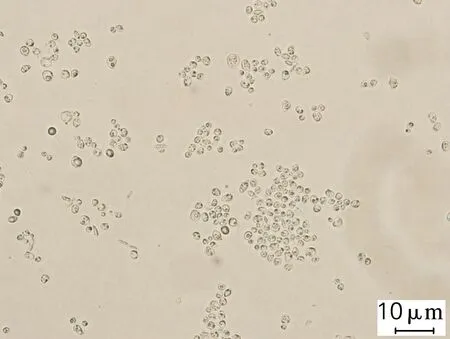
(b) ρ(Na2SO4)=0.5 g/L

(c) ρ(Na2SO4)=0.01 g/L
图2C.curvatusATCC 20509在不同质量浓度的Na2SO4条件下微生物脂质体生物的成像结果
Fig.2 Liposomes results ofC.curvatusATCC 20509 at different Na2SO4concentrations
2.2.2 不同浓度的硫酸盐对弯曲隐球酵母油脂成分的影响
采用GC-MS对不同n(C)/n(S)培养条件下所得油脂样品进行分析,结果如表4所示,其中油酸(18∶1)含量最高,其次分别是棕榈酸(16∶0)和硬脂酸(18∶0),这3种脂肪酸质量分数之和占总脂肪酸质量分数90%以上,这与Liu等[12]的研究成果相似。此外,实验结果还表明,硫元素限制对油脂的脂肪酸组成影响很大:饱和脂肪酸含量随着n(C)/n(S)的增加,呈先增加后减少的趋势,在n(C)/n(S)为180、719和35 958时,饱和脂肪酸质量分数分别为46.4%、60.8%和56.0%,该趋势与磷元素限制相反。说明硫元素限制对脂肪酸组成产生较大影响,有望通过对硫元素的调控直接调控菌油的脂肪酸组成。


表4 不同碳硫摩尔比下弯曲隐球酵母脂肪酸组分
3 结 论
采用磷元素和硫元素限制对弯曲隐球酵母的油脂积累进行调控。结果表明,提高培养基的n(C)/n(P) 或n(C)/n(S)均能够促进微生物的油脂积累。油脂含量和油脂得率随着n(C)/n(P)的增加而升高,随着n(C)/n(S)的增加先上升后下降。对脂肪酸组分进行分析表明,菌油中油酸含量最高,其次是棕榈酸和硬脂酸。n(C)/n(P)和n(C)/n(S)对脂肪酸的成分也产生影响,随着n(C)/n(P)的增高,饱和脂肪酸含量先下降后上升;而随着n(C)/n(S)的增高,饱和脂肪酸含量先上升后下降。因此有望通过对磷元素或硫元素的调控,直接调控菌油的脂肪酸组成。本研究为营养元素胁迫调控微生物转化甲壳素单体——N-乙酰-D-葡萄糖胺生产微生物油脂,提高其产量及改变油脂成分提供了依据,此外,该实验结果也为富氮生物质生产微生物油脂提供了新的思路和策略。
[1] 赵宗保.加快微生物油脂研究为生物柴油产业提供廉价原料[J].中国生物工程杂志,2005,25(2):8-11.
[2] JIN M, SLININGER P J, DIEN B S, et al. Microbial lipid-based lignocellulosic biorefinery: feasibility and challenges[J]. Trends in Biotechnology, 2015, 33(1): 43-54.
[3] 赵宗保,胡翠敏.能源微生物油脂技术进展[J].生物工程学报,2011,27(3):427-435.
[4] BRAUNWALD T, SCHWEMMIEIN L, GRAEFF-HONNINGER S, et al. Effect of different C/N ratios on carotenoid and lipid production byRhodotorulaglutinis[J]. Applied Microbiology and Biotechnology, 2013, 97(14): 6581-6588.
[5] BEOPOULOS A, NICAUD J M, GAILLARDIN C. An overview of lipid metabolism in yeasts and its impact on biotechnological processes[J]. Applied Microbiology and Biotechnology, 2011, 90(4): 1193-1206.
[6] RATLEDGE C, WYNN J P. The biochemistry and molecular biology of lipid accumulation in oleaginous microorganisms[J]. Advances in Applied Microbiology, 2002, 51: 1-51.
[7] WU S G, HU C M, JIN G J, et al. Phosphate-limitation mediated lipid production byRhodosporidiumtoruloides[J]. Bioresource Technology, 2010, 101(15): 6124-6129.
[8] WU S G, ZHAO X, SHEN H W, et al. Microbial lipid production byRhodosporidiumtoruloidesunder sulfate-limited conditions[J]. Bioresource Technology, 2011, 102(2): 1803-1807.
[9] WU S G, HU C M, ZHAO X, et al. Production of lipid from N-acetylglucosamine byCryptococcuscurvatus[J]. European Journal of Lipid Science and Technology, 2010, 112(7): 727-733.
[10] 吴思国,赵鑫,胡翠敏,等.转化N-乙酰-D-葡糖胺产油真菌的筛选[J].中国生物工程杂志,2008,28(11):58-62.
[11] 李植峰,张玲,沈晓京,等.四种真菌油脂提取方法的比较研究[J].微生物学通报,2001,28(6):72-75.
[12] LIU B, ZHAO Z K. Biodiesel production by direct methanolysis of oleaginous microbial biomass[J]. Journal of Chemical Technology and Biotechnology, 2007, 82(8): 775-780.
Regulation of lipid accumulation from N-acetyl-D-glucosamine byCryptococcuscurvatusunder nutrition stress conditions
GAO Ning1,2, LIU Sasa1,2, BAO Ruiqi1,2, XIE Tongzhou1,2,JI Chaofan1,2, DONG Xiuping1,2, LIN Xinping1,2
( 1.School of Food Science and Technology, Dalian Polytechnic University, Dalian 116034, China;2.National Engineering Research Center of Seafood, Dalian Polytechnic University, Dalian 116034, China )
CryptococcuscurvatusATCC 20509 using N-acetylglucosamine as unique carbon source was used to investigate phosphorus and sulfate limitation impact on lipid accumulation, and fatty acid compositions were also analyzed by GC-MS. The results illustrated that both phosphorus and sulfur limitation could regulate lipid accumulation under nitrogen-rich condition. The lipid content and yield increased withn(C)/n(P) ratio increasing, while, increased initially and then decreased withn(C)/n(S) ratio increasing. The fatty acid analysis showed that the content of saturated fatty acid decreased first and then increased withn(C)/n(P) ratio increasing, while the content of saturated fatty acid increased first and then decreased withn(C)/n(S) ratio increasing.
Cryptococcuscurvatus; lipid; nutrition stress conditions
2016-09-29.
国家自然科学基金项目(3150100464);中国博士后科学基金项目(2016M591419).
高 宁(1989-),女,硕士研究生;通信作者:林心萍(1985-),女,讲师.
TS222;Q815
A
1674-1404(2017)03-0157-05
高宁,刘洒洒,包汭琪,谢同舟,纪超凡,董秀萍,林心萍.营养胁迫调控弯曲隐球酵母转化N-乙酰-D-葡萄糖胺生产油脂[J].大连工业大学学报,2017,36(3):157-161.
GAO Ning, LIU Sasa, BAO Ruiqi, XIE Tongzhou, JI Chaofan, DONG Xiuping, LIN Xinping. Regulation of lipid accumulation from N-acetyl-D-glucosamine byCryptococcuscurvatusunder nutrition stress conditions[J]. Journal of Dalian Polytechnic University, 2017, 36(3): 157-161.
