增龄因素对大鼠成骨细胞BMP-Smad通路基因表达的影响*
2017-06-05张凤成魏泽宁李传洁李亚男
张凤成 魏泽宁 李传洁 李亚男
增龄因素对大鼠成骨细胞BMP-Smad通路基因表达的影响*
张凤成 魏泽宁 李传洁 李亚男
目的:通过检测机体在单一因素变量(增龄性改变)的影响下,机体BMP-Sm ad成骨信号基因的表达趋势,探讨增龄对该通路因子的影响。方法:成年、中年、老年未交配SD大鼠雌雄各4只,处死后获取大鼠颅盖骨及股骨。颅盖骨采用组织块法行细胞培养,检测成骨细胞的细胞周期;股骨采用Q-PCR检测BMP-Smad成骨相关基因的表达情况并绘制趋势图谱。结果:成年大鼠的成骨细胞的细胞周期活跃,其DNA合成期(S期)的成骨细胞比例明显高于中年大鼠;BMP-Smad成骨相关因子随着增龄而出现明显的降低,而该通路的始发因子BMP-2因子的改变并不明显,甚至在机体步入老年后有升高的趋势;来源于骨组织的成脂因子的表达同样伴随着机体的增龄呈现下降趋势。结论:增龄会导致机体的成骨能力逐渐降低,成骨细胞的活性逐渐下降;BMP-Smad信号通路的成骨因子随着增龄其表达趋势逐渐下降;机体成骨能力的下降和成脂能力的增强可能促使BMP-2因子的稳定表达甚至轻微升高。
增龄;BMP-2;Runx2;Osterix;PPARγ;细胞周期
骨组织生长、发育、代谢和衰老分别表现为骨量的增加或减少,在组织学上则以骨生成和骨重建的方式进行[1]。成骨细胞作为骨组织细胞的重要成员,是骨形成和改建的主要功能细胞,该细胞主要由间充质干细胞分化而来,在分化发育的过程中主要经历四个阶段:细胞增殖、基质分泌、基质成熟、基质矿化[2]。从分子生物学角度来讲,多条信号通路参与了成骨细胞分化和骨形成的调节,其中最重要、也是最早发现和确认的一条通路为BMP-Smads,构成该通路的BMP-2、Runx2、Osterix因子相互作用介导成骨,三种因子的表达趋势很好的代表了该条通路乃至整个成骨通路的表达活性[3]。另外,PPARγ因子的表达往往与成骨因子表达趋势相反,结合该因子的同期检测对成骨因子表达趋势的解释更加具备客观性。依照国际普遍采用的美国国家衰老研究所(National Institute on Aging,NIA)标准,本实验选取成年大鼠(6月龄)、中年大鼠(12月龄)以及老年大鼠(20月龄)作为实验对象,检测机体BMP-2、Runx2、Osterix三种成骨因子的表达趋势,辅以细胞周期以及PPARγ因子的检测,探讨增龄对于BMP-Smads成骨通路因子表达的影响。
1.材料与方法
1.1实验动物健康未交配6月龄、12月龄、20月龄SD大鼠雌雄各4只共计24只(由301医院医学实验动物中心提供)。
1.2 基因检测及细胞培养所需试剂及设备BMP-2测定试剂盒,Runx2测定试剂盒,Osterix测定试剂盒,PPARγ测定试剂盒(上述试剂盒均由南京建成生物工程研究所提供)、RNA酶抑制剂DEPC(NOVON,北京)、DMEM培养基(杭州四季青公司)、青霉素-链霉素(碧云天公司)、0.25%胰酶和EDTA(GIBICO,美国)、细胞冻存液DMSO (Sigma,美国)、PCR仪(A ligent,美国)、核酸浓度测量仪(Themo nano-drop,美国)、酶标仪(Therm o,美国)等。
1.3 大鼠基因表达的检测SD大鼠处死前禁食12h,称量每只SD大鼠体重,采用3%戊巴比妥钠注射液,按照30mg/kg的剂量进行腹腔注射达到深入麻醉的效果。获取双侧股骨组织,注意保留关节处,彻底去净肌肉等软组织后置于液氮中保存。
获取RNA:取冻存组织研磨,加入Trizol及氯仿液,室温静置5m in 后置于离心机12000rpm,4℃离心15m in,取上清液并加入等体积异丙醇静置10m in再次于离心机12000rpm,4℃离心10m in75%乙醇清洗沉淀并干燥,溶解于DEPC处理水中。
加入逆转录引物:计算公式为:XμlRNA+1μl Oligo(dT)15引物+(9-X)μl 无核酸酶水=10μl。置于70℃水浴锅中,预变性5m in,然后置于冰上2m in。向每个样品管中加入10μl配置好的RT-M ix。设置反转录程序,依次为退火(25℃,5m in)、延伸(42℃,5m in)、失活(70℃,15m in)。终止(4℃)。
PCR扩增:引物设计见表1。首先在95℃条件下预变性,然后在95℃条件下变性15分钟,60℃条件下退火延伸1m in,该过程循环35-40次,最后依次在95℃和60℃条件下进行溶解曲线分析PCR扩增。

表1 相关基因PCR引物图
1.4 成骨细胞培养、鉴别及细胞周期测定①成骨细胞的培养及鉴别获取大鼠颅盖骨并将组织剪成1mm*3mm左右的组织块,用PBS缓冲液清洗组织块3次,加入0.25%胰酶震荡消化8m in,离心收集组织块,将收集的组织块再次剪碎至0.5mm* 0.5mm大小,将组织块转入混有胎牛血清的DMEM培养瓶内,4h静待组织贴壁后翻转平放,将适量培养液加到非细胞生长面上,定期换液并观察细胞形态;采用倒置显微镜连续观察动态细胞形态。②采用流式细胞仪检测成骨细胞周期三次,并取平均值获取对数生长期细胞以1×106cells/L接种于培养皿内,收集细胞并用PBS清洗细胞沉淀并重悬,孵育离心并再次用PBS清洗细胞,加入8%的小牛血清重悬打匀,混入70%乙醇后于4℃固定30m in,1000rpm/m in离心5m in,吸出乙醇和PBS,加入RNA酶37℃孵育30m in,流式细胞仪检测,Mod Fit软件分析DNA数据,获取G0/G1、S、G2/M期对应的成骨细胞数,计算增殖指数(Proliferation Index),PI=S+G2/M。
1.5 统计学分析采用SPSS17.0软件检测数据是否具有统计学差异,数据的走势图采用GraphPad Prism 5.0进行绘制。为避免统计学分析中Ⅰ类错误(假阳性)概率控制在α范围内(α=0.05),多组样本均数的两两比较采用SNK法,P<0.05时具有统计学意义。
2.结果
2.1 体重变化趋势24只SD大鼠生长情况良好,健康,未交配。大鼠的体重随着增龄逐渐呈现出升高的趋势,在此期间大鼠并未出现系统性疾病,经统计学SNK法分析可以得出三组之间的两两比较均具有统计学差异(见图1)。

图1 体重变化趋势图
2.2 基因表达情况Runx2、Osterix基因mRNA表达趋势:6月龄大鼠表达量最高,12月龄大鼠较6月龄大鼠表达下降,20月龄大鼠的表达量最低。三者中两两比较均具有统计学差异(P<0.05) (见图2)。
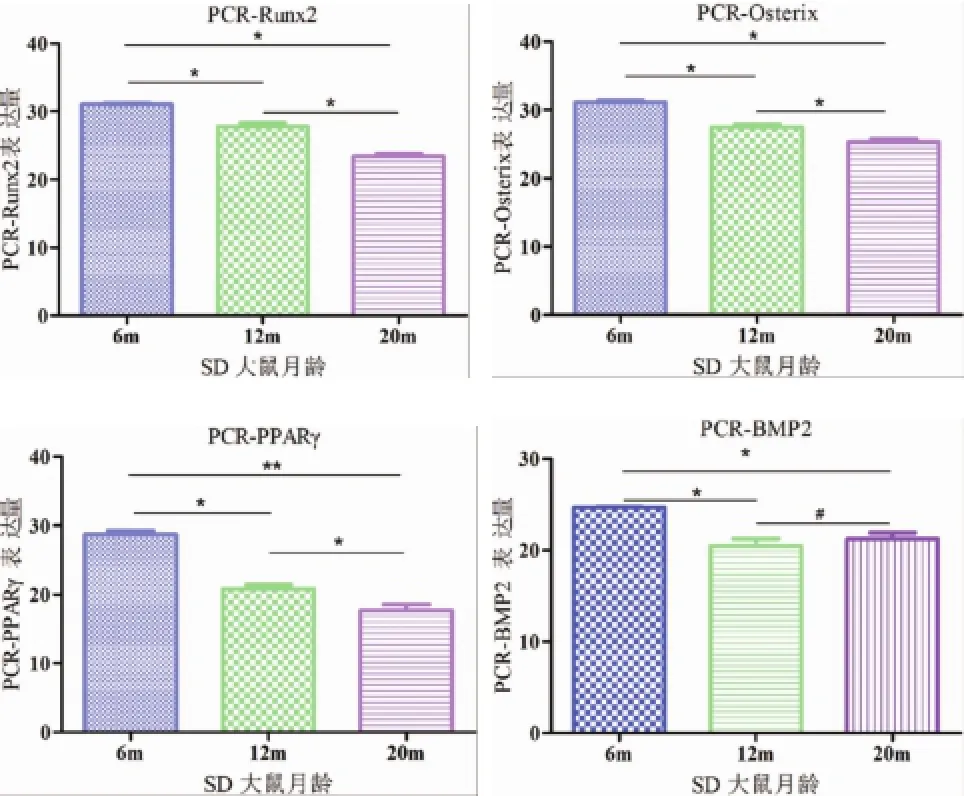
图2 Q-PCR结果图
PPARγ基因m RNA表达趋势:随着增龄亦呈现降低趋势。三者中两两比较均有统计学差异(P<0.05,P<0.01)。
BMP-2基因m RNA表达趋势:6月龄大鼠表达量最高,12月龄大鼠表达下降,而20月龄大鼠的表达量却有轻度升高。虽然后二者之间并无统计学差异,但这种趋势和上述的成骨因子表达具有明显的相反趋势。
2.3 成骨细胞培养及细胞周期的测定倒置显微镜下观察6月龄和12月龄大鼠体外培养的成骨细胞均具有较好的代表性,其形态和数量均较理想,其中尤以成年雄性大鼠的最为典型:镜下观察可见细胞呈现典型的长梭形,有较大突起,胞浆较丰富(见图3,图4)。
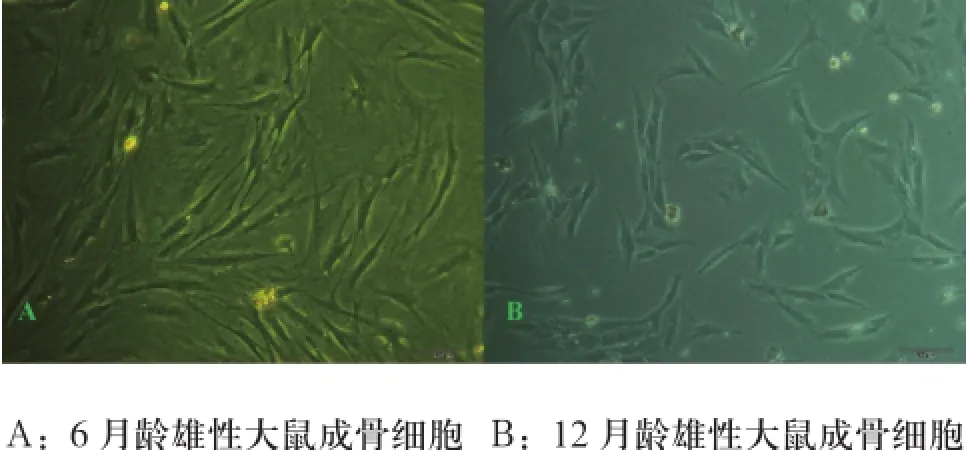
图3 组织块培养成骨细胞图(×100)

图4 细胞周期图
对于成年和中年大鼠的细胞周期,流式细胞仪结果显示,6月龄大鼠的G0/G1期(DNA合成前期)细胞比例相对较低,而S期、G2/M期(DNA合成期及合成终止期)的细胞比例相对较高,增值指数PI较高;而12月龄大鼠组的G0/G1期细胞比例要比成年大鼠高(P<0.05),而S期、G2/M期细胞比例要比成年大鼠低(P<0.05)。
3.讨论
机体的间充质干细胞在各种刺激因子的调控下分化为成骨细胞,成骨细胞的分化成熟及矿化是骨发生的基础,该过程通过众多调控因子组成的信号传导途径启动骨特异性转录因子和生长因子的表达[4,5]。其中BMP/Smads通路是主要的信号传导途径,该通路包括的因子较多,例如BMP-2、Smads、Runx2、M sx2、Osterix等,上述因子相互作用构成BMP-Smad通路的分支较多,但构成该通路主干的代表性基因为BMP-2、Runx2、Osterix,三种基因的表达趋势能够很好的代表机体成骨的活性[2]。
通过对不同月龄大鼠上述三者基因的检测可以达到研究增龄对于BMP-Smad成骨信号通路影响的目的。按照美国国家衰老研究所(NIA)标准[6],对于SD大鼠而言,成年大鼠的指标为6-8月龄,老年大鼠的指标为20-26月龄,而介于二者之间的则为中年大鼠。本实验结合检测指标特性,同时参考国际学者普遍采用的鼠龄[7],选取6月龄、12月龄以及20月龄分别作为成年大鼠、中年大鼠以及老年大鼠标准[8]。
Runx2和Osterix基因均是成骨细胞特异性转录因子,对于骨组织的形成和重建起到重要作用。早在2004年国外学者Enomoto等[9]就明确发现,Runx2基因敲除的小鼠无法有效的形成成骨细胞,即使在BMP-2因子存在的情况下,这点在颅骨组织中表现的尤其突出,但该因子的缺乏却保留了骨髓间充质干细胞分化为正常脂肪细胞和软骨细胞的能力。Osterix因子同样是机体成骨不可或缺的因子,其对于机体成骨细胞的诱导,需要首先经过双向潜能或多项潜能的分化[10]。Runx2在骨形成中的主要作用体现在软骨内成骨和膜内成骨,调控间充质干细胞(MSCs, mesenchymal stem cells)向成骨细胞的分化,以及刺激肥大软骨细胞的分化,因而Runx2的突变引起的骨异常是二者共同作用的结果,而Osterix的突变虽然同样抑制成骨细胞的分化,但破骨细胞、血管侵入以及软骨分化均是正常的。虽然二者的机理不同,但是Runx2和Osterix基因的突变都是以骨形成缺失和成骨细胞分化数量减少为特征的,Nakash ima[11]和Katagiri[12]等的实验发现,Runx2因子的缺乏并未检测到Osterix的转录产物,但Osterix因子的缺乏却能够检测到正常的Runx2表达量,因而得出Osterix位于Runx2的下游发挥机体成骨诱导。该实验中我们发现,在增龄性改变的情况下,Runx2与Osterix的表达均表达为下降趋势,符合机体增龄性成骨分化的特点。
骨形态发生蛋白(BMP,bone morphogenetic p rotein)是转化生长因子β(TGF-β)超家族最大的一类,是一种分泌性多功能蛋白,该因子作为BMP信号通路的首发因子在成骨诱导和分化过程中至关重要,具有诱导未分化的间充质干细胞向成软骨细胞和成骨细胞定向分化与增殖的能力,促进成骨细胞分化成熟,参与骨和软骨的生长发育及其重建过程,进而加速骨缺损的修复[13]。但相关研究表明,BMP因子并不是成骨专属因子,BMP-2和BMP-4能够促进多潜能干细胞向前脂肪细胞定向分化,该路径通过BMPR-ⅠA实现,其与经典成骨通路中的BMP通路存在共性:上游基因均是BMP-2和Smads,根据后续基因的不同分别发挥成骨和成脂作用[14,15],因而,随着机体增龄性改变,成骨能力的下降和成脂能力的增强促使BMP-2基因的表达趋于稳定,甚至出现后续增高的现象。
脂肪细胞的分化主要通过MAPK通路,在该通路中,过氧化物酶体增殖物激活受体γ(PPARγ,peroxisome proliferator-activated receptor)是异常关键的信号因子[16]。PPARγ不但能促进前脂肪细胞分化为成熟脂肪细胞,而且与成熟脂肪细胞内脂肪形成密切相关,在成脂的终末分化过程中,各种激素如糖皮质激素和胰岛素等和多种炎症因子如前列腺素和白介素1等都可直接或间接通过调节PPARγ的表达来促进或抑制成脂[17],随着机体增龄性改变,脂肪细胞的分化能力逐渐增强,相对应的,来源于脂肪间充质干细胞的PPARγ因子的表达呈现逐渐升高的趋势[18],但是PPARγ因子同样可以在骨组织中表达,虽然其表达量要比脂肪组织的中的量低得多[19],本实验中的PPARγ基因的mRNA来源于股骨组织而非来源于脂肪组织,所以该产物的表达情况并不能如实反映机体的成脂活性,只能代表骨组织中成脂活性的改变[20],结果提示,源于骨组织的PPARγ基因的表达随着增龄呈现明显的下降趋势,与脂肪组织来源的PPARγ表达相反。
成骨细胞周期能够调节细胞的增殖、分化和凋亡,同样可以反应机体的成骨活性[21]:G0期细胞属于静止期细胞,尚未进入增殖状态,G1期代表DNA合成前期,S期为DNA合成期,G2期为DNA合成后期,此期DNA成为四倍体,其中S期和G2期为细胞周期的两个限制点,代表了细胞增殖活性,细胞能否越过此限制点是增殖的关键[22]。实验中显示,成年大鼠处于S期和G2/M期的细胞比例要明显高于中年大鼠,增殖指数更高,表明成年大鼠更多成骨细胞进行分化中年大鼠的成骨细胞大多数被阻滞在G0/G1期,该实验提示成骨细胞活性随着增龄逐渐降低甚至停滞。
本实验中老年大鼠则难以培养出成骨细胞。当前,对于老年鼠成骨细胞的培养多集中于小鼠[23],采用常规的酶消化法已经可以获得形态良好的成骨细胞和骨细胞,细胞活性与机体活力相一致[24]。而对于老年大鼠的成骨细胞培养则鲜有报道。因而我们推测是大鼠相对于小鼠过快的代谢率导致细胞活性过低的缘故[25],但其中的具体机理仍需要进一步实验进行探讨。
上述成骨因子的表达特性并非该实验所特有,前期学者同样研究了机体在系统性疾病状态下成骨因子的表达变化。李传洁等[26]研究发现,在雌激素缺乏导致大鼠机体出现骨质疏松的状况下,以Runx2、ALP为代表的成骨因子表达趋势下降,骨密度减低,成骨能力减弱,而成脂能力增强;魏泽宁等[27]同样发现,在一型糖尿病大鼠模型中,成骨相关因子例如Runx2、一型胶原(COL2A 1)、BGP、Osterix等表达活力下降,成骨标记产物降低。
成骨通路中另外一条同等重要的路径便是W nt/β-catenin通路,目前的研究证实该通路不但促进成骨,而且还能够抑制脂肪细胞的分化[28],很多相关实验证明二者在相同因素下的表达趋势是一致的,但能否说明增龄对于W nt/β-catenin通路的作用是否同BMP-Smad相同则有待进一步探讨。
4.总结
机体随着增龄性改变,成骨细胞的增殖指数和活性逐渐降低甚至出现停滞;构成BMP-Smad通路因子的Runx2和Osterix的表达伴随机体的增龄呈现逐渐下降的趋势,而BMP-2因子在步入老年后的的表达出现了回升,主要是由于此时机体的成脂作用逐渐增强的缘故;来源于骨组织的PPARγ因子的表达伴随着增龄亦呈现下降趋势,此时该因子代表的是骨组织而非脂肪组织的成脂活性的改变。
本实验弥补了增龄状态下BMP-Sm ad信号通路因子的表达改变,有望为骨组织工程学研究提供一个新的思路。
[1] An J, Yang H, Zhang Q, et al. Natural products for treatment of osteoporosis: The effects and mechanism s on prom oting osteob last-m ediated bone formation[J]. Life Sci,2016,15(147):46-58
[2] Know les H J. Hypoxic regulation of osteoclast differentiation and bone resorption activity[J]. Hypoxia(Auck l),2015,11 (3):73-82
[3] Vanhantpua S, Ojansicu M, Autio R. Bone M orthogenetic Protein-2 induces donor-denpendent osteogenic and adipogenic d ifferen tiation in hunm an adipose stem cells[J]. Stem Cells Transl Med,2015,4(12): 1391-1402
[4] Ogaw a H, Akiyam a H. Analysis of m uscu loskeletal system s and their diseases: regulation of chond rogenesis andcartilage regeneration by m olecu lar and developmental biology[J]. C lin Calcium,2015,25(8): 1116-1124
[5] Pînzariu A, Sind ilar A, Haliga R, et al. Nutritional factors in transdifferentiation of scheletal muscles to adipocy tes[J].Rev M ed Ch ir Soc M ed Nat Iasi,2014,118(3): 699-705
[6] Elena J, Moerman, Kui Teng, et al. Aging activates adipogen ic and suppresses osteogenic prog ram s in m esenchym al marrow stroma/stem cells: the role of PPAR-γ2 transcription factor and TGF-β/BMP signaling pathw ays[J]. Ag ing Cell,2004,3(6): 379-389
[7] Khan SI, Hübner PP, Brichta AM, et al. Aging reduces the high-frequency and short-term adaptation of the vestibu loocu lar reflex in m ice[J]. Neurobiol Aging,2016,51: 122-131
[8] Chu J, PraticòD. The retromer com plex system in a transgenic m ouse m odel of AD: in fluence of age[J]. Neurobiol Aging,2017,3(52): 32-38
[9] Enomoto H, Furuich i T, Zanma A, et al. Runx2 deficiency chondrocy tes causes adipogenic changes in vitro[J]. Cell Sci,2004,11(7): 4172-4251
[10] Yano H, Hamanaka R, Nakamura-Ota M, et al. Sp7/Osterix induces the m ouse pro-α2(I) collagen gene (Col1a2) expression via the proximal promoter in osteoblastic cells[J].Biochem Biophys Res Comm un,2014,452(3): 531-536
[11] Nakashima K, Zhou X, Kunkel G, et al. The novel zine finger containing transcrip tion factoe osterix is required for osteoblast differentation and bone formation[J]. Cell,2002,108: 17-29
[12] Katagiri T,Takahashi N.Regulatory mechanism s of osteob last and osteoclast differentiation[J]. Oral Dis, 2002, 8: 147-159
[13] McBride Gagyi SH, M cKenzie JA, Buettmann EG, et al.Bmp2 conditional knockout in osteoblasts and endothelial cells does not impair bone form ation after in ju ry or mechanical loading in adult m ice[J]. Bone, 2015, 81: 533-543
[14] Petzold R, Veh low D, Urban B, et al. Colloid, adhesive and release properties of nanoparticu lar ternary comp lexes betw een cationic and an ionic polysaccharides and basic proteins like bone morphogenetic protein BMP-2[J]. Colloids Surf B Biointerfaces,2016,151: 58-67
[15] Gustafson B, Hammarsted t A, Hedjazifar S, et al. BMP4 and BMP Antagonists Regulate Human W h ite and Beige Adipogenesis[J]. Diabetes,2015,64(5): 1670-1681
[16] Feng S, Reuss L, W ang Y, et al. Potential of Natu ral Products in the Inhibition of Adipogenesis through Regulation of PPARγExpression and/or Its T ranscriptional A ctiv ity[J].Molecules,2016,21(10): 1-19
[17] H udak CS, Gulyaeva O, W ang Y,et al.Pref-1 m arks very ear ly mesenchymal precursors required for adipose tissue developmen t and expansion[J]. Cell Rep, 2014, 8(3): 678-687
[18] Katarzyna Kornicka, K rzysztofMarycz, K rzysztof Andrzej Tomaszew ski, et al. The Effect of Age on Osteogenic and Adipogenic Differentiation Potential of Human Adipose Derived Strom al Stem Cells (h ASCs) and the Im pact of Stress Factors in the Cou rse of the Differentiation Process[J]. Oxidative Medicine and Cellular Longevity,2015,30: 1-20
[19] Zhuang H, Zhang X, Zhu C, et al. Molecular Mechanism s of PPARγGoverning MSC Osteogenic and Adipogenic Differentiation[J]. Cu rr Stem Cell Res Ther,2016,11(3): 255-264 [20] Yamanouchi K, Ban A, Shibata S, et al. Both PPARγand C/EBPαare su fficient to induce transdifferentiation of goat fetal myob lasts into adipocy tes[J]. J Reprod Dev, 2007, 53 (3): 563-572
[21] 李西海,刘伯龄,刘献祥. 川芎嗪含药血清干预软骨细胞周期作用机制的研究[J]. 中医正骨, 2009, 21(2): 1-3
[22] Lesniew ski L A,Seals D R,W alker A E. Dietary rapam ycin supplementation reverses age-related vascular dysfunction and ox idative stress, w h ile m odulating nu trien t-sensing, cell cycle and senescence pathw ays[J]. Aging Cell, 2016,16(1): 17-26
[23] Amber Rath Stern, Matthew M Stern, Mark E Van Dyke[2], et al. Isolation and cu ltu re of prim ary osteocytes from the long bones of skeletally mature and aged m ice[J]. Biotechniques,2012,52(6): 361-373
[24] Ch ristian R Gomez, Gaylord J Knutson, Kari B Clifton, et al. Age-dependent response of m urine fem ale bone m arrow cells to hyperbaric oxygen[J]. Biogerontology,2012,13: 287-297
[25] Kusano Y, Tsujihara N, Masui H, et al. Consum ption of Japanese Yam Improves Lipid Metabolism in H igh-Cholesterol Diet-Fed Rats[J]. J Nutr Sci Vitam inol,2016,62(5): 350-360
[26] 李传洁,刘娜,王俊成,等. 雌激素缺乏对大鼠核因子C (N fic)与成骨相关基因表达的影响[J]. 口腔颌面修复学杂志, 2015, 16(3): 129-133
[27] 魏泽宁,张凤成,李传洁,等. 糖尿病大鼠N fic与成骨相关基因表达的影响[J]. 中华老年口腔医学杂志, 2016, 14(2): 72-76
[28] Laudes M. Role of WNT signalling in the determ ination of hum an m esenchym al stem cells into preadipocytes[J]. J M ol Endocrinol,2011,46(2): R65-72
Theeffectsofaging on theexpression of BMP-Smad signalpathway gene
ZHANG Feng-cheng,WEIZe-ning,LIChuan-jie,LIYa-nan(Medical Research Center of Stomatology,Chinese PLA GeneralHospital,Beijing 100853,China)
Objective:Through detecting the expression of BMP-Smad in the body under the influence of a single factor variable (aging), to investigate the effect of aging on the pathway factor. Methods:Selcting 4 male and female virgin SD rats in adult, m idd le age and old age, then get the calvaria and femur of rats after the execution. Culturing the osteoblasts w ith tissue block method and analysising cell cycle w ith flow cytometry; Q-PCR were used to detect the expression of relevant genes and map the trend. Results:Cell cycle of the adult rats are more active, their DNA synthesis phase (S phase) of the osteoblast cell ratio was significantly higher than that of middle-aged rats (P<0.01); the expression of osteogenic related genes in BMP-Smad significantly decrease with aging,but the initiating factor of BMP-Smad pathwaythe-BMP-2 does not change obviously, it even rise when the body enters old age; the adipohenic related genes derived from bone tissue also declines w ith aging as well as the osteogenic factors. Conclusion:Aging could lead to the reduction of the osteogenic ability and the decline of the osteoblast activity; The expression of Osteogenic factor in BMP-Smad signaling pathw ay gradually decreased w ith increasing age. BMP-2 express stablely even rise due to the decline of osteogenic ability and the enhancement of adipogenic ability.
Aging; BMP-2; Runx2; Osterix; PPARγ; Cell Cycle
R783
A
1672-2973(2017)02-0107-06
2016-10-19)
张凤成 解放军总医院口腔科硕士生北京100853
魏泽宁 解放军总医院口腔科硕士生北京100853
李传洁 解放军总医院口腔科硕士生北京100853
李亚男 通讯作者解放军总医院口腔科副主任医师副教授北京100853
