香青菜不同溶剂提取物抗氧化活性研究
2017-06-01王罗玲沈雪林李亚峰陈春许史泰龙王桃云
王罗玲,沈雪林,李亚峰,陈春许,史泰龙,王桃云,3,*
(1.苏州科技学院化学生物与材料工程学院,江苏苏州215009;2.苏州市种子管理站,江苏苏州215011;3.苏州大学药学院,江苏苏州215123)
香青菜不同溶剂提取物抗氧化活性研究
王罗玲1,沈雪林2,李亚峰1,陈春许1,史泰龙1,王桃云1,3,*
(1.苏州科技学院化学生物与材料工程学院,江苏苏州215009;2.苏州市种子管理站,江苏苏州215011;3.苏州大学药学院,江苏苏州215123)
采用DPPH自由基、超氧阴离子自由基、羟基自由基、ABTS、总还原力测定这5种体外抗氧化活性测定方法对香青菜石油醚萃取物,乙酸乙酯萃取物,正丁醇萃取物和水萃取物4个不同极性部位的抗氧化活性进行测定,并利用隶属函数法对各提取物的抗氧化活性进行综合评价。研究结果表明,香青菜各提取物均具有一定的抗氧化活性,且抗氧化活性与提取物浓度呈正相关关系,其中乙酸乙酯提取物的抗氧化活性最强,水提取物的抗氧化活性最弱。因此,香青菜具有很好的应用前景和研究价值。
香青菜;提取物;抗氧化活性;隶属函数法
香青菜(Brassica chinensis L.)属十字花科芸薹属植物,是苏州地方传统特色珍稀蔬菜品种,距今已有100多年的栽培历史。香青菜是苏州市第一个申报农产品地理标志的蔬菜品种,主要分布在苏州市沿东太湖流域的震泽、盛泽、横扇、桃源等地区[1]。香青菜是一种香味浓郁、品质柔嫩、风味独特、营养丰富的小白菜(青菜),是叶菜类中的上品[2]。目前有关香青菜的研究较少,只有少数有关香青菜品种选育和栽培技术的研究报道[1-3]。本研究以栽培最广泛的“黄种”香青菜为试验材料,对香青菜不同极性溶剂萃取物的抗氧化活性进行研究,为深入研究和开发香青菜资源,提升香青菜的种质资源价值提供科学参考。
1 材料与方法
1.1 材料
1.1.1 原料
香青菜(黄种)是2013年12月购自苏州市吴江震泽镇蔬菜生产基地,并由苏州市种子管理站沈雪林高级农艺师鉴定为“黄种”香青菜。
1.1.2 试剂
亚油酸、β-胡萝卜素、2,2-联氮-二(3-乙基苯并噻唑-6-磺酸)二铵盐(ABTS)、三吡啶三吖嗪(TPTZ)及过硫酸钾:Fluka公司;1,1-二苯基-2-三硝基苯肼(DPPH)、芦丁、维生素C:TCI公司;邻二氮菲、H2O2、2,6-二叔丁基对甲酚(BHT)、DMF(N,N-二甲基甲酰胺)、DMSO(二甲基亚砜):分析纯,上海国药公司。
1.2 主要仪器设备
UV-2450紫外-可见光分光光度计:岛津仪器有限公司;SYC-C水浴振荡器:上海新苗医疗器械制造有限公司;LGJ-10冷冻干燥机:北京四环科学仪器有限公司;EYELA N-1100S-W旋转蒸发仪:东京理化器械株式会社;GL-12B台式离心机:上海安亭科学仪器厂。
1.3 方法
1.3.1 香青菜粉末及不同溶剂提取物制备
新鲜采集过来的香青菜地上部分先用水洗净,然后在烘箱中40℃下烘干,粉碎机粉碎并过60目筛,所得粉末密封贮于棕色广口瓶中,备用。
香青菜不同溶剂提取物制备工艺:香青菜粉末→分别用蒸馏水、正丁醇、乙酸乙酯和石油醚提取2次→提取完毕后离心得到不同溶剂提取液→旋蒸至近干→用少量溶剂转移到蒸发皿中→冷冻干燥→香青菜不同溶剂提取物。
1.3.2 DPPH自由基清除试验
参照Tai Zhi-gang等[4]和张前军等[5]的方法,精密量取0.075 mmol/L DPPH甲醇溶液7.8 mL及0.2 mL各种不同浓度的样品溶液(用DMSO溶解),迅速摇匀后,在室温(25℃左右)、黑暗条件下反应30 min,然后在515 nm波长下测定吸光值,每个样品重复3组试验。以BHT为阳性对照,不加样品的溶液为空白对照,DPPH·清除率按下式计算。
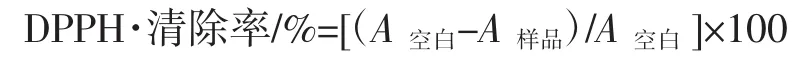
式中:A空白为不加样品的溶液反应后的吸光值;A样品为各种不同浓度的样品反应后的吸光值。
1.3.3 超氧阴离子自由基(O2-·)清除试验
参照Sun Su-jie等[6]和李路宁等[7]的方法,首先测定邻苯三酚自氧化速率,将4.2 mL去离子水与4.5 mL pH 8.2的100 mmol/LTris-HCl混合,25℃水浴20 min,加入0.3 mL邻苯三酚溶液,在325 nm处测定反应的前4 min的吸光值,每0.5分钟测一次,绘制时间-吸光值曲线,并计算出邻苯三酚自氧化速率(△A/min)。然后用不同浓度的样品液代替反应体系中的4.2 mL去离子水来测定各种香青菜提取物对邻苯三酚自氧化的抑制率;以Tris-HCl溶液为零点参比,抗坏血酸作为阳性对照。超氧阴离子清除率计算公式为:
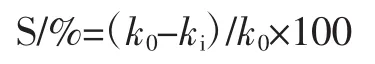
式中:k0为邻苯三酚自氧化速率,△A/min;ki为待测样品存在时的氧化速率,△A/min。
1.3.4 羟基自由基(·OH)清除试验
参照Wei Qin等[8]的方法,配制0.1 mol/L pH 7.4磷酸缓冲液(PBS)、7.5 mmol/L FeSO4溶液、7.5 mmol/L邻二氮菲溶液和0.1%H2O2(体积分数)溶液,根据·OH清除率计算公式中各项的具体操作步骤,按序依次加入各反应液,充分振荡摇匀后,37℃温育1 h,于536 nm下测吸光值。每个样品进行3组平行试验,以BHT为阳性对照,·OH清除率按下式计算。空白对照:蒸馏水1mL+ PBS液2 mL+1 mL样品液+1 mL FeSO4+1 mL H2O2。
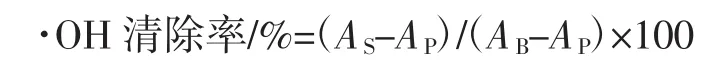
式中:AS为邻二氮菲1 mL+PBS液2 mL+样品液1 mL+FeSO41 mL+H2O 1 mL;AP为邻二氮菲1 mL+PBS液2 mL+甲醇1 mL+FeSO41 mL+H2O21 mL;AB为邻二氮菲1 mL+PBS液2 mL+甲醇1 mL+FeSO41 mL+蒸馏水1 mL。
1.3.5 清除ABTS+自由基试验
参照Kong Kin-weng等[9]和Tabart Jessica[10]的方法,用蒸馏水配制2.45 mmol/L过硫酸钾和7 mmol/L ABTS溶液,然后按0.5∶1的体积比混合,加入10 mL蒸馏水,充分混匀后在室温、避光的条件下静置12 h,得到ABTS储备液。ABTS储备液使用前用无水乙醇稀释成工作液,使其在30℃、734 nm波长处的吸光度为0.70±0.05。取ABTS工作液4 mL置于试管中,分别加入1 mL BHT溶液(阳性对照)、香青菜提取物溶液或无水乙醇(空白对照),振荡30 s,30℃水浴反应6 min,测定其吸光度值,每个样品进行3组平行试验,ABTS+清除率按下式计算。

式中:At为香青菜提取物或BHT混合反应液的吸光度;A0为ABTS工作液吸光度。
1.3.6 β-胡萝卜素/亚油酸体系中抗脂质过氧化作用的测定
参照Liu Wei等[11]和Patricia Arancibia-avila等[12]的方法,精确称取2 mg β-胡萝卜素溶于4 mL氯仿中,然后取该溶液1.5 mL、200 mg吐温80及25 μL亚油酸混合于圆底烧瓶中,40℃旋转蒸干氯仿,残渣加入100 mL蒸馏水振荡混匀得到乳化液,取5 mL乳化液加到含有0.6 mL香青菜提取物样品液的试管中充分混匀后,立即在470 nm处测定在“0”时刻的吸光度值,然后将所有试管置于沸水浴中,反应1 h并迅速冷却到室温后测定吸光度值,对照组用0.6 mL蒸馏水代替样品或BHT溶液,每个样品进行3组平行试验。以不加亚油酸的混合物为空白对照,BHT为阳性对照,每个样品进行3组平行试验,脂质过氧化作用抑制率按下式计算。
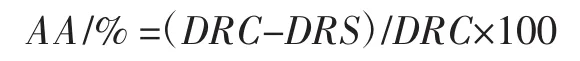
式中:AA为抑制率,%;DRC(对照组)=[ln(a对照/ b对照)/60];DRS(样品组)=[ln(a样品/b样品)/60];a为0时刻的吸光度,b为60 min时的吸光度。
1.3.7 铁离子还原法(FRAP)测定总还原力
总还原力是抗氧化物质抗氧化活力的一个重要判定指标,总还原力越大,其抗氧化活性越强。参照Brewer Lauren-renee等[13]和Amin Ardestani[14]的方法,取0.1 mL样品液,加入3.1 mL蒸馏水和现配的在37℃预热过的1.8 mL FRAP工作液(pH3.6,300 mmol/L醋酸钠缓冲液,10 mmol/L TPTZ溶液和20 mmol/L氯化铁溶液,三者以10∶1∶1的体积比混合),混匀后在37℃条件下水浴反应5 min,以用0.1 mL蒸馏水代替样品液的混合液为空白对照,于593 nm下测定吸光值。以FeSO4为标准品,样品的铁还原能力以每克样品相当于FeSO4的毫摩尔数表示,每个样品进行3组平行试验。以FeSO4的浓度(μmol)为横坐标、吸光度值为纵坐标,建立的回归方程:y=0.001 7x+0.142 9,R2=0.999,线性范围为100 μmol/L~1 000 μmol/L,式中:y为吸光度值;x为FeSO4溶液浓度。最后根据FRAP标准曲线求得各样品的总还原力。
1.3.8 隶属函数法进行抗氧化能力综合比较
通过对香青菜不同提取物在不同抗氧化模型中的半清除率值,参考马文涛等[15]的隶属函数法对各种不同香青菜提取物的抗氧化活性进行综合评价。隶属函数法的计算公式如下:
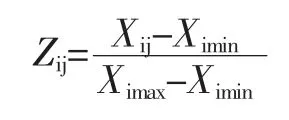
式中:Zij表示隶属函数值,其中i为香青菜提取物种类,j为抗氧化模型种类;Xij为i半清除率值;Ximin和Ximax分别是某种抗氧化类型中所得的半清除率的最小值和最大值;对各种香青菜提取物的隶属函数值取平均值,均值越小则表示该提取物的抗氧化活性越强。
1.4 数据处理
采用SPSS19.0软件进行差异显著性分析,并通过线性回归方程计算IC50(IC50为清除率达到50%时的样品浓度)。
2 结果与分析
2.1 DPPH自由基清除力测定
不同提取物清除DPPH自由基活力见图1。不同香青菜提取物清除DPPH·结果见表1。DPPH自由基是一种较为稳定的以氮为中心的芳香族自由基,其乙醇溶液呈深紫色,在515 nm处具有最大光吸收。抗氧化剂可直接与孤对电子配对,使DPPH自由基吸收减弱,颜色从紫色逐渐变成黄色,因此可以通过测定吸光值减弱的程度来评价该抗氧化剂的活性[4]。
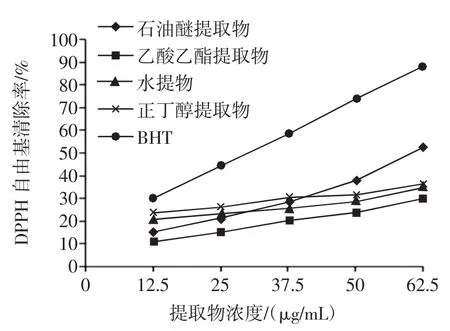
图1 不同提取物清除DPPH自由基能力Fig.1DPPH radical scavenging activity of different EBC
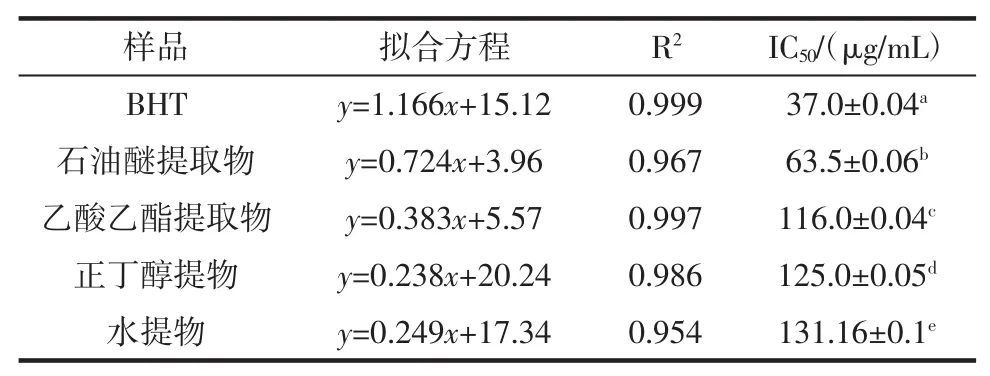
表1 不同香青菜提取物清除DPPH·结果Table 1The results of scavenging DPPH·of different EBC
由图1和表1可知,4种不同的香青菜提取物对DPPH·都有较好的清除能力,在12.5μg/mL~62.5 μg/mL范围内,抗氧化活性随浓度增大而增强,其抗氧化活性均比BHT要弱一些。在石油醚提取物浓度为62.5 μg/mL时清除率达到52.4%。由各种提取物的IC50值大小比较及方差分析可知DPPH·除能力大小顺序为:BHT>石油醚提取物>乙酸乙酯提取物>正丁醇提取物>水提物,且几种提取物对DPPH·的清除效果存在显著差异。
2.2 超氧阴离子自由基(O2-·)清除力测定
不同提取物清除O2-·自由基活力见图2。不同香青菜提取物清除O2-·结果见表2。O2-·是基态氧得到一个电子后形成的第一个氧自由基,可由机体自氧化产生。O2-·是一种弱氧化剂,但可以生成·OH和单线态氧等其它自由基,造成机体氧化胁迫,从而引发多种疾病,所以在检测抗氧化物质活性时,经常将其作为一个重要指标来检测。本试验利用邻苯三酚在碱性条件下会发生自氧化,生成有色中间产物和O2-·,O2-·对自氧化有催化作用。利用邻苯三酚自氧化速率变化来计算提取物对O2-·的清除作用[16]。

图2 不同提取物清除O2-·能力Fig.2O2-·scavenging activity of different EBC
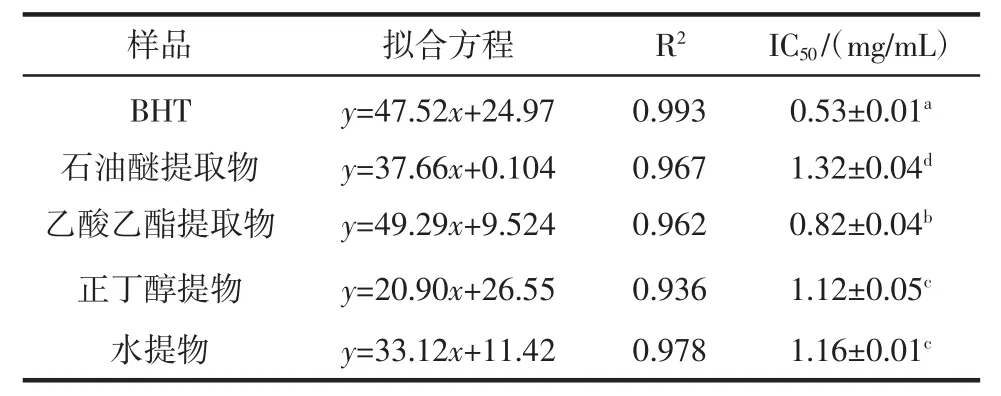
表2 不同香青菜提取物清除O2-·结果Table 2The results of scavenging O2-·of different EBC
由图2和表2可知,4种不同的香青菜提取物均对O2-·有一定的清除能力,在0.23 mg/mL~1.38 mg/mL范围内,抗氧化活性随浓度呈现量效关系,在乙酸乙酯提取物浓度为1.38 mg/mL时清除率达71.4%。由各种提取物的IC50值大小比较及方差分析可知,O2-·清除能力大小顺序为:BHT>乙酸乙酯提取物>正丁醇提取物>水提物>石油醚提取物,且各提取物对O2-·的清除效果除了正丁醇提取物与水提物差异不显著外,其余均存在显著性差异。
2.3 羟基自由基(·OH)清除力测定
不同提取物清除·OH自由基活力见图3。不同香青菜提取物清除·OH结果见表3。羟基自由基化学性质活泼,是对生物机体损害最大的自由基,清除羟基自由基的能力是评价抗氧化物质活性的重要指标[17]。
由图3和表3可知,4种不同的香青菜提取物对·OH都有较强的清除能力,在83 mg/mL~415 μg/mL范围内,抗氧化活性与提取物浓度呈正相关关系,各提取物中正丁醇提取物的清除·OH能力最强。由各种提取物的IC50值大小比较及方差分析可知,·OH清除能力大小顺序为:BHT>正丁醇提取物>乙酸乙酯提取物>石油醚提取物>水提物,且各提取物对·OH的清除效果存在显著差异。
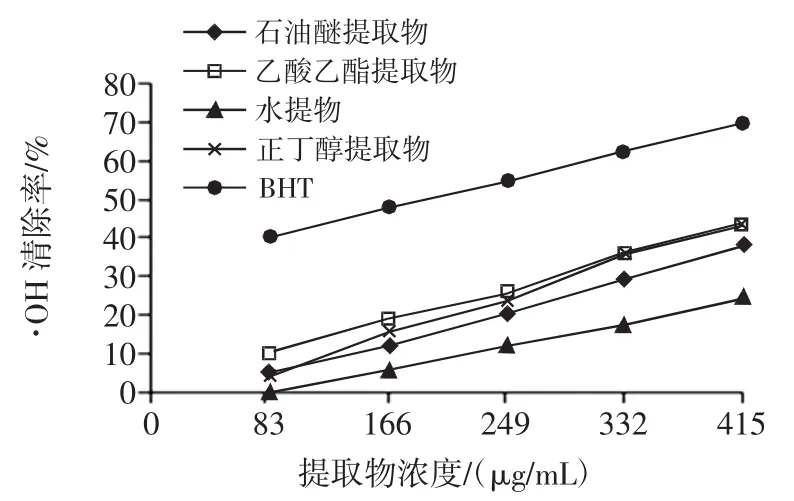
图3 不同提取物清除·OH能力Fig.3·OH scavenging activity of different EBC
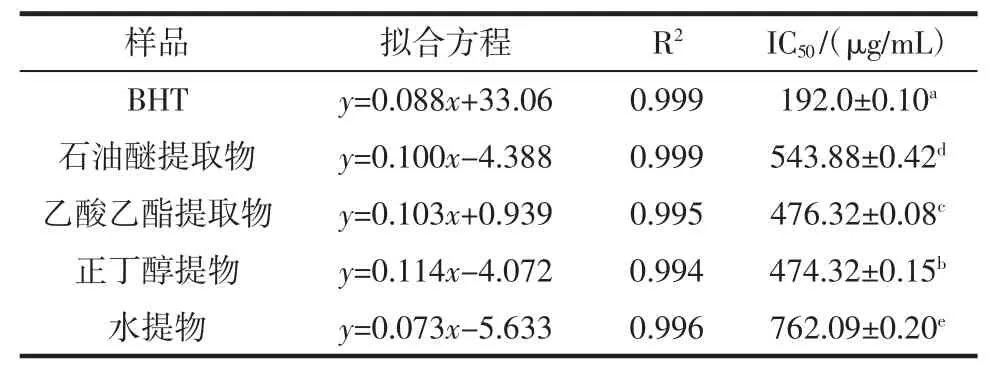
表3 不同香青菜提取物清除·OH结果Table 3The results of scavenging·OH of different EBC
2.4 ABTS+自由基清除力测定
不同提取物清除ABTS+自由基活力见图4。不同香青菜提取物清除ABTS+自由基结果见表4。ABTS+自由基清除法目前已被广泛应用于亲水性和亲脂性物质抗氧化能力的测定。
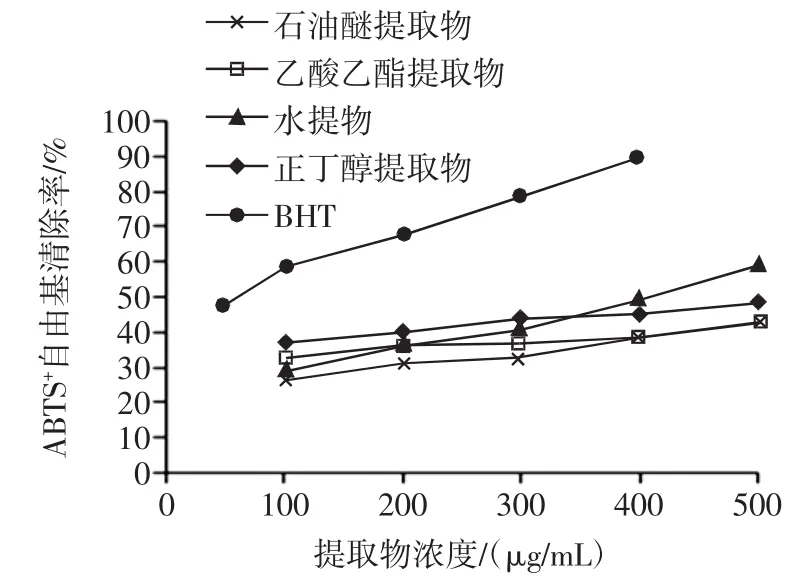
图4 不同提取物清除ABTS+能力Fig.4ABTS+scavenging activity of different EBC
由图4和表4可知,4种不同的香青菜提取物对ABTS+自由基都有较强的清除能力,在100 μg/mL~500 μg/mL范围内,抗氧化活性与提取物浓度呈正相关关系,各提取物中正丁醇提取物的清除ABTS+自由基能力最强。由各种提取物的IC50值大小比较及方差分析可知,ABTS+自由基清除能力大小顺序为:BHT>水提物>正丁醇提取物>石油醚提取物>乙酸乙酯提取物,且各提取物对ABTS+自由基的清除效果存在显著差异。
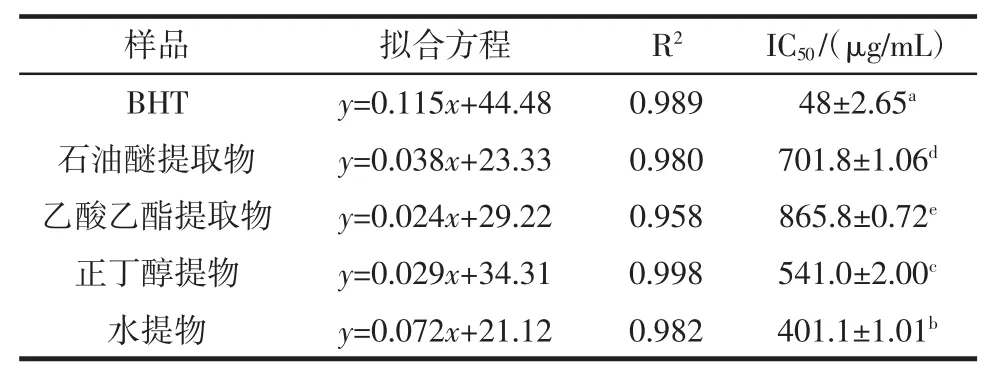
表4 不同香青菜提取物清除ABTS+自由基结果Table 4The results of scavenging ABTS+radical of different EBC
2.5 β-胡萝卜素/亚油酸体系中对脂质过氧化抑制作用的测定
不同提取物对脂质过氧化抑制作用见图5。不同香青菜提取物对脂质过氧化抑制作用结果见表5。β-胡萝卜素易发生氧化而褪去黄色,在反应体系中亚油酸氧化产生的过氧化物使β-胡萝卜素发生氧化而褪色,当反应体系中有抗氧化剂时,褪色速度缓慢,且褪色程度与抗氧化活性呈负相关,从而可以测定各提取物对脂质过氧化的抑制能力[11]。
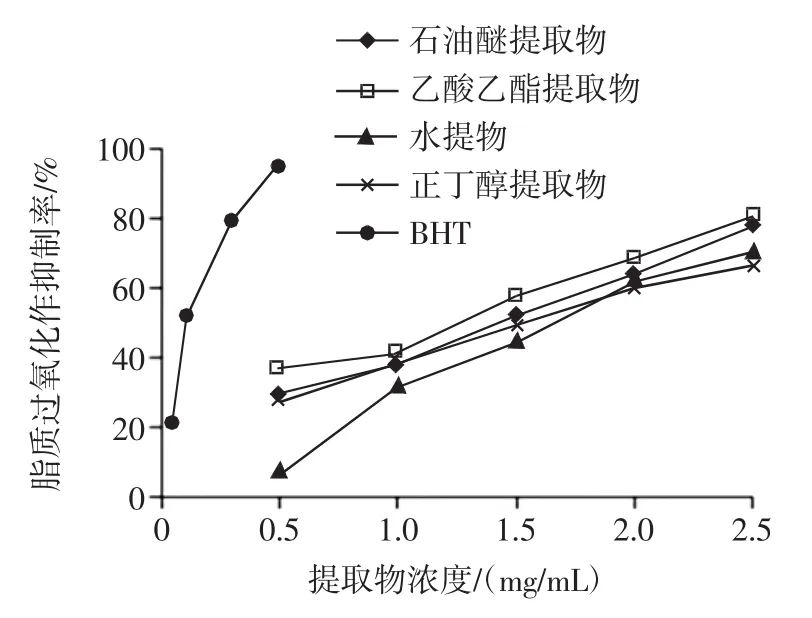
图5 不同溶剂提取物抑制脂质过氧化作用能力Fig.5Anti-lipid peroxidation activity of different EBC
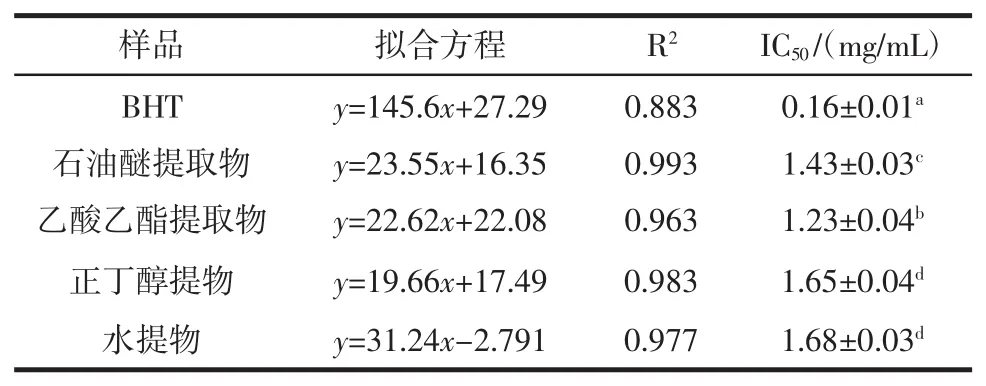
表5 不同香青菜提取物抗脂质过氧化作用结果Table 5The results of anti-lipid peroxidation of different EBC
由图5和表5可知,4种不同的香青菜提取物均对β-胡萝卜素/亚油酸体系中抗脂质过氧化有较强的抑制能力,在0.5 mg/mL~2.5 mg/mL范围内,抗氧化活性与提取物浓度呈正相关关系,各提取物中乙酸乙酯提取物的抑制能力最强。由各种提取物的IC50值大小比较及方差分析可知,脂质过氧化抑制能力大小顺序为:BHT>乙酸乙酯提取物>石油醚提取物>正丁醇提取物>水提物,且各提取物对脂质过氧化抑制能力除了正丁醇提取物与水提物差异不显著外,其余均存在显著性差异。
2.6 总还原力测定
抗氧化剂通过自身还原作用供给电子而使自由基变为稳定分子,失去活性,故还原力大小是反映抗氧化剂提供电子能力强弱的直接体现。各提取物的还原力与吸光度值成正比,还原力可通过待测物吸光度大小来表示总还原力越大,则其抗氧化活力越强[18]。各提取物的总还原力测定结果见表6。
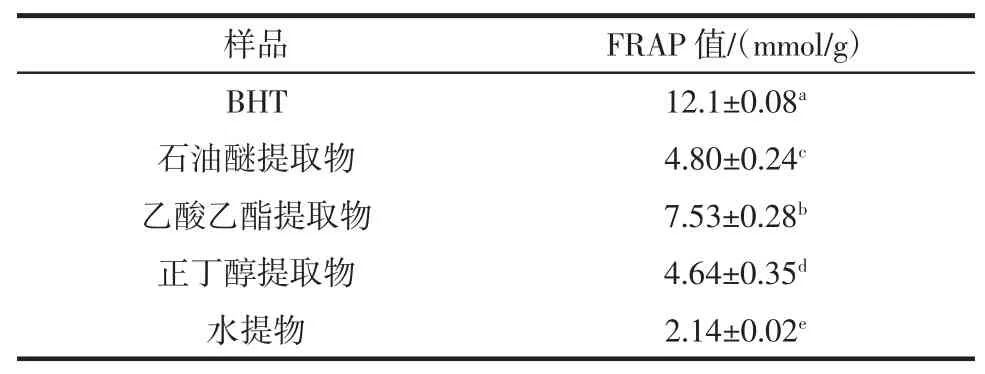
表6 不同溶剂提取物FARP值Table 6The FRAP value of different EBC
由表6可知,4种不同的香青菜提取物都具有较强的总抗氧化能力,其FRAP值得范围在2.14 mmol/g~7.53 mmol/g之间,其中乙酸乙酯提取物的总抗氧化能力最强。总抗氧化能力大小顺序为:BHT>乙酸乙酯提取物>石油醚提取物>正丁醇提取物>水提物。且各提取物的总抗氧化能力存在显著差异。
2.7 各提取物抗氧化能力综合比较
由于各种抗氧化机理不尽相同,导致相同提取物对不同自由基的抑制能力有所差异。为了系统地了解各种提取物的综合抗氧化能力强弱,本试验采用了隶属函数法对各提取物抗氧化能力综合比较,以进一步确定香青菜中抗氧化成分的主要分布位置。测定结果见表7。
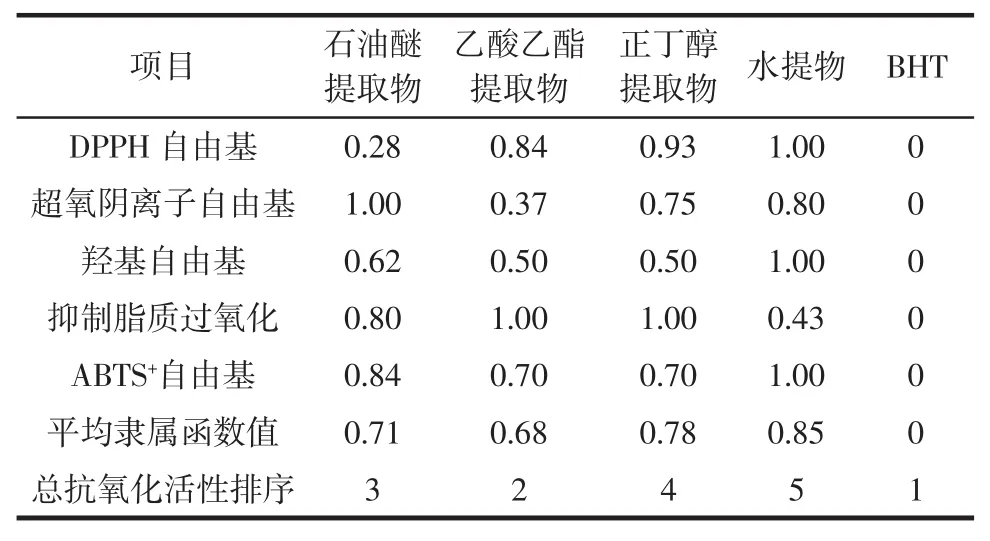
表7 各提取物总抗氧化活性综合评价Table 7Total antioxidant activity evaluation of different extracts
由表7可知,各提取物中乙酸乙酯提取物的总抗氧化活性最强,水提取物的总抗氧化活性最弱。总抗氧化能力大小顺序为:BHT>乙酸乙酯提取物>石油醚提取物>正丁醇提取物>水提物。
3 结论
几种香青菜提取物均具有一定的抗氧化活性,且其抗氧化活性与提取物的浓度呈正相关关系。其中乙酸乙酯提取物的抗氧化活性最强,石油醚提取物的抗氧化活性次之,水提取物的抗氧化活性最弱,说明香青菜中的大部分抗氧化活性成分分布在弱极性提取物中。香青菜作为一种传统特有蔬菜,除了具有香味浓郁、品质柔嫩、风味独特、营养丰富等优良特性以外,还具有较好的抗氧化活性。因此,香青菜具有很好的开发利用价值。
[1]陈虎根,杨雪梅,蒋树德,等.苏州地方特色品种—香清菜[J].上海蔬菜,2004(5):22-23
[2]杨雪梅,韩建军,张胜,等.小白菜新品种寒香青菜的选育[J].河南农业科学,2012,41(11):114-116
[3]郁寅良,潘复生,王友俊,等.无公害香青菜生产技术规程要点[J].蔬菜,2003(5):8-9
[4]Tai Z G,Cai L,Dai L,et al.Antioxidant activity and chemical constituents of edible flower of Sophora Viciifola[J].Food Chemistry, 2011,126(4):1648-1654
[5]张前军,刘瑜新,康文艺,等.饿蚂蝗抗氧化活性研究[J].中成药, 2010,32(11):1980-1982
[6]Sun S J,He H,Xie B J,et al.Novel Antioxidant Peptides from Fermented Mushroom Ganoderma lucidum[J].JournalofAgriculturaland Food Chemistry,2004,52:6646-6652
[7]李路宁,陈威,赵立仪,等.蓝莓花青素的酰化及其抗氧化性评价[J].食品工业科技,2014,35(6):102-105
[8]Wei Q,Ma X H,Zhao Z,et al.Antioxidant activities and chemical profiles of pyroligneons acid from walnut shell[J].Journal of Analytical and Applied Pyrolysis,2010,88(2):149-154
[9]Kong K W,Sarni M J,Aminudin N,et al.Antioxidant activities and polyphenolics from the shoots of Barringtonia racemosa(L.)Spreng in a polar to apolar medium system[J].Food Chemistry,2012,131:324-332
[10]Tabart J,Franck T,Kevers C,et al.Antioxidant and anti-inflammatoryactivitiesof Ribesnigrum extracts[J].Food Chemistry,2012,131:1116-1122
[11]Liu W,Fu Y J,Zu G Y,et al.Supercritical carbon dioxide extraction of seed oil from Opuntia dillenii Haw.and its antioxidant activity[J]. Food Chemistry,2009,114(1):334-339
[12]Patricia A A,Toledo F,Park Y S.et al.Antioxidant properties of durian fruit as influenced by ripening[J].LWT-Food Science and Technology,2008,41:2118-2125
[13]Brewer L R,Kubola J,Siriamornpun S,et al.Wheat bran particle size influence on phytochemical extractability and Antioxidant properties[J].Food Chemistry,2014,114:483-490
[14]Amin A,Razieh Y.Inhibitory effects of ethyl acetate extract of Teucrium polium on in vitro protein glycoxi-dation[J].Food and Chemical Toxicology,2007,45:2402-2411
[15]马文涛,樊卫国.贵州野生柑橘的抗寒性测定和综合评价[J].西北植物学报,2014,34(10):2063-2069
[16]黄优生,谢明勇,聂少平,等.山楂提取物的抗氧化活性研究[J].食品与生物技术学报,2010,29(2):189-192
[17]殷军,葛青,毛建卫,等.竹叶多糖的组分及抗氧化活性分析[J].食品工业科技,2013,34(2):100-103
[18]Choe J H,Jang A,Choi J H,et al.Antioxidant Activities of Lotus Leaves(Nelumbo nucifera)and Barley Leaves(Hordeumv-ulgare) Extracts[J].Food Science Biotechnology,2010,19(3):831-836
Study on the Antioxidant Activity of Different Extracts from Brassica chinensis L.
WANG Luo-ling1,SHEN Xue-lin2,LI Ya-feng1,CHEN Chun-xu1,SHI Tai-long1,WANG Tao-yun1,3,*
(1.School of Chemical Biological and Material Engineering,Suzhou University of Science and Technology,Suzhou 215009,Jiangsu,China;2.Suzhou Station of Seed Management,Suzhou 215011,Jiangsu,China;3.College of Pharmaceutical Science,Soochow University,Suzhou 215123,Jiangsu,China)
The antioxidant activity of four solvent(petroleum ether,ethyl acetate,normal butyl alcohol and aqueous)extracts from Brassica chinensis L.were determined using five antioxidant assay,including DPPH radical,superoxide scavenging effect,hydroxyl radical,ABTS radical and reducing power.At the same time,total antioxidant activity of these four extracts was evaluated by subordination function method.The results showed that all of the extractions from Brassica chinensis(EBC)L.had antioxidant activity and the content of EBC had a highly significant correlation with the activity.And the ethyl acetate extraction of Brassica chinensis showed the highest antioxidant activity,while the water extraction of Brassica chinensis L.showed the lowest antioxidant activity.So,the Brassica chinensis L.has great applied foreground and research value.
Brassica chinensis;extractions;antioxidant activity;subordination function method
10.3969/j.issn.1005-6521.2017.09.007
2015-06-14
苏州科技计划项目-应用基础研究计划(SYN201322);江苏省高等学校大学生创新创业训练计划项目“苏州传统特色珍稀蔬菜-香青菜的挥发性香气成分分析与活性研究”(201310332065X)
王罗玲(1991—),女(汉),本科在读,生物技术专业。
*通信作者:王桃云(1973—),男,副教授,博士,主要从事植物资源与食品功能成分研究。
