经导管肾动脉化疗栓塞联合射频消融术治疗肾癌的疗效分析
2017-06-01吕天石王灏琛佟小强邹英华
吕天石,王灏琛,王 健,宋 莉,佟小强,邹英华
(北京大学第一医院介入血管外科,北京 100034)
·临床研究·
经导管肾动脉化疗栓塞联合射频消融术治疗肾癌的疗效分析
吕天石,王灏琛,王 健,宋 莉,佟小强,邹英华*
(北京大学第一医院介入血管外科,北京 100034)
目的 评价TACE联合射频消融术(RFA)治疗肾癌的疗效。方法 回顾性分析我中心收治的23例肾癌患者资料。全部患者均首先行肾TACE治疗,并在3~4周后在超声及CT的联合引导下行RFA术。评价患者术前术后的卡氏功能状态评分(KPS评分)及肾功能变化情况,同时在随访期内定期对患者行腹部超声、CT/MR增强扫描评价其疗效。结果 至随访终止,全部23例患者中生存21例(21/23,91.30%),死亡2例(2/23,8.70%)。全部患者在术前和随访期结束时的KPS评分及血肌酐水平差异无统计学意义(P均>0.05)。至随访结束,23例患者肾内病灶的治疗效果为完全缓解16例、部分缓解5例、进展2例。结论 TACE联合RFA治疗肾癌创伤小、疗效确切、围术期并发症少,是一种较为安全有效的方法。
肾肿瘤;化学栓塞,治疗性;导管消融;联合治疗
近年来,随着血管腔内介入治疗的迅速发展,TACE、射频消融术(radiofrequency ablation, RFA)已经成为临床治疗肾脏恶性肿瘤的常用方法。尤其对于体质差、合并症多、麻醉风险大或不愿接受手术切除的中晚期肾细胞癌(renal cell carcinoma, RCC)患者,介入治疗可有效抑制肿瘤生长、提高生活质量和延长生存时间。目前,TACE联合RFA治疗肝脏恶性肿瘤的应用较广泛,疗效也已得到一致认可。但TACE联合RFA治疗RCC的研究并不多见。本研究回顾性分析了在我中心接受TACE联合RFA治疗的RCC患者23例,旨在探讨其治疗效果及临床应用价值。
1 资料与方法
1.1 一般资料 收集2012年1月—2016年11月在我院接受TACE联合RFA治疗的RCC患者23例,其中男19例、女4例,年龄37~85岁,平均(61.0±11.3)岁。所有患者均经病理或临床确诊,且均曾出现肉眼血尿。患者术前均接受腹部超声、CT或MR检查。肿瘤直径2~9 cm,平均(4.8±1.2)cm,其中<4 cm者12例、4~7 cm 8例、>7 cm 3例。肿瘤按Robson分期,Ⅰ期11例、Ⅱ期9例、Ⅲ期1例、Ⅳ期2例;位于左肾10例、右肾13例。20例术前血肌酐水平正常,3例术前血肌酐水平高于正常值,其中1例达到304 μmol/L。术前卡氏功能状态(Karnofsky Performance Status, KPS)评分70~100分,平均 (93.5±8.7)分。
1.2 仪器与方法 采用仪器:GE Innova-4100型及Philips Integris Allura型血管造影机;GE 750HD CT扫描仪;GE Logiq P3 Expert 超声诊断仪;RITA 1500X射频消融发生器(美国);射频消融针为StarbustTMXL射频电极针。
1.2.1 TACE方法 腹主动脉造影确定肿瘤供血动脉后,应用2.7/2.8F的微导管超选至所有肿瘤供血动脉,将化疗药物(阿霉素20~40 mg)与碘化油充分混合制成的乳剂经导管注入靶区域,必要时加用颗粒型栓塞剂(如微球栓塞剂或PVA颗粒等),以保证栓塞效果。
1.2.2 RFA 肾TACE术后3~4周,待患者栓塞后反应充分缓解,复查各项指标达标后即拟行RFA治疗。治疗均采用经皮经肾途径,于局麻联合静脉基础麻醉下完成。所有治疗均采用CT扫描定位、超声引导穿刺的方法,根据肿瘤位置及大小选择治疗的温度及时间,治疗范围以覆盖整个瘤体及周边0.5~1.0 cm的正常肾组织为标准。拔出电极针时边电凝边缓慢退针。治疗全程给予患者心电监护,术后予消炎、止血及对症处理。
1.3 后续治疗及随访 肾TACE与RFA联合治疗术后第1个月行腹部CT/MR增强扫描,此后每个月行腹部超声及血生化检查(肝肾功能)、血常规检查,每3个月行腹部CT/MR增强扫描。本研究的随访终点为患者死亡或至2016年11月30日。
1.4 疗效评价 全部23例患者的23处病灶均按改良版实体瘤治疗疗效评价标准1.1版(mRECIST1.1)进行评价,分为完全缓解(complete remission, CR):增强CT或MR动脉期强化灶完全消失并维持4周以上;部分缓解(partial remission, PR):增强CT或MR动脉期强化灶的最大径减小30%以上并维持4周以上;进展(progressive disease, PD):增强CT或MR动脉期强化灶的最大径增大20%以上或出现新病灶;稳定(stable disease, SD):介于PR与PD之间的情况。
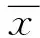
2 结果
2.1 疗效评价 23例患者均获得技术成功,技术成功率为100%(23/23,图1),同时所有患者均未出现需延长住院时间或危及生命的严重不良反应。至随访终止,生存21例(21/23,91.30%),死亡2例(2/23,8.70%),死亡原因分别为术后3个月及5个月时RCC广泛进展伴多发转移及其相关并发症。至随访终止,患者肾内病灶的治疗效果为CR 16例(16/23,69.57%),PR 5例(5/23,21.74%),PD 2例(2/23,8.70%);其中评价为PR的5例患者中,4例接受了补充肾TACE治疗。最大径小于4 cm的肿瘤全部达到CR,而肿瘤最大径超过7 cm的3例患者中2例为PR,另1例在术后5个月因多发远隔转移及相关并发症死亡。患者术前和随访期结束时KPS评分及血肌酐水平差异无统计学意义(P均>0.05,表1)。
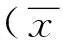
表1 术前及随访期结束时患者KPS评分及肌酐水平变化±s)
2.2 并发症及术后反应 多数患者在联合治疗后出现不同程度的腰部疼痛、食欲差等症状,其中5例于RFA术后2日内出现体温升高,以上症状均在对症处理后1周内好转。全部患者在整个治疗过程中均未出现需要延长住院时间或危及生命的严重不良反应。
3 讨论
目前,外科手术是治疗RCC的首选方法,但目前研究表明介入治疗,尤其是TACE联合RFA术,治疗RCC的疗效与手术基本相当。Pan等[1]研究显示,接受RFA治疗的患者平均住院时间明显少于手术切除组。在适应证方面,由于RFA为微创手术,与手术切除比较,其可在更低的肾小球滤过率患者中实施,且肾小球滤过率的波动也较手术切除组小;虽然经RFA治疗的患者原位复发的情况较肾部分切除的患者多,但在远隔转移方面二者无显著性差异。类似的结论也见于Wang等[2]的报道。Thompson等[3]的一项研究共入组1 804例患者,包括1 424例Ⅰa期患者,其中1 057例患者接受肾部分切除治疗、180例患者接受RFA治疗、187例患者接受冷冻消融治疗,结果发现3种治疗方法的原位复发率相似;但与RFA治疗相比,肾部分切除术及冷冻消融治疗远处转移率更低。Olweny等[4]研究报道,对于Ⅰa期RCC而言,接受RFA与肾部分切除术的患者生存时间并无显著差异。
肾TACE通过对肿瘤血管的超选择,可以将栓塞剂及化疗药物准确地输送至肿瘤供血动脉内,起到治疗肿瘤的作用[5]。其具体机制为通过减少肿瘤血供,使肿瘤缺血坏死;同时足量化疗药物作用于局部,使肿瘤细胞坏死,产生抗原,刺激机体细胞发生免疫反应,推迟肿瘤复发和转移的时间,有效地延长患者的生存时间[6]。
近年来,RFA以其创伤小、围术期并发症少、住院时间短及疗效确切等优点,越来越多地应用于肿瘤治疗,特别是肝脏肿瘤的治疗中。自1997年Zloota等[7]首次报道以来,RFA在RCC治疗领域也逐步兴起,且均取得了较为理想的疗效。Duan等[8]报道了栓塞联合RFA治疗不可切除RCC的疗效,该研究共入组28例患者,除2例在随访期内分别因远隔转移及肺心病死亡外,其余26例患者的肾内病灶均得到良好控制,肿瘤明显缩小。Clark等[9]在超声或CT引导下使用多极射频针对22例患者的26个病灶进行RFA,病灶平均直径为(2.2±0.7)cm,随访1~31个月,结果显示25个病灶完全消融,1个病灶在随访第21个月时局部复发,后经再次射频治疗后控制良好。Gervais等[10]对34例患者的42个病灶进行消融治疗,并经CT或MR随访,结果显示29个外生型病灶和2个肾实质内病灶得到完全消融;11个肾窦部病灶中有5个得到完全消融。另有研究[11]报道,RCC的RFA治疗效果受多种因素影响,其中主要为肿瘤大小、形状、血供等。

图1 患者男,65岁,右侧肾癌 A、B.腹部CT增强提示右肾中部占位; C.肾TACE术中超选右肾肿瘤供血动脉,可见肿瘤染色; D.栓塞术后即刻造影可见碘油沉积良好,肿瘤染色消失; E、F.患者取左侧卧位,在CT引导下行RFA术治疗; G、H.术后1个月复查,原病灶治疗效果良好,未见残存或原位复发征象
TACE联合RFA治疗首先应用于肝癌的治疗,多数研究已经阐明其原理,并有充分的临床证据证实联合治疗的效果[12-14]。RCC的介入联合治疗虽然开展时间略晚,但依靠大量在肝癌治疗方面的理论基础与临床实践,目前其在RCC的治疗领域占据重要地位。Rendon等[15]报道认为,射频前未栓塞肾动脉者的消融灶为楔形,而并非理想的球形,主要是由于消融靶区域及周边的血流影响热量传导,即“热沉效应”所致。Horkan等[16]同样发现,通过减少肾脏血流量可明显增加消融范围。Chang等[17]的研究将实验猪分为2组,其中1组在对肾脏靶区域消融前阻断肾血流,另1组不做处理,结果发现肾血流阻断组的消融灶明显大于未阻断组,且消融灶形态也更加稳定。
本研究经肾TACE联合RFA治疗的23例患者,在随访期内评价为CR 16例,PR 5例,PD 2例。若根据肿瘤最大径进行分类,最大径小于4 cm的肿瘤全部达到CR,而肿瘤最大径超过7 cm的3例患者中2例为PR,另1例在术后5个月因多发远隔转移及相关并发症死亡,提示肿瘤大小是影响RFA效果的主要原因之一。同时,本组全部23例患者术前与术后KPS评分差异无统计学意义(P>0.05),进一步证明了肾TACE联合RFA治疗RCC的微创特性。尤其对于一些高龄、合并症较多或麻醉风险较大的患者,介入治疗可能成为这部分患者的首选治疗方法。另外,肾功能不良通常认为是介入手术的相对禁忌证,但本研究结果认为,轻中度的肾功能不全的患者仍然能够耐受介入治疗,并且肾功能在术后并无明显恶化趋势。考虑可能与术前及术后充分水化、对比剂种类及用量等相关。由此可知,在充分重视及保护患者肾功能的情况下,部分肾功能不全的RCC患者仍能够接受介入治疗。
随访过程中,除2例Robson Ⅳ期患者在联合治疗后3个月及5个月因肿瘤进展及全身多发转移死亡外,其余21例患者的肾内病灶均得到良好控制。由此可见对于RobsonⅠ~Ⅱ期的RCC患者,应用肾TACE联合RFA术治疗可以取得良好的治疗效果。
本研究的不足:作为一项回顾性研究,纳入患者数量较少,更多观点有待大宗前瞻性研究进一步探讨。
总之,肾TACE联合RFA术治疗RCC创伤小、疗效确切、围术期并发症少,是一种较为安全有效的方法。尤其对于一部分高龄、合并症较多或麻醉风险较大的患者,介入治疗可能成为其首选治疗方法。
[1] Pan XW, Cui XM, Huang H, et al. Radiofrequency ablation versus partial nephrectomy for treatment of renal masses: A systematic review and meta-analysis. Kaohsiung J Med Sci, 2015,31(12):649-658.
[2] Wang S, Qin C, Peng Z, et al. Radiofrequency ablation versus partial nephrectomy for the treatment of clinical stage 1 renal masses: A systematic review and meta-analysis. Chin Med J (Engl), 2014,127(13):2497-2503.
[3] Thompson RH, Atwell T, Schmit G, et al. Comparison of partial nephrectomy and percutaneous ablation for cT1 renal masses. Eur Urol, 2015,67(2):252-259.
[4] Olweny EO, Park SK, Tan YK, et al. Radiofrequency ablation versus partial nephrectomy in patients with solitary clinical T1a renal cell carcinoma: Comparable oncologic outcomes at a minimum of 5 years of follow-up. Eur Urol, 2012,61(6):1156-1161.
[5] 童强,徐丹枫,董伟华,等.肾动脉化疗栓塞结合免疫治疗巨大肾癌21例.介入放射学杂志,2007,16(7):493-495.
[6] Hansmann J, Richter GM, Hallscheidt P, et al. Angiography and interventional radiology of the kidney. Radiologe, 1999,39(5):361-372.
[7] Zlotta AR, Wildschutz T, Raviv G, et al. Radiofrequency interstitial tumor ablation (RITA) is a possible new modality for treatment of renal cancer: Ex vivo and in vivo experience. J Endourol, 1997,11(4):251-258.
[8] Duan XH, Li YS, Han XW, et al. C-arm CT-guided renal arterial embolisation followed by radiofrequency ablation for treatment of patients with unresectable renal cell carcinoma. Clin Radiol, 2016,71(1):79-85.
[9] Clark TW, Malkowicz B, Stavropoulos SW, et al. Radiofrequency ablation of small renal cell carcinomas using multitined expandable electrodes: Preliminary experience. J Vasc Interv Radiol, 2006,17(3):513-519.
[10] Gervais DA, Mcgovern FJ, Arellano RS, et al. Renal cell carcinoma: Clinical experience and technical success with radio-frequency ablation of 42 tumors. Radiology, 2003,226(2):417-424.
[11] 张建国,王艳丽,史秋生,等.选择性肾动脉化疗栓塞联合多电极射频治疗晚期肾癌.中国综合临床,2007,23(3):260-261.
[12] 崔彦,畅坚,周立艳,等.经皮射频联合肝动脉导管化疗栓塞治疗大肝癌疗效分析.中国介入影像与治疗学,2006,3(1):1-4.
[13] Buscarini L, Buscarini E, Di Stasi M, et al. Percutaneous radiofrequency thermal ablation combined with transcatheter arterial embolization in the treatment of large hepatocellular carcinoma. Ultraschall Med, 1999,20(2):47-53.
[14] Yamasaki T, Kurokawa F, Shirahashi H, et al. Percutaneous radiofrequency ablation therapy with combined angiography and computed tomography assistance for patients with hepatocellular carcinoma. Cancer, 2001,91(7):1342-1348.
[15] Rendon RA, Gertner MR, Sherar MD, et al. Development of a radiofrequency based thermal therapy technique in an in vivo porcine model for the treatment of small renal masses. J Urol, 2001,166(1):292-298.
[16] Horkan C, Ahmed M, Liu Z, et al. Radiofrequency ablation: Effect of pharmacologic modulation of hepatic and renal blood flow on coagulation diameter in a VX2 tumor model. J Vasc Interv Radiol, 2004,15(3):269-274.
[17] Chang I, Mikityansky I, Wray-Cahen D, et al. Effects of perfusion on radiofrequency ablation in swine kidneys. Radiology, 2004,231(2):500-505.
Transcatheter arterial chemoembolization combined with radiofrequency ablation in treatment of renal cell carcinoma
LYUTianshi,WANGHaochen,WANGJian,SONGLi,TONGXiaoqiang,ZOUYinghua*
(DepartmentofInterventionalandVascularSurgery,PekingUniversityFirstHospital,Beijing100034,China)
Objective To evaluate the safety and effectiveness of TACE with radiofrequency ablation (RFA) in treatment of renal cell carcinoma. Methods Data of 23 cases of renal cell carcinoma were retrospectively analyzed. Firstly all patients were treated with renal TACE, and then RFA under the guidance of ultrasound and CT was performed 3 to 4 weeks later. The therapeutic effects were evaluated by enhanced CT or MR scans during the follow-up period. Meanwhile, the changes of Karnofsky Performance Status (KPS) scores and renal functions between preoperative and postoperative periods were also evaluated. Results To the end of the follow-up, in all 23 patients 21 cases (21/23, 91.30%) survived and 2 cases died (2/23, 8.70%). KPS scores and serum creatinine levels were observed in all 23 patients at the initial stage and the end of the follow-up period, there were no significant differences (allP>0.05). At the end of follow-up, 16 cases were complete remission, 5 were partial remission and 2 were progressive disease. Conclusion TACE combined with RFA is a safe and effective method in treatment of renal cell carcinoma with less trauma, less complication and more effective.
Kidney neoplasms; Chemoembolization, therapeutic; Catheter ablation; Combined therapy
吕天石(1986—),男,北京人,硕士,医师。研究方向:肿瘤介入治疗学。E-mail: terrencelv@126.com
邹英华,北京大学第一医院介入血管外科,100034。E-mail: yinghzou@139.com
2016-12-21
2017-02-25
R737.11; R815
A
1672-8475(2017)05-0261-05
10.13929/j.1672-8475.201612022