水稻黄嘌呤脱氢酶基因OsXDH克隆及表达分析
2017-05-30

摘要:【目的】克隆水稻黄嘌呤脱氢酶(Xanthine dehydrogenase,XDH)基因(OsXDH),分析其生物信息学特性及表达特性,为研究XDH在水稻生长发育和响应逆境胁迫中的调控机制提供理论依据。【方法】以粳稻品种日本晴为材料,采用同源克隆技术克隆OsXDH基因,应用生物信息学方法对其氨基酸序列进行分析。利用实时荧光定量PCR(qPCR)检测OsXD14基因的组织表达特性及逆境胁迫下的表达情况,并对不同转基因株系乳熟期剑叶OsXDH基因表达量、XDH活性和叶绿素含量进行比较分析。【结果】克隆获得OsXDH基因的开放阅读框序列(ORF)(GenBankg登录号LOC4333171),其长度为4110 bp,编码1369个氨基酸。OsXDH蛋白分子量大小为150.23 kD,理论等电点(pI)为6.54,与小麦、高粱、玉米、谷子和油菜等作物XDH蛋白氨基酸序列的相似性分别为84.54%、84.07%、81.52%、76.35%和69.22%,表明XDH蛋白氨基酸序列具有高度保守性。OsXDH基因在水稻不同组织部位均有表达,灌浆期的表达量显著高于苗期和分蘖盛期(P<0.05),且受干旱、黑暗、高温和盐胁迫诱导高效表达。OsXDH过表达水稻转基因株系乳熟期剑叶的XDH活性和叶绿素含量高于野生型,OsXDH干扰转基因株系的XDH活性和叶绿素含量低于野生型。【结论】OsXDH基因受水稻生长发育和逆境胁迫因子诱导表达,推测其是调控水稻生长发育和响应逆境胁迫的关键基因。
关键词:水稻;OsXDH基因;基因克隆;生物信息学;表达分析;胁迫
中图分类号:S511.03 文献标志码:A 文章编号:2095-1191(2017)12-2113-09
0引言
【研究意义】由于生态环境不断恶化,干旱、盐碱、极端温度及重金属污染等严重影响粮食作物的产量和品质。作物抗性是由多基因控制的数量性状,抗性基因克隆和功能分析已成为研究热点。黄嘌呤脱氢酶(Xanthine dehvdrogenase,XDH)作为调控嘌呤代谢的中间酶类,能将黄嘌呤和次黄嘌呤催化生成尿酸,经一系列代谢反应,最终生成酰脲类物质(Ureides),在应答生物胁迫与非生物胁迫中发挥重要作用(Montalbini,2000;Aguey-Zinsou et al.,2003;Zdunek-zastocka and Lips,2003;Taylor and Cowan,2004;Zrenner et al.,2006;Brychkova et al.,2008a)。因此,克隆水稻XDH基因(OsXDH),分析其序列特征,可为阐明植物XDH的抗逆境胁迫调控机制提供理论参考。【前人研究进展】目前,已对不同植物XDH的抗逆境胁迫调控机制开展了大量研究,结果均表明XDH对逆境胁迫有应答响应,与植物体内的多个生理代谢相关(Aguey-Zinsou et al.,2003;Taylorand Cowan,2004;Nakagawa et al.,2007),如Montal-bini(1991)研究发现,感染锈病的豆科植物叶片中嘌呤分解代谢加快,酰脲类物质含量快速积累,对非共生病原的抗性增强。植物抗性增强的原因是嘌呤代谢产物酰脲类物质具有较高的碳氮比,易于在植物体内转运,是氮素贮存和低耗转运载体,可降低氮素转运过程中的能量损耗,以提高植物在逆境胁迫下的生存能力(Buchanan-Wollaston,1997;Gepstein,2004),因此,植物体内的XDH活性随着盐和NH4浓度的增加而升高,且氨态氮处理下XDH活性高于硝态氮处理(Barabfis et al.,2000;Zrenner et al.,2006;Zdunek-zastocka and Lips,2003)。也有研究表明,酰脲类物质可清除植物体内H2O2、O2等活性氧自由基(Becker et al.,1989;Pastori and del Rio,1997),增加尿囊素和尿囊酸含量,從而降低氧化性损伤和减少幼苗死亡(Brychkova et al.,2008b)。当植物受干旱、盐胁迫和黑暗胁迫时,XDH活性升高,尿酸和酰脲类物质含量增加,体内活性氧含量降低,促使植株对环境胁迫的耐受能力增强,其病死率明显降低(Brychkova et al.,2008b;Watanabe et al.,2010;Maet al.,2016;Hofinann,2016;You et al.,2017)。但钼素缺失会阻碍黄嘌呤分解代谢,不利于氮素在植株体内的运输,导致植株长势变弱(孙学成和胡承孝,2005)。此外,有研究表明XDH蛋白结构的发生改变可介导细胞分裂素、脱落酸和生长素等植物激素的动态平衡,发挥对植物性状及抗逆境胁迫的调控作用(Leydecker et al.,1995;Taylor and Cowan,2001;Smith and Atkins,2004;Watanabe et al.,2014)。【本研究切入点】至今鲜见有关水稻OsXDH基因克隆并分析其在非生物胁迫下表达特性的研究报道。【拟解决的关键问题】利用同源克隆技术克隆水稻OsXDH基因的开放阅读框序列(ORF),采用生物信息学软件分析其序列结构特征,并用实时荧光定量PCR(qPCR)检测其组织表达特性及逆境胁迫下的表达情况,同时比较不同OsXDH转基因水稻株系乳熟期剑叶OsXDH基因表达量、XDH活性及叶绿素含量的差异,为研究XDH对水稻品种生长发育及响应逆境胁迫的调控机理提供理论参考。
1材料与方法
1.1试验材料
供试的粳稻品种为日本晴(Oryza sativa L.spp.japonica cv.Nipponbare),其野生型、OsXDH干扰转基因株系(Ri3、Ri5和Ri6)及过表达转基因株系(OEl、OE3和OE9)均由江西省作物生理生态与遗传育种重点实验室提供。主要试剂:KOD FX高保真PCR酶购自东洋纺(上海)生物科技有限公司,Mini-BEST Plant RNA Extraction Kit试剂盒、PrimeScriptTMRT Master Mix试剂盒和SYBR Premix Ex TaqTMⅡ试剂盒购自宝生物工程(大连)有限公司,其他生化试剂均购自生工生物工程(上海)股份有限公司。主要设备仪器:人工气候箱(GXZ智能型,宁波江南仪器厂)、ChemiDoc XRS+凝胶成像系统(BIO-RAD,美国)、NanoDrop ND2000超微量核酸蛋白分析仪(Thermo,美国)、CFX96 Real-Time PCR Detection System(B10-RAD,美国)、TU-1810紫外可见分光光度计(普析通用,北京)和电泳转印系统(BIO-RAD,美国)。
1.2胁迫处理及样品采集
干旱胁迫处理采用土培法,高温、黑暗和盐胁迫处理均采用水培法。所有处理均在人工气候箱中进行,正常生长条件参数:12 h/12 h(白天/黑夜)、28℃/25℃(白天/黑夜)、光照强度为20000 lx/0 lX(白天/黑夜)和75%相对湿度。水稻幼苗在正常条件下生长N4.5叶期,选取长势基本一致的植株进行胁迫处理。干旱胁迫处理:施用30%PEG-6000溶液进行模拟干旱胁迫处理,胁迫时间为4 d。高温胁迫处理:处理期间将人工气候箱温度调至42℃/42℃(白天/黑夜),其他参数不变,胁迫时间为5 d。黑暗胁迫处理:处理期间将人工气候箱光照调至0 lx/0 lX(白天/黑夜),其他参数不变,胁迫时间为6 d;盐胁迫處理:在营养液中添加200 mmol/L NaCl,胁迫时间为3 d,胁迫处理后,更换为正常的水培营养液。每处理均在胁迫处理前、胁迫处理后及恢复生长7 d后采集主茎最上部完全展开叶,液氮速冻后,于80℃保存,用于不同逆境胁迫下OsXDH基因的表达特性分析。
将日本晴的野生型、OsXDHtz扰转基因株系及过表达转基因株系种植于江西农业大学实验田,采集野生型苗期(4.5叶期)的叶(主茎最上部叶)、茎、根及分蘖盛期和灌浆期主茎最上部叶,液氮速冻后,于-80℃保存,用于qPCR检测不同组织及不同生育期OsXDH~因的表达情况;采集野生型、OsXDH干扰转基因株系及过表达转基因株系乳熟期剑叶,液氮速冻后,于-80℃保存,用于OsXDH基因表达量、XDH活性和叶绿素含量测定。
1.3总RNA提取及cDNA第一链合成
按照RNAprep Pure植物总RNA提取试剂盒说明提取水稻叶片总RNA,利用NanoDrop ND2000超微量核酸蛋白分析仪对其浓度和质量进行检测,利用1%琼脂糖凝胶电泳检测其完整性。以提取的总RNA为模板,按照PrimeScriptTM1stStand cDNA Syn-thesis Kit说明反转录合成cDNA第一链。
1.4引物设计及合成
根据拟南芥AtXDH1基因序列在NCBI数据库中进行BLAST检索,发现在水稻基因组数据库中存在相似度较高的转录本(OSJNBa0091822.11),被诠释为Xanthine dehydrogenase。根据NCBI数据库中AtXDH1基因的cDNA序列,利用Primer 5.0设计引物(表1),引物由生工生物工程(上海)股份有限公司合成。
1.5基因克隆
以cDNA为模板进行PCR扩增,反应体系50.0μL:2xPCR Buffer for KOD FX 25.0μL,2 mmol/LdNTPs 10.0μL,10μmol/L正、反向引物(ORF-F和ORF-R)各1.5μL,cDNA模板2.0μL,1.0 U/μL KODFX 1.0μL,ddH2O补足N50.0μL。扩增程序:94℃预变性2.0 min;98℃10 s,58℃30 s,68℃5 min,进行35个循环;68℃延伸10.0 min,4℃保存。取10.0μL PCR产物用于1%琼脂糖凝胶电泳检测,其余送至生工生物工程(上海)股份有限公司测序。
1.6生物信息学分析
利用NCBI数据库进行BLAST同源比对分析,利用ORF Finder寻找基因序列的编码框,利用Prot-Param和Smart进行蛋白的理论性质和保守结构域预测,利用NetPhos 3.1 Server和DictyOGlvc 1.1 Server预测氨基酸序列磷酸化及O-糖基化修饰情况,利用ProtScale分析蛋白质的疏水性,利用SignalP1.1Server、TMHMM Sever 2.0和PSORT II预测蛋白的信号肽和亚细胞定位预测,运用SOPMA预测蛋白的二级结构,使用DNAMAN进行氨基酸序列比对及聚类分析。
1.7 qPCR检测
利用SYBR*Premix Ex TaqTMⅡ试剂盒在CFX96Real-Time PCR Detection System上进行qPCR检测,内参基因为Ubq-real,其引物序列(Ubq-real-F和Ubq-real-R)见表1。反应体系25.0μL:SYBR Pre-mix Ex Taq Ⅱ 12.5μL,正、反向引物(qPCR-F和qPCR-R)各1.0μL,DNA模板(<100 ng)2.0μL,ddI-120补足至25.0μL。扩增程序:95℃预变性30 s;95℃5 s,60℃30 s,进行40个循环。利用Bio-Rad CFX Manager 2.1数据分析模块分析OsXDH基因的表达丰度。
1.8 XDH活性测定
称取0.2 g去除叶脉的水稻剑叶碎片,液氮研磨2~3次后加入800.0μL蛋白提取液研磨至糊状;将研磨液移入2 mL离心管,4℃下14000 r/min离心20 min后取上清液,65℃水浴90 s变性,再离心取上清液;取10μL上清液放入5 mL离心管中,加入490.0μLddH2O和4.5 mL考马斯亮蓝溶液混匀,于595 nm波长下测定OD值。利用牛血清蛋白制作标准曲线,测定可溶性蛋白含量,并进行非变性聚丙烯酰胺凝胶电泳,上样量为50 ug,时长为4 h,将胶片放至以次黄嘌呤为底物和以氮蓝四唑为显色剂的混合溶液中,暗处20 min,用冰醋酸清洗后成像(Sagiet al.,1998)。
1.9叶绿素含量测定
参照Lichtenthaler和Wellbuen(1983)的方法,用80%丙酮溶液提取水稻叶片叶绿素,并用分光光度法测定其含量。
1.10统计分析
试验数据采用Excel 2007进行整理作图;利用SPSS 22.0进行显著性分析(One-way ANOVA)。
2结果与分析
2.1 OsXDH基因cDNA编码区的克隆结果
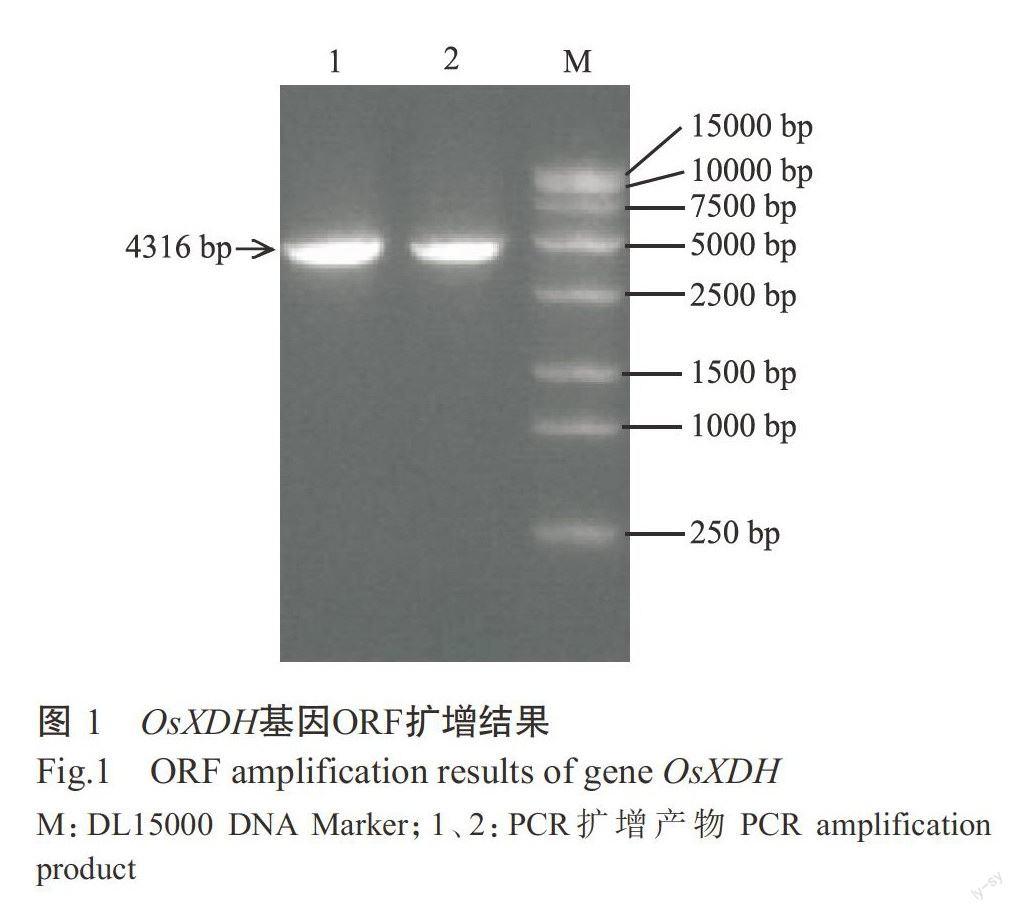
以反转录合成的cDNA为模板,以CDS-F和CDS-R为引物,PCR扩增获得目的片段。结果如图1所示,目的片段约4500 bp,与预期结果相符。测序结果显示,克隆获得的OsXDH基因序列长度为4316bp,其开放阅读框(ORF)长度为4110 bp,编码1369个氨基酸(图2)。将OsXDH基因序列提交至Gen-Bank,登录号LOC4333171。OsXDH基因与基因组DNA序列的比对结果显示,该基因含有14个外显子和13个内含子。
2.2 0sXDH蛋白的生物信息学分析结果
2.2.1理化性质 OsXDH蛋白的理化性质预测结果显示,其分子式为C6713H10509N182501976857,分子量为150.23 kD,理论等电点(pI)为6.54;丙氨酸、甘氨酸、亮氨酸和缬氨酸个数分别占0sXDH蛋白氨基酸总数的8.0%、8.2%、8.6%和7.7%,不含蛋氨酸和含硒半胱氨酸;不稳定指数为38.87,表明其为稳定蛋白。
2.2.2保守结构域 OsXDH蛋白不仅存在1个CO_deh_flav_C结构域(455~561 aa),可与钼结合形成钼辅因子,构成XDH底物的结合部位和氧化还原部位,还存在1个进化保守的蛋白结构域Aid Xandh C(620~727 aa),此结构域仅存在于醛氧化酶和黄嘌呤脱氢酶中,由此推测黄嘌呤脱氢酶与醛氧化酶具有相似的功能,均可参与植物对非生物胁迫的响应。
2.2.3蛋白磷酸化和糖基化位点 氨基酸残基的磷酸化和糖基化可调节蛋白的活性和功能。0sXDH蛋白氨基酸序列中发生磷酸化修饰的位点有131个,其中色氨酸、苏氨酸和酪氨酸磷酸化修饰位点分别有71、45和15个(图3);发生O-糖基化修饰的位点仅1个(图4)。通过预测磷酸化与O-糖基化修饰位点,为黄嘌呤脱氢酶翻译后修饰调控研究提供参考。
2.2.4信号肽及亚细胞定位 信号肽预测结果显示,OsXDH蛋白信号肽平均值为0.106(<0.500),推测其为非分泌蛋白,在细胞质中合成后不被转运。利用TargetP 1.1 Server预测发现OsXDH蛋白广泛位于细胞内(除叶绿体和线粒体外),而pSORTⅡ预测其位于叶绿体中,存在明显分歧,因此,其实际位置需利用免疫荧光、GFP融合表达等技术进一步确认。
2.2.5二级结构 OsXDH蛋白的二级结构中,无规则卷曲(Random coil,C)占35.43%,α-螺旋(α-he-liX,H)占31.56%,延伸链(Extended strand,E)占22.86%,β-转角(β-turn,t)占10.15%。如图5所示,4种二级结构分布较均匀。
2.2.6 亲/疏水性 蛋白的亲/疏水性有助于提高其稳定性及多样性,与其结构和功能密切相关。由图6可知,0sXDH蛋白疏水性最强的位点为第1314位,分值2.389;亲水性最强的位点为第1029位,分值-3.589,亲水性平均值为-0.098,由此推测0sXDH为亲水性蛋白。
2.2.7同源比对及系统发育进化树分析 从NCBI数据库筛选获得5种作物的XDH蛋白氨基酸序列,并与OsXDH蛋白的氨基酸序列进行比对,结果显示OsXDH蛋白的氨基酸序列与高粱(Sorghum bico-lot)、谷子(Setaria italica)、小麦(Aegilops tauschii)、玉米(Zea mays)和油菜(Brassica napus)XDH氨基酸序列相似性分别为84.54%、84.07%、81.52%、76.35%和69.22%(图7)。系统发育进化树分析结果表明,单子叶植物和双子叶植物XDH蛋白同系物分别聚在两个不同的分支,表明XDH蛋白在单子叶植物和双子叶植物间存在一定的分化,但XDH蛋白在同种属间保守性较高,如水稻与小麦、二穗短柄草(Brachypodium distachyon)、谷子和高粱同属一个小分支,均为禾本科植物,XDH蛋白具有较高的同源性;虽然玉米同属禾本科植物,但与芦笋、油棕、芭蕉和蝴蝶兰分属于单子叶植物的另一分支群(图8),其原因可能与物种起源地环境有关,玉米、芦笋、油棕、芭蕉和蝴蝶兰均起源于热带或亚热带地区。综上所述,植物中XDH蛋白的氨基酸序列具有高度保守性,水稻OsXDH蛋白与小麦、二穗短柄草的XDH蛋白分子进化距离最小,亲缘关系最近。
2.3 OsXDH基因表达特性分析结果
2.3.1 OsXDH基因组织表达特性 从图9-A可知,苗期OsXDH基因在水稻根、茎和叶(主茎最上部叶)中的表达量无显著差异(P<0.05,下同)。从图9-B可知,苗期和分蘖盛期OsXDH基因在水稻主茎最上部叶片的表达量无显著差异,但灌浆期OsXDH基因的表达量显著高于苗期和分蘖盛期,由此推测OsXDH基因为特异性表达,参与水稻生长发育相关的分子调控。
2.3.2不同胁迫下OsXDH基因的表达情况 由图10可知,不同胁迫处理均可诱导水稻OsXDH基因上调表达,其中干旱、黑暗和高温胁迫处理后OsXDH基因的表达量均显著高于胁迫处理前,恢复生长7 d后其表达量显著降低,但仍显著高于胁迫处理前,尤其是干旱和高温胁迫处理后OsXDH基因的表达量增至胁迫处理前的2.5倍。盐胁迫处理后OsXDH基因的表达量显著高于胁迫处理前,恢复生长7 d后其表达量显著降低,但与胁迫处理前无显著差异。可见,OsXDH基因的表达受到逆境胁迫因子诱导高效表达,参与逆境胁迫响应。
2.4 OsXDH基因表达量对水稻乳熟期生理指标的影响
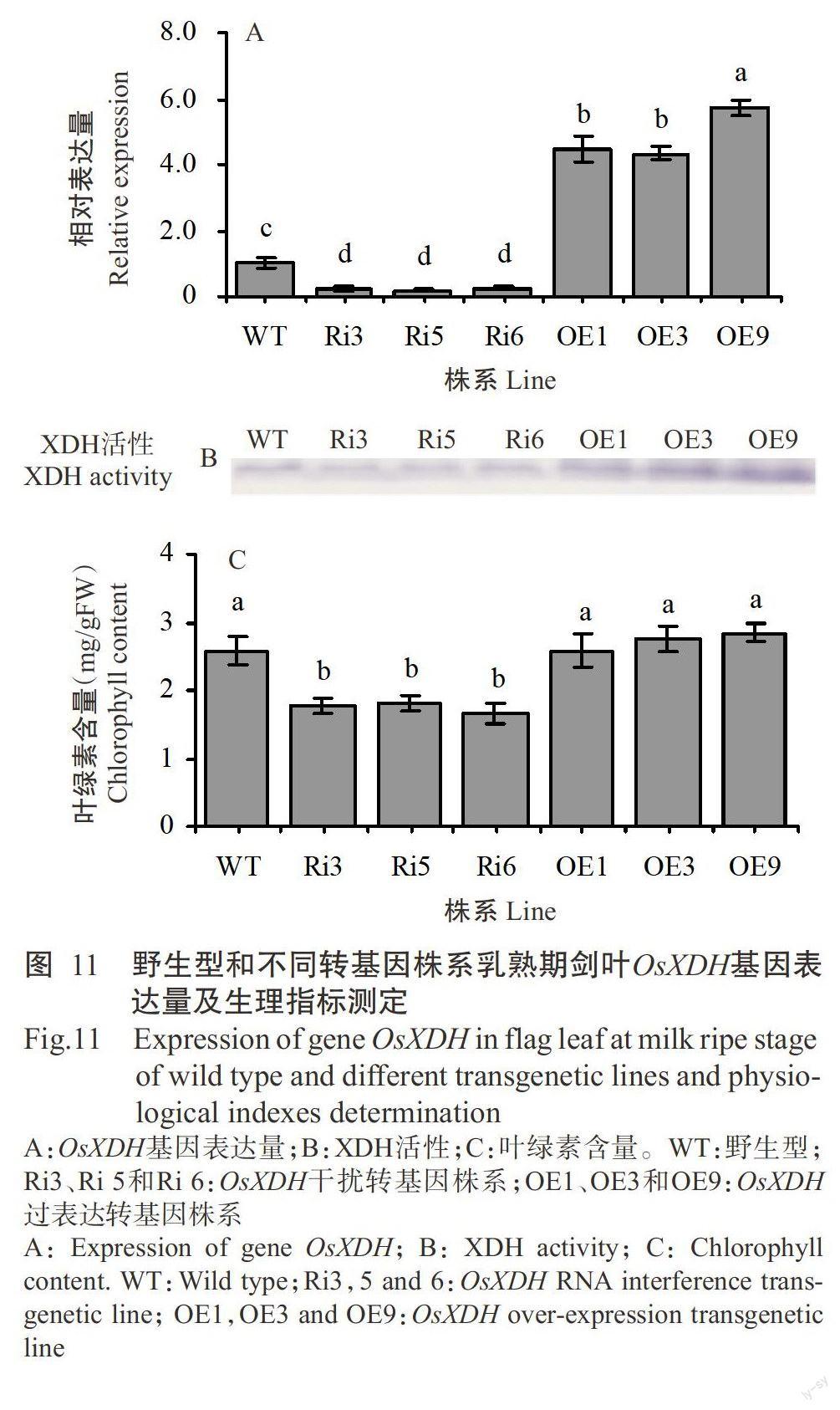
对野生型、OsXDH干扰转基因株系及过表达转基因株系乳熟期剑叶的OsXDH基因表达量、XDH活性和叶绿素含量进行比较分析,结果表明,OsXDH干扰转基因株系的OsXDH基因表达量均显著低于野生型和OsXDH过表达转基因株系,OsXDH过表达转基因株系的OsXDH基因表达量均显著高于野生型(图11-A);OsXDH干扰转基因株系XDH活性低于野生型,而OsXDH过表达转基因株系高于野生型(图11-B);OsXDH干扰转基因株系的叶绿素含量显著低于野生型和OsXDH过表达转基因株系,OsXDH过表达转基因株系的叶绿素含量高于野生型,但未达显著水平(圖11-C)。表明OsXDH基因表达量、XDH活性与叶绿素含量呈正相关,结合水稻不同生育时期OsXDH基因的表达特性,推测OsXDH基因参与调控水稻生育后期的生长发育。
3讨论
本研究从粳稻品种日本晴中克隆获得OsXDH基因ORF序列,长度为4110 bp,编码1369个氨基酸。已有研究表明,拟南芥和兰科植物的XDH基因均属于核基因(Xiong et al.,2001;Hesberg et al.,2004;G6miak et al.,2010),但本研究中不同生物信息学软件对OsXDH蛋白亚细胞定位结果不同,故未能明确其位置,需利用免疫荧光、GFP融合表达等技术进行蛋白亚细胞定位。此外,本研究通过同源比对及聚类分析,发现水稻OsXDH蛋白的氨基酸序列与单子叶作物高粱、小米和小麦的同源性较高,均在80.00%以上,虽然单子叶与双子叶植物分属不同分支,但其同源性仍在70.00%以上,证明不同植物中XDH蛋白的氨基酸序列具有高度的保守性,推測其在不同植物中发挥相似的生理功能。
本研究发现OsXDH基因在不同组织及不同生育期均有表达,但其在水稻灌浆期的表达量显著高于苗期和分蘖盛期,表明OsXDH基因为特异性表达。同时本研究发现,在干旱、黑暗、高温和盐胁迫下,OsXDH基因表达量显著上调,尤其在干旱和高温胁迫下其增至胁迫处理前的2.5倍,推测水稻OsX-DH基因参与逆境胁迫响应。这与Hesberg等(2004)研究发现拟南芥中AtXDH1基因受不同逆境胁迫因子诱导均表达上调的结论一致。说明不同植物中的XDH基因具有相似表达调控功能。
本研究利用OsXDH干扰转基因株系和过表达转基因株系,对OsXDH基因的功能进行初步鉴定,结果显示,OsXDH干扰转基因株系中的XDH活性和叶绿素含量低于野生型,而OsXDH过表达转基因株系的XDH活性和叶绿素含量均高于野生型,表明通过调控OsXDH基因的表达水平可调节水稻XDH活性,从而调控水稻的生长发育,与前人在拟南芥中的研究结果(Nakagawa et al.,2007;Watanabe et al.,2010;Zarepour et al.,2010;Watanabe et al.,2014)一致。由此推测OsXDH基因参与调控水稻生育后期的生长发育。在今后的研究中,可利用OsXDH~-扰转基因株系和过表达转基因株系进一步研究OsX-DH基因水稻在生长发育及逆境胁迫应答过程中的调控机制。
4结论
OsXDH基因受水稻生长发育和逆境胁迫因子诱导表达,推测其是调控水稻生长发育和响应逆境胁迫的关键基因。
