高产洛伐他汀的功能性红曲固态发酵营养液最佳pH值的研究
2017-05-25齐文武陈晓云郑世茂
齐文武,陈晓云,郑世茂,庞 欣
(北京东方红航天生物技术股份有限公司,北京 101400)
高产洛伐他汀的功能性红曲固态发酵营养液最佳pH值的研究
齐文武,陈晓云,郑世茂,庞 欣
(北京东方红航天生物技术股份有限公司,北京 101400)
目的:研究功能性红曲固态发酵营养液的pH对洛伐他汀产量的影响。方法:基于现有的发酵工艺,设置了4个营养液pH梯度,分别为3.4、3.6、3.8和4.0,希望找到高产洛伐他汀的最佳pH条件。结果:当pH=3.6时,洛伐他汀含量相对较高,但是色价较低;当pH=3.4时,洛伐他汀的含量相对较低,但是色价较高,但仍然达不到功能性红曲米的要求,需在下一步的工作中继续改进。所有的处理条件下,均未检出桔青霉素。结论:功能性红曲固态发酵高产洛伐他汀的营养液最佳pH值为3.6。
功能性红曲;洛伐他汀;固态发酵;最佳pH;营养液
红曲霉的固体发酵产物红曲也称为红曲米,最早发明在汉代,在我国已有上千年的历史,可做药用和食用[1-2]。其中以明代李时珍所著《本草纲目》对红曲的记载最为完整,其性味甘、温,无毒,归肝、脾、胃、大肠经。红曲有健胃消食、活血化瘀等功效[3]。
1979年,日本科学家Endo等[3]从红色红曲霉的培养液中分离出活性物质红曲可林k,此发现引起多国专家学者对红曲霉进行了深入研究,取得了令人瞩目的成果。随着研究的深入,红曲霉中越来越多具有药用价值、营养价值的代谢产物被发现[4-5]。
发酵过程中培养液的pH值是微生物在一定环境条件下代谢活动的综合指标,是一项重要的发酵参数,它对菌体的生长和产物的累积有很大的影响。在红曲发酵过程中,由于营养液的pH值会影响洛伐他汀的代谢过程,使洛伐他汀的产生量和产生比例发生改变,因此营养液的最适pH值一直受到研究人员的广泛重视。由于工业化生产管理相对比较宽泛,综合各项管理成本,营养液pH值一般设定为一个范围,而非一个精确的数值。随着pH检测设备由实验室逐步走进企业,使营养液pH的精确控制成为可能。
本研究针对红曲霉固态发酵过程中营养液pH 对洛伐他汀、桔青霉素含量和红曲色素的影响,探究在低或无桔青霉素基础上红曲霉固态发酵营养液的最佳pH培养条件。
1 材料和方法
1.1 材料
1.1.1 菌种 实验所用菌种为本公司制备保存的菌种,菌种编号:HT331511191111。
1.1.2 试剂及培养基材料 色谱级甲醇、无水乙醇、牛肉浸膏、大豆蛋白胨、葡萄糖、酵母浸膏和大米粉等。
1.1.3 仪器设备 Waters高效液相色谱仪、双光束紫外分光光度计、分析天平、医用离心机、高速粉碎机、超声波清洗机、水浴锅、各种型号标准筛等。
1.2 发酵方法
1.2.1 接种 将保藏菌种进行扩大培养,接种于液体培养基,摇床培养72 h后接种于固体培养基。
1.2.2 培养基配制 液体培养基的物料按比例准确称量,混匀,250mL/瓶进行分装,121℃,灭菌20 min,备用;固体营养液的物料按比例准确称量,混匀,试验设4个处理,分别加入冰乙酸调节pH分别为3.4、3.6、3.8、4.0备用,做好标记;将配好的营养液加入按一定比例配好的大米粉混料中,充分混匀,进行分装,121℃、灭菌30 min,备用。
1.2.3 发酵、烘干、粉碎 经过高温发酵、低温发酵得到红曲。红曲经过烘干、粉碎、过筛、混匀、取样检测。
1.3 洛伐他汀含量测定方法(参照本公司企业标准)
1.3.1 色谱参考条件 色谱柱C185 μm×150 mm×4.6 mm;波长237 nm;柱温25℃;流速1.0 mL/min;流动相,甲醇∶水∶磷酸=850∶150∶0.4(体积分数)。
1.3.2 处理方法 样品全部经过100目标准筛,称取样品0.1~0.2 g,至8 mL的离心管,精密加入4 mL的75%乙醇超声处理60 min(温度50~70℃,15~20 min摇匀1次),取出,3 000~4 000 r/min离心10 min,吸取上清液1 mL,置于8 mL刻度试管,加入0.5 mL的0.1mol/L 氢氧化钠-乙醇溶液,摇匀,静置10 min,加入0.5 mL的0.1mol/L 磷酸-乙醇溶液,摇匀,静置10 min,离心,取上清液 5μL,检测。
称取标准品10 mg,至50 mL的容量瓶,定容,混匀。吸取1 mL标准液,置于8 mL刻度试管,加入0.5 mL的0.1mol/L 氢氧化钠-乙醇溶液,摇匀,静置10 min,加入0.5mL的0.1mol/L 磷酸-乙醇溶液,摇匀,静置10 min,离心,取上清液5 μL,检测。
1.3.3 计算公式 样品含量计算公式如式(1):
(1)
1.4 红曲粉中红色素含量测定
1.4.1 测定条件 紫外分光光度计波长505 nm、10 mm比色皿。
1.4.2 测定方法 参照《GB 1886.19-2015》[6],样品全部过60目标准筛,准确称取红曲粉0.2 g,置于100 mL容量瓶中,用70%乙醇定容至刻度,60±0.5℃水浴中,准确浸泡1 h,冷却并定容,摇匀,过滤,备用,以色价高低表示红色素含量高低。以70%乙醇作为参比溶液,于紫外分光光度计上测定吸光度A值。
1.4.3 计算公式
(2)
式(2)中:X——红曲粉样品的色价(u/g);A——样品浸泡液的吸光度;m——取样红曲粉的质量(g)。
1.5 桔青霉素的测定
桔青霉素的测定依据《GB/T5009.222-2008》[7]。
1.6 统计学方法
采用SPSS11.0软件进行统计分析,各组数据采用方差分析方法,P<0.05认为有统计学意义。
2 结果与分析
2.1 不同pH对红曲发酵产物的影响
由图1—4的图谱的峰形基本一致,表明同一菌种发酵得到的红曲粉,尽管固体营养液的pH值不同,但发酵产物除洛伐他汀含量不同外,其他成分基本一致,说明营养液pH在 3.4~4.0的范围内,对发酵产物的组分没有显著影响,但洛伐他汀的产生量有所不同。

图1 pH=3.4时洛伐他汀含量图谱

图2 pH=3.6时洛伐他汀含量图谱
图3 pH=3.8时洛伐他汀含量图谱
图4 pH=4.0时洛伐他汀含量图谱
2.2 营养液pH对洛伐他汀含量的影响
为了保证数据的可靠性,完全相同的实验设计共进行了2次,每次4个处理、3个重复。将2次结果取均值,采用SPSS11.0软件进行统计分析。结果表明,不同pH值的营养液对洛伐他汀的含量有显著性差异。 pH 3.6的营养液处理后的样品中洛伐他汀含量显著高于3.4、3.8和4.0等3个不同pH值处理的样品(P<0.05),其中以pH 3.6处理后的样品中洛伐他汀的含量最高,pH 3.4处理后的样品中洛伐他汀含量最低。
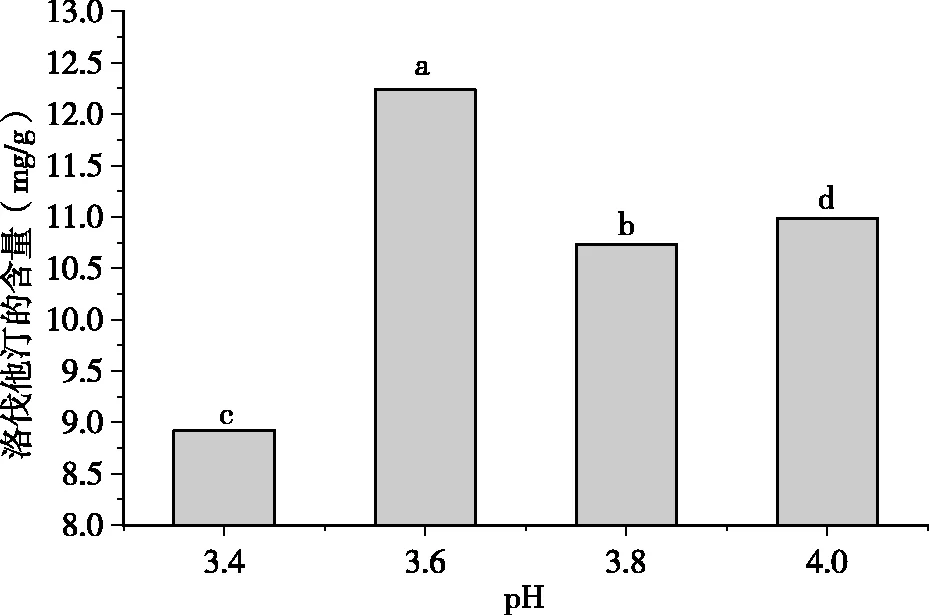
图5 不同pH对红曲产洛伐他汀的影响
2.3 营养液pH对色价的影响
图6表明,该工艺条件下,pH在3.6~4.0区间,色价处于一个较低的水平,而且色价的合成曲线与洛伐他汀含量曲线呈现相反的趋势。这与他人研究的洛伐他汀的产生会抑制红曲色素的生成结果相一致[8]。

图6 色价检测曲线
2.4 营养液pH对发酵产物桔青霉素含量的影响
从附表可以看出,pH在3.4~4.0的范围内桔霉素均未检出,为今后工艺改进创造了良好的前提条件。

附表 不同pH对红曲产桔青霉素的影响
3 讨论
红曲具有辅助降血脂的功能,是目前国家食品药品监督管理局批准的原料之一,红曲作为重要的保健食品原料已开发出多种产品。红曲的固体发酵在我国已有上千年的历史,发酵菌种繁多,发酵工艺各异。同一菌种,不同发酵工艺对发酵产物有何影响均需仔细研究。一方面提高目的产物的含量可以有效节约成本,另一方面改变发酵工艺是否会改变其他代谢产物的产出,甚至是否会产生有害的桔青霉素,是更加值得我们重视的问题。
工业上主要采用红曲霉固态发酵的方式生产洛伐他汀,培养基和培养条件对洛伐他汀的产量影响很大,当培养条件不适时,洛伐他汀的产量极微,甚至不产生[9-10]。因此,要想提高洛伐他汀的产量,需从优化培养条件入手。大工业生产中,考虑到人工、生产成本等因素通常采用pH试纸测定营养液的pH,固体营养液的pH一般控制在3.4~4.0之间,范围较宽。不同的pH值会导致每批洛伐他汀的产量不同,因此,在工业生产中进一步精确控制营养液的pH,对提高洛伐他汀的生产水平,降低成本生产意义重大。随着pH测试笔在生产中的广泛应用,使精确控制营养液pH 值成为可能。本研究对营养液的pH进行了优化,确定了营养液的最佳pH,在最佳pH条件下,洛伐他汀的产量较高,且发酵过程中无桔青霉产生,这为工业上红曲霉固态发酵产洛伐他汀提供了思路。
令人遗憾的是,该菌种在该工艺条件下,红曲色素含量太低。《GB 1886.19—2015》[6]对功能性红曲粉的色价要求是大于等于1 000,而本试验中红曲粉色价在100左右,虽然随着pH的变化有所变化,但远远不能满足工业化生产对红曲色素含量的要求。红曲色素为红曲霉发酵产生的天然色素,符合食品着色剂“天然、营养、多功能”的发展方向,具有很好的应用前景[11-12],如何通过改良菌种或改善代谢条件,得到洛伐他汀和红曲色素均高产的工艺值得研究。◇
[1]杨萌,吴振强,梁世中. 功能性红曲的研究现状及前景预测[J].现代食品科技,2007,23(3):95-97.
[2]李东,刘源,谢静,等. 红曲的起源、分类学及生药学鉴定[J].中国药业,2009,18(3):1-2.
[3]Endo A,Monacolin K.A new hypochole-sterolemic agent produced by a MonascusSpecies [J]. Antibiotics,1979,32(8):852-854.
[4]江利香,葛 锋,刘 畅. 红曲洛伐他汀的高产策略[J]. 中草药,2011,42(7):1446-1452.
[5]张徐兰,吴天祥,李鹏. 红曲霉有效成分应用研究进展[J]. 酿酒科技,2006(9):78-80.
[6]GB 1886.19-2015.食品安全国家标准 食品添加剂 红曲米[S].
[7]GB/T 5009.222-2008.红曲类产品中桔青霉素的测定[S].
[8]廖南清.群感效应对红曲霉洛伐他汀和红曲色素合成的影响及调控机制研究[D]. 广州:广东药学院,2015.
[9]欧阳泽智. 红曲霉荞麦的固态发酵及其产物降血脂作用的研究[D].延边:延边大学,2012.
[10]Ajdari Z,et al. Nutritional Requirements for the Improwement of Growth and Sporulation of Several Strains of Monascuspurpureus on Solid State Cultivation[J].Journal of Biomedicine and Biotechnology,2012(2011):1-9.
[11]蒋冬花,孙蕾,陈璨,等. 高产色素红曲霉菌株的筛选、鉴定和固体发酵条件优化[J].浙江农业学报,2015,27(9):1639-1645.
[12]陆磊,刘秀河.功能性红曲米发酵工艺与控制[J]. 山东食品发酵,2013(4):9-11.
(责任编辑 李婷婷)
The Optimum pH Value of Functional Solid Fermentation of Monascus Nutrient Solution for Best Yield of Lovastatin
QI Wen-wu, CHEN Xiao-yun, ZHENG Shi-mao, PANG Xin
(Beijing Dawn Aerospace Bio-tech CO.LTD,Beijing 101400,China)

functional monascus;lovastatin;solid-state fermentation;optimum pH;nutrient solution
齐文武(1988— ),男,学士,研究方向:保健食品与食用菌开发。
庞欣(1970— ),女,博士,研究方向:保健食品与食用菌开发。
