小鼠剪尾出血模型的优化
2017-05-24崔庆华张志晓冯子良范泉水
田 靖, 崔庆华, 郭 平, 张志晓, 冯子良, 郑 颖, 范泉水
(成都军区疾病预防控制中心, 昆明 650032)
小鼠剪尾出血模型的优化
田 靖, 崔庆华, 郭 平, 张志晓, 冯子良, 郑 颖, 范泉水
(成都军区疾病预防控制中心, 昆明 650032)
目的 探讨小鼠剪尾出血模型在凝血药物体内评价过程中应用的可行性。方法 对传统鼠尾出血模型实验过程进行考察和比较分析,对小鼠剪尾模型制备方法进行优化,建立了一种可快速准确检测鼠尾出血量和出血时间的方法。并利用商品化凝血酶药物苏灵验证了该方法在凝血药物药效学评价中的有效性,对鼠尾出血量(出血时间)与小鼠凝血时间指标的敏感性比较也显示了此模型的优越性。结果 优化后的鼠尾出血模型可对小鼠出血量进行低至微升级的精确检测,通过一定时间间隔的出血量来确定出血终点的方法,很大程度上消除了实验中的人为误差。该模型操作简便、易于使用,可以敏感且有效模拟体外创伤的动物模型,在评价凝血药物的药效中发挥作用。结论 小鼠剪尾出血模型可以敏感反应凝血药物的体内作用,可作为凝血药物初步筛选和评价的有效工具。
小鼠剪尾出血模型; 创伤模拟; 出血量; 出血时间
鼠尾出血模型造模简单方便、易于观察,在动植物凝血活性成分的评价以及白血病药物的研发中发挥着重要作用。然而,小鼠尾部出血模型使用40多年来,不同实验室在小鼠出血模型的制备方法上存在一些差异,这些差异体现在造模和检测的各个细节,由于没有统一标准来说明这些操作的合理性和必要性,使得该模型制备缺乏规范,限制了鼠尾出血模型的广泛应用。
本文作者认为,小鼠尾部出血造模这一过程实际上对小鼠尾部静脉、动脉和组织均造成损伤,可视为一种较为理想的体外创伤模型。作者试图在小鼠清醒状态下剪尾造模,确保室温条件下鼠尾平放、血液自由流动,用滤纸采集血液,准确检测出血量,以出血量值判定出血时间,弥补出血时终点判定模糊等人为误差,从而使该模型能够有效反应药物对小鼠出血量和出血时间的影响。本文通过对小鼠鼠尾出血模型的造模过程以及研究方法的优化,使其能够很好模拟生物创伤出血过程,以探讨该模型在凝血药物筛选和评价中的作用。
1 材料与方法
1.1 实验动物
SPF级KM小鼠,4~5周龄, 体质量18~22 g,购自中国人民解放军第三军医大学实验动物中心[SCXK-2012-0011]; 饲养于昆明医科大学SPF动物实验室[SYXK(滇)K2015-0002]。
1.2 药物、试剂和仪器
苏灵, 代号Saculin, 购自北京康辰药业有限公司; NaOH, 购自广东光华化学厂有限公司; EDTANa2, 购自美国Sigma公司; 生理盐水, 购自昆明南疆制药厂; Stat Fax®2100型酶标仪, 购自美国Awareness technology公司; NanoDrop2000超微量分光光度计(型号ND2000), 购自美国Thermo scientific公司; 水浴锅,购自金坛市杰瑞尔电器有限公司,型号HH-2J; #4滤纸,购自美国Whatman公司; 2.5 mL注射器,购自江西洪达医疗器械集团有限公司; 96孔板,购自广州洁特生物过滤制品有限公司。
1.3 血液样品最大吸收波长测定
小鼠眼眶内眦取血法采集小鼠新鲜血液1 mL,用质量浓度为4%EDTANa2抗凝,取20 μL小鼠抗凝血液溶解于2 mL质量浓度为10%的NaOH裂解液中, 震荡试管,使血细胞充分裂解30 min,得血液裂解样品。取2 μL裂解液,用NanoDrop对其进行蛋白吸收波长进行扫描,将明显吸收峰处波长确定为最大吸收波长。
1.4 血液裂解标准品吸光度曲线绘制
分别取小鼠抗凝血2 μL、4 μL、6 μL、8 μL、10 μL、12 μL、14 μL、16 μL和18 μL加入到2 mL质量浓度为10%NaOH溶液中, 充分裂解30 min, 以质量分数10%NaOH溶液为空白对照, 用NanoDrop依次测定其在418 nm处吸光值, 绘制拟合曲线, 计算R2值。将各样品依次加入到96孔板中, 200μL/孔,每个浓度重复三孔, 用酶标仪测定样品在450 nm、405 nm、492 nm波长以及双波长405 nm/630 nm、450 nm/630 nm处吸光值, 绘制拟合曲线, 计算R2值。
1.5 出血量检测方法建立以及回收率检测
将#4滤纸剪成15 mm×15 mm方块,在滤纸上分别滴加抗凝血3 μL、9 μL和18 μL, 使滤纸片充分吸收血液后将滤纸片放入含有2 mL质量浓度为10% NaOH裂解液的试管中,室温下充分震荡,观察滤纸片纤维完全松散,滤纸片上血液完全溶解为止。静止试管30 min,取上清200 μL/孔测定450 nm/630 nm处的吸光值,利用标准曲线计算回收血液量,计算回收率。同以上方法,检测微量血液(0.4 μL~1.8 μL)的回收血液量,计算回收率。
1.6 小鼠出血量与出血时间检测
小鼠20只,雌雄各半,按照体质量随机分为2组,每组10只,尾静脉给药,样品组给予生理盐水配制的苏灵(0.62 U/kg),对照组给予相应体积的生理盐水。用药30 min后将小鼠用固定器固定,用含有乙醚的棉球对小鼠进行吸入性麻醉,使其减少自主行动后将鼠尾平放于桌面上, 用体积分数70%乙醇消毒鼠尾,待酒精挥发后在鼠尾末端5 mm处用灭菌的手术刀片割断,立即用15 mm×15 mm定量滤纸片吸取断尾处血液(不要直接接触到尾部)并开始计时,每2 min将吸取血液的滤纸片放入装有2 mL 质量浓度10% NaOH溶液的玻璃试管中,稍微震荡, 待滤纸片上血液完全溶解后, 静置30 min后加入96孔板,用分光光度计检测450 nm/630 nm吸光度,对照标准曲线,计算出每分钟内的流血量(μL),以累积出血量计算出每只小鼠的出血总量。当每2 min流出血液少于1 μL判定为出血终止,记录出血终止前2 min时间点为出血时间。同时按照常规方法记录小鼠实际出血时间,以滤纸片上肉眼未见血点为出血终止。
1.7 小鼠凝血时间检测
小鼠40只, 雌雄各半,随机分为4组,每组10只。每组小鼠分别静脉给予剂量为0.16 U/kg、0.64 U/kg和2.48 U/kg生理盐水稀释的苏灵溶液,对照组给予生理盐水。给药30 min后小鼠眼眶内眦取血并计时,丢弃第一滴血,取两滴血液滴于37 ℃水浴保温的玻片上,用针尖垂直挑动血液,10 s挑动一次,待出现第一丝纤维蛋白时停止计时,即为小鼠凝血时间。
1.8 统计方法
采用SAS 9.2软件采用相应的统计学分析方法进行显著性差异分析, P<0.05为差异有统计学意义。
2 结果
2.1 血液裂解样品最大吸收波长确定
将溶解在质量分数10% NaOH中的小鼠抗凝血样品进行全波长扫描后发现该血液样品在418 nm处具有最大吸收峰,扫描结果见图1。
2.2 酶标仪检测波长对吸光度的影响

图 1 血液裂解样品的蛋白广谱扫描图
血液标准样品吸光度检测及拟合曲线如图2A和图2B所示。通过比较同一样品在不同检测波长下吸光值拟合曲线显示,酶标仪450 nm/630 nm吸光值曲线(R2=0.98485)具有良好的线性关系,而在450 nm、405 nm、492 nm和405 nm/630 nm波长下检测则线性不佳。与NanoDrop分光光度计检测到的418 nm吸光值曲线(R2=0.99434)相比,酶标仪450 nm/630 nm吸光值曲线也最为接近,因此,可以用酶标仪450 nm/630 nm处吸光值代替418 nm处吸光值,进行大量样品的吸光度检测。
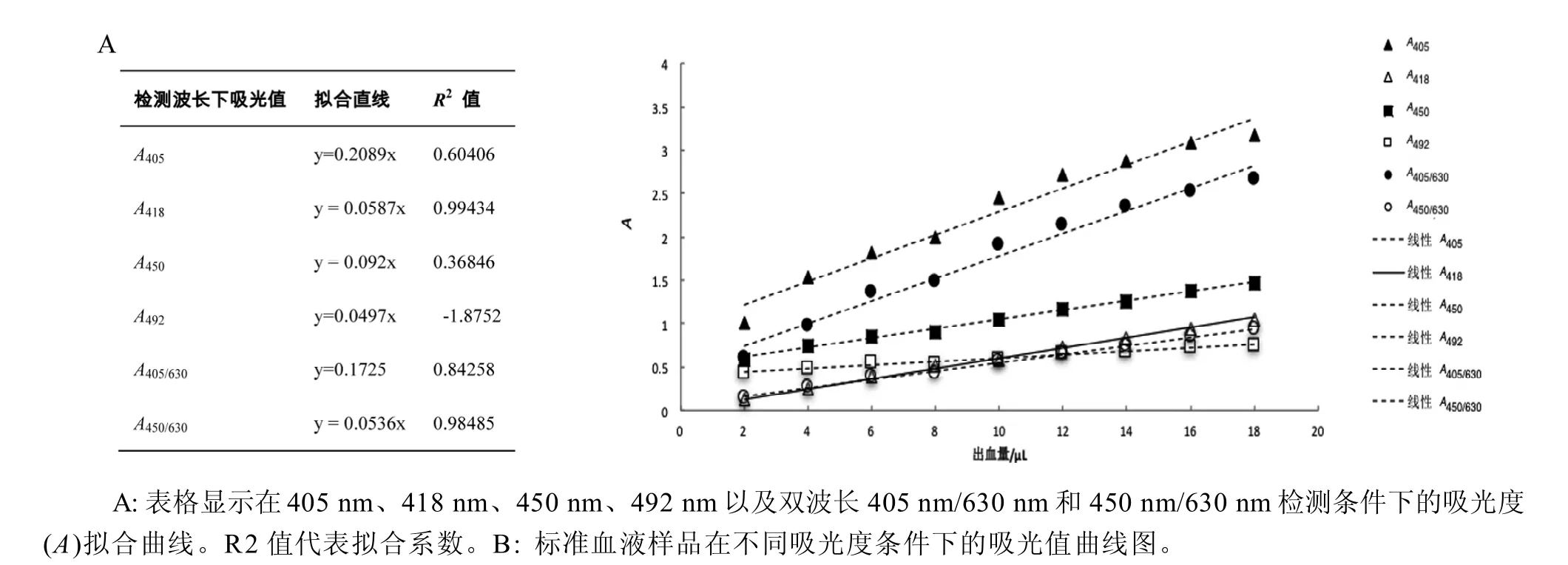
图 2 血液样品标准品在不同波长检测条件下的吸光度值
2.3 酶标仪450 nm/630 nm波长检测血液样品的回收率
对血液量检测方法进行了回收率验证, 血液量小于1 μL的微量血液样本(0.4 μL~0.8 μL)的回收率在76.96%~93.28%, 血液量大于1 μL(1.0 μL~18 μL)时, 样品回收率在95.15%~113.49%, 表明本方法可以较为准确检测小鼠实际出血量, 并且对大于1 μL的血液样本检测准确率更接近于真实值。

表 1 模拟血液样品的回收率
2.4 鼠尾出血模型出血量和出血时间检测的有效性验证
为了验证鼠尾出血时间和出血量检测是否可以有效评价药物的止血效果,评价了商品化药品苏灵给药对这两个指标的影响。结果显示, 0.62 U/kg剂量苏灵(Saculin)(由临床使用剂量换算)可以显著缩短小鼠尾部出血总量(图3)、显著缩短出血时间(图4),凝血效果显著。出血准确时间检测直接统计,按照原方法进行统计分析(表2),结果也显示与改进后的出血时间统计方法得出结论一致。

图 3 剪尾后小鼠出血量检测(n=10)

图 4 剪尾后出血小鼠出血百分比与时间曲线(n=10)

表 2 精确测定小鼠出血时间
2.5 鼠尾出血量和出血时间检测与小鼠凝血时间指标敏感性的比较
为了评价出血量和出血时间指标在检测药物药效中的敏感性方面是否具有优势, 将这两个指标与凝血时间指标进行比较。结果显示, 引起小鼠出血时间显著缩短的苏灵剂量(0.62 U/kg)对小鼠凝血时间并没有显著性影响, 随着给药剂量增加4倍(2.56 U/kg),凝血时间有缩短的趋势,但与对照组比较无显著性差异(图5)。
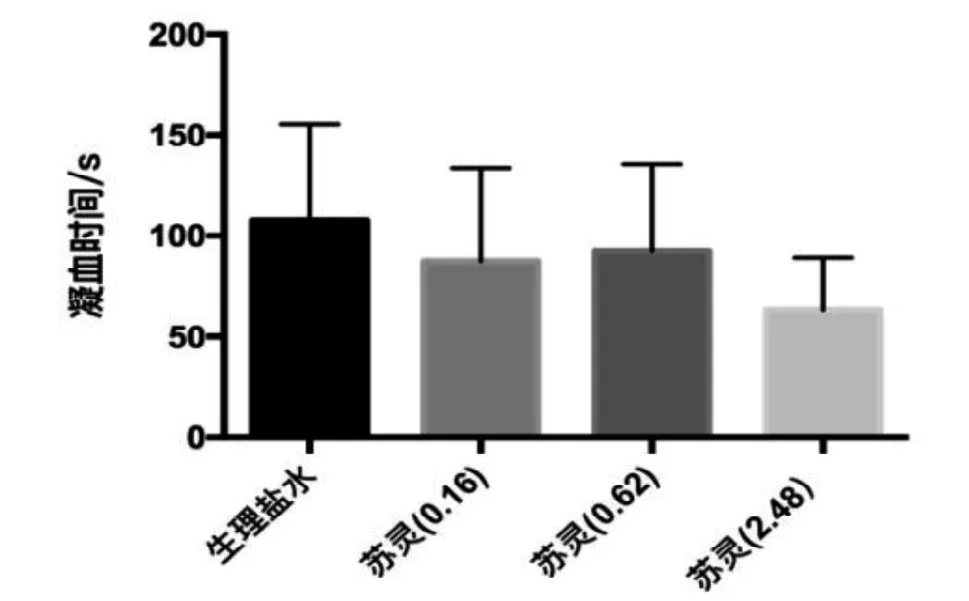
图 5 小鼠凝血时间(n=10)
3 讨论
从模拟创伤的角度去看待小鼠尾部出血模型是本研究的出发点,作者对模型进行了必要改进,在检测方法上也有所创新。
国内在制作小鼠剪尾模型时通常不进行麻醉,而国外剪尾模型中使用最多的麻醉剂如异氟醚(isoflurane)[1]、氯氨酮(ketamine)/美托咪定[2]、氯氨酮(ketamine)/甲苯噻嗪[3]、戊巴比妥钠(pentobarbital sodium)[4]等在静脉给药麻醉时通常会导致动物体温降低[5]或导致收缩压改变[6]等情况而影响鼠尾出血量,本方法在满足动物福利的基础上采用乙醚对小鼠进行吸入麻醉,以最大限度减少麻醉剂对凝血参数的影响。鼠尾切口的选择常按照距离尾尖2 mm~20 mm[4,7-9]、鼠尾直径(3 mm)[10]处剪断,或是只选择性切断尾部静脉[11],本方法通过严格控制小鼠体质量达到尽量缩小鼠尾个体间差异,而5 mm剪尾位置的确定可以保证小鼠具有足量可供检测的出血量外,不会对其生命或者健康造成影响。剪尾后观察出血情况是将鼠尾平放于桌面或是将其垂直放入37℃生理盐水[12,13]中,除了维持一个恒定的环境温度外,还利于血液的收集,37℃水浴条件下观察与室温平放鼠尾观察相比,前者可显著缩短出血时间[14],因此在室温条件下收集血液、观察出血时间可能比较接近自然创伤后出血和止血的生理过程。
采用滤纸浸润面积[15]和滤纸称重法来估算[16]出血量比较粗略。本实验检测小鼠血液裂解液样品在418 nm吸光度值的方法可以大大提高检测精确性,并不同于文献报道[17,18]的在550 nm左右进行吸光度检测的方法。为了达到出血量的大样本检测, 降低方法对实验仪器设备的要求, 作者探索了利用96孔板酶标仪的现有波长组合酶标仪450 nm/630 nm双波长来代替418 nm检测的吸光度值, 标准样品在两个吸光度条件下标准曲线可以较好重叠,并达到良好线性结果, 使血液检测量可以达微升级。究其原因,450 nm波长与418 nm波长相接近, 用630 nm波长抵消一部分背景之后,恰好能满足418 nm波长检测的需要,这一推测已在实验中验证。
各研究者判定出血终点以出血时间不长于30 min[4]、60 min[19]或者30 s内不出现反复出血为出血终止,而绝大多数实验方法中并没有对出血终止的判定方法加以准确说明。实际操作中, 对出血终点的判定往往不是特别清晰,小鼠由于个体差异会出现停止出血后再出血, 甚至多次反复出血的情况, 使出血时间指标浮动性变大,对实验结果造成影响。本方法将出血量与出血时间检测相结合,以出血量判定出血时间。由于血液定量方法在检测>1 μL血液样品时准确性较高, 因此人为规定将鼠尾间隔2 min内出血量<1 μL的阶段判定为出血终止,并用生存分析法对小鼠出血时间进行显著性差异分析。此方法可以很好代替传统精确测量出血时间的方法,统计学处理方法的调整也可以更科学分析出血时间不属于正态分布的时间相关数据。
动物实验中曾证实[20]苏灵可以使小鼠剪尾出血时间和兔凝血时间显著缩短,因此苏灵可作为阳性药物进行方法学比较。结果显示,能够显著缩短出血量和出血时间剂量的苏灵并不能显著缩短小鼠凝血时间,因此凝血时间指标和出血时间(出血量)指标的敏感性显而易见。
然而,动物实验方法只能是对药物药效进行一个初步的预判,不能代表药物在人体的真实作用。因此应该谨慎对待动物实验的结果,从实验动物的种属类别、检测指标、检测方法等多方面进行考虑和实验设计,以求最大限度预测药物对人体的作用。
[1] Mei B, Pan C, Jiang H, et al. Rational design of a fully active, long-acting PEGylated factor VIII for hemophilia A treatment [J]. Blood, 2010, 116(2):270-279.
[2] Broze GJ Jr, Yin ZF, Lasky N. A tail vein bleeding time model and delayed bleeding in hemophiliac mice[J]. Thromb Haemost, 2001, 85(4):747-748.
[3] Maroney SA, Cooley BC, Ferrel JP, et al. Absence of hematopoietic tissue factor pathway inhibitor mitigates bleeding in mice with hemophilia[J]. Proc Natl Acad Sci U S A, 2012, 109(10):3927-3931.
[4] Tranholm M, Kristensen K, Kristensen AT, et al. Improved hemostasis with superactive analogs of factor VIIa in a mouse model of hemophilia A[J]. Blood, 2003, 102(10):3615-3620.
[5] Taylor DK. Study of two devices used to maintain normothermia in rats and mice during general anesthesia[J]. J Am Assoc Lab Anim Sci, 2007, 46(5):37-41.
[6] Flecknell P. Laboratory Animal Anaesthesia, Fourth Edition [M]. Elsevier Academic Press, 2016:50.
[7] 许火龙, 李冲, 韦晓慧, 等. 核桃叶提取液对小鼠出血时间和凝血时间的影响[J]. 中外医学研究, 2016, 14(12):2-4.
[8] 刘萍, 刘文波, 张婧, 等. 仙脉通胶囊对小鼠出血时间和凝血时间的影响[J]. 中医药信息, 2012, 29(6):40-41.
[9] 吴晓宁, 余陈欢, 徐静红. 乌蕨总黄酮及水提液的药理实验[J]. 康复学报, 2004, 14(1):13-14.
[10] Ivanciu L, Toso R, Margaritis P, et al. A zymogen-like factor Xa variant corrects the coagulation defect inhemophilia[J]. Nat Biotechnol, 2011, 29(11):1028-1033.
[11] Johansen PB, Tranholm M, Haaning J, et al. Development of a tail vein transection bleeding model in fully anaesthetized haemophilia A mice characterization of two novel FVIII molecules[J]. Haemophilia, 2016, 22(4):625-631.
[12] 祝晓雯, 宋嬿, 金若敏,等.水蛭超细粉及水煎液活血化瘀作用的比较研究[J]. 中药新药与临床药理, 2011, 22(1): 33-37.
[13] 聂牧, 王云, 郭守东, 等. 板栗多糖抗动脉血栓形成的作用食品科学[J]. 2015, 36(11):187-190.
[14] Dejana E, Callioni A, Quintana A, et al. Bleeding time in laboratory animals. II - A comparison of different assay conditions in rats[J]. Thromb Res, 1979, 15(1-2):191-197.
[15] 刘彬, 张海涛, 刘慧明, 等. 鲎素对小鼠出血时间和凝血时间的影响[J]. 广东医学院学报, 2015, 33(1):49-51.
[16] 张家铨, 邹节明. 血伤宁的药理研究[J]. 中成药, 1980(2): 43-46.
[17] 王继生, 李惠芝, 邱宗荫, 等. 茅莓总皂苷的主要药效学研究[J]. 中药药理与临床, 2007, 23(1):34-36.
[18] Shaw ST Jr, Aaronson DE, Moyer DL. Quantitation of menstrual blood loss-further evaluation of the alkaline hematinmethod[J]. Contraception, 1972, 5(6):497-513.
[19] Warner RL, McClintock SD, Barron AG, et al. Hemostatic properties of a venomic protein in rat organ trauma[J]. Exp Mol Pathol, 2009, 87(3):204-211.
[20] 沈稚琴, 黄稚萍. 月经血量测定的方法学和临床应用[J].现代检验医学杂志, 1995, 10(2):5-7.
Improvement on Tail Tip Bleeding Model in Mice
TIAN Jing, CUI Qing-hua, GUO Ping, ZHANG Zhi-xiao, FENG Zi-liang, ZHENG Ying, FAN Quan-shui
( Institute of Military Medical, Chengdu Military Region’s Center for Disease Control & Prevention, Kunming 650032, China)
Objective The application of tail tip bleeding model in mice was explored to evaluate the hemostatic activity of some coagulation components. Method This tail tip bleeding model improved to be used as a trauma model in the aspect of coagulant evaluation was compared with the traditional operation process. The new method was established for fast quantitative detection of the blood loss and decided the bleeding time from the starting point when the tail was cut off to the end point when the blood loss was less than 1 μL in two minutes intervals. Saculin approved as a coagulant drug on sale in domestic market was used to verify the effectiveness of this assay. The sensitivity between coagulate time and blood loss (or bleeding time) is also compared in mice. Results The advanced tail tip bleeding model in mice can quantitative analysis blood loss and bleeding time in order to reduce the personal error to a great extent. This model is easy to use and can simulate the process of trauma properly. Conclusion The tail tip bleeding model in mice can reflect the action of the coagulant drug sensitively, which is a useful tool for screening and assessment of coagulants.
Tail tip bleeding model; Mice; Simulated trauma; Blood loss; Bleeding time
Q95-33
A
1674-5817(2016)06-0040-06
10.3969/j.issn.1674-5817.2017.01.009
2016-08-08
全军医学科技青年培育项目(14QNP055)
田 靖(1982-), 女, 博士, 主治医师, 从事生物毒素及其机制的研究。
E-mail: tianjing1980s@126.com
郑 颖, 女, 博士, 主任医师, 研究方向: 药学和生物毒素学。E-mail: zhengyingcdc@163.com
范泉水, 男, 博士, 主任医师, 研究方向: 病毒学和生物毒素学。E-mail: fqs168@126.com
