海水中致病菌检测研究进展
2017-05-24刘淑文丁家旺
刘淑文, 丁家旺, 秦 伟
海水中致病菌检测研究进展
刘淑文1, 2, 丁家旺1, 秦 伟1
(1. 中国科学院海岸带环境过程与生态修复重点实验室(烟台海岸带研究所), 山东省海岸带环境过程重点实验室, 中国科学院烟台海岸带研究所, 山东烟台 264003; 2. 中国科学院大学, 北京 100049)
海水中致病菌种类繁多、致病性强, 对水产养殖和人体健康存在着潜在危害。传统的检测方法培养过程复杂繁琐、耗时长、效率低, 难以满足实际工作的需求。因此, 建立海水中致病菌的快速、灵敏、准确的检测技术势在必行。本文综述了流式细胞技术、分子生物学方法、免疫学方法和生物传感器技术等在海水致病菌检测中的应用, 总结了上述方法在海水致病菌检测中的研究现状。
海水致病菌; 检测; 流式细胞技术; 分子生物学方法; 免疫学方法; 生物传感器技术
随着我国沿海经济建设速度的逐步加快和海洋开发活动的日益频繁, 排往近海的污染物总量持续增加, 海水环境污染尤其河口海岸带环境污染问题日渐凸显。在种类繁多的海水环境污染物中, 致病菌正引起人们越来越多的关注。海水中的致病菌有来自陆源, 亦有来自海洋自身。陆源的致病菌主要来自生活污水、大陆径流以及海岸沙滩的流入[1]。大肠杆菌是水质粪便污染的指示菌, 是海水陆源污染的重要生物之一[2]。目前, 世界大部分国家及国际组织将大肠杆菌数量作为海水水质的卫生学指标和水环境的细菌学指标[3]。已有研究表明, 具有净化病原菌能力的繁茂膜海绵(), 能够以摄食的方式净化水环境中的大肠杆菌[4]。除陆源致病菌外, 自然海水中含有喜好生长于有机质丰富环境中的副溶血性弧菌、霍乱弧菌、创伤弧菌等致病菌。这些致病菌在海水中的数量可以有效指示海水遭受有机物污染的程度[5]。研究表明, 海水中致病菌的污染不仅威胁人体的健康安全, 而且会对水产养殖业带来巨大的危害和损失[6]。因此, 实现海水致病菌的快速检测, 不仅可以有效掌握环境污染物的时空分布特点、追踪污染途径、寻找污染源、预测污染的发展动向及环境质量变化趋势, 而且可以为改善海域生态质量、促进海水资源的合理开发利用提供科学依据和技术支撑。
1 海水中致病菌的检测方法
由于海水组分复杂、基体效应大、海水中致病菌的含量低, 且易随海流变化, 因而要求分析方法具有良好的选择性、高灵敏度及快速检测过程。传统的检测方法培养过程复杂繁琐、耗时长、效率低, 难以满足实际工作的需求。因此, 研究者不断探索新的检测方法。本文从流式细胞技术、分子生物学方法、基因芯片技术、免疫学方法和生物传感器技术等方面综述了海水致病菌检测的研究进展。
1.1 流式细胞技术(flow cytometry, FCM)
流式细胞分析具有快速、灵敏、精确以及便于操作等优点, 已在微生物检测方面发挥越来越重要的作用。流式细胞仪能够检测被荧光分子标记的细胞或微粒[7]。邓灯等[8]建立了一种特异性好、精密度高的鱼肠道弧菌单克隆抗体的流式细胞检测技术。以抗鱼肠道弧菌单克隆抗体为基础, 结合流式细胞术, 根据荧光信号强弱比例确定检测鱼肠道弧菌时所需单克隆抗体。在最优反应条件下, 抗鱼肠道弧菌单克隆抗体可特异性识别鱼肠道弧菌, 并且通过对不同密度的鱼肠道弧菌进行重复性试验发现变异系数均在5%以内。流式细胞技术与分子生物学等技术的结合已成为流式细胞仪的发展方向, 并且能够稳定而全面地检测细菌种类[9]。Joachimsthal等[10]利用流式细胞术与荧光原位杂交技术结合, 实现对轮船压舱水中的各种细菌含量及总量进行检测, 结果表明, 压舱水中细菌总量达到0.67%~39.55%, 其中肠道菌、弧菌以及大肠杆菌的含量分别为0~2.46%、0.18%~35.82%和0~2.46%。在墨西哥北部湾的浮游细菌种类调查的项目中, Jochem等[11]同样将两种技术相结合, 从而准确鉴定出海洋细菌的种类, 并对细菌生物量进行了统计, 分析了墨西哥北部湾海域浮游细菌的时空变化。
流式细胞术在微生物方面的应用发展相对较晚, 但是很适合对大数量的细菌进行逐个的快速多参数精确测量。需要指出的是, 流式细胞仪的前期成本比较高, 其应用前景对荧光材料的选择和样品处理的发展提出了挑战[12-13]。
1.2 分子生物学方法
随着现代生物技术的快速发展, 分子生物学方法以其简单、快速、专一、微量、准确等优点在快速检测病原微生物方面得到了迅速发展。目前海水致病菌检测常用的分子生物学方法主要包括聚合酶链式反应(Polymerase Chain Reaction, PCR)技术和基因芯片技术等。
1.2.1 聚合酶链式反应
聚合酶链式反应是最常用的核酸扩增技术, 具有特异性、高效性和准确性高三大特点, 已广泛应用于微生物病原菌的检测[14-17]。目前, 常用的PCR技术包括多重PCR (multiplex PCR), 实时荧光定量PCR (Quantitative Real-time PCR)和反转录PCR(Reverse Transcription PCR, RT-PCR), 如表1所示。
1.2.1.1 多重PCR
多重PCR可通过扩增多个核酸片段, 从而实现对多种致病菌的同时检测。Kong等[18]采用多重PCR实现了对海水中6种不同致病菌的准确、快速、同时检测。该检测技术的最低检测限度可达1 CFU/mL。为了进一步提高灵敏度, Gonzalez等[19]将多重PCR和DNA微阵列结合, 实现了对海水鱼类5种致病菌的飞克级检测。嵌套式PCR可解决PCR中由于模板量低而检测不到谱带所导致的灵敏度低的问题。Calvo等[20]提出的多重PCR与高准确度嵌套式PCR结合技术实现了对水体中5种致病菌的同时检测。但在实验过程中应展开阴性对照, 从而减少假阳性样品的干扰。
1.2.1.2 实时荧光定量PCR
荧光定量PCR是近年发展起来的一项新技术。该技术巧妙地利用了PCR技术核酸扩增的高效性、探针技术的高特异性、光谱技术的高敏感性以及计量高准确性等优点, 在致病菌的检测中有较好的应用前景。Fykse等[21]在7 h内准确灵敏地检测到压舱水中100 CFU/mL的霍乱弧菌。由于标记有luxS基因的定量实时PCR对粘质沙雷氏菌具有特异性作用, 因此这一检测技术可灵敏、快速地检测到环境水样中的沙雷氏菌[22]。同时, 实时荧光定量PCR还可量化被动物粪便污染的海水沉积物中的细菌[23], 定量检测水体中靶基因的复制份数和RNA的复制份数等[24]。但由于荧光素种类、检测光源的局限性以及其较高的成本, 实时荧光定量PCR复合式检测的广泛应用受到限制。
1.2.1.3 反转录PCR
当样品中存在无致病性的死细胞或者游离的DNA时, 致病菌DNA的检测中会产生假阳性信号。因此上述PCR法很可能会夸大检测结果。李善志等[25]以mRNA为检测模板, 针对单增李斯特菌的溶血素基因hlyA设计引物, 以此建立起灵敏的活菌检测RT - PCR技术, 并对冷冻虾仁等人工污染样品中单增李斯特活菌进行检测, 最低检测限可达4.5 CFU/mL。
由于面临低温, 营养被剥夺等因素, 海水中的致病菌进入一种活的非可培养(viable but non-culturable,VBNC)的状态, 这种状态下的致病菌在一定条件下可以复苏并仍有致病能力, 依然会对人体健康潜在危害[26-27]。传统的细胞培养方法不能检测VBNC状态下的细菌细胞, 因而可能低估其潜在的致病性。而PCR法由于扩增了游离的DNA或者死细胞中的DNA, 从而夸大了其致病能力。RT-PCR广泛应用于VBNC 状态下致病菌致病能力的检测。半巢式反转录PCR的应用能准确灵敏地检测人工海水中VBNC状态的创伤弧菌, 并能够对其致病能力进行验证[28]。除了致病菌的检测, RT-PCR与Taqman探针技术的结合还能够定量检测海水中的肠道病毒[29]。
PCR 由于其高度的敏感性及特异性等优势在海水致病菌检测中得以广泛应用。多重PCR技术能够同时检测多种致病菌, 简便、高效、快速, 而且还可减少或避免因操作步骤过多而污染所带来的假阳性等问题。但是多重PCR技术的体系比较复杂, 可以通过优化设计引物与PCR反应条件等手段来进一步增强特异性, 提高灵敏度。实时荧光定量PCR将DNA扩增与分子杂交同步进行, 由于在封闭体系内扩增与检测, 既省去了凝胶电泳的繁琐操作, 缩短了检测时间, 又避免了试验过程中污染, 减少了假阳性的发生率, 具有特异性强、灵敏度高、准确度高、操作自动化等优点。但是该技术需要昂贵的仪器, 成本高。反转录PCR虽然可以检测到VBNC状态下致病菌, 但是操作繁琐, 提取过程中的RNA极易受到RNA酶的污染而降解, 其纯度和完整性难以得到保证。
PCR检测病原微生物虽然快速, 但可能因为扩增模板量太低而检测不到谱带。而且PCR产物需要用酶切或分子杂交验证, 在对野外环境的水样、海产品标本进行检测时, 通常由于菌量少、菌株变异大, 而使得检出率较低[30]。PCR检测技术仍存在成本高、效率低、质控差等缺陷, 未来应向高灵敏度、高特异性、高通量、高重复性、简易、经济方向发展。以适应致病菌对检测技术的要求[31]。
1.2.2 基因芯片技术
基因芯片技术具有微型化、高通量、平行化、自动化等优势。目前, 许多学者将基因芯片技术应用到对致病菌的快速检测与鉴定中。戈蕾[32]采用基因芯片技术成功检测到6种主要的海水鱼类病原弧菌。为了提高菌种鉴定准确率, 需借助16S rDNA进行测序分析, 例如致病菌哈氏弧菌[33]以及海洋细菌C-5[34]的鉴定。利用细菌分类学上具有重要意义的16S rDNA基因作为检测的靶分子, 并在其间设计检测探针, 可建立一套致病菌的基因芯片快速检测技术。Barlaan等[35]在16S rDNA基因基础上, 结合电化学微阵列芯片的使用, 实现了对海水中8种致病菌的检测, 并且在单个基因芯片上就能够实现对90种致病菌的检测(表1)。
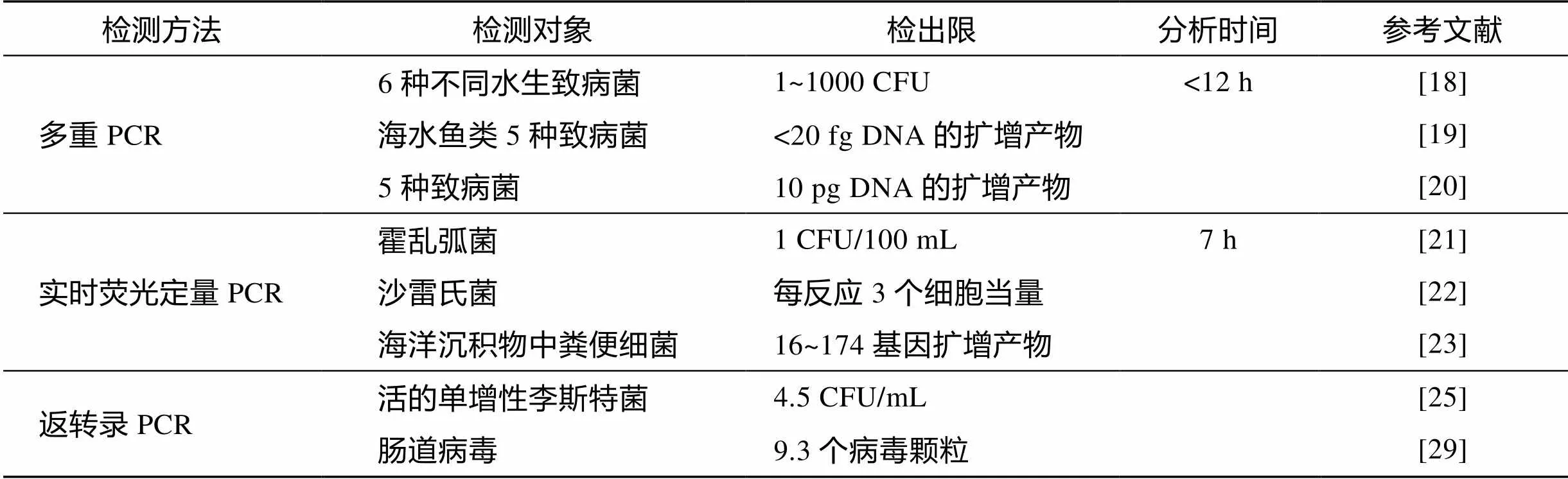
表1 分子生物学方法检测海水中致病菌
基因芯片技术作为生物芯片技术中发展最完备的一个分支, 理论上可以做到在一次实验中检测出所有的致病菌, 具有很好的灵敏度, 其在海水中致病菌的检测方面也发挥越来越重要的作用。但在获取大量准确的基因序列、简化样品制备和标记操作、增加信号检测灵敏度以及降低成本等方面还需要进一步提高[36]。
1.3 免疫方法
免疫学技术是结合生物化学或者物理学方法建立的病原检测技术, 该技术简化了病原微生物的鉴定步骤。其中以酶联免疫、荧光免疫以及免疫磁珠为主的分析方法在微生物研究中被广泛应用。
1.3.1 酶联免疫分析法(Enzyme-Linked Immunosorbent Assay, ELISA)
酶联免疫分析法是把酶的放大作用与免疫反应特异性相结合的分析技术, 是酶分析技术的经典代表, 也是最常用的免疫技术之一。Zhong等[37]提出的以IgY为捕获抗体, IgG检测抗体构成的夹心ELISA能够实现对副溶血性弧菌快速灵敏检测, 其检测限为2.5×104CFU/mL, 检测时间为4 h。与以往的ELISA相比, 该方法在稳定性和准确性上有较大的提高。利用ELISA技术亦可对海水样品中所有的弧菌进行特异性的捕获, Laczka等[38]在70 min内实现对12种弧菌的快速、准确、灵敏检测。
1.3.2 荧光免疫检测技术(Immunofluorescence Assay, IA)
荧光免疫检测技术可通过检测荧光强度来直接检测致病菌。Goel等[39]借助异硫氰酸荧光素(FITC)对霍乱弧菌O1外膜蛋白的多克隆抗体进行染色, 该方法能够快速灵敏地特异性识别霍乱弧菌O1。除了对霍乱弧菌O1的荧光标记, Wang等[40]还对霍乱弧菌O139荧光标记, 采用荧光免疫检测聚集物(immunofluorescent-aggregation, IFAG)方法对其进行检测, 即使在干扰细菌的存在下, 该方法也能成功检测到环境水样中的霍乱弧菌O1和霍乱弧菌O139。
1.3.3 免疫磁珠技术(Immunomagnetic Beads Separation Techniques, IMBS)
免疫磁珠技术不仅具备了固相化试剂特有的优点以及免疫学反应的高度特异性, 还有高效、快速、可重复性好、操作简单等优点, 因此越来越广泛地应用于微生物学检测。免疫磁珠技术检测海水中鳗弧菌时, 由于磁珠的富集作用, 磁珠与菌液最佳反映时间缩短到20 min, 检测敏感度高达到0.13 CFU/mL。该技术比常规分离培养方法高出近100倍[41]。李倩倩等[42]通过共价交联法将三色量子点与抗沙门菌、抗志贺菌和抗金黄色葡萄球菌的特异性抗体偶联, 选用3种不同颜色、不同发射波长的量子点作标记, 经免疫磁珠富集, 同一反应体系中可实现3种菌同时检测。
免疫分析中, 载体磁珠的应用可代替常规的选择性增菌培养过程, 特异地将目的微生物从样品中快速地分离出来[43]。同样, 磁珠载体也与PCR技术[44]、电化学技术[45]、流式细胞术[46]等结合使用, 可充分发挥二者优势, 大大提高分离效率和检测极限。
免疫学方法的优点是高效, 可在几个小时内出结果(表2), 不需复杂仪器, 所需设备简单、易操作。但该方法在识别过程中容易受其他微生物共同抗原以及抗体与非抗原物质之间的非特异性反应的干扰, 易出现假阳性结果。因此, 需要制备更高特异性的单克隆抗体或多克隆抗体。免疫磁珠分离技术在一定程度上可代替常规的选择性增菌培养过程, 可特异有效地将目的微生物从样品中快速的分离出来。但是免疫磁珠制备困难, 要获得均匀性好、超顺磁性、粒度适中、易于结合蛋白质的磁珠难度大。此外, 一旦菌体发生变异, 该方法的检测结果将可能会不准确[47]。
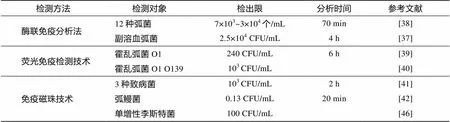
表2 免疫学方法检测海水中致病菌
1.4 生物传感器技术
生物传感器是以固定化生物活性物质(酶、蛋白质、微生物、DNA以及生物膜等)作为分子识别元件与适当的物理或者化学换能器有机结合而组成的一种先进分析检测装置。其工作原理为: 待测物质经扩散作用进入固定生物敏感膜层, 经分子识别而发生生物学反应, 传感器的敏感层与复杂样品中的特定目标分析物之间如酶与底物、抗体与抗原、外凝集素与糖蛋白、核酸与其互补片段之间的识别反应会产生一些物理信号如光、热、声、质量、颜色、电化学等的变化, 经特定仪器放大后加以显示或记录。产生的信息如光、热、音等被相应的信号转换器变为可定量和可处理的电信号, 再经二次仪表放大并输出, 以电极测定其电流值或电压值, 从而换算出被测物质的量或浓度。
生物传感器(Biosensor) 具有分析速度快、专一性强、准确度高、成本低、可重复使用、易实现自动化等优点。在致病菌的检测应用中, 根据生物传感器选用的换能器工作原理可分为光学生物传感器、电化学生物传感器、质量传感器等。
1.4.1 光学生物传感器(Optical Sensor)
光学传感器由于具有高选择性和灵敏度而广泛应用于致病菌的检测中。光学传感器中以荧光传感器和表面等离子体共振传感器应用较为广泛。
1.4.1.1 表面等离子体共振传感器(Surface Plasmon Resonance Biosensor, SPR)
SPR传感技术具有实时快速、分析复杂体系的时间短, 灵敏度高, 无需标记样品并能在混浊或不透明的样品中进行检测等优点。因此, 近年来SPR传感技术的开发研究工作得到了迅猛发展[48]。刘儒平等[49]建立了一种基于SPR技术的大肠杆菌特异性快速检测方法。该方法利用一抗和二抗的质量扩增效应和生物素—亲和素的多级放大效应, 实现了对低浓度大肠杆菌ATCC25922 的快速检测。该方法操作快速、灵敏度高、特异性强, 在食品安全分析、环境污染检验等方面具有广阔的应用前景。Yilmaz借助分子印迹技术合成的生物接受体固定在SPR生物传感器上, 该方该方法简单快速, 准确性较高, 但灵敏度需要提高[50]。Piliarik等借助DNA技术构建的新型SPR生物传感器, 能够识别食源性致病菌特定DNA或RNA的核酸片段, 进行高通量、灵敏、快速检测, 该方法可在15 min内实现对核酸100 pM级的检测[51]。但SPR难以区分非目标致病菌, 存在非特异性吸附, 对温度、样品组成等干扰因素敏感的问题。
1.4.1.2 荧光传感器
荧光检测的灵敏度高, 可实现单分子检测, 响应速度快, 有固定的荧光信号, 可用多种染料实现多重分析[52]。Liu 等[53]借助CdSe/ZnS树突状核壳结构纳米晶体作为荧光标记物, 在没有任何富集和孵化步骤下, 该方法对大肠杆菌O157︰H7的检测限达到2.3 CFU/mL, 检测时间为30 min。磁性纳米颗粒用于快速分离磁珠-细胞结合物, Wang等[54]将等量子点QDs和磁纳米颗粒应用到生物传感器中用于快速检测单增性李斯特菌, 该传感器的检测限为2~3 CFU/mL, 检测时间为1.5 h。在同一个样品溶液中, 通过使用不同尺寸的QDs作为荧光标记物可以实现对不同细菌物种的同时检测。Cho等[55]建立的原位荧光磁免疫传感器能够在2 h内快速灵敏准确地检测出低量大肠杆菌、沙门氏菌、单增性李斯特菌, 检出限达到5 CFU/mL。这一方法简单实用, 具有作为致病菌筛选工具的潜在优势。
1.4.2 电化学传感器
电化学传感器是发展最为成熟和应用最广的一类传感器, 它可以在浑浊介质中使用, 在微型化、集成化、智能化等方面得到快速发展。电化学传感器具有操作简单、携带方便、对分析物可以进行连续快速检测等优越性能, 在生命科学、食品安全、医学检验和环境监测等领域得到广泛应用[56]。按其所转换的电学量类型可以将电化学传感器分为: 电流型生物传感器、电位型生物传感器和阻抗型生物传感器。
1.4.2.1 电流型传感器(Amperometric biosensor)
电流型传感器是常用的生物传感器。以丝网印刷电极为基础电极, 制备的多种用于检测海水致病菌的电化学传感器已有多次报导。Sharma[57]在丝网印刷电极的基础建立的电流型免疫传感器可检测海水中的霍乱弧菌, 灵敏度为8 CFU/mL。这一方法简单可行, 可用于环境中霍乱弧菌的检测。此外, Laczaka提出的在丝网印刷电极上运用酶联免疫分析法可在1h内从含有12种不同的弧菌海水样品中特异性检测副溶血弧菌, 实现4×102CFU/mL的检测[58]。该方法成本低, 耗时短, 微型化可实现原位检测。用电化学活性物质聚苯标记的大肠杆菌O157︰H7通过免疫磁分离后, 可在丝网印刷电极上进行电化学检测。这一方法可在70 min内实现70 CFU/mL大肠杆菌O157︰H7的检测[59]。尽管较低的检出限和较短的检出时间有利于快速定性检测, 但是该传感器还需要在准确性上进行进一步的验证, 以及在定量上进行改善。
1.4.2.2 电位型传感器(Potentiometric biosensor)
电位型传感可以基于pH变化或者离子浓度变化实现对致病菌的检测。标记在大肠杆菌上的尿素酶可催化尿素产生NH3使得溶液的pH值发生变化, 通过检测pH值的变化来检测大肠杆菌。基于此提出的电位传感器在可1.5 h内实现10 CFU/mL的检测[60-61]。我们课题组提出了一种基于核酸适体识别的免标记、免固定化电位型传感器, 实现了海水中致病菌的快速检测。单增性李斯特菌能够与核酸适体特异性结合, 改变核酸适体的构型或表面电荷, 从而影响其与鱼精蛋白的作用, 使得电极电位变化发生改变。该电位型传感器的灵敏度达到10 CFU/mL, 可以推广用于其他致病菌的检测。实际样品检测时, 我们采用样品在线过滤系统实现对致病菌的富集, 能够有效消除海水带电荷离子的干扰[62]。
1.4.2.3 阻抗型传感器(Impedimetric biosensor)
阻抗传感器简单、快速、无需标记, 广泛应用于致病菌的检测。Guo等通过自组装单层膜(SAM)将α—甘露糖苷固定在金电极上, 用于特异性捕获大肠杆菌ORN 178。细胞膜上磷脂双分子层的绝缘性会阻碍电极表面的电子传递, 因此通过检测电极表面阻抗增加来确定有捕获的大肠杆菌存在。该方法简单快速, 可实现102CFU/mL的检测[63]。用二茂铁-抗微生物的缩氨酸蛙皮素I修饰的电化学阻抗传感器可用来检测大肠杆菌O157︰H7。在检测过程中, 键合到二茂铁-缩氨酸膜表面的大肠杆菌会使膜结构发生变形, 二茂铁基团进入到溶液中, 因而电子更容易传递到金电极表面, 电阻抗值降低。在该传感器中, 选用带正电荷的蛙皮素I作为生物识别成分, 能够特异性优先检测革兰氏阴性致病的大肠杆菌。该方法的检测时间小于2 h, 检测限达到103CFU/mL[64]。Wan等[65]以功能化抗体修饰的3D泡沫镍基底作为捕获平台的免疫传感器, 借助电化学阻抗滴定法实现了对海水中硫酸盐还原菌的检测, 该方法具有高的选择性和灵敏度。此外, 金纳米颗粒(AuNPs)修饰的还原的氧化石墨烯纸(rGOP)有较大的活性区域, 有利于抗体的固定。Wang等[66]在此基础上构建的电化学阻抗免疫传感器能够灵敏准确地检测大肠杆菌O157︰H7。此方法避免了阻抗检测的高成本, 有助于实现仪器便携式及适时检测等。此外, 石墨烯纸电极能够长期保存且抗压能力强, 能够作为生物化学的微系统的应用。
1.4.3 质量传感器(Mass-Sensitive Biosensor)
质量传感器的信号传导是基于微小的质量变化, 适用于对质量变化极其敏感的检测。石英晶体微天平(Quartz Crystal Microbalance, QCM)是最常用的质量传感器, 具有结构简单、成本低、灵敏度高、测量精度可达纳克量级等优点, 在微生物检测方面得到广泛的应用和发展。为实现快速检测致病菌, Ozalp等[67]将沙氏门菌适体固定在磁珠上形成适体QCM传感器。磁珠分离系统可以有效捕获细菌细胞, 使反应时间小于10 min, 检测限为100 CFU/mL。该传感器表面经氢氧化钠溶液洗脱后可重复使用。Salam等将Au纳米颗粒与QCM免疫传感器表面的多克隆抗体结合, 构成的新型QCM传感器能够特异性地实时快速灵敏检测伤寒沙氏门菌。与之前报道的QCM传感器相比, 该传感器可有效提高灵敏度, 对伤寒沙氏门菌的检测限为10~20 CFU/mL[68]。Hong[69]等通过将氧化的免疫球蛋白G与单层自组装膜上的酰肼交联固定到压电生物传感器膜上, 用于检测海水动物体内的迟钝爱德华氏菌。该传感器特异性强, 灵敏度高, 再生性好, 可重复使用10次。
从表3可以看出, 生物传感器技术在海水致病菌的检测中取得了丰硕的成果。其在灵敏度、特异性以及检测时间等方面又有了较大的提高, 但是由于微生物是活体物质, 对其的分析和检测依然存在很多不确定性。生物传感器在致病菌检测中仍需要改进很多问题, 比如: 灵敏度需要进一步提高, 由于实际样品的检测往往需要很低的检出限, 而由于非特异性信号等因素的干扰, 检出限能达到10 CFU/mL左右的传感器并不占多数; 稳定性需要提高, 由于构建生物传感器的生物敏感元件多为生物结构, 容易受外界条件影响, 因而生物传感器在检测和存放过程中应克服生物结构本身易变性的问题; 很多生物传感器使用寿命并不长, 重复利用率不高, 容易造成资源的浪费。因此, 提高生物传感器的灵敏度、使用寿命和生物响应稳定性, 设计微型化、便携化、实用化的生物传感器是今后的一个发展方向[70]。
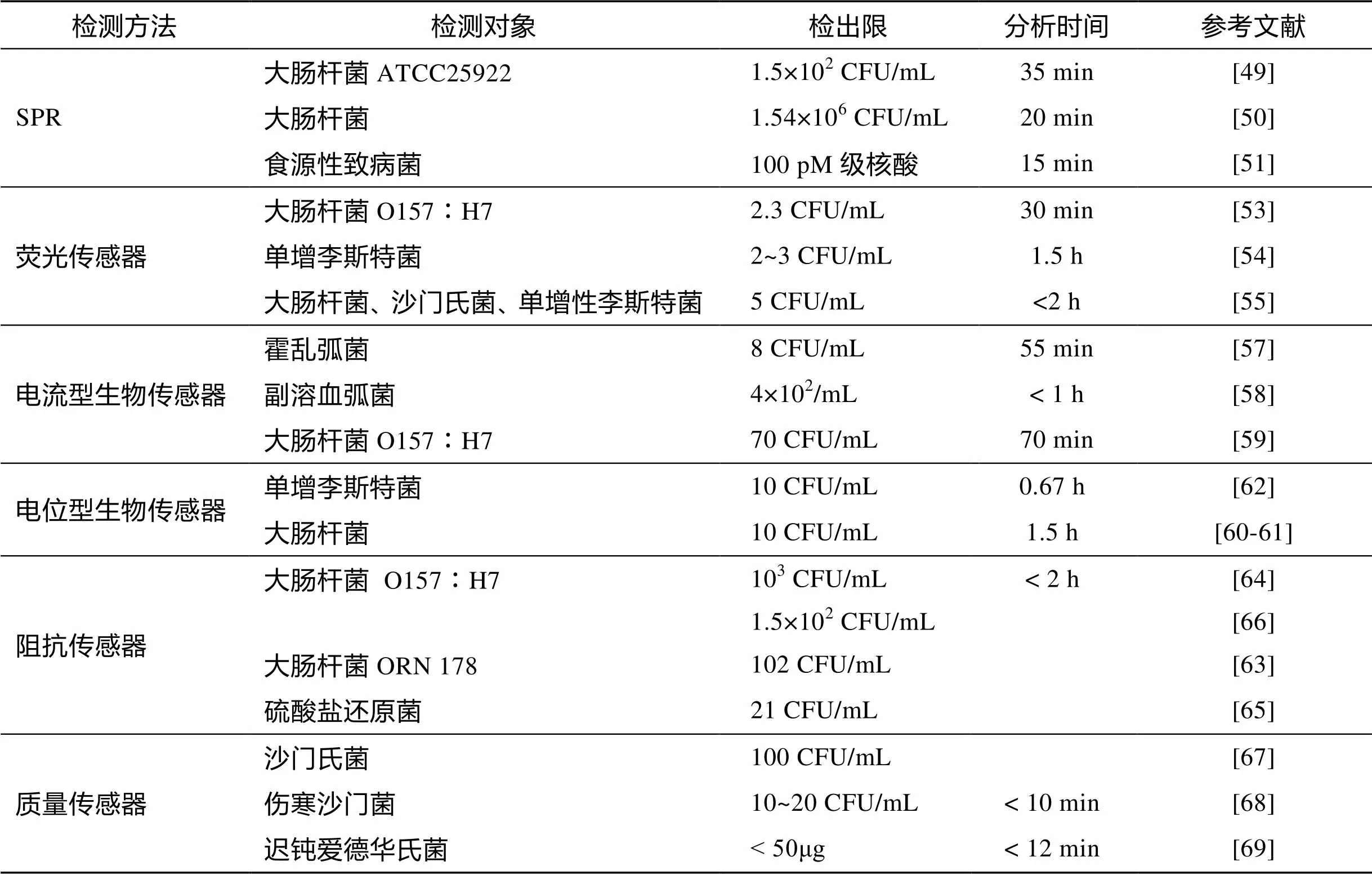
表3 生物传感器技术检测海水中致病菌
2 总结与展望
每一种检测海水中致病菌的技术, 在不断发展和创新过程中都各有优势。海水中存在众多致病菌, 借助多重PCR技术、基因芯片技术可实现对多种致病菌的同时检测; 实时荧光定量PCR利用荧光信号的积累能够实时监测整个PCR过程, 实现定量检测, 易实现自动化; 而反转录PCR只能检测活的致病菌细胞, 可大大降低假阳性结果。免疫方法具有高效性, 与PCR检测技术相比, 明显缩短了检测时间; 以磁珠为载体的免疫技术能快速有效富集目标病原菌, 且有较好的灵敏度和特异性。根据检测原理的不同而发展起来的多类型传感器在致病菌的检出中应用广泛, 无论在分析速度, 准确性还是在灵敏度方面均有很大提高。
尽管许多发展的方法已经实现了对某些海水中致病菌的检测, 但是在海水复杂的基质中, 致病菌浓度很低, 菌种繁多, 因此理想的致病菌检测技术应具有更高的灵敏度, 更强的选择性以及可在短时间内快速检测。
分子生物学技术因为具有特异性强、灵敏度高以及快速简单等优点, 已被广泛应用于致病菌的检测。致病菌的分离、富集和选择高效的DNA提取方法是实现快速、特异、灵敏检测的重要基础[71]。因此, 今后研究中, 分子生物学技术的工作应着重研究具有较强分离能力的分离方法, 例如对膜分离技术[72-73]进行优化、纳米磁性材料的应用[74-75]等均可以有效提高致病菌的分离、富集效率。值得注意的是, 在分离富集过程中应尽可能选择特异性富集, 为后续DNA的提纯提供质量保证。同时简化DNA的提取步骤, 缩短提取时间, 提高DNA的纯度也是提高分子生物学检测方法的又一重要手段。磁性材料经过与致病菌特异性基因片段互补的寡核苷酸片段修饰后, 可以选择性分离目标DNA, 此法灵敏、快速且干扰小[76-77]。
分子识别元件作为传感器的重要元件, 是影响传感器特异性、稳定性以及适用范围的关键因素。适配体具有分子小、易合成、易修饰、相对稳定且对靶物质可特异性识别、结合力很强等优势, 近几年已作为一类分子识别元件用于搭载各种传感元件组建成不同类型的生物传感器[78-82]实现了对致病菌的检测要求。同时, 近几年来, 适配体作为构建新型液相芯片的基础在致病菌的检测中也逐步引起关注[83-85]。新型液相芯片技术是以物理学、光学等编码的基质为载体, 通过制备不同配体功能化的载体, 实现对同一液相环境中多种靶细菌的同时检测, 具有操作简便、高灵敏度、高通量以及宽的线性测定范围等优点。因此, 随着适配体筛选技术和液相芯片技术不断提高, 以适配体为分子识别元件构建的生物传感器以及以适配体为基础构建的新型液相芯片检测技术将会在海水中病菌的检测中发挥重要的作用。
随着新材料的出现和新技术的发展, 功能化纳米材料在致病菌的检测中发挥巨大的作用。例如有利于分离、富集和纯化的磁性纳米材料能够有效缩短增菌时间, 大幅度提高检测效率[86-88]; 利用纳米金的光学特性引起的体系颜色的变化能够实现致病菌的快速检测[89-91]; 以及利用量子点的荧光特性能够显著提高灵敏度等[92-93]。其中, 量子点作为理想的生物探针, 具有量子产率高、光稳定性好、斯托克斯位移大、激发光谱宽、发射光谱窄等独特的光学特征[94-96], 在致病菌的检测中潜在较大的应用价值, 例如量子点免疫层析试纸条[97-98, 92]、量子点生物传感器[99-100]、量子点标记流式细胞术[101-102]等检测技术的建立。随着量子点合成工艺的不断改进以及量子点与免疫分析、适配体分析、生物传感等检测方法的结合, 将会为人们提供更多快速、灵敏、高效的检测方法, 在海水致病菌检测领域将会有更广阔的应用前景[103]。
检测系统的智能化、微型化、便携化发展, 使实时、现场、动态、快速检测正在成为现实, 将成为一种新的发展趋势。微流控芯片技术是将生物或化学样品制备、输送、反应、分离、检测等基本操作集成到一块芯片上完成。纸芯片是近年来发展起来的一种基于纸的微流控器件, 具有操作简单、成本低廉、制作简单等优势, 在致病菌的检测中已有应用[104-105]。但是微流控纸芯片应用于致病菌的检测尚处于初级阶段, 要成功应用于海水致病菌的检测仍需要通过不断地优化与研究, 加强与电子设备的结合, 研制针对致病菌具有富集、分离、检测多功能于一体的微流控纸芯片, 使其适用于海水中致病菌的检测。
[1] Yamahara K M, Layton B A, Santoro A E, et al. Beach sands along the California coast are diffuse sources of fecal bacteria to coastal waters[J]. Environmental Science & Technology, 2007, 41: 4515-4521.
[2] Haack S K, Fogarty L R, Wright C. Escherichia coli and enterococci at beaches in the Grand Traverse Bay, Lake Michigan: Sources, characteristics, and environmental pathways[J]. Environmental Science & Technology, 2003, 37: 3275-3282.
[3] Rompre A, Servais P, Baudart J, et al. Detection and enumeration of coliforms in drinking water: current methods and emerging approaches[J]. Journal of Microbiological Methods , 2002, 49: 31-54.
[4] 张喜昌, 张卫, 褚亚东, 等. 繁茂膜海绵清除大肠杆菌的过程[J]. 海洋科学, 2015, 39: 21-27.Zhang Xichang, Zhang Wei, Chu Yadong, et al. Study on the removal process of Escherichia coli by sponge Hymeniacidon perlevis[J]. Marine Sciences, 2015, 39: 21-27
[5] 闫茂仓, 陈少波, 单乐州, 等. 海水养殖动物致病弧菌的研究进展[J]. 水产科学, 2009, 28(08): 475-481.Yan Maocang, Chen Shaobo, Shan Lezhou, et al. A Critical Review: Pathogenic Vibrio in Maricultural Animals [J]. Fisheries Science, 2009, 28(08): 475-481.
[6] Mittelmann A S, Ron E Z, Rishpon J. Amperometric quantification of total coliforms and specific detection of Escherichia coli[J]. Analytical Chemistry, 2002, 74: 903-907.
[7] 林怡雯, 杨天, 李丹, 等. 基于CTC-流式细胞仪活性细菌总数的快速检测技术研究[J]. 环境科学学报, 2013, 33(09): 2511-2515.Lin Yiwen, Yang Tian, Li Dan, et al. Rapid detection of viable bacteria by integrated CTC (5-Cyano-2, 3-ditoyl tetrazolium chloride) dying and flow cytometry assay (CTC-FCM) [J]. Acta Scientiae Circumstantiae 2013, 33(09): 2511-2515.
[8] 邓灯, 吴晓春, 程顺峰, 等. 鱼肠道弧菌单克隆抗体流式细胞术检测技术的研究[J]. 水产科学, 2015, 34(2): 113-117. Deng Deng, Wu Xiaochun, Cheng Shunfeng, et al. Detection of bacterial pathogen vibrio ichthyoenteri by monoclonal antibody and flow cytometry[J]. Fisheries Science, 2015, 34(2): 113-117.
[9] 刘昕, 张俊彬, 黄良民. 流式细胞仪在海洋生物学研究中的应用[J]. 海洋科学, 2007, 1: 92-96. Liu Xi, Zhang Junbin, Huang Liangmin. Applications of flow cytometry (FCM) in researches of marine biology[J]. Marine Sciences, 2007, 31(1): 92.
[10] Joachimsthal E L, Ivanov V, Tay S T L, et al. Bacteriological examination of ballast water in Singapore Harbour by flow cytometry with FISH[J]. Marine Pollution Bulletin, 2004, 49: 334-343.
[11] Jochem F J. Morphology and DNA content of bacterio-plankton in the northern Gulf of Mexico: analysis by epifluorescence microscopy and flow cytometry[J]. Aquat Microb Ecol, 2001, 25: 179-194.
[12] 魏熙胤, 牛瑞芳. 流式细胞仪的发展历史及其原理和应用进展[J]. 现代仪器, 2006, (04): 8-11.Wei Xiyin, Niu Rifang. The development history, mechanism and application of Flow cytometer[J]. Modern Instruments, 2006, (04): 8-11.
[13] 刘新星, 霍转转, 云慧, 等. 流式细胞术在细菌快速检测中的应用[J]. 微生物学通报, 2014, 41(01): 161- 168. Liu Xinxing, Huo Zhuanzhuan, Yun Hui, et al. Application of flow cytometry to rapid detection of bacteria[J]. Microbiology China, 2014, 41(01): 161- 168.
[14] Cameron C E, Zuerner R L, Raverty S, et al. Detection of pathogenic Leptospira bacteria in pinniped populations via PCR and identification of a source of transmission for zoonotic leptospirosis in the marine environment[J]. J Clin Microbiol, 2008, 46: 1728-1733.
[15] 庞兴红, 周永灿, 徐先栋, 等. 基于一种新基因的溶藻弧菌毒力菌株检测方法的建立[J].水产科学, 2011, 30( 6) : 342-346.
[16] Kumar H S, Parvathi A, Karunasagar I, et al. A gyrB-based PCR for the detection of Vibrio vulnificus and its application for direct detection of this pathogen in oyster enrichment broths[J]. Int J Food Microbiol, 2006 111( 3) : 216-220.
[17] 邓曦, 唐书泽, 周鹏飞, 等.创伤弧菌的优化培养及快速检测[J]. 食品工业科技, 2014, 35(6): 197-201. Deng Xi, Tang Shuze, Zhou Pengfei, et al. Optimization and rapid detection of Vibrio vulnificus [J]. science and technology of food industry, 2014, 35 (6): 197-201.
[18] Kong R Y, Lee S K, Law T W, et al. Rapid detection of six types of bacterial pathogens in marine waters by multiplex PCR[J]. Water Res, 2002, 36: 2802-2812.
[19] Gonzalez S F, Krug M J, Nielsen M E, et al. Simultaneous Detection of Marine Fish Pathogens by Using Multiplex PCR and a DNA Microarray[J]. Journal of Clinical Microbiology, 2004, 42: 1414-1419.
[20] Calvo L, Gregorio I, Garcia A, et al. A new pentaplex- nested PCR to detect five pathogenic bacteria in free living amoebae[J]. Water Res, 2013, 47: 493-502.
[21] Fykse E M, Nilsen T, Nielsen A D, et al. Real-time PCR and NASBA for rapid and sensitive detection of Vibrio cholerae in ballast water[J]. Mar Pollut Bull, 2012, 64: 200-206.
[22] Joyner J, Wanless D, Sinigalliano C D, et al. Use of Quantitative Real-Time PCR for Direct Detection of Serratia marcescens in Marine and Other Aquatic Environments[J]. Applied and Environmental Microbiology, 2014, 80: 1679-1683.
[23] Luna G M, Dell’Anno A, Pietrangeli B, et al . A new molecular approach based on qPCR for the quantification of fecal bacteria in contaminated marine sediments[J]. J Biotechnol, 2012, 157: 446-453.
[24] Fey A, Eichler S, Flavier S, et al. Establishment of a real-time PCR-based approach for accurate quantification of bacterial RNA targets in water, using Salmonella as a model organism[J]. Appl Environ Microbiol, 2004, 70: 3618-3623.
[25] 李善志, 吴清平, 张菊梅, 等. RT-PCR 方法检测单核细胞增生李斯特活菌研究[J]. 中国卫生检验杂志, 2006, 16(6): 641-643. Li Shanzhi, Wu Qingping, Zhang Jumei, et al. Detect ion of viable Listeria monocytogenes with RT - PCR assay[J].Chinese Journal of Health Laboratory Technology, 2006, 16(6): 641-643.
[26] Asakura H, Ishiwa A, Arakawa E, et al. Gene expression profile of Vibrio cholerae in the cold stress-induced viable but non-culturable state[J]. Environ Microbiol, 2007, 9: 869-879.
[27] 姚斐, 寇运同, 陈刚, 等. 副溶血弧菌菌株1211U的活的非可培养状态[J]. 海洋科学, 2000, 24(6): 52- 54+28.Yao Fei, Kou Yuntong. Chen Gang, et al. The Viable But Nonculturable State of Vibrio parahaemolyticus 1211U[J]. MarinE Sciences, 2000, 24(6): 52-54, 28.
[28] Fischer-Le Saux M, Hervio-Heath D, Loaec S, et al. Detection of Cytotoxin-Hemolysin mRNA in Nonculturable Populations of Environmental and Clinical Vibrio vulnificus Strains in Artificial Seawater[J]. Applied and Environmental Microbiology, 2002, 68: 5641-5646.
[29] Donaldson K A, Griffin D W, Paul J H. Detection, quantitation and identification of enteroviruses from surface waters and sponge tissue from the Florida Keys using real-time RT-PCR[J]. Water Research, 2002, 36: 2505-2514.
[30] 贺电, 吴后波. 分子生物学技术在水产养殖动物病原快速检测中的应用[J]. 海洋科学, 2007, 31(03): 76- 81.He Dian, Wu Houbo. The application of molecular methods to rapid detection of aquatic pathogens[J]. Marine Sciences, 2007, 31(03): 76-81.
[31] 胡金强, 雷俊婷, 景建洲, 等. 食源性致病菌PCR检测技术研究进展[J]. 轻工学报, 2016, 03: 49-56.Hu Jinqiang, Lei Junting, Jing Jianzhou, et al. Research progress in detection of foodborne pathogenic bacteria PCR [J]. Journal of light industry, 2016, 03: 49-56.
[32] 戈蕾. 海水鱼类主要弧菌鉴定和毒力基因检测的膜芯片技术[D]. 青岛: 中国海洋大学, 2007.Ge Lei.Development of membrane chip technology about identification and virulence genes detection of marine fish vibrios[D]. Qingdao: OCEAN UNIVERSITY OF CHINA, 2007.
[33] 徐先栋, 谢珍玉, 欧阳吉隆, 等. 褐点石斑鱼脱鳞病病原菌的分离与鉴定[J]. 海洋科学, 2012, 36(2): 67-74.Xu Xiandong, Xie Zhenyu, Ouyang Jilong, et al. Isolation and identification of bacterial pathogens from Epinephelus fuscoguttatus with scale-peeled syndrome disease[J]. Marine Sciences, 2012, 36(2): 67-74.
[34] 韦露, 陈偿, 龙云映, 等. 一株拮抗菌C-5的分离及鉴定[J]. 海洋科学, 2015, 10: 29-35.Wei Lu, Chen Chang, Long Yunying, et al. Isolation and identification of a probiotic strain C-5[J]. Marine Sciences, 2015, 39(10): 29.
[35] Barlaan EA, Sugimori M, Furukawa S, et al. Electronic microarray analysis of 16S rDNA amplicons for bacterial detection[J]. J Biotechnol, 2005, 115: 11-21.
[36] 陆琳, 刘国传, 张惠媛, 等. 国境口岸致病微生物检测基因芯片探针设计新方法的研究[J]. 生物医学工程学杂志, 2009, 26(03): 643-652.Lu Lin, Liu Guochuan, Zhang Huiyuan, et al. A new method of designing genechip probe for frontier port detection of pathogenic microorganism[J]. Journal of biomedical engineering, 2009, 26(03): 643-652.
[37] Zhong Q P, Dong Y Q, Wang L, et al. Development of IgY-Based Sandwich Enzyme-Linked Immunosorbent Assay for the Detection of Vibrio parahaemolyticus[J]. Information Technology and Agricultural Engineering, 2012, 134: 517-524.
[38] Laczka O F, Labbate M, Seymour J R, et al. Surface immuno-functionalisation for the capture and detection of Vibrio species in the marine environment: a new management tool for industrial facilities[J]. PLoS One, 2014b, 9: e108387.
[39] Goel A K, Tamrakar A K, Kamboj D V, et al. Direct immunofluorescence assay for rapid environmental detection of Vibrio cholerae O1[J]. Folia Microbiologica, 2005, 50: 448-452.
[40] Wang D, Xu X, Deng X, et al. Detection of Vibrio cholerae O1 and O139 in environmental water samples by an immunofluorescent-aggregation assay[J]. Appl Environ Microbiol, 2010, 76: 5520-5525.
[41] 郝华. 用于海洋弧菌快速检测的免疫磁珠技术的研究[D]. 厦门: 集美大学, 2010. Hao Hua. Research on Rapid detection of marine Vibrio by the methods of immunomagnetic bead[D]. Xiamen: Jimei University, 2010.
[42] 李倩倩, 陈萍, 王静, 等. 基于多色量子点和免疫磁珠技术检测沙门菌、志贺菌和金黄色葡萄球菌[J]. 卫生研究, 2013, 42(04): 660-663.Li Qianqian, Chen Ping, Wang Jing, et al. Detection of Salmonella, Shigella and Staphylococcus aureus based on quantum dots and immunomagnetic beads [J]. Journal of hygiene research, 2013, 42(04): 660-663.
[43] Yang L J, Li Y B.Detection of viable Salmonella using microelectrode-based capacitance measurement coupledwith immunomagneticseparation[J]. Journal of Microbiological Methods, 2006, 64: 9-16.
[44] Hagren V, von Lode P, Syrjala A, Korpimaki T, et al. An 8 hour system for Salmonella detection with immunomagnetic separation and homogeneous time-resolved fluorescence PCR[J]. International Journal of Food Microbiology, 2008, 125: 158-161.
[45] 张璇, 鲜瑶. 免疫磁珠技术及其在食品微生物检测中的应用[J]. 农产品质量与安全, 2011(1): 40-43. Zhang Xuan, Xian Yao. Immunomagnetic technology and its application in food microbiological detection of [J]. agricultural products quality and safety, 2011(1): 40-43.
[46] Hibi K, Abe A, Ohashi E, et al. Combination of immunomagnetic separation with flow cytometry for detection of Listeria monocytogenes[J]. Analytica Chimica Acta, 2006, 573: 158-163.
[47] 蔡尽忠. 大肠菌群快速检测方法研究进展[J]. 生命科学仪器, 2015, 13(2): 14-18. Cai Jinzhong. Research Progress of Rapid Detection Method for Coliform Group[J].Life Science Instruments, 2015, 13(02): 14-18.
[48] 王颖娜, 常丽萍, 郭淑琴. SPR传感器的应用及其发展[J]. 材料导报, 2012, 26(5): 32-36. Wang Yingna, Chang Liping, Guo Shuqin. Development and application of SPR sensor[J]. Mater Review A, 2012, 26(5): 32-36.
[49] 刘儒平, 王程, 徐万帮, 等. 基于生物素-亲和素放大的SPR传感器检测大肠杆菌研究[J]. 传感技术学报, 2013, 26 (6): 757-761. Liu Ruping, Wang Cheng, Xu Wanbang, et al. Streptavidin (SA)-biotin amplification strategy based SPR sensor for rapid detection of escherichia coli[J]. CHINESE JOURNAL OF SENSORS AND ACTUATORS, 2013, 26 (6): 757- 761.
[50] Yilmaz E, Majidi D, Ozgur E, et al. Whole cell imprinting based Escherichia coli sensors: A study for SPR and QCM[J]. Sensors and Actuators B-Chemical, 2015, 209: 714-721.
[51] Piliarik M, Parova L, Homola J. High-throughput SPR sensor for food safety[J]. Biosens Bioelectron, 2009, 24: 1399-1404.
[52] Li B M, Yu Q L, Duan Y X. Fluorescent labels in biosensors for pathogen detection[J]. Critical Reviews in Biotechnology, 2015, 35: 82-93.
[53] Liu Y C, Brandon R, Cate M, et al. Detection of pathogens using luminescent Cdse/ZnS dendron nanocrystals and a porous membrane immunofilter[J]. Anaytical Chemistry, 2007, 79: 8796-8802.
[54] Wang H, Li Y B, Slavik M. Rapid detection of Listeria monocytogenes using quantum dots and nanobeads- based optical biosensor[J]. Journal of Rapid Methods and Automation in Microbiology, 2007, 15: 67-76.
[55] Cho I H, Mauer L, Irudayaraj J. In-situ fluorescent immunomagnetic multiplex detection of foodborne pathogens in very low numbers[J]. Biosensors & Bioelectronics, 2014, 57: 143-148.
[56] 丁家旺, 秦伟. 电化学传感技术在海洋环境监测中的应用[J]. 环境化学, 2014, 33(1): 53-61.Ding Jiawang, Qin Wei. Applications of electrochemicalsensing technologies in marine environmental monitoring[J]. Environmental Chemistry, 2014.33(1): 53-61.
[57] Sharma M K, Goel A K, Singh L, et al. Immunological Biosensor for Detection of Vibrio cholerae O1in Environmental Water Samples[J]. World Journal of Microbiology and Biotechnology, 2006, 22: 1155-1159.
[58] Laczka O, Labbate M, Doblin M. Application of an ELISA-type amperometric assay to the detection of Vibrio species with screen-printed electrodes[J]. Analytical Methods, 2014a, 6: 2020.
[59] Setterington E B, Alocilja E C. Rapid electrochemical detection of polyaniline-labeled Escherichia coli O157: H7. Biosensors & Bioelectronics, 2011, 26: 2208-2214.
[60] Ercole C, Del Gallo M, Pantalone M, et al. A biosensor for Escherichia coli based on a potentiometric alternating biosensing (PAB) transducer[J]. Sensors and Actuators B-Chemical, 2002, 83: 48-52.
[61] Ercole C, Del Gallo M, Mosiello L, et al. Escherichia coli detection in vegetable food by a potentiometric biosensor[J]. Sensors and Actuators B-Chemical, 2003, 91: 163-168.
[62] Ding J W, Lei J H, Ma X, et al. Potentiometric aptasensing of Listeria monocytogenes using protamine as an indicator[J]. Anal Chem, 2014, 86: 9412-9416.
[63] Guo X F, Kulkarni A, Doepke A, et al. Carbohydrate- Based Label-Free Detection of Escherichia coli ORN 178 Using Electrochemical Impedance Spectroscopy[J]. Analytical Chemistry, 2012, 84: 241-246.
[64] Li Y X, Afrasiabi R, Fathi F, et al. Impedance based detection of pathogenic E-coli O157: H7 using a ferrocene-antimicrobial peptide modified biosensor[J]. Biosensors & Bioelectronics, 2014, 58: 193-199.
[65] Wan Y, Zhang D, Wang Y, et al. A 3D-impedimetric immunosensor based on foam Ni for detection of sulfate- reducing bacteria[J]. Electrochemistry Communications, 2010, 12: 288-291.
[66] Wang Y, Ping J, Ye Z, et al. Impedimetric immunosensor based on gold nanoparticles modified graphene paper for label-free detection of Escherichia coli O157: H7[J]. Biosensors & Bioelectronics, 2013, 49: 492-498.
[67] Ozalp V C, Bayramoglu G, Erdem Z, et al. Pathogen detection in complex samples by quartz crystal microbalance sensor coupled to aptamer functionalized core-shell type magnetic separation[J]. Analytica Chimica Acta, 2015, 853: 533-540.
[68] Salam F, Uludag Y, Tothill I E. Real-time and sensitive detection of Salmonella Typhimurium using an automated quartz crystal microbalance (QCM) instrument with nanoparticles amplification[J]. Talanta, 2013, 115: 761-767.
[69] Hong S R, Choi S J, Jeong H D, et al. Development of QCM biosensor to detect a marine derived pathogenic bacteria Edwardsiella tarda using a novel immobilisation method. Biosens Bioelectron, 2009, 24: 1635-1640.
[70] 曹淑超. 生物传感器在环境监测中的应用[J]. 能源环境保护, 2015, 29(2): 59-62.Cao Shuchao. Appplication of biosensors in environmental monitoring[J]. Energy Environmental Protection, 2015, 29(2): 59-62.
[71] 董妍, 胡文忠, 何煜波, 等. 食源性致病菌分子生物学检测中菌体分离富集与DNA提取技术研究进展[J]. 食品工业科技, 2015, 23: 371-375. Dong Yan, Hu Wenzhong, He Yubo, et al. Research progress in separation, enrichment and DNA extraction of foodborne pathogens based on molecular biological technology[J]. Science and Technology of Food Industry, 2015, 23: 371-375.
[72] 胡朝友, 傅春玲, 张宏斌.饮用水中大肠埃希菌富集和DNA提取方法优化[J]. 中国食品卫生杂志, 2014, 26(001): 36-39. Hu Zhaoyou, Fu Chunling, Zhang Hongbin, et al. Optimized methods for Escherichia coli concentration and DNA extraction in drinking water[J]. Chinese Journal of Food Hygiene, 2014, 26(001) : 36-39.
[73] Jeníková G, Pazlarová J, Demnerová K. Detection of Salmonella in food samples by the combination of immunomagnetic separation and PCR assay[J]. International Microbiology, 2010, 3(4): 225-229.
[74] 钟子清, 熊勇华, 赖卫华, 等.纳米免疫磁珠富集单核增生李斯特菌[J]. 食品科学, 2013, 34(23): 212-215. Zhong Ziqing, Xiong Yonghua, Lai Weihua, et al. Nanoparticle-based Immunomagnetic Separation of[J]. Food Science, 2013, 34(23): 212-215.
[75] Yang Y, Xu F, Xu H, et al. Magnetic nano-beads based separation combined with propidium monoazide treatment and multiplex PCR assay for simultaneous detection of viable Salmonella Typhimurium, Escherichia coli O157∶H7 and Listeria monocytogenes in food products[J]. Food microbiology, 2013, 34(2): 418-424.
[76] Amagliani G, Omiccioli E, Brandi G, et al. A multiplex magnetic capture hybridisation and multiplex real - time PCR protocol for pathogen detection in seafood[J]. Food microbiology, 2010, 27( 5) : 580-585.
[77] Omiccioli E, Amagliani G, Brandi G, et al. Simultaneous direct detection of Salmonella spp., Listeria monocytogenes and Escherichia coli O157 in milk samples by magnetic extraction and multiplex PCR [J]. Journal of Rapid Methods &Automation in Microbiology, 2009, 17(2): 195-213.
[78] Wu H, Li M, Wang Y, et al. Aptasensors for rapid detection of Escherichia coli O157∶H7 and Salmonella typhimurium[J]. Nanoscale Research Letters, 2012, 7(47): 765-781.
[79] Song Y, Yang X, Li Z, et al. Label-free chemiluminescent ATP aptasensor based on graphene oxide and an instantaneous derivatization of guanine bases[J]. Biosensors and Bioelectronics, 2014, 51: 232-237.
[80] Duan N, Wu S, Dai S, et al. Simultaneous detection of pathogenic bacteria using an aptamer based biosensor and dual fluorescence resonance energy transfer from quantum dots to carbon nanoparticles[J]. Microchimica Acta, 2014, 182(5-6): 917-923.
[81] Lei P, Tang H, Ding S, et al. Determination of the invA gene of Salmonella using surface plasmon resonance along with streptavidin aptamer amplification[J]. Microchimica Acta, 2015, 182(1-2): 289-296.
[82] Zhang H, Ma X, Liu Y, et al. Gold nanoparticles enhanced SERS aptasensor for the simultaneous detection of Salmonella typhimurium and Staphylococcus aureus[J]. Biosensors and Bioelectronics, 2015, 74: 872-877.
[83] Duan N, Wu S, Yu Y, et al. A dual-color flow cytometry protocol for the simultaneous detection of Vibrio parahaemolyticus and Salmonella typhimurium using aptamer conjugated quantum dots as labels [J]. Analytica chimica acta, 2013, 804: 151-158.
[84] Wu S, Duan N, Shi Z, et al. Simultaneous aptasensor for multiplex pathogenic bacteria detection based on multicolor upconversion nanoparticles labels[J]. Analytical chemistry, 2014, 86(6): 3100-3107.
[85] Zhang H, Ma X, Liu Y, et al. Gold nanoparticles enhanced SERS aptasensor for the simultaneous detection of Salmonella typhimurium and Staphylococcus aureus[J]. Biosensors and Bioelectronics, 2015, 74: 872-877.
[86] Wang Y, Ravindranath S, Irudayaraj J. Separation and detection of multiple pathogens in a food matrix by magnetic SERS nanoprobes[J]. Analytical and bioanalytical chemistry, 2011, 399(3): 1271-1278.
[87] Choi K H, Lee H J, Park B J, et al. Photosensitizer and vancomycin-conjugated novel multifunctional magnetic particles as photo inactivation agents for selective killing of pathogenic bacteria[J]. Chemical Communications, 2012, 48(38): 4591-4593.
[88] Chen L, Zhang J. Bioconjugated magnetic nanoparticles for rapid capture of gram-positive bacteria[J]. Journal of Biosensors & Bioelectronics, 2012, 2012.
[89] Jans H, Huo Q. Gold nanoparticle-enabled biological and chemical detection and analysis[J]. Chemical Society Reviews, 2012, 41(7): 2849-2866.
[90] Dykman L, Khlebtsov N. Gold nanoparticles in biomedical applications: recent advances and perspectives[J]. Chemical Society Reviews, 2012, 41(6): 2256-2282.
[91] Li F, Zhao Q, Wang C, et al. Detection of Escherichia coli O157︰H7 using gold nanoparticle labeling and inductively coupled plasma mass spectrometry[J]. Analytical chemistry, 2010, 82(8): 3399-3403.
[92] Xu F, Xu D, Ming X, et al. Quantum dot-based immunochromatography test strip for rapid detection of campylobacter jejuni[J]. Journal of nanoscience and nanotechnology, 2013, 13(7): 4552-4559.
[93] Yaohua H, Chengcheng W, Bing B, et al. Detection of Staphylococcus Aureus using quantum dots as fluorescence labels[J]. International Journal of Agricultural and Biological Engineering, 2014, 7(1): 77.
[94] Esteve-Turrillas F A, Abad-Fuentes A. Applications of quantum dots as probes in immunosensing of small- sized analytes [J]. Biosens Bioelectron, 2013, 41: 12-29
[95] Burris K P, Stewart C N. Fluorescent nanoparticles: Sensing pathogens and toxins in foods and crops [J]. Trends Food Sci Tech, 2012, 28(2): 143-152.
[96] Jennings T L, Triulzi R C, Tao G, et al. Simplistic attachment and multispectral imaging with semiconductor nanocrystals [J]. Sensors. 2011, 11: 10557-10570.
[97] Chen X X, Gan M, Hong Xu H, et al. Development of a rapid and sensitive quantum dot-based immunochromatographic strip by double labeling PCR products for detection of Staphylococcus aureus in food[J]. Food Control, 2014, 46: 225-232.
[98] Kim G, Park S B, Moon J H, et al. Detection of pathogenic Salmonella with nanobiosensors [J]. Anal Meth, 2013, 5: 5717-5723.
[99] Kim G, Moon J H, Moh C Y, et al. A microfluidic nano- biosensor for the detection of pathogenic Salmonella [J]. Biosens. Bioelectron, 2015, 67: 243–247.
[100]Duan N, Wu S, Yu Y, et al. 2013. A dual-color flow cytometry protocol for the simultaneous detection of Vibrio parahaemolyticus and Salmonella typhimurium using aptamer conjugated quantum dots as labels [J]. Anal Chim Acta, 2013, 804: 151-158.
[101]Hahn M A, Keng P C, Krauss T D. Flow cytometric analysis to detect pathogens in bacterial cell mixtures using semiconductor quantum dots [J]. Anal Chem., 2008, 80: 864-872.
[102]韩四海, 张卫卫, 李璇, 等. 基于量子点的食源性致病菌快速检测方法研究进展[J]. 食品安全质量检测学报, 2015, 12: 4767-4774.Han Sihai, Zhang Weiwei, Li Xuan, et al. Research advances of quantum dots based rapid detection methods of foodborne pathogens[J]. Journal of Food Safety and Quality, 2015, 12: 4767-4774.
[103]Tian F, L Y J, Shi J, et al. A polymeric microfluidic device integrated with nanoporous alumina membranes for simultaneous detection of multiple foodborne pathogens[J]. Sensors and Actuators B: Chemical.2016, 225: 312-318.
[104]Chang W H, Wang C H, Lin C L, et al. Rapid detection and typing of live bacteria from human joint fluid samples by utilizing an integrated microfluidic system[J]. Biosensors and Bioelectronics, 2015, 66: 148-154.
[105]Leineweber W, Williams M. Assured bacterial detection towards paper-based microfluidic chip for resource - limited areas [D]. SantaClara: Santa Clara University, 2015, 2015.
Research progress in detecting pathogenic bacteria in seawater
LIU Shu-wen1, 2, DING Jia-wang1, QIN Wei1
(1. Key Laboratory of Coastal Environmental Processes and Ecological Remediation, Yantai Institute of Coastal Zone Research (YIC), Chinese Academy of Sciences (CAS); Shandong Provincial Key Laboratory of Coastal Environmental Processes, YICCAS, Yantai 264003, China; 2. University of Chinese Academy of Sciences, Beijng 100049, China)
There are many different kinds of pathogenic bacteria in seawater, each of which are potentially hazardous to aquaculture and human health. Conventional methods for detecting pathogenic bacteria have the drawbacks of complicated culturing procedures, time-consuming labor, and low efficiency, which limits their practical application. Therefore, there is an urgent need for the development of rapid, sensitive, and accurate detection technology for pathogenic bacteria in seawater. In this paper, we provide an overview of the applications of flow cytometry, the molecular biology method, the immunology method, and biosensors with respect to bacteria in seawater and summarize the research status of these methods.
pathogenic bacteria in Seawater; detecting; flow cytometry, molecular biological method; immunology method; biosensor
P736.22
A
1000-3096(2017)02-0145-12
10.11759/hykx20160310002
2016-03-10;
2016-12-01
中国科学院战略性先导科技专项(XDA11020702); 山东省泰山学者人才计划项目(TS20081159)
刘淑文(1991-), 女, 山东烟台人, 硕士生, 主要从事电位型传感器研究, E-mail: shuwenliu@yic.ac.cn; 秦伟, 通信作者, 研究员, E-mail: wqin@yic.ac.cn
Jul. 9, 2016
[This study was funded by the Strategic Priority Research Program of the Chinese Academy of Sciences, No.XDA11020702; Taishan Scholar Program of Shandong Province, No. TS20081159]
(本文编辑: 梁德海)
