利用SSR和SFP标记分析水稻叶色突变体的多态性
2017-05-18刘明浩方希林陈茜霖吴旺嫔陈光辉
刘明浩,肖 楠,方希林,陈茜霖,吴旺嫔,陈光辉,2,王 悦
(1.湖南农业大学农学院,湖南 长沙 410128;2.南方粮油作物协同创新中心,湖南 长沙 410128)
利用SSR和SFP标记分析水稻叶色突变体的多态性
刘明浩1,肖 楠1,方希林1,陈茜霖1,吴旺嫔1,陈光辉1,2,王 悦1
(1.湖南农业大学农学院,湖南 长沙 410128;2.南方粮油作物协同创新中心,湖南 长沙 410128)
利用1 286对SSR标记和66对SFP标记对水稻转绿型新叶黄化突变体ygr和正常绿叶水稻品种日本晴(NBP)的基因组进行多态性研究。结果表明:1 236对SSR标记和63对SFP标记有扩增产物,扩增效率为96.08%;亲本间共筛选到248对SSR多态标记和12对SFP多态标记,平均每条染色体有22对,多态检出率为19.23%;多态标记覆盖水稻基因组达1 626.2 cM,相邻多态标记间平均遗传距离为6.25 cM。不同类型标记间比较发现,SSR标记的多态检出率比SFP标记高1.1个百分点,两者相差不大。
水稻;SSR标记;SFP标记;叶色;多态性
分子标记技术在水稻功能基因定位、分子标记辅助选择育种以及遗传多样性分析等研究中具有重要作用。20世纪90年代以来,分子生物学的迅速发展,水稻品种93-11 和日本晴测序的完成,加速了水稻分子标记的开发和应用。不同类型分子标记的开发对水稻功能基因的定位和克隆具有重要意义。简单重复序列(simple sequence repeats,SSR)也称微卫星标记,覆盖了水稻的整个基因组,具有数量多、高多态性、呈共显性等优点。Ouyang等[1]研究表明,水稻基因组含有18 828个SSR分子标记。目前,这些SSR分子标记在水稻功能基因图位克隆和分子标记辅助选择育种的研究中得到广泛应用。SFP标记(single feature polymorphism,SFP)是近年来开发出来的一种基于微阵列技术的基因组插入/缺失差异标记。Edwards等[2]根据基因组插入/缺失差异,开发出880个SFP标记,这些标记也被广泛用于水稻功能基因的研究中。
水稻产量的90%~95%来自光合作用,提高光能利用率,是发挥水稻产量潜力的重要途径之一。叶色突变体是开展水稻光合作用机制、叶绿体结构功能及发育调控机理等基础研究的理想材料。不断发掘和鉴定新的尤其是实用型的水稻叶色突变基因,有助于在生产应用中提高杂交水稻种子的生产质量,进一步揭示水稻光合作用分子机理。该研究旨在找出转绿型新叶黄化突变体(ygr)和日本晴(NBP)亲本间呈现多态性的分子标记,比较SSR和SFP两种标记的多态检出率,并探讨多态性标记的分布规律,以期为进一步定位及克隆突变基因奠定基础。
1 材料与方法
1.1 供试材料
转绿型新叶黄化突变体ygr和正常绿叶品种NBP,均由湖南农业大学水稻研究所提供。
1.2 试验方法
1.2.1 育 苗 供试的ygr和NBP种子,预先在37℃浸种(两干两湿),露白后,播种于塑料育秧盘中。育苗土为市面上购买的营养土,温室育苗。
1.2.2 水稻基因组DNA的提取及PCR扩增 水稻基因组DNA的提取参照McCouch的方法,略有改进[3]。PCR扩增体系(10 μL):DNA 模板(20 ng/μL)1 μL,引物(2 pmol/μL)1 μL,10×Buffer 1 μL,dNTPs(2.5 mmol/L)0.2 μL,rTaq酶(5 U/μL) 0.1 μL,ddH2O 6.7 μL。PCR扩增程序:95℃预变性5 min:95℃变性30 s,55~58℃退火30 s,72℃延伸1 min,35个循环;72℃再延伸7 min,4℃保存。电泳及检测:在每管PCR产物中,加入2 μL Loading Buffer(指示剂)。以50 bp梯度的DNA Ladder为对照,以0.5×TBE为电泳缓冲液,150V恒压电泳1.5~2.0 h,用8%的非变性聚丙烯酰胺凝胶(PAGE)电泳分离。银染程序根据Sanguinetti等[4]的方法改进而成。
1.2.3 标记来源 选择均匀覆盖水稻全基因组的1 286对SSR标记和66对SFP标记,检测ygr和NBP之间的多态性。其中,SSR标记及其序列信息来自McCouch、国际水稻基因组测序计划等发表的文献和Gramene数据库(http://www.gramene.org/)[5],SFP标记的设计方法和序列信息参见Edwards等[2]发表的文献。所有的标记由上海英潍捷基生物公司和湖南华擎生物技术有限公司合成,-20℃保存。
1.2.4 数据分析 利用多态标记检测ygr和NBP亲本间多态性,“1”代表同ygr相同的带型,“2”代表同NBP相同的带型,“-”代表带型不清或缺失的带型。连锁图谱采用MapDraw 2.1软件绘制[6]。
2 结果与分析
2.1 供试SSR和SFP标记在12 条染色体上的分布
在ygr和NBP亲本间,共检测1 352对分子标记的多态性,其中SSR标记有1 286对,SFP标记有66 对,共覆盖水稻全基因组1 857.6 cM,平均每条染色体约有113对。由表1可知,在水稻全基因组12条染色体上,6号染色体标记分布最多,有133对,其次是3号染色体,有121对,而12 号染色体上的分子标记最少,只有99对。所有染色体上,SSR标记的扩增率都在90%以上,而SFP标记在3、5、8号染色体上的扩增率均为83.33%,其他染色体上扩增率为100%(表1)。
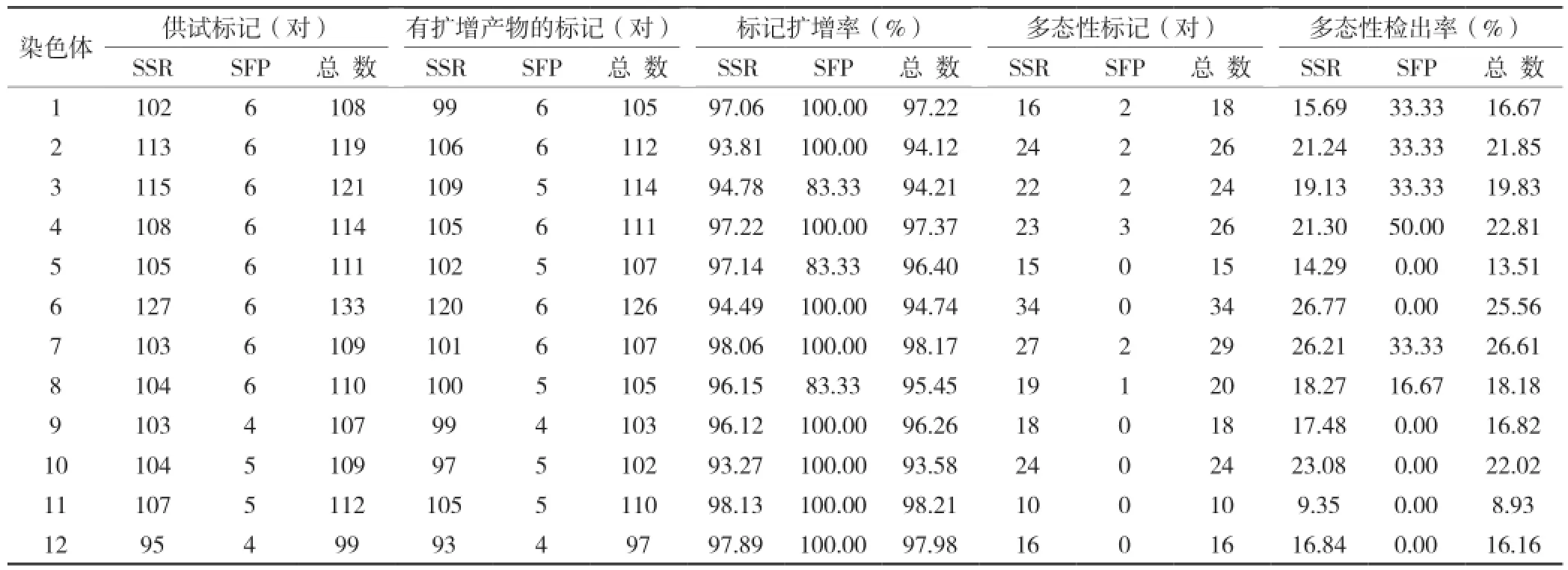
表1 SSR和SFP标记在水稻12条染色体上的分布
2.2 SSR和SFP标记多态性检出率的比较
由表1可知,有260对分子标记在ygr和NBP亲本间呈现多态性。其中,SSR标记有248对,SFP标记有12对,平均每条染色体有22对多态标记,多态检出率为19.23%。不同染色体之间比较,6号染色体筛选得到的多态标记最多,有34对;而7号染色体的多态性检出率最高,达到26.61%。SSR标记的多态检出率为19.28%,而SFP标记的多态检出率为18.18%,两者相差不大。
2.3 多态标记在图谱上的分布
以ygr和NBP亲本间检测到的220 对多态分子标记构建水稻多态图谱如图1所示,多态标记覆盖水稻全基因组1 626.2 cM,相邻标记间遗传距离为6.25 cM。其中,3号染色体上多态标记覆盖距离最长,达229.9 cM;第11染色体的平均间距最大,达到11.14 cM;6号染色体的多态标记平均间距最小,为3.57 cM。此外,图谱中尚有一些染色体位置多态标记覆盖不够均匀,如2号染色体SSR标记RM213至RM266之间相距41.7 cM,而3号染色体SSR标记RM5548至RM85之间相距70.9 cM。这些相邻标记间距较大并不是因该染色体区段供试分子标记密度或者间距过大造成的,如1号染色体SSR标记RM582至RM5638之间37 cM区段内供试分子标记有26对,但是没有在ygr与NBP亲本间发现多态分子标记,因此,在有大量供试分子标记覆盖的情况下,多态性可能与亲本间基因组序列的同源性有关。

图1 ygr与NBP亲本间SSR和SFP标记的多态图谱
3 讨 论
SSR标记在水稻基因组内的数量丰富,呈共显性,而且在利用过程中,操作步骤少而简单,使其在构建遗传图谱和分子标记辅助选择上,得到广泛的应用。鲍根良等[7]研究显示,SSR多态性的检出率,与亲本的亲缘关系呈正相关,即两个品种的亲缘关系越远,其多态的检出率越高。因此,在构图遗传图谱时,应该充分考虑两个亲本的亲缘关系,最好选择生态类型差异较大,或者亲缘关系相差较远的两个亲本。该研究以转绿型新叶黄化突变体ygr和正常绿叶品种NBP为亲本构建水稻多态图谱,亲本间多态性检出率为19.23%,在包含260个多态标记的水稻多态图谱中,1、2号染色体上各有1个,3号染色体上有2个大于30 cM的区段存在。这可能与亲本之间在染色体部分区段的同源性有关。
SFP标记源于微阵列技术,是一种InDel标记。黄玲等[8]研究表明,SFP标记的扩增率和多态率,均要高于SSR标记,亲本间的差异也要更加明显。然而,该研究中SFP的多态检出率为18.18%,略低于SSR的多态检出率,这可能与亲本间特异性相关。
随着生物信息学的不断发展,多态性分子标记的开发效率不断提高,高密度遗传图谱的构建变得越来越容易,而且其相应的成本也越来越低。利用生物信息学,综合使用各种类型的标记如SNP、Indel、ILP、STS、CAPS等,对靶区段进行加密,将获得更加理想的遗传图谱,从而缩短目标基因(QTLs)的定位区间,为基因克隆奠定坚实的基础。
[1] Ouyang S,Liu J,Jones K M,et al. The map-based sequence of the rice genome[J]. Nature,2005,436:793-800.
[2] Edwards J D,Janda J,Megan T,et al. Development and evaluation of a high-throughput,low-cost genotyping platform based on oligonucleotide microarrays in rice [J]. Plant Methods,2008,4(1):13.
[3] McCouch S R,Kochert G,Yu Z H,et al. Molecular mapping of rice chromosomes[J]. Theoretical and Applied Genetics,1988,76(6):815-829.
[4] Sanguinetti C J,Dias N E,Simpson A J. Rapid silver staining and recovery of PCR products separated on polyacrylamide gels[J]. Biotechniques,1994,17(5):914.
[5] Mccouch S R,Teytelman L,Xu Y,et al. Development and mapping of 2240 new SSR markers for rice(Oryza sativa L.)[J]. DNA Research,2002,9(6):199-207.
[6] 刘仁虎,孟金陵. MapDraw在Excel中绘制遗传连锁图的宏[J]. 遗传,2003,25(3):317-321.
[7] 鲍根良,富田桂,小林麻子,等. 粳稻品种SSR多态性检出率的分析[J]. 中国农业科学,2005,38(12):2549-2554.
[8] 黄 玲,黄红梅,肖应辉,等. 利用SSR和SFP标记分析不同抗瘟性水稻品种的多态性[J]. 湖南农业大学学报(自然科学版),2010,36(3):267-271.
(责任编辑:成 平)
Polymorphism Analysis of Rice Leaf Color Mutant by SSR and SFP Markers
LIU Ming-hao1,XIAO Nan1,FANG Xi-lin1,CHEN Qian-lin1,WU Wang-pin1,CHEN Guang-hui1,2,WANG Yue1
(1.College of Agronomy, Hunan Agricultural University, Changsha 410128, PRC; 2.Collaborative Innovation Center of Paddy Crop and Oil Crops in Southern, Changsha 410128, PRC)
One thousand two hundred and eight six pairs of SSR markers and 66 pairs of SFP markers were used to find the genomic polymorphism between the new leaf yellowing mutant ygr and normal green leaf cultivar NBP. The results showed that 1 236 pairs of SSR markers and 63 pairs of SFP markers had amplification products and amplification efficiency was 96.08%. A total of 248 pairs of SSR polymorphic markers and 12 pairs of SFP polymorphic markers were screened. There were 22 pairs of polymorphic markers on each chromosome, and the polymorphism was 19.23%. Polymorphic markers covered 1 626.2 cM of the rice genome, and the average genetic distance was 6.25 cM between adjacent polymorphic markers. Compare by different types of markers, the polymorphism detection rate of SSR marker was higher than that of SFP marker by 1.1 percent point, with no significant difference.
rice; SSR markers; SFP markers; leaf color; polymorphism
Q343.1+7
A
1006-060X(2017)04-0001-04
10.16498/j.cnki.hnnykx.2017.004.001
2017-02-22
国家自然科学基金(31301650);湖南省教育厅优秀青年项目(16B127);湖南农业大学大学生创新性实验计划项目(XCX1549)
刘明浩(1989-),男,山东临沂市人,硕士研究生,研究方向:水稻分子育种。
王 悦
