ATRA对小鼠的急性毒性与抗感染作用研究
2017-04-24任超郁彪李如杰诸葛增玉李留安金天明
任超,郁彪,李如杰,诸葛增玉,李留安,金天明
ATRA对小鼠的急性毒性与抗感染作用研究
任超,郁彪,李如杰,诸葛增玉,李留安,金天明通信作者
(天津农学院动物科学与动物医学学院,天津300384)
为研究全反式维甲酸(ATRA)对小鼠的急性毒性与抗感染作用,在ATRA急性毒性试验中采用最大给药量,记录小鼠给药7 d内的临床症状,然后通过剖检及病理组织学观察研究ATRA的急性毒性。将大肠杆菌经口感染小鼠建立感染模型,记录小鼠感染7 d内的临床症状,通过剖检和器官指数的测定来研究ATRA对小鼠的抗感染作用。结果表明,ATRA以最大给药量(人用剂量500倍)灌胃没有对小鼠造成明显的异常反应,体重与对照组相比差异不显著,剖检和病理组织学观察无可见病变。同时,口服高剂量ATRA的小鼠在感染后体重恢复效果好于低剂量组,口服ATRA的小鼠肝脏、肾脏、脾脏器官指数与对照组相比差异显著。说明ATRA对小鼠无急性毒性,同时具有良好的促进肝脏、肾脏、脾脏生长发育,提高机体免疫力和抗感染效果,可应用于兽医临床治疗以及疾病预防和控制。
ATRA;急性毒性;抗感染作用;小鼠;大肠杆菌
全反式维甲酸(all-trans retinoic acid,ATRA)是维生素A的天然衍生物,也是体内一种重要的生物活性物质。研究表明,ATRA在胚胎发育、诱导正常分化、免疫功能的发挥等过程中起到重要调节作用[1]。Kaufman等研究表明,以维生素A缺乏或核视网膜酸受体双敲除的小鼠为试验组,免疫腺病毒活载体疫苗,与健康小鼠相比,试验组小鼠的肠道免疫反应减弱。实际上,维生素A稍有不足就会显著削弱疫苗在肠黏膜诱导的保护性免疫反应,而短期补充维生素A就可以完全恢复机体的肠道免疫力。可见ATRA在肠黏膜中发挥重要的作用,而且能够促进效应性体液免疫反应和细胞免疫反应[2]。体内和体外试验表明,ATRA 可以增强TH2 细胞的分化,抑制TH1 细胞的分化,是维生素A 最强有力的恢复抗体反应的代谢产物[3]。
本研究通过急性毒性试验和抗感染试验阐明ATRA对小鼠的急性毒性和抗细菌感染作用,探讨其作用机制和保护效果,同时对不同剂量ATRA的抗感染作用展开研究,探讨其浓度与抗感染作用效果的相关性,并为临床应用和深入研究提供参考数据。
1 材料
1.1 试验动物
昆明系小鼠60只,购自天津医科大学实验动物中心,雌雄各半,5~8 周龄,体重为(20±2)g,饲料充足,饮水不限,分笼饲养,室温、湿度适宜。
1.2 主要试剂
ATRA购自美国Sigma公司。
1.3 菌株
大肠杆菌由天津农学院预防兽医学实验室保存。
2 方法
2.1 最大给药量试验
2.1.1 试验动物分组与处理
小鼠适应性喂养3 d,随机分为2组,每组10只,试验组按照人用剂量的500倍(最大给药量为0.75 g/kg)进行灌胃,ATRA以二甲基亚砜(DMSO)溶解,浓度为0.6 g/mL,0.25 mL/只,每隔6 h灌胃1次,共灌胃4次;对照组灌胃等量的DMSO。给药后观察7 d,记录每日各组小鼠的体重及精神状态、活动情况、皮毛光泽、食欲排泄、死亡等临床症状。
2.1.2 剖检与病理组织学观察
7 d后剖检,观察各组小鼠的肝、脾、肾、心的病变情况,计算器官指数(各脏器重量与体重之比),采集各组小鼠的肝、脾、肾、心组织,用4%甲醛溶液进行固定。经过7 d的组织固定,将各组小鼠的脏器进行常规病理组织切片的制备与HE染色,光镜下观察各脏器的病理变化,“-”表示无病变,“+”表示轻度损伤。
2.1.3 统计与分析
应用SPSS 11.5软件对实验数据进行统计分析处理,表格利用Excel软件制作,以(±)表示。
2.2 抗感染试验
2.2.1 试验动物分组与处理
小鼠适应性喂养2 d,随机分为4组,每组10只。1组、2组分别灌服ATRA溶液1 μmol/kg和5 μmol/kg,连续7 d,同时1、2组分别灌服等量的DMSO,记录各组每日的体重变化。参考文献[4],7 d后,1组、2组、3组分别灌服大肠杆菌0.2 mL/只,1×108CFU/mL,第4组灌服等量的生理盐水,观察各组对大肠杆菌感染后的抵抗力和发病情况,记录各组每日的体重变化。感染后,以3组出现精神沉郁、活动减少、体重下降、腹泻为临床检测指标,在感染7 d后剖检,观察各组小鼠的器官病变情况,称重并计算器官指数。
2.2.2 统计与分析
应用SPSS 11.5软件对试验数据进行统计分析处理,图片利用Graphad Prism软件绘制。
3 结果与分析
3.1 最大给药量试验
3.1.1 小鼠行为及体重变化
以人用剂量的500倍给药(最大给药量为0.75 g/kg)后,试验组小鼠在给药过程中,活动量减少;在给药后7 d内,试验组与对照组小鼠的精神、活动、食欲、排泄、皮毛等临床症状均无异常,也无其他中毒反应。在给药后7 d内,试验组与对照组小鼠的体重均有增长,差异不显著(见表1)。
表1 各组小鼠的体重(SD,n =10) g

表1 各组小鼠的体重(SD,n =10) g
组别第1天第3天第5天第7天 试验组25.72±1.3427.56±1.9529.47±2.0531.96±2.11 对照组26.23±1.2527.92±2.1229.64±1.9432.32±2.08
3.1.2 病理剖检观察
给药7 d后,剖检小鼠的肝、脾、肾、心,试验组与对照组相比,小鼠各脏器的形状、大小与色泽均正常,未见病变情况。试验组与对照组相比,小鼠的肝、脾、肾、心的器官指数差异不显著(见表2)。
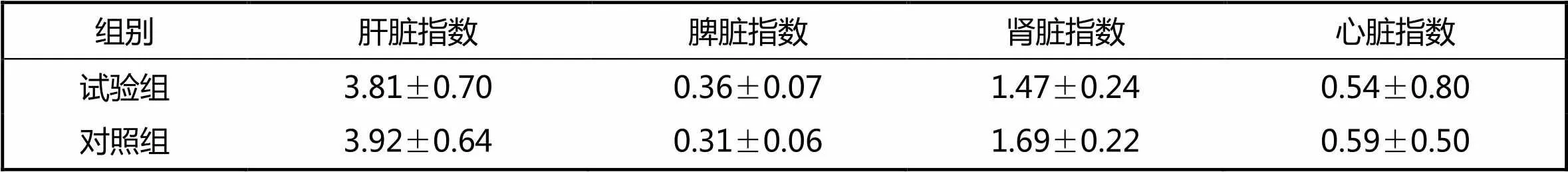
表2 各组小鼠的器官指数 %
3.1.3 病理组织学观察
给药7 d后试验组与对照组相比,小鼠的肝、脾、肾、心的病理组织学观察未见异常,差异不显著(见表3)。

表3 各组小鼠器官病理学检查结果
3.2 抗感染试验
3.2.1 体重变化
由图1可知,口服ATRA后,各组小鼠的体重呈显著上升趋势,各组体重差异不显著。感染后,即试验第8天,2组、3组、4组体重显著下降,之后缓慢上升,其中第2组体重恢复效果好于第1组和3组。

图1 体重的测定结果
3.2.2 器官指数
由图2可知,各组肝脏指数1组与2组相比,差异显著(<0.05),说明高剂量ATRA能够促进肝脏的生长发育;各组肾脏指数1组与3组相比,差异显著(<0.05),2组与3组相比,差异显著(<0.05),说明ATRA能够促进肾脏的生长发育;各组脾脏指数1组与3组相比,差异极显著(<0.01),2组与3组相比,差异极显著(<0.01),说明ATRA能够促进脾脏的生长发育,进而提高机体的免疫力。

图2 器官指数的测定结果
4 讨论
试验中ATRA在以人用剂量的500倍给药后未导致小鼠死亡,且小鼠均没有表现出中毒反应,剖检与病理组织学观察显示,各组小鼠的脏器均正常,表明ATRA的急性毒性较低,使用安全性良好。目前对于ATRA的临床应用主要是抗肿瘤疾病与发育生物学相关领域[5-6],与免疫相关的应用还有待进一步深入研究。
本试验中,经大肠杆菌感染后,口服ATRA的小鼠与未服用的小鼠相比,其脾脏器官指数差异极显著(见图2),说明ATRA能够促进免疫器官的生长发育,进而提高机体对抗大肠杆菌感染的能力;肝脏和肾脏器官指数也说明,ATRA能够促进相关器官的生长发育,对抗感染免疫有重要调节作用。此外,体重的变化也说明ATRA能够使机体更快地从细菌感染的情况中恢复。试验第8天即大肠杆菌感染第一天,1~3组的小鼠体重均明显下降,说明大肠杆菌经口感染会因胃肠道反应而使体重明显下降,而从感染第2天开始,1~3组的体重开始缓慢回升,其中体重回升速度2组快于1组,1组快于3组,说明ATRA能够帮助机体对抗肠道细菌感染,而且使用剂量以5 μmol/kg的效果要优于1 μmol/kg。研究表明,ATRA通过大量表达核视网膜酸受体产生信号,促进多种免疫细胞如先天性、适应性免疫细胞的发育和分化,从而增强系统性免疫应答[7]。ATRA在黏膜免疫反应中也发挥重要作用,促进皮肤和黏膜组织的内皮形成,能够使归巢到肠道和皮肤的淋巴细胞发生分化。因此,充足的ATRA对诱导T细胞表达肠归巢受体十分必要。同时,小鼠和人也需要充足的ATRA来诱导sIgA分泌型细胞的产生。研究发现,维生素A缺乏的小鼠在小肠缺乏T细胞和sIgA分泌型细胞,并且不能诱导嗜肠T细胞的归巢[8-10]。研究人员利用鼠伤寒沙门氏菌感染小鼠构建胃肠炎疾病模型,检测体重、肠道重量、促炎性反应因子(TNF-α、IL-6、IL-1β、IL-10、IL-17、IFN-γ等),表明ATRA可以减轻鼠伤寒沙门氏菌对小鼠的致病性,增强机体的抗菌能力[11],这与本次试验的结果相吻合。综上所述,ATRA能够提高机体免疫力,其安全性良好,具有较为明显的抗细菌感染作用,能够作为潜在的免疫佐剂或是免疫增强剂,未来可在兽医临床治疗以及疾病预防和控制中发挥重要作用。
[1] 王育盛,韩愈,杨剑,等. 全反式维甲酸对大鼠肠系膜动脉的舒张作用及其机制[J]. 中华高血压杂志, 2013,21(2):130-134.
[2] Kaufman D R,De Calisto J,Simmons N L,et al. Vitamin A Deficiency Impairs Vaccine-Elicited Gastrointestinal Immunity[J].,2011,187(4):1877-1883.
[3] 喻三红,夏明灿,王立新,等. 全反式维甲酸对基因免疫应答的调节作用[J]. 中华微生物学和免疫学杂志,2004,24(5):337-340.
[4] 韩旭,徐玉,夏新智,等. 不同配比关系的丙酮酸乙酯复方混悬剂在细菌感染模型中的比较研究[J]. 中国畜牧兽医,2014,41(9):216-220.
[5] Shah N N, Stonecypher M, Gopal P,et al. Acute promyelocytic leukemia presenting as a paraspinal mass[J].,2016,14(3):126-129.
[6] Tripathy S,Chapman J D,Han C Y,et al. All-Trans- Retinoic Acid Enhances Mitochondrial Function in Models of Human Liver[J].,2016,89(5):560-574.
[7] Svensson M,Johansson-Linbom B,Zapata F,et al. Retinoic acid receptor signaling levels and antigen dose regulate gut homing receptor expression on CD8 T cells[J].,2008,1(1):38-48.
[8] Hammerschmidt S I,Friedrichsen M,Boelter J,et al. Retinoic acid induces homing of protective T and B cells to the gut after subcutaneous immunization in mice[J].,2011,121(8):3051-3061.
[9] Eksteen B,Mora J R,Haughton E L,et al. Gut homing receptors on CD8+T cells are retinoic acid dependent and not maintained by liver dendritic or stellate cells[J].,2009,137(1):320-329.
[10] Uematsu S,Fujimoto K,Jang M H,et al. Regulation of humoral and cellular gut immunity by lamina propria dendritic cells expressing Toll-like receptor 5[J].,2008,9(7):769-776.
[11] Sinha R,Howlader D R,Mukherjee P,et al. Retinoic acid decreases the severity ofserovar Typhimurium mediated gastroenteritis in a mouse model[J].,2016,221(7):839-844.
责任编辑:张爱婷
Acute Toxicity and Anti-infection Effect of ATRA in Mice
REN Chao, YU Biao, LI Ru-jie, ZHUGE Zeng-yu, LI Liu-an, JIN Tian-mingCorresponding Author
(College of Animal Science and Veterinary Medicine, Tianjin Agricultural University, Tianjin 300384, China)
In order to study the acute toxicity of all-trans retinoic acid(ATRA)and its anti-infection effect in mice, the maximum dosage was used in ATRA acute toxicity experiment, while the clinical symptoms of mice were recorded for 7 days. Then acute toxicity of ATRA was studied by autopsy and histopathology observation. The mice infection model was established by oral infection withto study the anti-infection effect of ATRA by recording the clinical symptoms, autopsy lesions and organ index of infected mice for 7 days. The results showed that the mice had not abnormal response and pathological changes in autopsy and histopathological observation compared to the control group in the maximum dosage of ATRA(500 times of the clinical dosage in human). The weight was also of insignificant difference compared to the control group. At the same time, the high dose of ATRA in mice to regain the weight was better than the low dose group before infection with. Liver index, kidney index and spleen index by using ATRA were significantly different compared with control groups. ATRA had no acute toxicity in mice and was good for the growth of liver, kidney and spleen to improve the immunity and anti-infection effect, which can be used in clinical veterinary treatment and disease prevention and control.
ATRA; acute toxicity; anti-infection effect; mice;
1008-5394(2017)01-0019-04
S859.82
A
2016-04-03
天津农学院科技发展基金项目“ATRA对家禽免疫调节作用的研究”(2013N09);天津农学院高校教师教育改革创新引导发展项目“建立创新创业实训平台,培养卓越畜牧兽医人才”(20171003);天津农学院实验教学示范中心教学改革项目“基于TCRP教学模式的兽医学实验教学改革”(2015SY102);天津市自然科学基金面上项目“断奶日龄影响仔猪GH/IGF-I轴功能的分子机制研究”(13JCYBJC25300)
任超(1986-),女,天津市人,实验师,硕士,研究方向为基础兽医学。E-mail:chaoren04050110@163.com。
金天明(1968- ),男,内蒙古通辽人,教授,博士,研究方向为基础兽医学。E-mail:jtm680@163.com。
