构筑山羊卵母细胞体外成熟体系的研究
2017-04-10潘文平
潘文平,康 浩,康 永
(1.荔浦师范学校,广西 桂林 546600;2.南宁市第一中学,南宁 530012;3.西北工业大学,西安 710072)
构筑山羊卵母细胞体外成熟体系的研究
潘文平1,康 浩2,康 永3
(1.荔浦师范学校,广西 桂林 546600;2.南宁市第一中学,南宁 530012;3.西北工业大学,西安 710072)
在细胞核移植过程中,体细胞必须在卵母细胞内进行重编程以恢复其全能性,卵母细胞成熟度直接影响体细胞重编程,故卵母细胞体外成熟培养是体细胞核移植极其重要的环节,而卵母细胞又受环境、培养液浓度、培养温度等影响。文章通过探讨不同浓度的FSH和LH及HMG影响山羊卵母细胞体外成熟因素的研究,建立了山羊卵母细胞体外成熟体系,为山羊核移植及以后的优良育种奠定基础。
卵母细胞;FSH;LH;HMG;体外成熟;山羊
卵母细胞的成熟是一个复杂的、动态的过程,有许多代谢事件发生,除了进行积极的mRNAs转录、蛋白质合成外,还有其他一些物质的降解[1]。在体外成熟培养中,通常以第一极体排出来判断卵母细胞的成熟,其实这只是核成熟的标志。除了核成熟外,卵母细胞的胞质成熟也很重要,尤其是对用于核移植的卵母细胞而言,胞质的成熟直接关系到能否使供体核实现彻底的再程序化、重构胚能否维持正常的分裂发育[2]。从这个意义上说,目前所用的卵母细胞成熟体系还不尽完善,一些对卵母细胞成熟和后续发育非常重要的物质不能完全合成。卵母细胞体外成熟中应用最广泛、效果稳定的基础培养液是TCM199。在牛和猪上,TCM199中添加10%的血清、促性腺激素和雌激素,获得了90%的成熟率。小鼠卵母细胞的体外成熟在CZB及K-SOMaa中也可得到很好的效果。由于血清成分复杂,人们在合成培养液(如SOFM、KSOM)中添加BSA、PVA及氨基酸来替代血清,使卵母细胞成熟并能进行受精后的发育。
激素是卵母细胞成熟培养中必不可少的成分,特别是促性腺激素,它对细胞成熟的启动发挥主要作用。FSH和/或LH是成熟培养液中使用较多的促性腺激素[3]。FSH(卵泡刺激素)是调节卵泡发育的一种重要激素,它能促进颗粒细胞加速有丝分裂并分泌卵泡液,从而使卵泡能够成熟排卵。鉴于在卵泡发育过程中的重要作用,FSH被广泛应用于哺乳动物卵母细胞体外成熟培养,并证实能够促进卵母细胞周围卵丘细胞的扩展[4]。LH(黄体生成素)可使卵母细胞恢复减数分裂,成熟卵泡分泌前列腺素(PGF2a)。因排卵前卵泡卵母细胞的成熟分裂恢复与LH峰的时间基本一致,一般认为LH是卵母细胞体内成熟的诱导者。卵泡体外培养的研究结果亦表明,LH或HCG能诱导卵泡内卵母细胞成熟分裂的恢复[5]。因此,LH被广泛用于卵母细胞的体外成熟培养,并证实能提高卵母细胞成熟后的胚胎发育能力特别是在无血清的条件下。
另外,人们还通过添加一些生长激素(如GH、GHRH等)、生长因子(EGF、IGF-I、NGF、TGFb、激动素等)和其他添加物质如卵泡液、非离子型表面活性剂、副甲状腺素相关蛋白(PTHrP)、成熟分裂激活物(MAS)等来提高卵母细胞的体外发育和成熟。
本文通过探讨山羊卵母细胞在不同FSH、LH浓度下体外成熟的效果,建立山羊卵母细胞体外成熟培养体系,对山羊的繁殖、育种提供科学依据,同时为山羊的种质资源保护给予参考。
1 材料与方法
1.1 原料
山羊卵巢,采集于桂林某屠宰场;TCM199,上海联硕生物科技有限公司;链霉素,华北制药股份有限公司;青霉素,华北制药股份有限公司;表皮生长因子(SIGMAE -4127),上海昊海生物科技股份有限公司;转铁蛋白等三价因子(ITS):SIGMAI-1884,上海玉博生物科技有限公司;尿嘧啶:SIGMA,U-1128,北京寰宇科创生物科技发展有限公司;透明质酸酶:SIGMA,H3506,北京鼎丰基业生物科技发展有限公司;肝素钠,苏州市苏牧动物药业有限公司;核染色机:Hochest33342:SIGMA,B-2261,苏州市苏牧动物药业有限公司;BSA:SIGMA,A6003,上海浩洋生物科技有限公司;丙酮酸钠:SIGMA,P-4562,上海研谨生物科技有限公司;L-谷氨酰胺(L-Glutamine):SIGMA,G3126,上海联硕生物科技有限公司;LH:宁波第二激素厂;FSH:宁波第二激素厂;HMG,西宝生物科技(上海)股份有限公司。
1.2 主要仪器
倒置荧光显微镜:日本,OLMPUS,IX71;CO2培养箱:上海旦鼎国际贸易有限公司MM-02470-00;电热恒温板:美国CT-946B;离心机:上海安亭,KA-1000;电子天平:德国,METTLER;体视显微镜:麦克奥迪SMZ-168;电热恒温鼓风干燥箱:上海苏达实验仪器;双重纯水蒸馏器:上海亚荣生化仪器厂;超净工作台:江苏净化仪器制造厂;恒温水浴锅:北京长安科学仪器厂;超低温冰箱:美国,FORMA SCIENTIFIC;手术器械:山东新华医疗器械股份有限公司。
1.3 方法
1.3.1 卵丘-卵母细胞复合体的收集 山羊卵巢采集于牛羊屠宰场,从屠宰场刚宰杀的母羊体内剪下卵巢,保存在加有双抗(青霉素与链霉素)的30~35℃灭菌生理盐水的保温瓶中,4 h内运回实验室用于试验。用预温30~35℃的灭菌生理盐水清洗3遍卵巢,并用剪刀修剪,减去多余的脂肪和结缔组织,以减少对实验的干扰。将处理好的卵巢放入盛有采卵液的平皿中,用无菌手术刀片切开卵巢表面2~6 mm大小的卵泡,使之释放出卵泡液和COCs。用排卵针捡取卵丘-卵母细胞复合体,检出的COCs分为A、B、C三级:A级,卵丘细胞完整,卵母细胞胞质均匀;B级,卵丘细胞不完整,卵母细胞胞质均匀;C级,卵母细胞裸露,或胞质略有退化。选择A,B级进行培养。
采卵液:TCM199+1%FBS+100mg/mL肝素钠+100 IU/mL青霉素+100 IU/mL链霉素。
1.3.2 卵丘-卵母细胞复合体的体外成熟培养 将收集到的A、B级COCs用洗卵液清洗3~4次,然后置于预平衡2~3 h含1 mL成熟液的U型皿中,进行体外成熟培养。培养条件为38.5℃,5%CO2饱和湿度,培养22~24 h。
洗卵液:TCM199+2%FBS。
收集到的卵母细胞分8组,第一组用TCM199作为空白对照组,其他7组使用不同的培养液进行体外成熟培养,同一实验组重复3次。
对照组:TCM199。
基础成熟液:TCM199+10mg/mLBSA+1×ITS+50μg/mL尿嘧啶+2.5 mM谷氨酰胺+1 mM丙酮酸钠+50 μg/mL EGF+1 μg/mLβ-E2。
OMⅠ:基础成熟液+100 μg/mLFSH+20 μg/mLLH;
OMⅡ:基础成熟液+200 μg/mLFSH+40 μg/mLLH;
OMⅢ:基础成熟液+300 μg/mLFSH+60 μg/mLLH;
OMⅣ:基础成熟液+0.05 IU/mLHMG;
OMⅤ:基础成熟液+0.10 IU/mLHMG;
OMⅥ:基础成熟液+0.15 IU/mLHMG;
OMⅦ:基础成熟液+0.20 IU/mLHMG。
1.3.3 卵母细胞体外成熟效果判断 将成熟培养后的COCs置于含0.3%透明质酸酶的D-PBS液内,用移液器轻轻吹打以除去成熟卵母细胞表面的卵丘细胞。在体视显微镜下,以异物针拨动卵母细胞进行观察,观察第一极体是否排出,或使用含有Hochest33342的洗卵液染色,通过荧光显微镜观察是否有发光的极体分布于卵母细胞透明带以内。以排出第一极体的定为成熟,否则定为不成熟。
2 结果与讨论
2.1 FSH和LH对山羊卵母细胞体外成熟的影响
在成熟液中添加不同浓度的FSH和LH,对山羊卵母细胞体外成熟有不同程度的影响,COCs在体外培养22 h时,都可以观察到卵丘细胞不同程度的扩散(图1)。随着添加激素浓度的升高,卵丘细胞扩散度增加,其中扩散直径,空白对照(图1-A)<OMI(图1-B)<OMII(图1-C)<OMIII(图1-D)。但试验中发现,当激素FSH>300μg/mL,LH>60 μg/mL时,卵丘细胞的扩散直径不再增加,这表明,添加激素对山羊卵母细胞的卵丘细胞扩散有一定的影响作用。同时运用imageJ2x软件测定不同激素浓度下卵母细胞在卵丘细胞包裹中的投影,计算激素对卵母细胞的影响。测定结果运用SPSS软件分析,结果表明不添加激素的对照组的扩散距离与OMI、OMⅡ和OMⅢ的扩散距离均差异显著(P<0.05)。OMI、OMⅡ和OMⅢ的扩散距离间均差异不显著(P>0.05)。但OMⅡ中的卵母细胞扩增距离优于OMI和OMⅢ中的卵母细胞扩增距离,如图2所示。
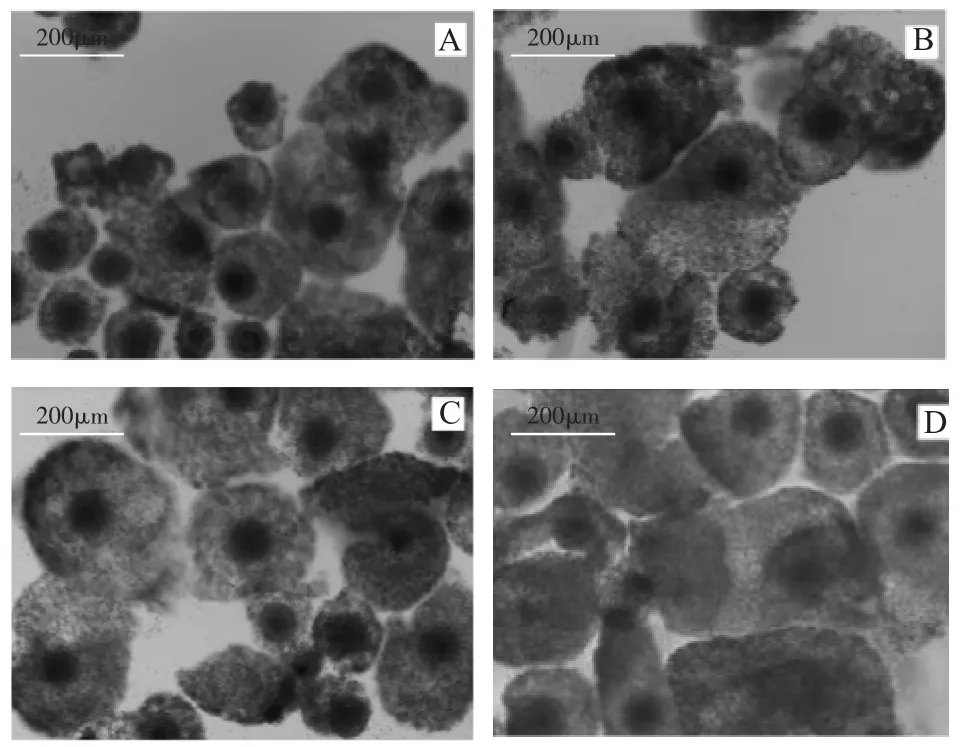
图1 FSH与LH对山羊卵丘-卵母细胞复合体扩散度的影响(100×)
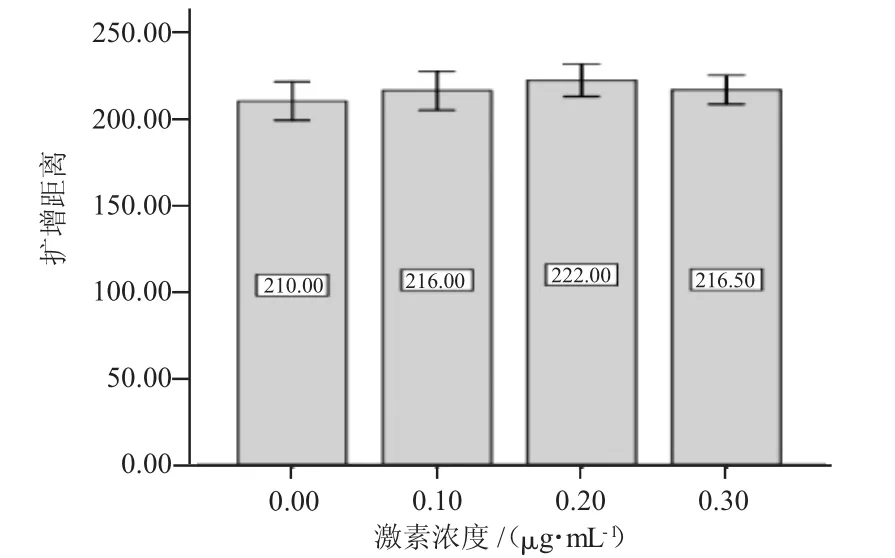
图2 不同FSH和LH激素浓度卵母细胞的扩增距离
由表1可知,在山羊卵母细胞成熟培养液中添加不同浓度的FSH和LH,对卵母细胞成熟率有不同的影响,成熟培养液中加入100μg/mLFSH和20μg/mLLH,成熟率57.9%,与对照组差异显著(P<0.05)。添加200 μg/mL FSH和40μg/mLLH的OMⅡ成熟率为68.8%,与对照组也差异显著(P<0.05)。添加300 μg/mLFSH和60 μg/mLLH的OMⅢ成熟率54.6%,与对照组同样差异显著(P<0.05)。且OMⅡ的成熟率与OMⅠ的成熟率和OMⅢ的成熟率间也差异显著(P<0.05)。说明在成熟液中添加适度浓度的FSH和LH对山羊卵母细胞体外成熟有着非常重要的影响,而过高的激素浓度对卵母细胞的成熟有抑制作用。

表1 不同FSH和LH浓度对山羊卵母细胞体外成熟的影响
2.2 HMG对卵母细胞体外成熟的影响
在卵母细胞体外成熟培养液中添加HMG(FSH∶LH≈1∶1)可替代FSH和LH激素的添加,不同HMG浓度也可促进COCs的扩散(图3),在培养22 h后卵丘细胞扩散直径表现为对照组(图3-A)<OMⅣ(图3-B)<OMⅤ(图3-C)<OMⅥ(图3-D)<OMⅦ(图3-E)。随着激素浓度的增加,扩散直径也在增加,但当浓度大于0.2 IU/mL时,扩散度不再增加。同样运用imageJ2x软件测定各组成熟液中的卵母细胞扩增距离显示,不加激素的对照组与添加激素的OMⅣ、OMⅤ、OMⅥ、OMⅦ各组中卵母细胞的扩增距离间差异显著(P<0.05)。添加激素的各组之间差异不显著(P>0.05)。如图4显示。
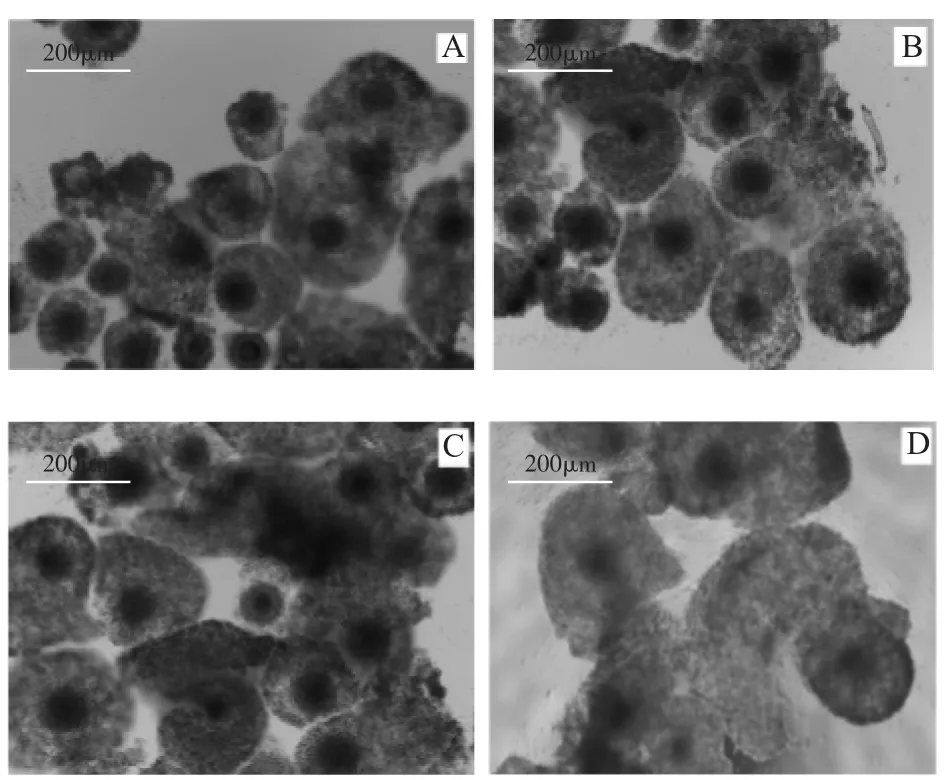
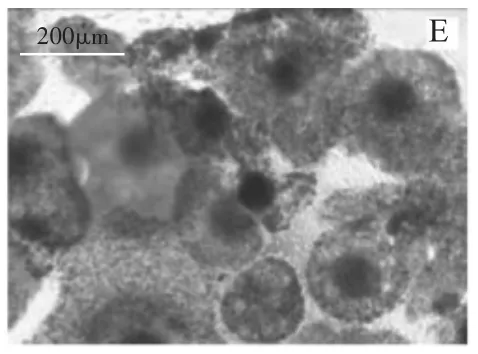
图3 HMG对卵丘-卵母细胞复合体(COCs)扩散的影响(100×)
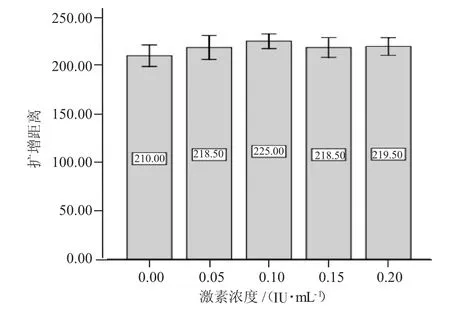
图4 不同HMG激素浓度卵母细胞的扩增距离
从表5山羊卵母细胞成熟率可看出:其中添加0.1 IU/mLHMG成熟液的成熟率为69.6%,与对照组差异显著(P<0.05)。这表明在成熟液中添加0.1IU/mLHMG有利于卵母细胞的成熟。而随着浓度的不断增加,成熟率逐渐下降,说明过多的HMG对山羊卵母细胞的成熟有抑制作用。
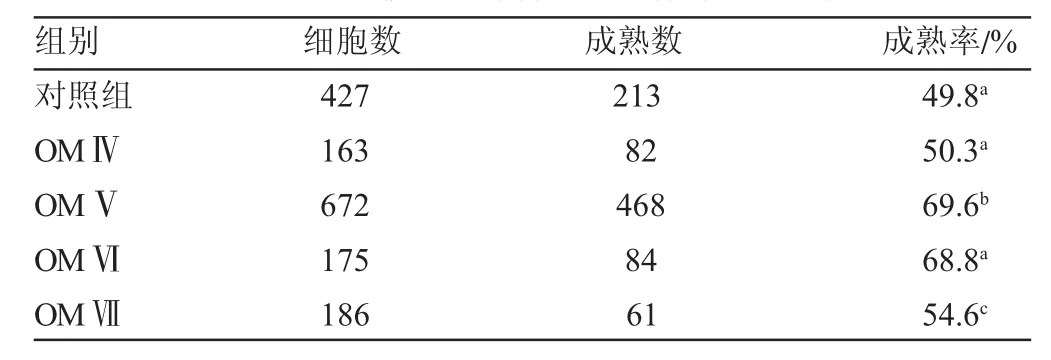
表5 HMG浓度对山羊卵母细胞体外成熟的影响
哺乳动物卵母细胞体外成熟培养技术是利用类固醇激素和促性腺激素在体外模拟卵泡的环境,进而诱发卵母细胞成熟的一项研究。在卵母细胞成熟过程中,促卵泡素FSH和促黄体素LH等促性腺激素具有协同作用,共同调节卵母细胞成熟。研究表明,在体外成熟卵母细胞培养中FSH能显著提高成熟率和早期胚胎的发育能力。其中FSH能诱导卵丘扩散、暂时抑制生发泡的存在,改变了减数分裂第一次所需的时间,从而促进了卵母细胞的体外成熟。LH也有类似作用,LH另一方面通过除去成熟分裂抑制因子激活卵母胞的减数分裂发生[6]。
FSH在卵泡发育中起至关重要的作用,它通过cAMP途径促进卵丘细胞增生并产生相应的LH受体[7],促使卵丘细胞膨散,通过刺激颗粒细胞分泌成熟促进物,直接或间接地作用于卵母细胞,启动卵母细胞成熟分裂[8]。将FSH加入培养基中促进人卵母细胞体外成熟,获得81%的成熟率[9]。对于LH,一般认为通过两条途径发挥作用:一是引起卵丘发生变化,促进卵丘细胞扩散,可以促进颗粒细胞上孕酮受体的表达及孕酮的产生,孕酮通过Connexin 43导致生发泡破裂(GVBD),便于精子通过卵丘细胞间隙到达透明带[10];二是显著增强了卵母细胞的存活力,降低了异常卵母细胞的数量,从而提高了卵母细胞的受精率[11]。
3 结论
本研究比较了FSH和LH配合使用或HMG单独使用时对山羊卵母细胞体外成熟的影响。结果表明,200 μg/mL FSH和40μg/mLLH配合使用对卵母细胞成熟的效果稍差于0.1IU/mLHMG的添加效果,这与有些研究结果略有不同,推断差异可能是由于激素的不同生产厂家造成的。
在本实验条件下,在不添加激素的情况下山羊卵母细胞同样会获得一定的成熟率。但在成熟培养过程中添加一定浓度的FSH和LH或HMG对山羊卵母细胞的第一极体排出有明显的促进作用,但浓度过高也会出现对山羊卵母细胞成熟率有抑制的表现。
[1]孙晓萍,郎侠,杨博辉,等.提高山羊繁殖性能的几种方法[J].畜牧与饲料科学,2010,31(3):91-92.
[2]Edwards R G.Maturation in vitro of mouse,sheep,cow,pig,rhesus,monkeyand human ovarian oocytes[J].Nature,1965,208:349-351
[3]武浩.小鼠、山羊交互异种核移植研究[D].陕西杨凌:西北农林科技大学,2004.
[4]石德顺,卢克焕.牛卵泡液对牛卵母细胞体外成熟的影响[J].广西农业大学学报,1994(13):1-5.
[5]徐建祥,周木清,陈小武,等.不同条件对牛卵母细胞体外成熟的影响[J].黑龙江动物繁殖,1996,4(2):13-14.
[6]谢常青,林戈,杨苏安,等.人类不成熟卵母细胞体外成熟影响的因素初探[J].生殖与避孕,2000,20(3):6-7.
[7]Masayuki S,Takato T.FSH and LH induce progesterone production and progesterone receptor synthesis in cumulus cells:a requirement for meiotic resumption in porcine oocytes[J].Molecular Human Reproduction,2002,8(7):612-618.
[8]R Roberts,AIatropoulou,DCiantar,et al.Follicle-stimulatinghormone affects metaphase I chromosome alignment and increases aneuploidy in mouse oocytes matured in vitro[J].BiologyofReproduction,2005,72(9):107-118.
[9]J K O'Brien,S L Catt,K A Ireland,et al.In vitro and in vivo developmental capacityofoocytesfromprepubertaland adultsheep[J].Theriogenology,1997,47:1433-1443.
[10]敖红,孙桂金,尹逊河,等.绵羊卵母细胞体外成熟的研究[J].中国草食动物,2006,26(6):14-16.
[11]赛务家甫.提高绵羊体细胞核移植效率的研究[D].陕西杨凌:西北农林科技大学,2007.
Study on In Vitro Maturation System of Goat Oocytes
Pan Wenping1,KangHao2,KangYong3
(1.Lipu Normal School,Guilin 546600,China;2.The First Middle School ofNanningCity,Nanning530012,China;3.Northwestern Polytechnical University,Xi’an 710072,China)
The oocyte in vitro maturation plays an extremely important role in somatic cell nuclear transfer,for it affects the reprogramming and totipotence of somatic cell directly.However,the oocyte in vitro maturation are affected by environment,mediumconcentration,culture temperature and soon.In this paper,the effects ofdifferentdensities ofFSH,LH,mixture ofFSH and LH,HMGon oocyte in vitro maturation in goatwere studied,and a systemofoocyte in vitro maturation was established,which would layafoundationforadvancedbreedingandnuclear transfer ofgoat.
oocyte;FSH;LH;HMG;in vitro maturation;goat
S827.3
A
2095-3887(2017)02-0004-04
10.3969/j.issn.2095-3887.2017.02.002
2017-01-04
潘文平(1983-),女,本科,从事生物教学及新型生物材料应用研究。
康永,男,博士,从事生物复合材料研究。
