姜黄素通过影响NF-κB信号通路促进肺癌细胞的放射敏感性
2017-03-10李晓波
李晓波,徐 芳
(山东省滕州市枣庄科技职业学院医学系 277500)
论著·基础研究
姜黄素通过影响NF-κB信号通路促进肺癌细胞的放射敏感性
李晓波,徐 芳
(山东省滕州市枣庄科技职业学院医学系 277500)
目的 探讨姜黄素联合放射治疗对肺癌NCI-H460细胞的活性及肺癌小鼠放射敏感性的影响。方法 把肺癌NCI-H460细胞分为4组:空白对照组、姜黄素组、γ射线组及γ射线照射与姜黄素的联合组;然后对各组分别应用噻唑蓝(MTT)检测细胞增殖,Annexin-V/PI染色法检测细胞周期分布及凋亡,Western blot检测凋亡相关蛋白Bcl-2及Bax的表达,RT-PCR 检测核因子κB(NF-κB)基因表达情况。另外,建立小鼠肺癌模型同样分为对应的4组,姜黄素按照1 mg/kg经尾静脉注射于小鼠,肿瘤局部进行剂量为5 Gy射线照射,处理28 d后,比较不同处理组小鼠瘤体体积。结果 与空白对照组、姜黄素组和γ射线组比较,联合组NCI-H460增殖率明显降低(P<0.05),凋亡率明显增加(P<0.05),抑凋亡蛋白Bcl-2表达明显降低(P<0.05),促凋亡蛋白Bax表达明显增高(P<0.05),NF-κB mRNA表达明显降低(P<0.05),并且肿瘤的体积有明显减少(P<0.05)。结论 姜黄素可通过抑制γ射线处理条件下NF-κB的表达并促进细胞的G2/M期阻滞来增强肺癌NCI-H460细胞对γ射线的敏感性。
姜黄素;γ射线;细胞增殖;NF-κB;辐射耐受性
目前我国约有70%以上的肿瘤患者需要放疗,并且对于许多肺瘤患者而言,放疗是可用的治疗方法之一[1]。但肺瘤患者往往在放疗过程中出现抵抗,从而导致治疗效果不理想[2-3]。因此,如何提高肺癌的放疗敏感性,改善患者生活质量是目前急需解决的问题。
姜黄素(curcumin)是我国传统中药姜黄的主要活性成分。其主要成分包括多种调控生长因子,趋化因子及转录因子等,因此具有抗炎、抗氧化、抗凝、降血脂等多方面生物功能[4]。研究显示,姜黄素可抑制体内、外肿瘤细胞的生长,是一种具有良好应用前景的抗癌新药[5]。体外研究发现,姜黄素通过抑制(NF-κB)信号通路增强肿瘤细胞的放射敏感性[6-8]。但姜黄素能否增强肺癌的放疗敏感性,目前还不清楚。本研究选用肺癌NCI-H460细胞系为研究对象,研究姜黄素对肺癌NCI-H460细胞放疗敏感性的影响,为探索肺癌治疗的新途径提供实验依据和理论基础。
1 材料与方法
1.1 实验材料
1.1.1 实验动物来源 小鼠Lewis肺癌瘤系,购自北京协和细胞资源中心。C57BL/6纯系小鼠,雄性,鼠龄4~6周,体质量16~22 kg,购自北京大学第一医院实验动物中心。
1.1.2 实验试剂和仪器 姜黄素(上海同田生物技术公司), RPMI-1640培养基、胎牛血清(FBS)、胰蛋白酶(美国Gibco公司),二甲基亚砜(DMSO,天津市天力化学试剂有限公司),青霉素钠和链霉素(华北制药有限责任公司),噻唑蓝(MTT,美国Sigma公司),二乙基亚硝胺(天津化学试剂研究所),Trizol(美国Invitrogen公司),流式细胞仪(美国BD公司),抗体Bcl-2、Bax(Cell Signal公司),Annexin V-FITC/PI凋亡检测试剂盒(美国BD公司),Spectra MR型酶标仪(美国Dynex公司)。
1.2 方法
1.2.1 NCI-H460细胞的γ射线照射条件 在室温下采用60 Co γ 射线全身一次性照射,吸收剂量率1.701 Gy/min,一次性给予NCI-H460细胞5 Gy的吸收剂量。
1.2.2 NCI-H460的培养及传代 采用含10%新生牛血清的RPMI-1640完全培养液,调整细胞密度为5×105个/mL接种于培养瓶中,待细胞长至80%~90%密度时,按比例传代。实验时取生长状况良好的对数生长期细胞,分为空白对照组、γ射线组(5 Gy)、姜黄素组(10 μmol/L)和γ射线联合姜黄素的联合组(5 Gy射线联合10 μmol/L姜黄素)。
1.2.3 细胞增殖实验 采用MTT法检测细胞增殖。取对数生长期NCI-H460细胞,调整细胞浓度为1.0×104个/mL,接种于48孔培养板中,按照试验分组采用10 μmol/L姜黄素及5 Gy γ射线分别处理48 h,弃去培养基,每孔加入50 μL MTT,37 ℃继续培养4 h,加200 μL DMSO,使甲瓒结晶完全溶解,酶标仪以参考波长630 nm,测量波长490 nm处的各孔的吸光度值(A)。实验重复3次取平均值,计算细胞增殖活性。计算公式为细胞增殖抑制率(%)=(对照组A值-实验组A值)/对照组A值×100%。
1.2.4 细胞凋亡实验 应用PI和Annexin V染色的方法检测细胞凋亡。取对数生长期NCI-H460细胞,接种于6孔培养板中。根据分组加入10 μmol/L姜黄素及5 Gy γ射线分别处理48 h。收集细胞及其上清液,1 000 r/min离心5 min后弃上清液,用预冷PBS将沉淀细胞清洗3遍,然后加入500 μL的 Binding Buffer悬浮细胞;加入5 μL Annexin V-FITC混匀后,加入5 μL Propidium Iodide混匀,室温避光反应15 min;1 h内流式细胞仪检测。FITC阳性代表细胞凋亡发生,PI阳性代表细胞死亡。
1.2.5 细胞凋亡蛋白分析实验 应用蛋白免疫印迹(Western blot)方法检测凋亡相关蛋白的表达。取上述收集的细胞接种于6孔板中,根据实验设计分组加入姜黄素及γ射线处理48 h后收集细胞。提取蛋白质,进行15%聚丙烯酰胺凝胶电泳分离蛋白。半干转膜至聚偏氟乙烯(PVDF)膜上,脱脂奶粉封闭1 h;分别加入一抗Bcl-2(1∶500)和Bax(1∶500),4 ℃摇床孵育过夜;洗膜液清洗3次(每次10 min),加入二抗(1∶5 000)室温孵育3 h;洗膜液清洗3次(每次10 min),用ECL发光显色后在X射线洗片机(HQ 320XT)上曝光检测,采用Quantity-One 4.6.2软件进行图像分析,以β-actin作为内参。
1.2.6 细胞周期分析实验 按照上述分组,取对数生长期NCI-H460细胞,接种于6孔板中,根据实验设计分组加入姜黄素及γ射线分别处理48 h后,收集细胞。用70%冰乙醇悬浮,吹打均匀,4 ℃放置12 h,PBS洗涤去乙醇,加入0.5 mL PBS重悬细胞,加入RNaseA至终浓度100 μg/mL,37 ℃ 温浴30 min。加入PI至终浓度50 μg/mL室温孵育30 min,采用流式细胞仪检测细胞周期。
1.2.7 mRNA表达水平的分析 采用RT-PCR检测NF-κB mRNA表达水平,按照上述分组,取对数生长期NCI-H460细胞,接种于6孔板中,根据实验设计分组加入姜黄素及γ射线处理48 h,收集细胞。采用Trizol法提取细胞总mRNA,使用反转录试剂盒合成cDNA模板。采用RT-PCR分析NF-κB mRNA表达水平的变化。RT-PCR反应条件:94 ℃ 5 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 45 s;72 ℃ 8 min。产物经1%琼脂糖凝胶电泳分离,0.5%溴化乙锭(EB)染色后,凝胶成像仪观察图像,分析各组间mRNA表达水平的差异。
1.2.8 C57BL/6小鼠Lewis肺癌模型建立及体内给药、获取标本 将小鼠Lewis肺癌瘤系制备成单细胞悬液,在小鼠右后肢皮下接种瘤细胞悬液,1×107个/只。将40只荷瘤小鼠随机分为4个组,分为空白对照组、γ射线组(5 Gy)、姜黄素组(1 mg/kg)和γ射线联合姜黄素的联合组(5 Gyγ射线联合1 mg/kg姜黄素)。姜黄素按照1 mg/kg经尾静脉注射于小鼠,肿瘤局部进行照射,照射剂量为15 Gy,治疗后28 d,分别将小鼠处死获取肿瘤组织,标本冻存于-20 ℃冰箱。用游标卡尺测量各组小鼠肿瘤长径(a)及短径(b),计算肿瘤平均体积。肿瘤体积计算公式:肿瘤体积(mm3)=a×b2/2。

2 结 果
2.1 MTT法测定姜黄素与γ射线对NCI-H460细胞增殖的影响 从图1可以看出,空白对照组NCI-H460细胞增殖活跃,而经过10 μmol/L姜黄素、5 Gy的γ射线或γ射线联合姜黄素处理48 h后姜黄素组,γ射线组,联合组,细胞的增殖均受到不同程度的抑制,其中联合组对细胞增殖活性抑制最明显,差异有统计学意义(P<0.05)。
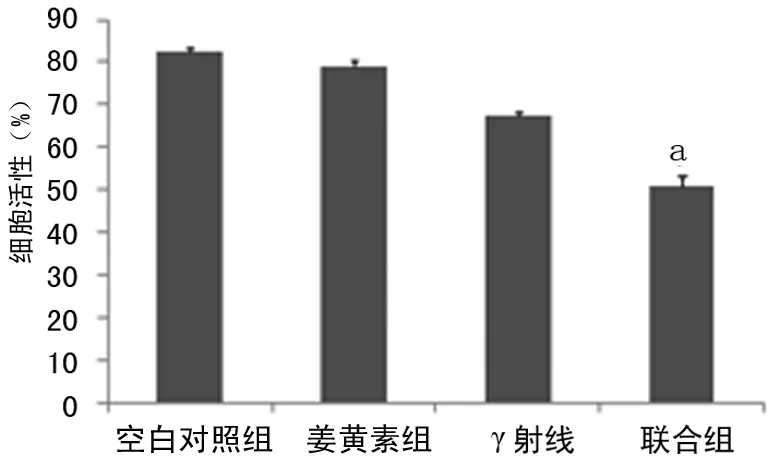
a:P<0.05,与其余各组比较。
图1 姜黄素和γ射线对NCI-H460细胞增殖活性的影响
2.2 流式细胞术检测γ射线与姜黄素对NCI-H460细胞凋亡率的影响 与空白对照组[(2.29±0.08)%]相比,γ射线组[(2.29±0.73)%]或姜黄素组[(2.41±0.59)%]细胞凋亡率有轻微增加,差异无统计学意义(P>0.05);而联合组[(215.21±0.32)%]明显促进细胞凋亡,与空白对照组比较,差异有统计学意义(P<0.05)。
2.3 γ射线与姜黄素对NCI-H460细胞周期的影响 流式细胞仪检测细胞周期的结果表明,γ射线组或姜黄素组G2/M期细胞增多,但与空白对照组比较,差异无统计学意义(P>0.05)。而联合组与对照相比较则可明显提高G2/M期细胞比例,差异有统计学意义(P<0.05),见表1。
表1 姜黄素和γ射线对NCI-H460 细胞周期的影响
a:P<0.05,与其余各组比较。
2.4 γ射线与姜黄素对NCI-H460细胞凋亡相关蛋白表达的影响 与对照组比较,联合组NCI-H460细胞内抗凋亡蛋白Bcl-2的表达明显降低,促凋亡蛋白Bax的表达明显升高(P<0.05),而γ射线和姜黄素单独处理则对Bcl-2和Bax蛋白的表达无显著影响,见图2。
A:Bcl-2蛋白表达;B:Bax蛋白表达;1:空白对照组;2:联合组;3:姜黄素组;4:γ 射线组。
图2 姜黄素和γ射线对NCI-H460细胞凋亡蛋白表达的影响
2.5 γ射线与姜黄素对NCI-H460细胞NF-κB mRNA表达的影响 与空白对照组比较,联合组NCI-H460细胞NF-κB mRNA的表达明显增加(P<0.05),而γ射线或姜黄素单独处理对NF-κB的表达无显著影响,见图3。
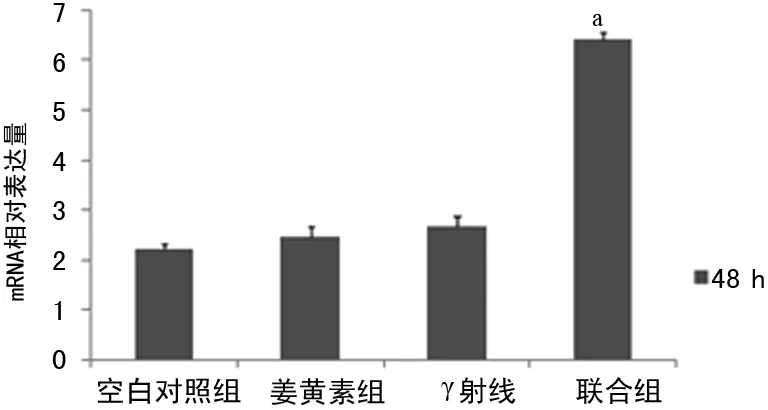
a:P<0.05,与其余各组比较。
图3 姜黄素和γ射线对NCI-H460细胞NF-κB mRNA表达的影响
2.6 γ射线与姜黄素对肺癌小鼠肿瘤体积的影响 C57BL/6小鼠经过接种肺癌肿瘤细胞两周后肿瘤直径增至5~8 mm时,根据分组,对小鼠进行相对应的治疗,与空白对照组相比,联合组明显抑制肿瘤的生长(P<0.05),见图4。
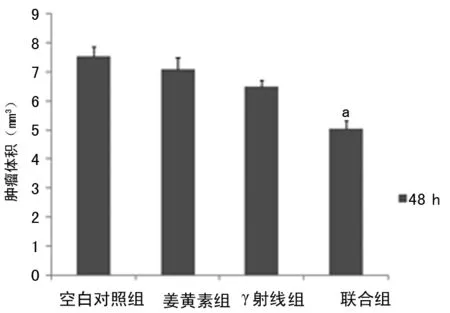
a:P<0.05,与其余各组比较。
图4 姜黄素和γ射线对肺癌小鼠肿瘤体积的影响
3 讨 论
肺癌逐渐成为危害人类生命的一种主要疾病之一。近年来许多学者尝试采用常规的化疗药等来增加放射治疗的效果[9-10]。尽管在某些情况下这种方法可以引起更好的治疗效果,但受到特定了一些因素的限制,包括增加的毒性反应,正常组织的损伤,增加的不良反应等,因此获得最小毒性的放疗增敏剂对肺癌患者至关重要。
目前中药放射敏感性的研究较少,探索中药在此方面的作用具有重要意义,姜黄素便是其中之一。研究发现,姜黄素在达到12 mg/d的剂量时,无明显的不良反应出现。也有研究发现,姜黄素对结肠癌具有预防作用[11]。本实验研究姜黄素对肺癌NCI-H460细胞放疗增敏的影响。结果发现,经过10 μmol/L姜黄素处理肺癌细胞,再进行5 Gy γ射线处理,能够明显抑制细胞增殖,增加细胞凋亡及促进促凋亡相关蛋白Bax的表达,抑制抑凋亡相关蛋白Bcl-2的表达。说明姜黄素可增强肺癌NCI-H460细胞对γ射线的敏感性。此外,肺癌动物模型结果显示,γ射线与姜黄素联合处理可明显抑制肿瘤生长,说明联合治疗能起到很好的抑瘤效果。
大量的研究表明,NF-κB与肿瘤的放射耐受性密切相关。例如,在恶性胶质瘤、乳腺癌、膀胱癌、食道上皮细胞癌中均发现放射激活了 NF-κB,而激活的NF-κB可保护细胞免受放射影响而死亡,从而在细胞放射耐受性上起作用[12-13]。相反,通过对NF-κB的抑制可增加放射敏感性,主要表现为DNA 结合能力减弱、 凋亡增加,或细胞生长和克隆源生存下降[6,14-16]。本次研究发现,经过姜黄素和γ射线处理肺癌细胞后,显著抑制NF-κB mRNA表达水平,提示姜黄素可能是通过抑制NF-κB的表达增强肺癌细胞放疗敏感性。另外,NF-κB可控制细胞周期调控基因如 C-MYC、Cyclin D1的表达,从而使G1期及 S 期细胞增加,而G1/S 期、G2/M 期细胞减少[17]。而诱导肿瘤细胞G2/M期阻滞是影响肿瘤细胞放射敏感性的重要原因[18]。本次研究也发现,经过姜黄素和γ射线处理后的肺癌细胞,可导致细胞的G2/M期阻滞,从而进一步说明姜黄素是通过抑制NF-κB的表达,并进而诱导肿瘤细胞G2/M期阻滞达到增强肺癌细胞放疗敏感性。
综上,本研究发现姜黄素能够增强肺癌细胞系NCI-H460的放疗敏感性,而这种作用可能与其对NF-κB活性的抑制相关。本研究为姜黄素应用肺癌的增敏治疗提供了新的实验依据,为其在临床中的应用奠定了基础。
[1]Haslett K,Pöttgen C,Stuschke M,et al.Hyperfractionated and accelerated radiotherapy in non-small cell lung cancer[J].J Thorac Dis,2014,6(4):328-335.
[2]Brindley DN,Lin FT,Tigyi GJ.Role of the autotaxin-lysophosphatidate axis in cancer resistance to chemotherapy and radiotherapy[J].Biochim Biophys Acta,2013,1831(1):74-85.
[3]Glide-Hurst CK,Chetty IJ.Improving radiotherapy planning,delivery accuracy,and normal tissue sparing using cutting edge technologies[J].J Thorac Dis,2014,6(4):303-318.
[4]Gupta SC,Patchva S,Koh W.et al.Discovery of curcumin,a component of golden spice,and its miraculous biological activities[J].Clin Exp Phamacol Physiol,2012,39(3):283.
[5]Sharma RA,Gescher AJ,Steward WP.Curcumin:the story so far[J].Eur J Cancer,2005,41:1955-1968.
[6]Aggarwal BB,Kumar A,Bharti AC.Anticancer potential of curcumin:preclinical and clinical studies[J].Anticancer Res,2003,23:3633-3698.
[7]Mörth C,Valachis A.Single-agent versus combination chemotherapy as first-line treatment for patients with advanced non-small cell lung cancer and performance status 2:a literature-based meta-analysis of randomized studies[J].Lung Cancer,2014,84(3):209-214.
[8]Asai N,Ohkuni Y,Kaneko N.Relapsed small cell lung cancer:treatment options and latest developments[J].Ther Adv Med Oncol,2014,6(2):69-82.
[9]Cruz-Correa M,Shoskes DA,Sanchez P,et al.Combination treatment with curcumin and quercetin of adenomas in familial adenomatous polyposis[J].Clin Gastroenterul Hepatol,2006,4(8):1035-1038.
[10]Berger R,Jennewein C,Marschall V,et al.NF-κB is required for Smac mimetic-mediated sensitization of glioblastoma cells for γ-irradiation-induced apoptosis[J].Mol Cancer Ther,2011,10(10):1867-1875.
[11]MinevaND,WangX,YangS,etal.InhibitionofRelBby1,25-dihydroxyvitaminD3promotessensitivityof breast cancer cells to radiation[J].J Cell Physiol,2009,220(3):593-599.
[12]Koga F,Yoshida S,Tatokoro M,et al.Erb B2 and NFκB overex-pression as predictors of chemoradiation resistance and putative targets to overcome resistance in muscle-invasive bladder cancer[J].PLoS One,2011,6(11):e27616.
[13]Chen MF,Lu MS,Chen PT,et al.Role of interleukin 1 beta in esophageal squamous cell carcinoma[J].J Mol Med (Berl),2012,90(1):89-100.
[14]Munshi A,Kurland JF,Nishikawa T,et al.Inhibition of constitutively activated nuclear factor-kappa B radiosensitizes human melanoma cells[J].Mol Cancer Ther,2004,3(8):985-992.
[15]Locke JE,Bradbury CM,Wei SJ,et al.In domethacin lowers the threshold thermal exposure for hyperthermic radiosensitization and heat-shock inhibition of ionizing radiation-induced activa-tion of NF-kappa B[J].Int J Radiat Biol,2002,78(6):493-502.
[16]Russo SM,Tepper JE,Baldwin AS Jr,et al.Enhancement of radiosensitivity by proteasome inhibition: implications for a role of NF-kappa B[J].Int J Radiat Oncol Biol Phys,2001,50(1):183-193.
[17]Li X,Liu D,Liu X,et al.Cp G ODN107 potentiates radiosensitivity of human glioma cells via TLR9-mediated NF-κB activation and NO production[J].Tumour Biol,2012,33(5):1607-1618.
[18]Qiao Q,JiangY,Li G.Curcumin improves the antitumor effect of X-ray irradiation by blocking the NF-κB pathway:an in-vitro study of lymphoma[J].Antieancer Drugs,2012,23(6):597-605.
Curcumin induce the radiosensitivity of human lung carcinoma NCI-H460 cells through the NF-κB pathway
LiXiaobo,XuFang
(DepartmentofMeolicme,VocationalCollegeofScienceandTechnology,Tengzhou,Shandong277500,China)
Objective To study the combination effect of curcumin and γ ray on the activity of human lung carcinoma NCI-H460 cells and explore the sensitization of curcumin to γ ray.Methods The NCI-H460 cells proliferation were detected by MTT,the cell cycle and apoptosis by flow cytometry.The expression of Bcl-2 and Bax were detected by Western Blot and the NF-κB gene expression by RT-PCR.In addition,the mice model of lung cancer was randomly divided into 4 groups:control group,curcumin group,γ ray group and combination group.After 28 days,the tumor volume was measured.Results The proliferation and cell cycle of NCI-H460 cells were inhibited and the apoptosis was increased in combination group.In addition,compared with curcumin group or γ ray group,the expression of Bcl-2 was inhibited,but the expression of Bax was increased and the mRNA expression of NF-ΚB was inhibited in combination group(allP<0.05).Also in combination group the tumor volume was significantly inhibited compared with curcumin group or γ ray group(allP<0.05).Conclusion Curcumin might induce the radiosensitivity of Human Lung Carcinoma NCI-H460 cells through the pathway.
curcumin;γ ray;cell proliferation;NF-κB;radiation tolerance
李晓波(1980-),讲师,硕士,主要从事基础医学研究。
10.3969/j.issn.1671-8348.2017.06.009
R734.2
A
1671-8348(2017)06-0749-03
2016-10-19
2016-11-17)
