伊洛前列素对低氧性肺动脉高压大鼠肺部内皮素-1表达的影响*
2017-03-10陈世雄向光明高宝安
官 莉,金 柱,陈世雄,向光明,高宝安
(三峡大学呼吸病研究所/湖北省宜昌市中心人民医院呼吸内科,湖北宜昌 443003)
论著·基础研究
伊洛前列素对低氧性肺动脉高压大鼠肺部内皮素-1表达的影响*
官 莉,金 柱,陈世雄,向光明,高宝安△
(三峡大学呼吸病研究所/湖北省宜昌市中心人民医院呼吸内科,湖北宜昌 443003)
目的 探讨伊洛前列素对低氧性肺动脉高压(HPH)大鼠肺部内皮素-1(ET-1)的影响。方法 雄性SD大鼠32只,分为正常(NC)组,正常治疗(NT)组,低氧(HC))组,低氧治疗(HT)组,每组8只。NC组和NT组在常氧条件下饲养 3周;HC和 HT组放置于低氧舱(O2浓度10%)进行缺氧处理 3周(8 h/d);NT和HT组每天进行伊洛前列素雾化吸入治疗(2 μg/kg)。第3周结束时,测量各组平均肺动脉压(mPAP),右心室收缩期末压力(RVSP),右心室肥厚指数。HE染色观察各组肺动脉形态学变化,计算肺小动脉的血管壁厚百分比(WT%),RT-PCR分析各组肺组织匀浆中ET-1的变化趋势。结果 HC组大鼠血流动力学指标较其他组明显升高,HT组相关指标表达与NC组比较差异无统计学意义(P>0.05)。HC组较其他组肺动脉管壁增厚、管腔狭窄明显;HT组则有不同程度逆转。HC组大鼠肺组织匀浆中ET-1表达较NC组明显升高,HT组中ET-1表达与NC组比较差异无统计学意义(P>0.05)。结论 伊洛前列素对HPH有明显的治疗作用,可以降低HPH大鼠肺部ET-1的释放,阻止肺血管重塑。
高血压,肺性;缺氧;伊洛前列素;内皮素-1
肺动脉高压(pulmonary arterial hypertension,PAH)是一种复杂的,由遗传因素及多种病因引起的病理过程[1]。低氧性肺动脉高压(hypoxic pulmonary artery hypertension,HPAH)是属于PAH分类的第三大类,由高原疾病或肺部疾病所致的慢性持续缺氧诱发,有着很高的病死率[2]。HPAH特点是异常的肺血管收缩(hypoxic pulmonary vasoconstriction,HPV)和肺血管重塑(pulmonary artery remodeling,PAR)。这两个过程导致肺血管阻力逐步增加,最终致使患者右心衰竭而死亡[3]。长时间持续性缺氧诱导会使血管内皮细胞受损,导致其合成和分泌各种血管舒缩因子失调。在病变早期引起HPV,后期则导致不可逆PAR。PAR是HPAH持续发展的关键因素,而内皮损伤及功能紊乱是血管重塑的起点。如何逆转和减轻PAR,一直以来就是医学研究的热点和难点[4]。内皮素-1 (endothelin-1,ET-1)是调节心血管功能的重要因子,对维持基础血管张力与心血管系统稳态起重要作用,是已知最强缩血管物质。低氧时内皮细胞功能失衡,ET-1显著增加,诱发PAR[5]。伊洛前列素是类前列环素药物,与前列环素受体有良好的亲和力,有超强的选择性扩张肺血管作用。吸入型伊洛前列素在国内外已经用于治疗原发PAH[6-7],但其在低氧性PAH动物模型中的疗效报道很少。资料显示前列环素类药物可拮抗ET的生成和分泌,改善血管内皮功能紊乱。伊洛前列素对HPAH有效性及其对ET-1的影响是本研究的重点。本实验通过建立HPAH大鼠模型,研究伊洛前列素对动物HPAH的治疗作用,以及伊洛前列素对大鼠肺组织ET-1在低氧环境中分泌合成的影响,为HPAH的治疗和新药开发提供新的实验依据。
1 材料与方法
1.1 材料 雄性 6 周龄SD 大鼠 32 只,体质量 200~250 g,健康无疾病,由三峡大学医学院实验动物中心提供。吸入用伊洛前列素溶液 (2 mL∶20 μg,西班牙Bayer Pharma AG公司),兔抗大鼠ET-1多克隆抗体(美国Genetex公司),低氧舱(Oxycycler model A84XOV,美国Biospherix公司),Nikon & Spot图像采集处理系统(日本Nikon公司),RM-6280多道智能生理信号记录系统(成都仪器厂),鱼跃牌403C压缩空气式雾化器(中国江苏鱼跃医疗设备股份有限公司),总RNA提取试剂盒(美国Life Technologies公司),cDNA第一链合成试剂盒(美国Axygen Biosciences公司),定量PCR试剂盒(美国Axygen Biosciences公司)。
1.2 方法 通过血流动力学测定及肺动脉形态学测量血管壁厚百分比(pencent wall thitkness,WT%)验证造模是否成功。
1.2.1 大鼠HPAH模型的建立及分组 32只大鼠采用随机数字表法均匀分为 4 组:正常组(NC组),正常治疗组(NT组),低氧组(HC组),低氧治疗组(HT组),每组8只。每组平均体质量差异无统计学意义(P>0.05)。NC和NT组在常氧条件下饲养3周;HC组和HT组置入一体化低氧舱中,调节氧气(O2)浓度恒定为10%,每天 8 h,持续 3 周;NT组和HT组每天置入一大小为30 cm×20 cm×20 cm亚克力密闭容器内雾化吸入治疗,伊洛前列素加入氧气雾化器中按 220 ng·kg-1·h-1剂量雾化吸入,氧流量为 3 L/min(折算氧浓度为33%)每次持续 7.5 min,每次伊洛前列素总剂量达 1 μg/kg,每天早晚各1次,持续 3 周。所有实验动物均自由摄取食水。
1.2.2 血流动力学测定 在第3周末对所有大鼠进行处理,10% 水合氯醛腹腔注射(0.3 mL/100 g)麻醉后进行固定,开放颈部,内充肝素溶液(生理盐水+肝素10 U/mL)的聚乙烯塑料微导管(直径1 mm)缓慢插入右侧颈外静脉,导管另外一端连接压力传感器以便监测压力变化。由血管走行方向及压力波形引导,导管途经上腔静脉进入右心房、三尖瓣口、右心室,直至肺动脉干,待波形稳定后测量平均肺动脉压(mPAP)及右心室收缩期末压力(RVSP),RM-6280多道生理信号采集处理系统采集记录信号。测压结束后,解剖出大鼠心脏,剪去心房组织,分离出右心室(RV)和左心室+室间隔(LV+S)后滤纸吸干,称量RV和LV+S的质量,计算右心肥厚指数,右心肥厚指数=RV/(LV十S)。
1.2.3 肺动脉形态学指标观察 各组大鼠处死后,从右肺下叶相同部位取一组织块,放置于中性甲醛溶液(100 g/L,pH=7.4)固定1周时间。标本石蜡包埋、连续切片及 HE 染色,于400倍光镜下观察中小肺动脉(管径:>15~<150 μm)的形态变化。应用Nikon&Spot图像采集处理系统分析计算血管WT%,公式:(外弹力膜直径-内弹力膜直径)/外弹力膜直径×100%。每组大鼠测量10个中型肺动脉及小型肺动脉取其均值。
1.2.4 ET-1表达检测 使用逆转录PCR(RT-PCR)技术检测肺组织中ET-1表达变化。ET-1正向引物5′-TGC TCC TGC TCC TTG AT-3′ 和反向引向5′-TGG TCT GTG GTC TTT GTG GG-3′。将肺组织标本剪成小块放入装满液氮的研钵中匀浆,使用总RNA提取试剂盒提取总RNA,提取成功后,使用cDNA第1链合成试剂盒进行逆转录,定量PCR试剂盒进行PCR扩增检测,具体步骤为预变性 95 ℃1 min; 95 ℃15 s,58 ℃ 20 s,72 ℃ 20 s,40个循环;末段延伸 72 ℃ 5 min;溶解曲线72~95 ℃,每 20 s 升温1 ℃,得到结果后对扩增曲线进行分析。

2 结 果
2.1 血流动力学指标的测定 HC组mPAP较NC组[(14.6±3.7)mm Hg]和NT组[(14.5±2.5)mm Hg]显著升高(P<0.05),HT组[(17.1±2.1)mm Hg]相对于HC组明显降低(P<0.05)。HC组[(47.5±5.9)mm Hg]RVSP高于NC组[(28.6±2.1)mm Hg]及NT组[(29.1±1.8) mm Hg,P<0.05],亦高于HT组[(35.2±3.0)mm Hg,P<0.05],见图1B。HC组右心肥厚指数也反映了同样的趋势,HC组(36.7±2.4)%,NC组(23.8± 4.9)%,NT组(25.7± 4.7)%,HT组(28.7± 3.1)%,见图1C。
A:mPAP;B:RVSP;C:右心肥厚指数;a:P<0.05,与NC、NT组比较;b:P<0.05,与HC组比较。
图1 各组大鼠血流动力学指标的比较
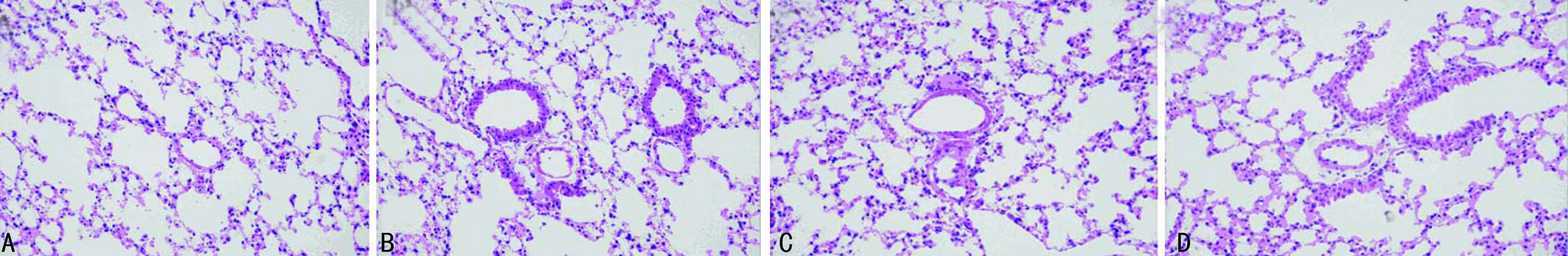
A:NC组;B:NT组;C:HC组;D:HT 组。
图2 各组大鼠肺动脉形态学变化(HE×400)
2.2 肺动脉形态学指标的变化 光镜下观察HE染色后的肺组织切片中显色较好,弹力层清晰的中小肺动脉。NC组大鼠肺动脉内膜完整光滑、管壁薄、肌层无增厚,HC组大鼠肺动脉出现管壁及中膜明显增厚,管腔狭窄,细小动脉肌化等血管重塑的变化特点,见图2。然而HT组有部分血管可以恢复到和NC组相当的水平,说明伊洛前列素抑制了低氧肺血管重塑。相对于NC组,HC组的WT%明显升高(P<0.05),HT组WT%比HC组明显降低(P<0.05),HT组与NC组的WT%相比差异无统计学意义(P>0.05),见图3。
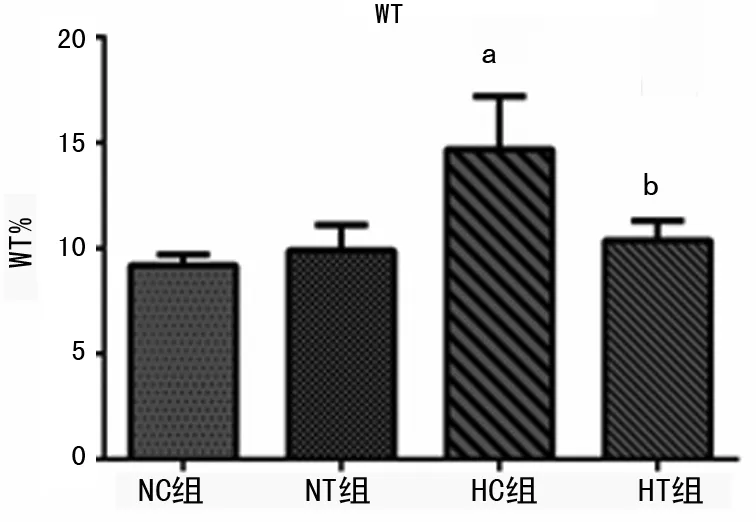
a:P<0.05,与NC、NT组比较;b:P<0.05,与HC组比较。
图3 各组大鼠WT%比较
2.3 各组大鼠肺组织ET-1表达的检测 PT-PCR扩增曲线分析显示,HC组ET-1表达相对于NC组明显升高(P<0.05),HT组ET-1表达比HT组明显降低(P<0.05),HT组与NC组的WT%相比差异无统计学意义(P>0.05),见图4。
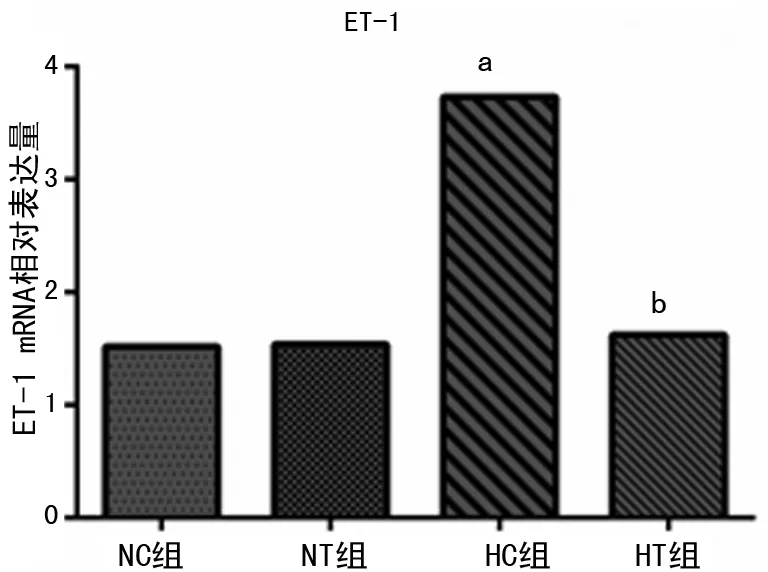
a:P<0.05,与NC、NT组比较;b:P<0.05,与HC组比较。
图4 各组大鼠肺组织ET-1表达的比较
3 讨 论
PAH原在高原地区常见,但随着近年来空气污染的加重,肺部基础疾病增多,继发性HPAH慢性在非高原地区亦有增多。持续慢性低氧引起HPV,进一步引起PAR。由于内皮损伤后功能失调,造成多种血管活性因子分泌合成紊乱,如ET-1,血管紧张素Ⅱ,血管内皮生长因子(vascular endothelial growth factor,VEGF) 、血小板衍生性生长因子(platelet derived growth factor,PDGF)等,这种现象加重血管损伤,促进PAR[8]。在血管重塑过程中,会出现无肌型动脉向肌型动脉转化,细动脉肌型化,中小动脉中层增厚、管腔狭窄等一系列的典型改变。随着PAR进一步进展,肺动脉压力持续升高,终点为右心衰竭,机体死。HE染色中血管形态的改变,以及右心指数的升高,都验证了肺动脉高压模型的成功建立。
ET是1988年由Yanagisawa等[9]发现的由21个氨基酸残基组成的多肽,是已知最强缩血管物质,分为ET-1、ET-2和ET-3三类。ET-1是惟一存在于血管内皮细胞的ET,能够引起强力而持久的血管收缩,对平滑肌细胞和成纤维细胞生长也具有强烈的促进作用。肺部是ET-1作用和代谢的最重要的器官。在低氧时,内皮细胞释放ET-1增加,进一步与血管平滑肌上的ETA、ETB 受体结合,促进Ca2+内流,引起平滑肌过度收缩痉挛,还促使某些与细胞增殖有关的原癌基因如c-fos,c-myc的表达增加,多方面促进血管重塑[10]。研究发现,肺动脉高压患者血浆ET-1水平明显升高,并且与肺血流量和心排出量呈负相关。动物实验显示,肺动脉高压大鼠肺动脉和肺组织匀浆中ET前体和ET-1及其受体ETA和ETB的 mRNA表达均明显增多,均提示ET-1在 HPAH 形成中扮演着重要的角色。
伊洛前列素是人工合成的前列环素类似物,作用部位是血管内皮细胞和平滑肌细胞[11]。发挥作用的机制为激活腺苷酸环化酶,使环磷腺甘(cAMP)水平升高,激活过氧化物酶增殖物激活受体(PPARγ)发挥生物学效应,使血管扩张,因此伊洛前列素有很强的扩张肺血管作用[12]。相对于其他前列环素药物,伊洛前列素优点在于可以优先到达通气良好的肺泡,直接选择性作用于肺动脉血管床,避免肺内分流,维持氧合稳定[13]。此外伊洛前列素还有抑制血栓形成,抗增殖活性和抗纤维化活性。在缺氧环境下伊洛前列素能拮抗炎性介质(如缓激肽、5-羟色胺、组胺等)引起的免疫反应,降低血管内皮通透性,维持内皮完整性[14]。在本实验中,持续缺氧时伊洛前列素对低氧肺动脉高压有确切的疗效,抑制ET-1的过度增加,延缓乃至逆转肺血管重塑,这可能是通过保护内皮细胞发挥作用的。但是伊洛前列素通过何种途径影响内皮细胞的ET-1合成和释放,具体调节机制如何,都待进一步研究。
[1]Guignabert C,Dorfmuller P.Pathology and pathobiology of pulmonary hypertension[J].Semin Respir Crit Care Med,2013,34(5):551-559.
[2]Galiè N,Hoeper MM,Humbert M,et al.Guidelines for the diagnosis and treatment of pulmonary hypertension:the task force for the diagnosis and treatment of pulmonary hypertension of the european society of cardiology and the european respiratory society,endorsed by the International Society of Heart and Lung Transplantation (ISHLT)[J].Eur Heart J,2009,30(20):2493-2537.
[3]Wang Z,Chesler NC.Pulmonary vascular wall stiffness:an important contributor to the increased right ventricular afterload with pulmonary hypertension[J].Pulm Circ,2011,1(2):212-223.
[4]Montani D,Chaumais MC,Guignabert C,et al.Targeted therapies in pulmonary arterial hypertension[J].Pharmacol Ther,2014,141(2):172-191.
[5]Shimoda LA,Sham JS,Liu Q,et al Acute and chronic hypoxic pulmonary vasoconstriction:a central role for endothelin-1[J].Respir Physiol Neurobiol,2002,132(1):93-106.
[6]Chen YF,Jowett S,Barton P,et al.Clinical and cost-effectiveness of epoprostenol,iloprost,bosentan,sitaxentan and sildenafil for pulmonary arterial hypertension within their licensed indications:a systematic review and economic evaluation[J].Health Technol Assess,2009,13(49):1-320.
[7]Kim EK,Lee JH,Oh YM,et al.Rosiglitazone attenuates hypoxia-induced pulmonary arterial hypertension in rats[J].Respirology,2010,15(4):659-668.
[8]Xu W,Erzurum SC.Endothelial cell energy metabolism,proliferation,and apoptosis in pulmonary hypertension[J].Compr Physiol,2011,1(1):357-372.
[9]Yanagisawa M,Kurihara H,Kimura S,et al.A novel potent vasoconstrictor peptide produced by vascular endothelial cells[J].Nature,1988,332(6163):411-415.
[10]Biasin V,Chwalek K,Wilhelm J,et al.Endothelin-1 driven proliferation of pulmonary arterial smooth muscle cells is c-fos dependent[J].Int J Biochem Cell Biol,2014,54(8):137-148.
[11]Reichenberger F,Mainwood A,Doughty N,et al.Effects of nebulised iloprost on pulmonary function and gas exchange in severe pulmonary hypertension[J].Respir Med,2007,101(2):217-222.
[12]Mirza S,Foley RJ.Clinical utility of treprostinil and its overall place in the treatment of pulmonary arterial hypertension[J].Clin Med Insights Circ Respir Pulm Med,2012,6(1):41-50.
[13]Reichenberger F,Mainwood A,Morrell NW,et al.Intravenous epoprostenol versus high dose inhaled iloprost for long-term treatment of pulmonary hypertension[J].Pulm Pharmacol Ther,2011,24(1):169-173.
[14]Li RC,Cindrova-Davies T,Skepper JN,et al.Prostacyclin induces apoptosis of vascular smooth muscle cells by a cAMP-mediated inhibition of extracellular signal-regulated kinase activity and can counteract the mitogenic activity of endothelin-1 or basic fibroblast growth factor[J].Circ Res,2004,94(6):759-767.
Effects of iloprost on expression of Endothelin-1 in lung in rats with hypoxic pulmonary hypertension*
GuanLi,JinZhu,ChenShixiong,XiangGuangming,GaoBaoan△
(InstituteofRespiratoryDiseaseofThreeGorgesUniversity/DepartmentofRespiratoryMedicine,YichangCentralPeople′sHospital,Yichang,Hubei443003,China)
Objective To investigate the influence of iloprost on the expression of lung endothelin-1(ET-1) in rats with hypoxic pulmonary hypertension(HPH).Methods Thirty-two male SD rats were randomly divided into four groups:normal control(NC) group,normal treatment(NT) group,hypoxia control(HC) group,hypoxia treatment(HT) group.NC group and NT group raised under normal Oxygen conditions 3 weeks.HC and HT group placed in a low Oxygen chamber (O210%) were treated 3 weeks of hypoxia 8 hours per day.NT and HT group were treated daily iloprost by inhalation therapy (2 μg/kg).Affer three weeks,measured mean pulmonary arterial pressure (mPAP),right ventricular systolic pressure (RVSP),index of right ventricular hypertrophy.HE staining was used to observe the morphological changes of pulmonary arteries and image analysis system was used to calculate the percentage of vascular wall thickness of small pulmonary arteries in each group,RT-PCR technique was used to assess the trends of ET-1 in lung tissue homogenates.Results The hemodynamics in HC group was significantly higher than other groups(P<0.05),there was no significant statistically difference of the hemodynamics in HT group compare with normal control group.Pulmonary arteries morphology,vessel wall thickening and vessel lumina stenosis in HC group than NC、NT、group.These indicators were significant improved in HT group.ET-1 expression in lung tissue were significantly increased in HC group than NC groups.No significant difference was found between and NC group HT group.Conclusion Aerosol inhalation of iloprost has exact therapeutic effect for rats with HPH.Iloprost reduced ET-1 overexpression in lung tissue in HPH rats and prevent pulmonary vascular remodeling.
hypoxic hypertension,pulmonary;anoxia;iloprost;endothelin-1
10.3969/j.issn.1671-8348.2017.06.005
湖北省自然科学基金资助项目(2012FFB06301);湖北省自然科学基金指导性计划项目(2014CFC1037)。
官莉(1977-),副主任医师,硕士,主要从事低氧性肺动脉高压的基础及临床研究。△
,E-mail:gaobaoan_hubei@163.com。
R543.2
A
1671-8348(2017)06-0735-03
2016-10-23
2016-11-21)
