甘蓝夜蛾CYP9A90基因的克隆及溴氰菊酯对其诱导表达
2017-02-13刘月庆杨文庆
刘月庆, 樊 星, 周 夏, 钱 金, 杨文庆, 杨 静, 樊 东*
(1. 东北农业大学农学院,哈尔滨 150030;2. 东北农业大学资源与环境学院,哈尔滨 150030)
甘蓝夜蛾CYP9A90基因的克隆及
溴氰菊酯对其诱导表达
刘月庆1, 樊 星2, 周 夏1, 钱 金1, 杨文庆1, 杨 静1, 樊 东1*
(1. 东北农业大学农学院,哈尔滨 150030;2. 东北农业大学资源与环境学院,哈尔滨 150030)
P450CYP9A家族基因与昆虫对拟除虫菊酯类杀虫剂的抗性相关。为证实溴氰菊酯对甘蓝夜蛾CYP9A基因的诱导效果,本研究采用RT-PCR和RACE技术克隆获得甘蓝夜蛾CYP9A基因,real-time PCR检测该基因在甘蓝夜蛾不同组织中的表达差异及溴氰菊酯处理甘蓝夜蛾5龄幼虫不同时间后该基因相对表达量变化,研究结果可为甘蓝夜蛾对溴氰菊酯的抗性治理提供依据。结果表明:克隆得到甘蓝夜蛾CYP9A基因cDNA全长序列,该序列包含1 828 bp,包括1个125 bp的5′非编码区,1个104 bp的3′非编码区和1个1 599 bp的开放阅读框,编码532个氨基酸,分子量约为61.1 kDa,等电点为8.84,GenBank登录号为KR676343,被国际P450命名委员会命名为CYP9A90。Real-time PCR分析结果表明,该基因在甘蓝夜蛾5龄幼虫6个组织中表达情况不同,其中在脂肪体中表达量最高。低剂量溴氰菊酯作用后不同时间点CYP9A90 mRNA总体呈现诱导表达趋势。
甘蓝夜蛾; P450; 基因克隆; 溴氰菊酯; 表达
细胞色素P450多功能氧化酶系(cytochrome P450 enzymes,P450s)在昆虫体内主要分布于中肠、脂肪体和马氏管等组织中[1],可代谢杀虫剂等多种内源及外源性化合物[2-3],以及多种激素及信息素[4-5]。一般认为,其对杀虫剂的代谢(解毒或活化)关系到昆虫对杀虫剂的耐受性和杀虫剂对昆虫的选择性,P450 介导的杀虫剂代谢解毒作用的增强是昆虫产生抗药性常见而重要的机制[4]。已有研究表明,对二氯苯醚菊酯产生抗性的致倦库蚊CulexquinquefasciatusCYP9M10基因的mRNA表达为敏感体系的264倍[6],小菜蛾对二氯苯醚菊酯抗性品系中CYP6BG1基因表达是敏感品系的4.9倍[7]。P450的可诱导性表现为昆虫暴露于药剂或其他异源物质环境下,其体内某一种或几种细胞色素P450的水平会显著上升,使得解毒作用显著增强[8]。其诱导作用增强了昆虫的解毒作用,提高了昆虫对环境有毒物质的适应能力,因此昆虫抗药性产生通常表现为P450酶活性的增强和其表达量的上升[4]。用氯氰菊酯诱导野桑蚕Bombyxmandarina时,CYP9A21基因在中肠的表达量是对照的2.1倍,导致野桑蚕对氯氰菊酯氧化解毒代谢作用的增加[9]。用氯虫苯甲酰胺诱导甜菜夜蛾,4个P450基因CYP9A9、CYP4G37、CYP4S11及CYP6B的表达明显上调[10]。溴氰菊酯可以显著增强褐飞虱体内CYP303A1的表达[11]。
甘蓝夜蛾MamestrabrassicaeLinnaeus,又名甘蓝夜盗虫、夜盗蛾等,属于鳞翅目夜蛾科,盗夜蛾亚科,为世界性分布害虫[12]。不仅为害甘蓝、白菜、卷心菜等十字花科蔬菜,还是瓜类、豆类、茄果类、甜菜的重要害虫[13]。目前对于甘蓝夜蛾的主要防治手段是化学防治,主要药剂包括高效氯氟氰菊酯、高效氯氰菊酯和溴氰菊酯。目前国内外一些文章报道了P450对杀虫剂的代谢解毒机制,研究多在 CYP4 家族、CYP6 家族和 CYP9 家族三个与抗药性相关的家族中[14],且Yang等通过试验证实发现棉铃虫中CYP9A家族与氰戊菊酯、溴氰菊酯、氯氰菊酯抗性有关[15-17],烟芽夜蛾中与硫代灭多威和氯氰菊酯抗药性相关的基因为CYP9A1[18-19],家蚕当中的CYP9A22与野桑蚕中的CYP9A21均能被氯氰菊酯诱导[9,20]。因此,本研究对甘蓝夜蛾CYP9A型基因的cDNA序列进行克隆,将其命名为CYP9A90;并通过荧光定量PCR技术检测该基因在各组织中的表达以及经溴氰菊酯诱导后的表达,为开展甘蓝夜蛾细胞色素P450基因的功能分析提供基础,同时也为P450酶系的抗性机理研究及甘蓝夜蛾抗性治理提供依据。
1 材料与方法
1.1 供试昆虫
在东北农业大学香坊实验基地黑光灯下诱集甘蓝夜蛾成虫,将其放入恒温培养箱内进行饲养,饲养温度为(25±1)℃,光周期L∥D=14 h∥10 h,相对湿度70%,以5%蜂蜜水饲喂,待其产卵,幼虫取食未接触任何农药的白菜叶,饲养2代后再用作试验材料。
1.2 试剂
RNA提取试剂盒TRIzolReagent购自Invitrogen公司;反转录酶M-MLV、低熔点琼脂糖购自Fermentas(FBI)公司;DNA 胶回收试剂盒、克隆载体 pMD18-T、DL2000 DNA Marker、3′RACE试剂盒、5′RACE试剂盒、TapDNA聚合酶购自大连宝生物公司;感受态细胞Trans5α购自北京全式金生物技术公司、限制性内切酶购自NEB公司、THUNDERBIRD SYBR qPCR Mix购自TOYOBO公司;大肠杆菌DH5α(本实验室保存),其余试剂均为进口或国产分析纯。基因测序由上海生工生物有限公司完成。
1.3 方法
1.3.1 总RNA提取与第一链cDNA的合成
选取发育良好的甘蓝夜蛾5龄第1天幼虫为试验材料,提取方法根据TRIzol试剂盒使用说明进行,提取得到的RNA为模板,以dt-Adapter(表1)为cDNA合成引物,根据M-MLV反转录酶使用说明进行,合成第一链cDNA。
1.3.2 cDNA全长序列克隆及序列分析
根据已登录GenBank的棉铃虫Helicoverpaarmigera(AY371318)CYP9A12和野桑蚕B.mandarina(EF535806)CYP9A22两种昆虫CYP9A基因的全序列设计甘蓝夜蛾CYP9A基因特异片段的简并引物Mb9-F和Mb9-R(表1)。以合成的cDNA为模板,以Mb9-F和Mb9-R为引物扩增甘蓝夜蛾CYP9AcDNA序列片段。PCR程序如下:95℃预变性5 min;95℃ 30 s,60℃ 30 s,72℃ 1 min,35个循环;72℃延伸10 min 。经1.0%的琼脂糖凝胶电泳检测扩增产物后回收目的片段,进行纯化后再克隆到pEasy-T1载体上,转化至感受态细胞DH5α中,氨苄筛选,挑斑活化,鉴定后选择阳性克隆菌斑送上海生工生物有限公司进行测序。按照得到的基因片段及试剂盒要求设计RACE嵌套引物Mb9-3′RACE-Ro,Mb9-3′RACE-Ri,Mb9-5′RACE-Ro,Mb9-5′RACE-Ri(表1),根据5′ Full RACE Kit说明进行5′ RACE扩增,根据3′ Full RACE Kit说明进行3′ RACE扩增。检测RACE产物并进行纯化、测序,测序结果拼接。利用Blastx进行相似性比对,DNAMAN翻译开放阅读框,氨基酸序列的分子量、等电点和信号肽等利用ExPASy在线网站(http:∥us.expasy.o-rg/tools/dna.html)推导获得。
1.3.3 不同组织表达分析
在RNA保存液中快速解剖5龄幼虫20头,获得前肠、中肠、后肠、马氏管、脂肪体和唾腺等6种组织。共设3个生物学重复。cDNA模板的制备同1.3.1。
根据CYP9A90基因全长序列,设计荧光定量PCR引物CYP9A-q-F和CYP9A-q-R。利用β-actin作为内参基因,设计引物β-actin-F和β-actin-R(表1)。实时荧光定量PCR按照qPCR Mix(Code:QPS-201)荧光定量试剂盒(TOYOBO)说明书的要求进行操作。PCR反应条件为:预变性95℃ 5 min, 变性95℃ 10 s,退火60℃ 12 s,延伸72℃ 20 s,40个反应循环,最后以每1 s上升1℃的速度从60℃上升至95℃记录熔解曲线。采用2-ΔΔCt法进行PCR相对定量分析。数据的多重比较利用SAS9.4软件来进行,数值均以平均值±SE进行表示,差异显著性分析应用HSD检验法进行检测,P< 0.01。
1.3.4 溴氰菊酯对CYP9A90基因的诱导表达分析
1.3.4.1 室内毒力测定
采用点滴法,用丙酮将2.5%溴氰菊酯水乳剂(拜耳作物科学(中国)有限公司)稀释成5个不同的浓度,点滴0.5 μL药液于甘蓝夜蛾5龄幼虫第2、3腹节之间,每个处理20头,3个重复,以丙酮作对照。点滴后的甘蓝夜蛾幼虫放在室温条件下饲养,24 h后计算死亡率。采用SAS软件对药剂使用剂量和昆虫死亡率之间进行回归分析。计算出5龄甘蓝夜蛾幼虫对溴氰菊酯的LD10、LD30和LD50。

图1 甘蓝夜蛾CYP9A90 cDNA序列及推导的氨基酸序列Fig.1 CYP9A90 cDNA and the deduced amino acid sequence from Mamestra brassicae
1.3.4.2 溴氰菊酯对甘蓝夜蛾CYP9A90基因的诱导表达
分别点滴0.5 μL LD10、LD30和LD50浓度的溴氰菊酯于甘蓝夜蛾5龄幼虫第2、3腹节之间,每处理120头,3个重复,以丙酮作对照,室温条件下饲养,在点滴处理后3、6、12、24 和 48 h 分别从每个重复收集存活的幼虫10头并冻存于液氮中保存。依照1.3.1方法获得cDNA第一链,-80℃冰箱中保存待用。采用real-time PCR方法分析甘蓝夜蛾CYP9A90基因相对表达量。反应体系及条件参见1.3.3。
表1 本研究所用引物
Tabel 1 The primers used in this study

引物名称Primername引物序列Primersequence(5'-3')dt-AdapterGACTCGAGTCGACATCGA(T)17Mb9-FGGTCAAGAATGGAAAGACATGCGNTCMb9-RATGGAGTTGAAGTCGAACTTCCGCCGTMb9-3'RACE-RoCAGAGTTTGGACTGACACCGACCTCATTGCMb9-3'RACE-RiCAGGAGCGTCTGGGGCACGAGATCAAGMb9-5'RACE-RoCGCAGGAGGCTATCACGTCGTTAGMb9-5'RACE-RiCCGACCTCCACCATGAAAGGCACCATCAGACGCYP9A-q-FAAGATTTTATCGTCCGCAAAGGCYP9A-q-RGTCCAACACCGAAGGGCATβ-actin-FCCAACGGCATCCACGAGACCAβ-actin-RTCGGCGATACCAGGGTACAT
2 结果与分析
2.1 CYP9A90基因的获得及序列分析
利用RT-PCR及RACE方法获得甘蓝夜蛾细胞色素P450基因1 828 bp的全长cDNA序列,包括1个125 bp的5′非编码区,1个104 bp的3′非编码区和1个1 599 bp的开放阅读框。编码532个氨基酸。氨基酸序列中包括P450蛋白特征序列FxxGxRxCxG(血红素结合区)(图2)。通过ExPaSy在线生物软件获得其氨基酸序列的分子量约为61.1 kDa,等电点为8.84。GenBank登录号为KR676343,国际P450命名委员会命名为CYP9A90。

图2 CYP9A90与其他昆虫CYP9A 氨基酸序列多重比对Fig.2 Multiple alignment of the amino acid sequences of CYP9A90 and other CYP9As
2.2 CYP9A90基因与鳞翅目其他种昆虫CYP氨基酸序列比对
从NCBI数据库获取与甘蓝夜蛾CYP9A90相似性高的其他昆虫CYP9A氨基酸序列16条,利用DNAMAN软件进行氨基酸序列比对,结果发现,甘蓝夜蛾CYP9A90与其他昆虫CYP9A亚家族的氨基酸序列同源性达70%以上,其中与甘蓝夜蛾(AY390260)一致性最高,达86%,与棉铃虫(DQ003275)、美洲棉铃虫(DQ788839)、斜纹夜蛾(GQ465040)、甜菜夜蛾(AB381883)和草地贪夜蛾(KJ671577)的一致性分别为 79%、78%、72%、71%和 70%;这7种氨基酸序列均具有相似的螺旋C、螺旋K、氧结合区、血红素结合区(图2)。通过MEGA5.0软件NJ法构建鳞翅目不同昆虫的细胞色素P450系统发育进化树(图3)。结果表明,CYP9A90推导出的氨基酸序列与同种的CYP9A13(AY390260)关系最近,与鳞翅目夜蛾科棉铃虫(DQ003275)、美洲棉铃虫(DQ788839)亲缘关系较近,与斜纹夜蛾(GQ465040)、甜菜夜蛾(AB381883)和草地贪夜蛾(KJ671577)关系稍远;与家蚕(AB498807)、稻纵卷叶螟(KP001131)、苹果蠹蛾(KC832920)等非夜蛾科昆虫的亲缘关系相对较远。

图3 昆虫CYP9A基因推导氨基酸的系统进化树构建Fig.3 Phylogenetic tree based on calculated amino acid sequences of CYP9A
2.3 CYP9A90基因在不同组织中的表达
通过real-time PCR检测发现CYP9A90在甘蓝夜蛾5龄幼虫的6个不同组织内表达情况不同,其中在脂肪体中表达最高,其次是前肠、中肠和后肠,而在马氏管和唾腺中没有检测到该基因的表达(图4)。脂肪体中该基因表达量分别是中肠、前肠和后肠的4.48、6.54和98.1倍。
2.4 溴氰菊酯对CYP9A90基因的诱导表达分析
2.4.1 室内毒力测定
经点滴法测定,溴氰菊酯对甘蓝夜蛾5龄幼虫的LD10、LD30和LD50分别为0.152(0.017~0.335)、0.448(0.146~0.792)和0.943(0.475~1.817)ng/g(表2)。
2.4.2 低剂量溴氰菊酯对CYP9A90基因表达量的影响
为了验证溴氰菊酯对CYP9A90基因表达量的影响,通过实时荧光定量技术对溴氰菊酯LD10、LD30和LD50剂量处理甘蓝夜蛾5龄幼虫不同时间(3、6、12、24和48 h)后CYP9A90基因的表达状况进行研究。LD30和LD50诱导效果不理想,与对照差异不显著,数据在此没有列出。图5表示低剂量溴氰菊酯LD10作用后CYP9A90基因在一定时间范围内,排除对照影响后,各时间点数值均为正值,表示该基因在各个时间点均被诱导,但诱导量存在差异。6、24和48 h表达量间差异不显著,但这3个时间点与3 h和12 h时间点的表达量间存在显著差异,分别是3 h和12 h的1.40、1.43、1.31倍和4.07、4.13、3.80倍。
表2 溴氰菊酯对甘蓝夜蛾5龄幼虫的毒力1)
Table 2 Toxicity of deltamethrin on fifth-instar larvae ofMamestrabrassicae

LD10(CI95)/ng·g-1LD30(CI95)/ng·g-1LD50(CI95)/ng·g-1毒力回归方程Toxicityregressionequation相关系数rCorrelationcoefficient0.152(0.017~0.335)0.448(0.146~0.792)0.943(0.475~1.817)y=1.978x-0.0790.989
1) CI95: 95%的置信限。 CI95: 95% confidence interval.
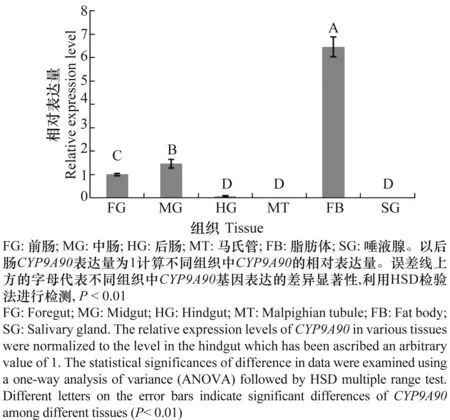
图4 CYP9A90在甘蓝夜蛾不同组织中的表达Fig.4 Expression pattern of CYP9A90 in different tissues of Mamestra brassicae

图5 溴氰菊酯点滴后不同时间点CYP9A90的表达量Fig.5 Expression of CYP9A90 treated by deltamethrin at different time points
3 讨论
由于P450基因在昆虫组织器官表达的差异性,使这些基因在昆虫体内表现的功能也不尽相同[21]。王炜等发现致倦库蚊CYP9J40基因在肌肉、消化道、卵巢、脑和胸部神经节均有明显表达,表明了该基因参与蚊虫对杀虫剂的抗性,并且对雌虫发育有重要的影响[22]。郑笑笑等发现甜菜夜蛾P450基因的分布也具有一定的特异性:主要分布在外源化合物进入体内所经过的主要入口的一些组织中,这些组织是针对经口、皮进入的外源化合物的第一道防线[23]。赵华强等发现家蚕CYP9A22的mRNA转录表达具有组织特异性,在中肠的表达量高于脂肪体[20]。CYP4D46基因在脂肪体中的相对表达量较高,说明CYP4D46可能与脂肪体的重要生理功能相关。本文研究的CYP9A90基因在5龄幼虫脂肪体中有最高表达,这可能与脂肪体的功能密切相关。在昆虫体内,脂肪体是最主要的代谢器官[24],因此推断本文研究的CYP9A90基因可能参与内源和外源物质的代谢,也可能参与杀虫剂的解毒作用。随后的试验将利用RNA干扰等技术探讨该基因与杀虫剂杀虫活性的关系,达到利用分子手段降低或延缓昆虫抗性甚至减少杀虫剂的目的。
外源物质不同剂量和作用时间对P450均产生不同的诱导效应,当外源物质达到一定剂量并作用一定的时间后才会产生诱导作用[22]。溴氰菊酯是最重要的拟除虫菊酯类杀虫剂,其使用范围很广[25]。目前,越来越多的试验证明很多昆虫已对拟除虫菊酯类杀虫剂产生抗性,而昆虫体内P450的参与是产生抗性的主要原因[26]。Pottelberge等发现巴比妥、苯巴比妥和香叶醇对二斑叶螨P450s诱导作用表现出时间效应,在药剂处理1~4 h内P450s酶活性迅速增加,而4~48 h内其活性达到最大[27]。王学贵等发现氯虫苯甲酰胺诱导甜菜夜蛾,CYP9A9基因上调表达表现出时间效应,在12 h达到最大[10]。刘昌燕发现吡虫啉诱导大草蛉P450基因上调表达表现出时间效应,在16 h达到最高峰[28]。在本研究中,CYP9A90基因被诱导表达,在3 h 时就开始出现诱导效应,至48 h时仍保持一定的诱导效应,总体情况下,各个时间点诱导表达量均为对照组的2倍左右,但在12 h出现诱导表达量明显减少的现象,与对照表达量间差异不显著。导致在该时间点排除对照影响后,其诱导表达量明显低于其他各时间点的表达量,其原因可能是由于此时间节点昆虫体内特殊生理过程导致该基因表达量明显下降,其具体原因有待下一步试验验证。在低剂量(LD10)溴氰菊酯条件下CYP9A90基因被诱导表达;而在较高剂量LD30、LD50条件下,可能虫体受到溴氰菊酯的影响较大,不能及时对刺激做出反应,所以CYP9A90并没有表现出诱导作用(数据未列出)。因此,溴氰菊酯只能在一定的剂量范围内对该基因发挥诱导作用,剂量过高反而无诱导效果。但不同昆虫种类和不同CYP基因对溴氰菊酯的诱导可能存在不同的效应,东亚飞蝗Locustamigratoria的CYP409A1和CYP408B1均可被不同浓度(LD10、LD30和LD50)的溴氰菊酯所诱导[29],与本研究的CYP9A90只有在LD10剂量下被诱导存在一定区别。在棉铃虫的脂肪体中,只有低剂量溴氰菊酯诱导了CYP6AE14、CYP6B2、CYP6B6、CYP9A14的表达[30],与本研究结果有类似之处。
P450酶系是一个共同作用的代谢酶系,探究P450酶系中CYP基因的种类和功能将有助于更好地开展P450的系统研究工作。本试验以对甘蓝夜蛾P450基因家族的CYP9A90基因为切入点,克隆了1个新的CYP9A基因,研究了其在不同组织中的分布及表达量差异,明确了低剂量溴氰菊酯杀虫剂对其诱导反应,研究结果丰富了甘蓝夜蛾P450基因家族成员,为在甘蓝夜蛾体内系统研究P450解毒作用,降低或延缓甘蓝夜蛾抗药性奠定基础。
[1] Hodgson E.Microsomal monooxygenase[M]∥Kurkut G A, Gillbert L I. Comprehensive insect physiology, biochemistry and pharmacology. Oxford: Pergamon Press, 1985:225-321.
[2] Scott J G, Liu N.Insect cytochrome P450s: Thinking beyond detoxification [J]. Recent Advances in Insect Physiology Toxicology & Molecular Biology, 2008:117-124.
[3] Schuler M A.P450s in plant-insect interactions [J]. Biochimica et Biophysica Acta, 2011, 1814(1): 36-45.
[4] Feyereisen R.Insect CYP genes and P450 enzymes [M]∥Gilbert L I. Insect molecular biology and biochemistry. Elsevier, Oxford, 2012: 236-295.
[5] Li X, Schuler M A, Berenbaum M R.Molecular mechanisms of metabolic resistance to synthetic and natural xenobiotics [J]. Annual Review of Entomology, 2007, 52(1): 231-253.
[6] Komagata O, Kasai S, Tomita T.Overexpression of cytochrome P450 genes in pyrethroid-resistantCulexquinquefasciatus[J]. Insect Biochemistry and Molecular Biology, 2010, 40(2):146-152.
[7] Bautista M A M, Tanaka T, Miyata T.Identification of permethrin-inducible cytochrome P450s from the diamondback moth,Plutellaxylostella(L.) and the possibility of involvement in permethrin resistance [J]. Pesticide Biochemistry and Physiology, 2007, 87(1): 85-93.
[8] Nebert D W, Gonzalez F J.P450 genes: structure, evolution, and regulation [J]. Annual Review of Biochemistry, 1987, 56: 945-993.
[9] 赵华强, 宋丽莉, 李兵, 等. 野桑蚕细胞色素P450氧化酶活性测定及CYP9家族基因的诱导转录[J]. 浙江农业学报, 2010, 22(3): 287-291.
[10]王学贵, 余慧灵, 梁沛,等. 氯虫苯甲酰胺诱导甜菜夜蛾细胞色素P450基因上调表达[J]. 昆虫学报,2015, 58(3):281-287.
[11]Lao Shuhua, Huang Xiaohui, Huang Haijian, et al. Genomic and transcriptomic insights into the cytochrome P450 monooxygenase gene repertoire in the rice pest brown planthopper,Nilaparvatalugens[J]. Genomics, 2015, 106(5): 301-309.
[12]张秀梅. 甘蓝夜蛾在青海省平安县的发生规律与防治措施[J]. 陕西农业科学, 2015(1): 35-38.
[13]张筱秀, 连梅力, 李唐, 等. 山西中部地区甘蓝夜蛾发生规律及为害特点调查研究[J]. 山西农业大学学报(自然科学版),2008, 28(4): 442-443.
[14]于荣荣. 飞蝗三个P450基因的分子特性及功能分析[D].太原: 山西大学, 2012.
[15]Yang Y, Wu Y, Chen S, et al. The involvement of microsomal oxidases in pyrethroid resistance inHelicoverpaarmigera, from Asia[J]. Insect Biochemistry & Molecular Biology, 2004, 34(8):763-773.
[16]Yang Y, Chen S, Wu S, et al. Constitutive overexpression of multiple cytochrome P450 genes associated with pyrethroid resistance inHelicoverpaarmigera[J]. Journal of Economic Entomology, 2006, 99(5): 1784-1789.
[17]Yang Y, Yue L, Chen S, et al. Functional expression ofHelicoverpaarmigeraCYP9A12 andCYP9A14 inSaccharomycescerevisiae[J]. Pesticide Biochemistry & Physiology, 2008, 92(2):101-105.
[18]Rose R L, Barbhaiya L, Roe R M, et al. Cytochrome P450-associated insecticide resistance and the development of biochemical diagnostic assays inHeliothisvirescens[J]. Pesticide Biochemistry & Physiology, 1995, 51(3): 178-191.
[19]Rose R L, Goh D, Thompson D M, et al. Cytochrome P450 (CYP)9A1, inHeliothisvirescens: the first member of a new CYP, family[J]. Insect Biochemistry & Molecular Biology, 1997, 27(6): 605-615.
[20]赵华强, 王东, 李兵,等. 家蚕细胞色素P450基因CYP9A22的克隆及在中肠和脂肪体的诱导转录[J]. 蚕业科学, 2008, 34(4): 634-641.
[21]Chung H, Sztal T, Pasricha S, et al. Characterization ofDrosophilamelanogastercytochrome P450 genes[J]. Proceedings of the National Academy of Sciences of the United States of America, 2009, 106(14): 5731-5736.
[22]王炜, 陈少良, 崔峰. 致倦库蚊GSTe1和CYP9J40的时空表达特点[J]. 应用昆虫学报, 2014, 51(6):1538-1544.
[23]郑笑笑, 魏苹, 赵丽娜,等. 甜菜夜蛾P450基因的克隆及组织特异性分析[J]. 杭州师范大学学报:自然科学版, 2012, 11(3):198-204.
[24]Yang J, Mccart C, Woods D J, et al. ADrosophilasystems approach to xenobiotic metabolism [J]. Physiological Genomics, 2007, 30(3): 223-231.
[25]Gilbert L I, Iatrou K, Gill S S.Comprehensive molecular insect science [M]. Oxford: Elsevier, 2005.
[26]Wondji C S, Irving H, Morgan J, et al. Two duplicated P450 genes are associated with pyrethroid resistance inAnophelesfunestus, a major malaria vector [J]. Genome Research, 2009, 19(3): 452-459.
[27]Pottelberge S V, Leeuwen T V, Amermaet K V, et al. Induction of cytochrome P450 monooxygenase activity in the two-spotted spider miteTetranychusurticae, and its influence on acaricide toxicity[J]. Pesticide Biochemistry & Physiology, 2008, 91(2):128-133.
[28]刘昌燕, 曾凡荣. 大草蛉P450基因cDNA片段的克隆及吡虫啉诱导表达[J]. 中国生物防治学报, 2014, 30(3): 427-433.
[29]Guo Yanqiong, Zhang Jianzhen, Yu Rongrong, et al. Identification of two new cytochrome P450 genes and RNA interference to evaluate their roles in detoxification of commonly used insecticides inLocustamigratoria[J]. Chemosphere, 2012, 87(7): 709-717.
[30]Zhou Xiaojie, Sheng Chengfa, Li Mei, et al. Expression responses of nine cytochrome P450 genes to xenobiotics in the cotton bollwormHelicoverpaarmigera[J]. Pesticide Biochemistry & Physiology, 2010, 97(3): 209-213.
(责任编辑:田 喆)
Cloning ofCYP9A90 and effects of deltamethrin on its mRNA expression inMamestrabrassicae
Liu Yueqing1, Fan Xing2, Zhou Xia1, Qian Jin1, Yang Wenqing1, Yang Jing1, Fan Dong1
(1.CollegeofAgriculture,NortheastAgriculturalUniversity,Harbin150030,China;2.CollegeofResourcesandEnvironment,NortheastAgriculturalUniversity,Harbin150030,China)
Genes inCYP9Asubfamily of P450 are associated with the resistance of insects to pyrethroids. In order to verify the induction effect of deltamethrin toCYP9AinMamestrabrassicae, RT-PCR and RACE were used to clone the full-length cDNA sequence ofCYP9Agene. Its mRNA expression profiles in different tissues at fifth-instar larvae and the effect of deltamethrin were detected by real-time PCR.The results would give us a basis for resolving the management problem of the resistance ofM.brassicaeto deltamethrin. The results showed that the cDNA sequence was 1 828 bp in length, which contained a 125 bp 5′-untranslated region, a 104 bp 3′ untranslated region and a 1 599 bp open reading frame, and coded a polypeptide of 532 amino acid residues with a predicted molecular weight of 61.1 kDa and pI 8.84 (GenBank accession no. KR676343). It was namedCYP9A90 by the P450 Nomenclature Committee. The real-time quantitative RT-PCR assay showed thatCYP9A90 gene expression levels were different in six tissues of the fifth-instar larvae. The expression level was at the highest point in fat body. Low dosage of deltamethrin treatment could induceCYP9A90 mRNA expression at different time points after treatment.
Mamestrabrassicae; cytochrome P450; cloning; deltamethrin; expression
2016-06-20
2016-07-21
黑龙江省教育厅科学技术研究项目(12531045)
Q 785, S 436.35
A
10.3969/j.issn.0529-1542.2017.01.009
* 通信作者 E-mail:dnfd@163.com
