固相萃取-高效液相色谱法检测食品中吡咯素的研究
2017-01-13刘慧琳陈晓默
刘慧琳,穆 琳,陈晓默,王 静
(北京食品营养与人类健康高精尖创新中心,北京市食品添加剂工程技术研究中心,北京工商大学,北京 100048)
固相萃取-高效液相色谱法检测食品中吡咯素的研究
刘慧琳,穆 琳,陈晓默,王 静*
(北京食品营养与人类健康高精尖创新中心,北京市食品添加剂工程技术研究中心,北京工商大学,北京 100048)
采用固相萃取结合高效液相色谱技术检测食品中的吡咯素。食品原料采用OasisTMHLB固相萃取柱进行预富集,并用HPLC法进行检测。结果表明,吡咯素在5×10-7~2×10-3mol/L浓度范围内呈现良好的线性关系,相关系数R2=0.9999,RSD为0.78%~7.51%,最低检出限为5×10-7mol/L(S/N=3)。本方法操作简单,灵敏度高,可应用于食品中痕量吡咯素的检测。
高效液相色谱,固相萃取,吡咯素,检测
晚期糖基化终产物(advanced glycation end products,AGEs)是指蛋白质中赖氨酸的氨基部分与还原糖的羰基部分在非酶条件下发生美拉德反应,生成稳定的美拉德产物[1],主要包括吠喃糠酰咪唑(FFI)、羧甲基赖氨酸(CML)、吡咯素(Pyrraline)、戊糖素等[2]。研究发现,人体每日摄入AGEs约25~75 mg[3],其中大部分是羧甲基赖氨酸(CML)和吡咯素(Pyrraline),它们被人体消化、吸收,并参与体内的循环代谢,使慢性病的患病风险大大提高,危害性很大。由免疫学检测可知,糖尿病患者血清中的吡咯素含量显著高于正常组,动脉粥样硬化患者的肾小球基底膜以及胞外基质均出现了不同程度的吡咯素积聚的现象[4],进而发展为肾小球硬化,最终引发肾衰竭。吡咯素作为定量检测晚期糖基化终产物的重要指标及衡量美拉德反应程度的重要参数之一[5],不仅在控制食品加工工艺和保障食品安全方面发挥重要作用[6],对糖尿病肾病、糖尿病血管并发症、糖尿病神经病变、糖尿病心血管病变、白内障等疾病的诊断和研究具有重要的临床意义[7]。
目前,吡咯素的检测方法主要有反相高效液相色谱法[8-10]、光电二极管阵列检测法等[11-12]。因食品基质较为复杂,若直接利用反向高效液相色谱检测会缩短色谱柱的使用寿命;而离子交换色谱虽然耐酸碱,应用范围较广,易于再生、使用寿命长,但由于其机械强度较差、易溶胀且易被有机物污染,因此需要对实际样品的预处理方法进行改进。固相萃取技术作为预处理方法,不仅起到了预富集和除杂的作用,还有效地简化了检测步骤并缩短了检测时间,设备简单,价格不高,分离速度可控,而且操作方便。此外,固相萃取与高效液相色谱联用技术具有分辨率高,重复性好等优势。
本文利用固相萃取技术作为预处理方法,结合高效液相色谱技术对实际样品中的吡咯素进行了分析研究。通过优化固相萃取柱的种类、洗脱液的组成、液相色谱检测的流速以及样品的酸水解条件,从而对牛奶、奶粉、咖啡、酱油等常见食品中的吡咯素进行准确的定量检测。
1 材料与方法
1.1 材料与仪器
吡咯素标准品(Pyrraline,纯度为99.04%) 多伦多研究化学品公司;硼氢化钠、硼酸钠缓冲液、三氯乙酸、丙酮、盐酸、乙酸、甲醇、氨水、三氟乙酸 均为分析纯;乙腈 色谱纯;高纯水 ≥18 MΩ·cm-1;高钙牛奶、纯牛奶、全脂奶粉1、全脂奶粉2、丝滑拿铁咖啡、原味咖啡、生抽酱油、老抽酱油 购自当地超市。
岛津LC-20A HPLC仪、Inertsil ODS-SP(4.6 mm×250 mm,5 μm)色谱柱 岛津(中国)有限公司;高速冷冻离心机 西格玛奥德里奇(上海)贸易有限公司;OasisTMHLB固相萃取柱(3 cc,60 mg) 沃特世科技(上海)有限公司;MCX固相萃取柱(60 mg,3 mL)、C18固相萃取柱(60 mg,3 mL)、PCX固相萃取柱(60 mg,3 mL) 天津博纳艾杰尔科技有限公司;UGC-24M氮吹仪 北京优晟联合科技有限公司;KQ-700GVDV型三频恒温数控超声波清洗器 昆山市超声仪器有限公司。
1.2 实验方法
1.2.1 液相色谱条件 根据Portero-Otin法[9],色谱柱:Inertsil ODS-SP柱(4.6 mm×250 mm,5 μm);流动相A:水(0.1% TFA),流动相B:乙腈-水(1∶1,v/v),梯度洗脱程序:在1、10、30、35、40、45 min时流动相B的含量分别为0%、15%、20%、100%、0%,分析时间:45 min;流速:0.4、0.6、0.8、1.0、1.2 mL/min;进样量:5 μL;柱温:室温;紫外-可见光检测器,检测波长:298 nm。
1.2.2 配制标准溶液 称取5 mg吡咯素标准品用高纯水定容至10 mL,配制成摩尔浓度为2×10-3mol/L的标准储备液,再依次稀释成2×10-3、1×10-3、5×10-4、2×10-4、1×10-4、5×10-5、2×10-5、1×10-5、5×10-6、2×10-6、1×10-6、5×10-7mol/L一系列标准溶液,4 ℃冰箱存放。
1.2.3 固相萃取 根据Yoshihara法[15],并进一步优化实验条件,将MCX柱、PCX柱、C18柱、HLB柱预活化(依次通过3 mL甲醇、3 mL水),取1 mL样液上样,然后用2 mL水洗涤,最后目标物分别通过3 mL乙腈(1 mL/L TFA)、乙腈(2 mL/L TFA)、乙腈(10 mL/L TFA)、甲醇、甲醇(5%氨水)、甲醇(10%氨水)、甲醇(20%氨水)进行洗脱,而后氮吹干燥,并复溶于流动相中,通过0.22 μm滤膜过滤后按照1.2.1方法进行HPLC检测。
1.2.4 样品前处理
1.2.4.1 结合型吡咯素 称取2 mg蛋白质当量样品,加入硼酸钠缓冲液(0.5 mol/L,pH9.2,500 μL)混合后至缓冲液浓度为0.2 mol/L。加入硼氢化钠溶液(0.5 mol/L,0.1 mol/L NaOH配制,17.5 μL)后至硼氢化钠溶液浓度为0.1 mol/L后,样品在4 ℃下还原10 h后,加入60% TCA至TCA最终浓度为20%,7000×g离心10 min,蛋白质沉降后用丙酮洗涤2次,并分别加入1 mL 的1、3、6 mol/L HCl、1、3、6 mol/L HAc,在110 ℃条件下水解24 h,然后氮吹干燥,将干燥的蛋白质水解物复溶于1 mL高纯水中[13-14]。
1.2.4.2 游离型吡咯素 称取2 mg蛋白质当量的样品,加入无水甲醇至甲醇最终浓度为75%,7000×g离心10 min后,将上清液通过固相萃取柱。
1.3 数据处理
所有数据取平行实验的平均值(n=3),采用SPSS16.0,Excel软件进行ANOVA方差分析。
2 结果与分析
2.1 流速的选择
实验研究了在梯度洗脱条件下,不同的流速对洗脱效果的影响。结果如图1所示,随着流速的增加,吡咯素的出峰时间提前,流速为1.200 mL/min 时的出峰时间最早,为21.332 min,其次是流速为1.000 mL/min,其出峰时间为21.690 min。出峰时间早可以节约流动相,并节省时间,但流速过大可能会损坏色谱柱,缩短泵和色谱柱的使用寿命,因此最佳流速设定为1.000 mL/min(n=3),此时的色谱图见图2。
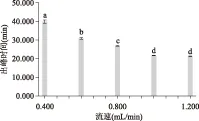
图1 不同流速对出峰时间的影响Fig.1 Effects of different rates on the peak time

图2 流速为1.000 mL/min时的色谱图Fig.2 The spectrum of pyrraline underthe rate of 1.000 mL/min
2.2 线性方程、相关系数、检出限
在最佳分离条件下,分别以不同浓度的标准溶液进样,以峰面积对摩尔浓度绘制标准曲线,如图3所示,回归方程为y=4.55×109x-4140.41,相关系数为R2=0.9999,表明在5×10-7~2×10-3mol/L浓度范围内吡咯素标准品的浓度和峰面积呈现良好的线性关系。此检测条件下的检出限为5×10-7mol/L(S/N=3),相对标准偏差0.78%~7.51%。

图3 吡咯素标准曲线Fig.3 The standard curve of pyrraline
2.3 固相萃取洗脱液的优化
通过实验,比较了7种洗脱液对吡咯素的洗脱效果,结果发现,不同的洗脱液对吡咯素有不同的洗脱能力,回收率范围在38.6%~96.3%,见图4。其中,甲醇-氨水的洗脱效果较好,均在94%以上,而乙腈-TFA组的回收率均<90%,可能是HLB固相萃取柱是由N-乙烯吡咯烷酮和亲脂性的二乙烯基苯聚合而成,氨水中和了吡咯素结合的质子,使其变为中性,从而破坏了吡咯素与吸附剂间的库仑力,而甲醇破坏了吡咯素与吸附剂上疏水基团之间的非极性相互作用,使吡咯素易被洗脱,因此,本实验选择甲醇(5%氨水)作为洗脱液,其回收率最高,为96.3%(n=3)。

图4 洗脱液对吡咯素回收率的影响Fig.4 Influence of elution on the recoveries of pyrraline注:A.乙腈(1‰ TFA);B.乙腈(2‰ TFA);C.乙腈(1% TFA);D.甲醇;E.甲醇(5%氨水);F.甲醇(10%氨水);G.甲醇(20%氨水)。
2.4 固相萃取柱的选择
由于食品中的吡咯素含量较低,且存在大量干扰物质,故HPLC法很难直接检测吡咯素,因此有必要将食品组分进行固相萃取预除杂和富集[16],上样液为1 mL,洗涤液为2 mL水,洗脱液为3 mL甲醇(5%氨水)。结果如图5所示,HLB固相萃取柱的回收率最高,为75%,可能是由于HLB固相萃取柱的填料是亲水-亲脂聚合物,在较宽的pH范围内具有较好的萃取效果[17],其次是PCX柱,为69.39%,而C18柱的净化效果最低,为13.99%,且当C18柱中的液体流干时会严重降低洗脱效果[17],故后续实验选择HLB柱检测实际样品(n=3)。

图5 固相萃取柱对吡咯素回收率的影响Fig.5 Influence of SPE columns on the recoveries of pyrraline
2.5 酸水解的优化
由表1可知,随着酸浓度增加,检测到吡咯素含量增加,即蛋白质的水解程度增加,这是由于酸浓度增加,即溶液中氢离子浓度增加,蛋白质酰胺键被切断的可能性增大,因此检测到的吡咯素含量增加[18],当用6 mol/L HCl进行水解时,吡咯素含量最高,故后续实验选择6 mol/L HCl水解实际样品(n=3)。

表1 不同条件下酸水解后食品中的结合型吡咯素含量
2.6 实际样品检测
2.6.1 结合型吡咯素 利用HLB固相萃取柱和高效液相色谱仪,按照1.2.4.1的方法对8种样品中的结合型吡咯素进行了检测,由图6可知,出峰时间为21.654 min的峰为吡咯素。由表2可知,6种样品中检测到了结合型吡咯素,不同样品中的吡咯素含量有较大的差异,其中全脂奶粉中的蛋白质含量较高,其与还原糖发生美拉德反应生成的结合型吡咯素含量较高,分别达到了141.90 μg/g奶粉、131.73 μg/g奶粉,而牛奶中结合型吡咯素含量较少,分别为11.53 mL/L牛奶、12.49 mL/L牛奶,不同的加热温度、加热时间使得产品生产加工过程中美拉德反应的程度不同,因而晚期糖基化终末产物的生成量不同,致使吡咯素的含量有较大差异(n=3)。

图6 全脂奶粉2的色谱图Fig.6 The spectrum of whole milk powder 2

表2 固相萃取结合HPLC法测定食品中的结合型吡咯素含量
2.6.2 游离型吡咯素 利用HLB固相萃取柱和高效液相色谱仪,按照1.2.4.2的方法对8种样品中的游离型吡咯素进行了检测,结果见表3。由表3可知,奶粉和牛奶中未检测到吡咯素,而咖啡和酱油中均含有吡咯素,是因为奶粉和牛奶中含有较多的蛋白质,与还原糖发生美拉德反应,生成的结合型吡咯素含量较高,而游离氨基酸较少,故未检测到游离型吡咯素;而酱油加工过程中豆粕酸解产生了游离氨基酸[19-20],以及咖啡豆中的风味前体物质氨基酸,在高温烘焙过程中参与了美拉德反应[21],与还原糖反应形成了晚期糖基化终末产物所致,其中丝滑拿铁咖啡中游离型吡咯素含量最高,其次是老抽酱油(n=3)。

表3 固相萃取结合HPLC法测定食品中的游离型吡咯素含量
3 结论
食品基质非常复杂,其中的痕量吡咯素难以准确定量,本研究优化了固相萃取的分离条件和高效液相色谱的分离条件,建立了固相萃取-高效液相色谱法检测食品中的痕量吡咯素,在5×10-7~2×10-3mol/L浓度范围内呈现良好的线性关系,检出限为5×10-7mol/L(S/N=3),相对标准偏差为0.78%~7.51%。该方法可对吡咯素进行预富集、净化和除杂,有效地缩短了检测时间,操作简便,灵敏度高,重复性好,可作为快速检测食品中痕量吡咯素的方法,并为监管部门提供吡咯素的检测依据,有一定的应用价值。
[1]Stitt A W,Jenkins A J,Cooper M E. Advanced glycation end products and diabetic complications[J]. Expert Opinion on Investigational Drugs,2002,11:1205-1223.
[2]Li Y,Zhang Y,Chen C,et al. Establishment of a rabbit model to study the influence of advanced glycation end products accumulation on osteoarthritis and the protective effect of pioglitazone[J]. Osteoarthritis and Cartilage,2016,24(2):307-314.
[3]付全意.食品模拟体系糖化反应过程中羧甲基赖氨酸的形成和抑制[D].广州:华南理工大学,2012.
[4]Miyata S,Monnier V. Immunohistochemical detection of advanced glycosylation end products in diabetic tissues using monoclonal antibody to pyrraline[J]. Journal of Clinical Investigation,1992,89(4):1102-1112.
[5]Sengl M,Ledl F,Severin T. Maillard-reaktion von rinderserumalbumin mit glucose hochleistung-flüssigkeitschromatographischer nachweis des 2-formyl-5-(hydroxymethyl)pyrrol-1-norleucins nach alkalischer hydrolyse[J]. Journal of Chromatography A,1989,463:119-125.
[6]蔡成岗,张慧,李赫,等.食品中高级糖基化终产物的研究进展[J].食品研究与开发,2013,34(24):280-282.
[7]魏芹,刘乃丰.羧甲基赖氨酸的研究进展[J].东南大学学报·医学版,2005(4):269-273.
[8]Peng X F,Ma J Y,Cheng K W.The effects of grape seed extract fortification on the antioxidant activity and quality attributes of bread[J].Food Chemistry,2010,119(1):49-53.
[9]Delatour T,Hegele J.Analysis of advanced glycation end products in dairy products by isotope dilution liquid chromatography electrospray tandem mass spectrometry.The particular case of carboxymethyllysine[J].Journal of Chromatography A,2009,1216(12):2371-2381.
[10]Zhang G,Huang G W.Determination of advanced glycation end products by LC-MS/MS in raw and roasted almonds(Prunus dulcis)[J].Journal of Agricultural and Food Chemistry,2011,59(22):12037-12046.
[11]Hull G L J,Jayne V W,Amesc J M,et al.N-(carboxymethyl)lysine content of foods commonly consumed in a Western style diet[J]. Food Chemistry,2012,131(1):170-174.
[12]Henle T,Axel A W,Klostermeyer H E. Maillard reactions in chemistry,food and health[M]. 1st edn. London:The Royal Society of Chemistry,1994,195-200.
[13]黄娟,杨俊青,陈松润,等. HPLC法测定婴幼儿配方乳粉中羧甲基赖氨酸[J].食品研究与开发,2016,37(3):175-177.
[14]孙晓华,赖克强,黄轶群,等.高效液相色谱-串联质谱法测定油条中羧甲基赖氨酸[J].食品工业科技,2014,35(11):298-301,323.
[15]Yoshihara K,Kiyonami R,Shimizu Y,et al. Determination of urinary pyrraline by solid-phase extraction and high performance liquid chromatography[J]. Biological and Pharmaceutical Bulletin,2001,24(8):863-866.
[16]朱晓玲,叶飞,杨洁,等.固相萃取-高效液相色谱法测定蜂蜜中的有机酸[J].色谱,2010,28(10):945-949.
[17]贾妍艳,谭建华,徐晨,等. 固相萃取-气相色谱-质谱法同时测定水中9种药品及个人护理用品[J]. 色谱,2014,32(3):263-267.
[18]马永全,胡林子,于新.酸法水解河蚬蛋白质的工艺优化研究[J].食品工业科技,2010,31(11):288-290.
[19]张海珍. 酿造酱油发酵过程风味变化规律及工艺优化的研究[D].杭州:浙江工商大学,2010.
[20]吴婷. 酱油发酵工艺条件优化的研究[D].长沙:湖南农业大学,2013.
[21]董文江,张丰,赵建平,等. 云南不同地区生咖啡豆的风味前体物质研究[J].现代食品科技,2016,32(1):290-296.
Determination of trace pyrraline in food samples using solid- phase extraction and high performance liquid chromatography
LIU Hui-lin,MU Lin,CHEN Xiao-mo,WANG Jing*
(Beijing Advanced Innovation Center for Food Nutrition and Human Health,Beijing Engineering and Technology Research Center of Food Additives,Beijing Technology & Business University(BTBU),Beijing 100048,China)
A solid phase extraction-high performance liquid chromatography for determination of pyrraline in food was established. Pyrraline was extracted from food material by a HLB-SPE column and analyzed by high performance liquid chromatography. Results showed that a good linear range from 5×10-7to 2×10-3mol/L with correlation coefficient of 0.9999 was obtained. The relative standard deviation were 0.78%~7.51%.The limit of detection was 5×10-7mol/L(S/N=3). The discussed method was simple and accurate and could be applied to the detection of trace pyrraline in food.
high performance liquid chromatography;solid phase extraction;pyrraline;detection
2016-05-06
刘慧琳(1987-),女,博士,讲师,研究方向:食品安全检测,E-mail:liuhuilin@btbu.edu.cn。
*通讯作者:王静(1976-),女,博士,教授,研究方向:食品营养与安全,E-mail:wangjing@th.btbu.edu.cn。
国家自然科学基金(31501559,31571940)。
TS207.3
A
1002-0306(2016)22-0090-05
10.13386/j.issn1002-0306.2016.22.009
