紫变青霉生物转化根皮苷制备根皮素的研究
2016-12-22梅建凤陈建澍张彦璐应国清
梅建凤,李 靓,易 喻,陈建澍,张彦璐,应国清
(浙江工业大学 药学院,浙江 杭州 310014)
紫变青霉生物转化根皮苷制备根皮素的研究
梅建凤,李 靓,易 喻,陈建澍,张彦璐,应国清
(浙江工业大学 药学院,浙江 杭州 310014)
为了开发一种生物转化根皮苷生成根皮素的工艺,首先从苹果皮富集培养物中分离筛选微生物菌株,进而优化产酶培养基主要组成、pH和转化条件,提高根皮素的转化得率.结果从富集培养物中筛选到一株紫变青霉(Penicilliumpurpurescens)QL-9204菌株,经产酶培养制备的粗酶液能转化根皮苷为根皮素;在产酶培养基组成为蔗糖2 g/L,(NH4)2SO46 g/L,NaCl 5 g/L,KH2PO45 g/L,MgSO41 g/L,MnSO41 g/L,pH=6时,QL-9204菌株经种子扩培后接种产酶培养基,于30 ℃,200 r/min条件下培养5 d,滤除菌体的粗酶液中加入80 mg/L的根皮苷,于30 ℃,250 r/min转化14 h后,根皮素的转化得率可达90.3%.利用紫变青霉菌QL-9204发酵制备的粗酶液转化根皮苷制备根皮素,具有方法简单、转化得率高和成本低的优势,有潜在的工业化应用价值.
根皮素;根皮苷;生物转化;紫变青霉
根皮素(phloretin),又名三羟苯酚丙酮,化学名3-(4-羟基苯基)-1-(2,4,6-三羟基苯基)-1-丙酮,属于二氢查尔酮化合物.根皮素广泛存在于荔枝、苹果、梨等水果以及多种蔬菜中,因在这些植物的根茎或根皮中含量较为集中而得名[1].根皮素具有较好的抗氧化、抗自由基作用,能抑制黑色素细胞活性,对色斑有很好的淡化作用[2];不仅如此,根皮素还具有很好的抗炎和免疫抑制作用[3-4];最新研究表明根皮素还具有抗肿瘤及抗癌活性[5-7].从天然植物中提取根皮素,收率往往较低,得到的多是其糖苷形式,即根皮苷(phlorizin)[8-9].根皮苷可以经酸碱水解得到根皮素.采用酸碱水解法虽然具有成本低的优势[10-11],但存在转化专一性差、产品需脱色和易造成环境污染等不足,应用有一定的限制;采用生物法转化天然产物,往往具有转化专一性高、条件温和及产品纯度高等优点[12-13].采用生物转化根皮苷制备根皮素,使用纯化的糖苷酶[14],因酶不能回收重复利用,必然导致生产成本较高.如果利用微生物发酵制备含糖苷酶的粗酶液来转化天然糖苷,只要避免杂酶对苷元结构的水解,就能够实现转化目标,则省去酶的分离和纯化步骤,可以突破酶制剂成本较高的瓶颈[15].
笔者筛选出转化专一性较好的微生物菌株,发酵制备含糖苷酶的粗酶液,在粗酶液中加入根皮苷,就能转化为根皮素,且根皮素不会被水解,可以获得较高的转化得率,可以克服酸碱水解和纯酶水解法的不足,具有反应条件温和、专一性强、生产成本低和环境友好的优点.
1 材料和方法
1.1 仪器与试剂
安捷伦1200型高效液相色谱仪(安捷伦科技有限公司),色谱柱为Phenomenex Luna C18键合硅胶柱(5 μm,250 mm×4.6 mm);YXQ-LS-70A高压蒸汽灭菌锅(上海博迅实业有限公司);SW-CJ-1BU超净工作台(苏州安泰空气技术有限公司);DHP-9402恒温培养箱(上海一恒科学仪器有限公司);HZ-9311K恒温振荡培养箱(太仓华利达实验设备有限公司)以及其他常规实验仪器.
根皮苷和根皮素标准品(西安开来生物工程有限公司,批号分别K141013和K141101,纯度98%),以及各类常用的市售色谱纯或分析纯商品试剂.
1.2 培养基
平板和斜面培养基采用马铃薯琼脂培养基(PDA),种子培养基采用马铃薯培养基(PDB)[16];初始产酶培养基的组成:蔗糖5 g/L,蛋白胨5 g/L,NaCl 5 g/L,KH2PO45 g/L,MgSO41 g/L,MnSO41 g/L,pH=6.所有培养基经121 ℃高压蒸汽灭菌20 min.
1.3 方 法
1.3.1 菌种的富集与分离
250 mL三角瓶中加入约50 g经粉碎的新鲜苹果皮,置于28 ℃的恒温箱培养5 d.用无菌水将长满霉菌的富集物稀释106~107倍后,涂布于PDA上,于28 ℃培养2 d,挑取颜色和形态不同的霉菌菌落转接PDA斜面培养基,置于28 ℃恒温培养2 d,得孢子丰富的纯种菌株斜面.
1.3.2 产酶培养
菌种筛选时,用接种环挑取分离得到的菌株孢子直接接种100 mL产酶培养基;产酶条件优化时,挑取菌种斜面孢子接种PDB种子培养基,于30 ℃,200 r/min振荡培养2 d,再移取种子液5 mL接种100 mL产酶培养基.接种后的产酶培养基于30 ℃,200 r/min振荡培养5 d.
1.3.3 根皮苷的生物转化
微生物产酶培养物用4层纱布过滤,滤液即为粗酶液.取50 mL粗酶液于250 mL三角瓶中,根皮苷用甲醇配制成10 g/L的溶液加入粗酶液中,于30 ℃,250 r/min振荡转化8~15 h.
1.3.4 根皮素和根皮苷的质量浓度分析
转化结束后,取转化液10 mL用同等体积的乙酸乙酯萃取2 次,合并乙酸乙酯,45 ℃下减压蒸干,用1 mL甲醇溶解残留物,经0.45 μm微孔滤膜过滤.用HPLC分析甲醇溶液中根皮苷和根皮素的质量浓度.色谱检测条件:流动相为V(甲醇)∶V(水)=7∶3,流速0.8 mL/min,柱温25 ℃,检测波长280 nm,进样量10 μL,由相同分析条件下的根皮苷和根皮素质量浓度—峰面积标准曲线计算样品中的两者的质量浓度.
2 结果与讨论
2.1 转化菌株的筛选
苹果皮中根皮苷含量较高,且天然苹果皮中本身带有大量的微生物,其中可能会有可以转化根皮苷的微生物存在,所以用苹果皮作为微生物分离源,筛选能转化根皮苷为根皮素的微生物菌株.从苹果皮富集物中分离到11 个霉菌菌株,利用这些菌株发酵制备的粗酶液转化根皮苷,在底物质量浓度为20 mg/L时,不同菌株转化根皮苷生成根皮素得率见表1.
表1 不同分离菌株转化根皮苷生成根皮素的得率
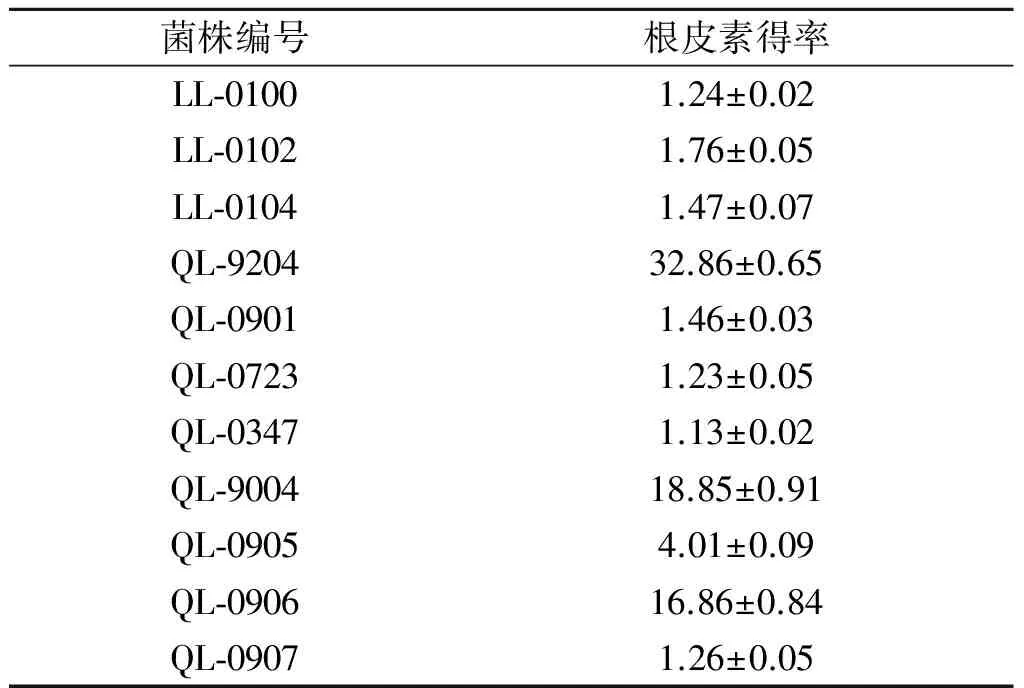
Table 1 The yield of phloretin from phlorizin after bioconversion by different isolated strains %
由表1可知:大部分菌株转化能力较弱,仅有QL-9204,QL-9004,QL-0906菌株转化能力较好,其中QL-9204菌株最佳,根皮素的转化得率达到32.7%.虽然根皮素转化得率不高,但转化体系中还有大量根皮苷存在(HPLC分析图谱见图1),根皮苷和根皮素的总摩数未降低,说明两者未被水解,进一步优化产酶培养条件和转化条件,转化得率能够得以提高.
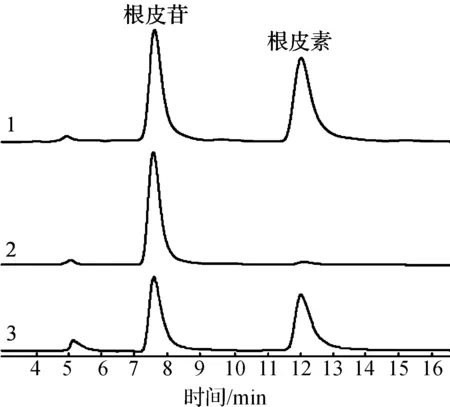
1—根皮苷和根皮素标准品;2—转化0 h对照;3—QL-9204菌株转化样品图1 根皮苷生物转化为根皮素HPLC分析图谱Fig.1 HPLC chromatograms of phlorizin and phloretin after bioconversion
2.2 QL-9204菌株的鉴定
QL-9204菌株接种在PDA平板培养基上,28 ℃培养2 d后,平板表面长出白色絮状的菌丝体,气生菌丝长度在1~2 mm,菌落边缘呈锯齿状不整齐,继续培养3 d后,菌落正面逐渐变灰绿色,背面逐渐变为紫红色.显微镜下观察菌丝孢子丝呈扫帚状,1~2 层小梗,分生孢子串呈不分枝的链状,椭圆形,淡黄色,表面粗糙.符合青霉属(Penicillium)菌株的形态特征.该菌株交由生工生物工程(上海)有限公司进行18S rDNA测序,测得序列长度为1 318 bp.将该序列在GenBank(http://www.ncbi.nlm.nih.gov)上进行BLAST比对,与30 株以上的紫变青霉菌株的18S rDNA序列有99%以上的相似度.综合QL-9204菌株的形态特征和18S rDNA的序列分析,可以确定QL-9204菌株为一株紫变青霉(Penicilliumpurpurogenum),该菌株提交中国典型培养物保藏中心保藏,保藏编号CCTCC No: M 2015781.
2.3 产酶培养基优化
2.3.1 培养基碳源种类及质量浓度
考察了产酶培养基中碳源种类对根皮素得率的影响,将初始产酶培养基中的蔗糖分别替换为5 g/L的葡萄糖、可溶性淀粉、乳糖和果糖.QL-9204菌株产酶培养制备的粗酶液转化根皮苷,在底物质量浓度为20 mg/L时,根皮素的转化得率见图2.
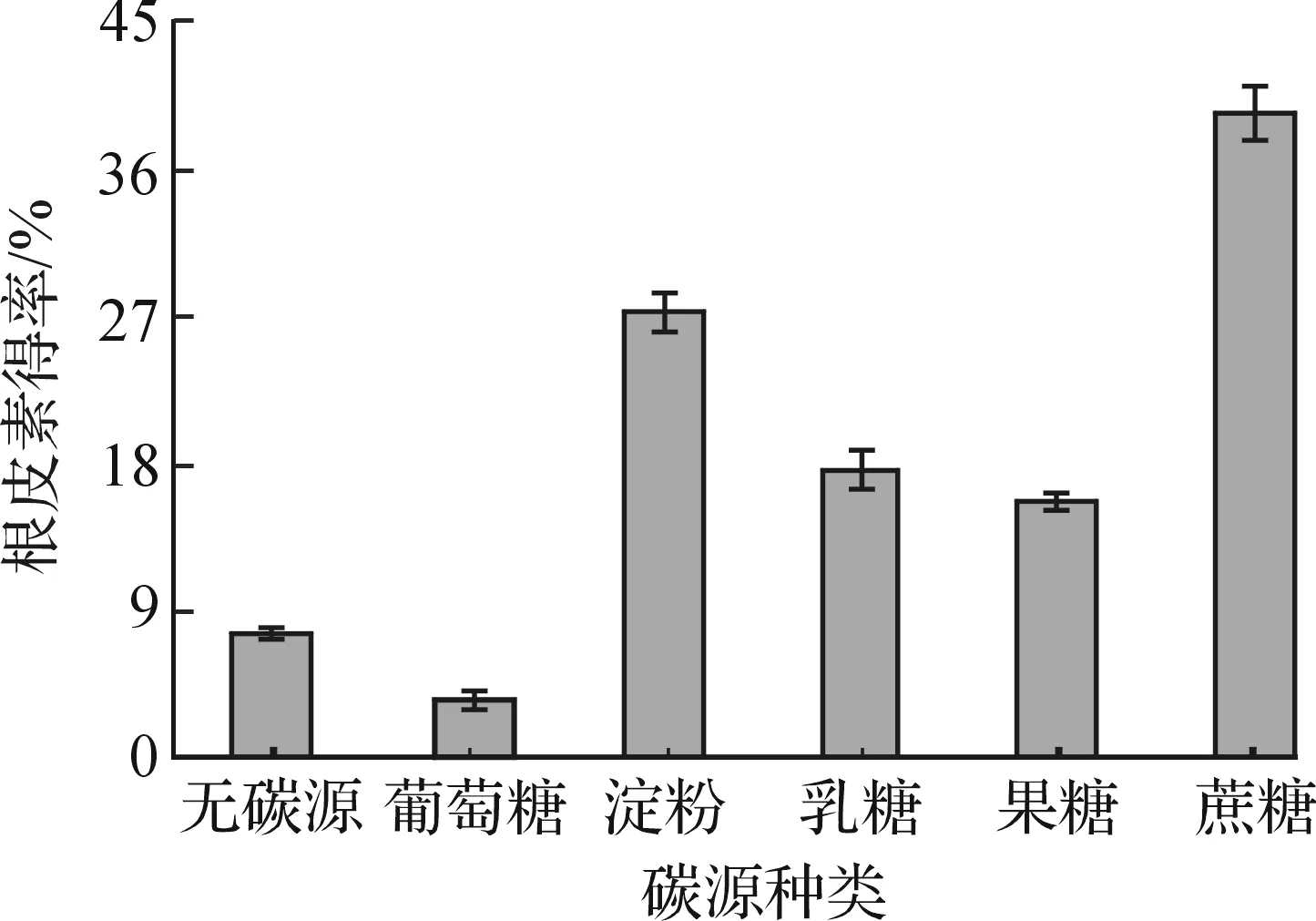
图2 培养基碳源种类对根皮素转化得率的影响Fig.2 Effects of different carbon source on the yield of phloretin
由图2可知:在产酶培养基碳源为单糖葡萄糖时,QL-9204菌株产酶转化根皮苷生成根皮素的得率最低,甚至低于不加碳源时的得率;而碳源为二糖或多糖时,根皮素得率则显著提高,说明转化根皮苷为根皮素的糖苷酶需要含糖苷键的糖类诱导生成.在碳源为蔗糖时,根皮素得率最高,达到39.3%,进而考察了蔗糖质量浓度对根皮素转化得率的影响,结果见图3.
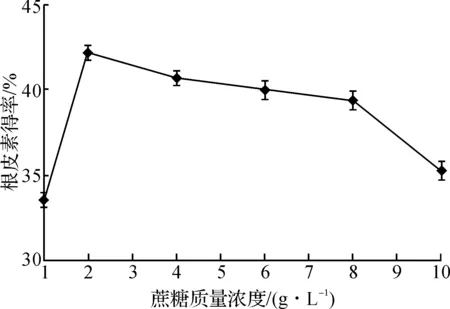
图3 蔗糖质量浓度对根皮素转化得率的影响Fig.3 Effects of sucrose concentration on the yield of phloretin
由图3可知:当蔗糖质量浓度为2 g/L时,根皮素的转化得率最高,达到了42.2%.当蔗糖质量浓度提高时,菌体生物量虽然有明显增加,但根皮素的转化得率反而降低,这可能是因为菌体生长过旺,产生的水解酶对根皮素的降解作用增强.
2.3.2 培养基氮源种类与质量浓度
考察了不同种类的氮源对根皮素转化得率的影响.选取蛋白胨、酵母浸出粉、牛肉膏、(NH4)2SO4和NaNO3作为培养基中的氮源,不同氮源的培养基含氮质量浓度均配制为1 g/L.QL-9204菌株产酶培养制备的粗酶液转化根皮苷,在底物质量浓度为20 mg/L时,根皮素的转化得率见图4.
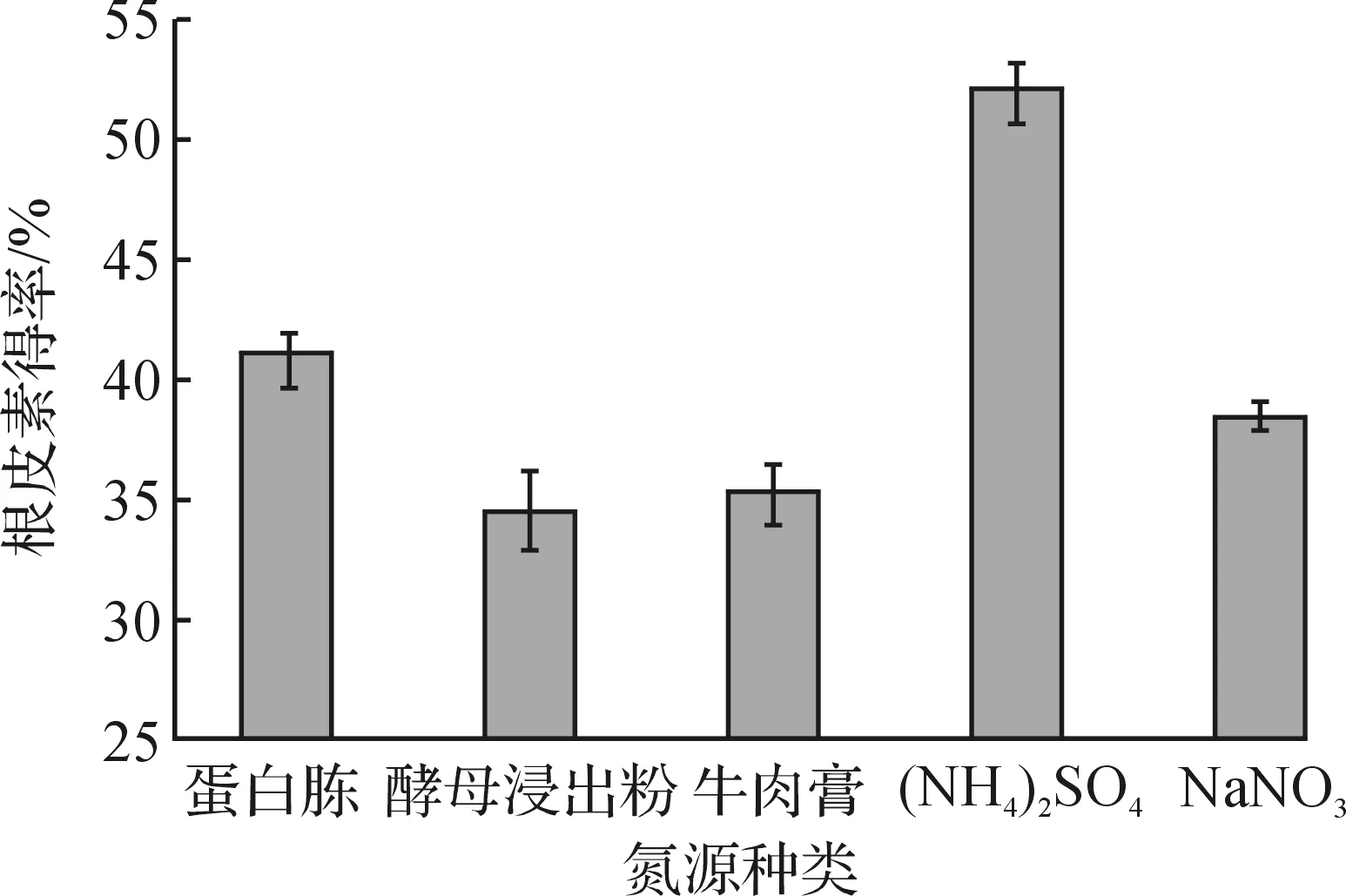
图4 培养基氮源种类对根皮素转化得率的影响Fig.4 Effects of different nitrogen source on the yield of phloretin
由图4可知:产酶培养基氮源为(NH4)2SO4时(质量浓度为4.72 g/L),根皮素的转化得率最高,达到51.9%.进而考察了产酶培养基中的(NH4)2SO4质量浓度对根皮素转化得率的影响,结果见图5.
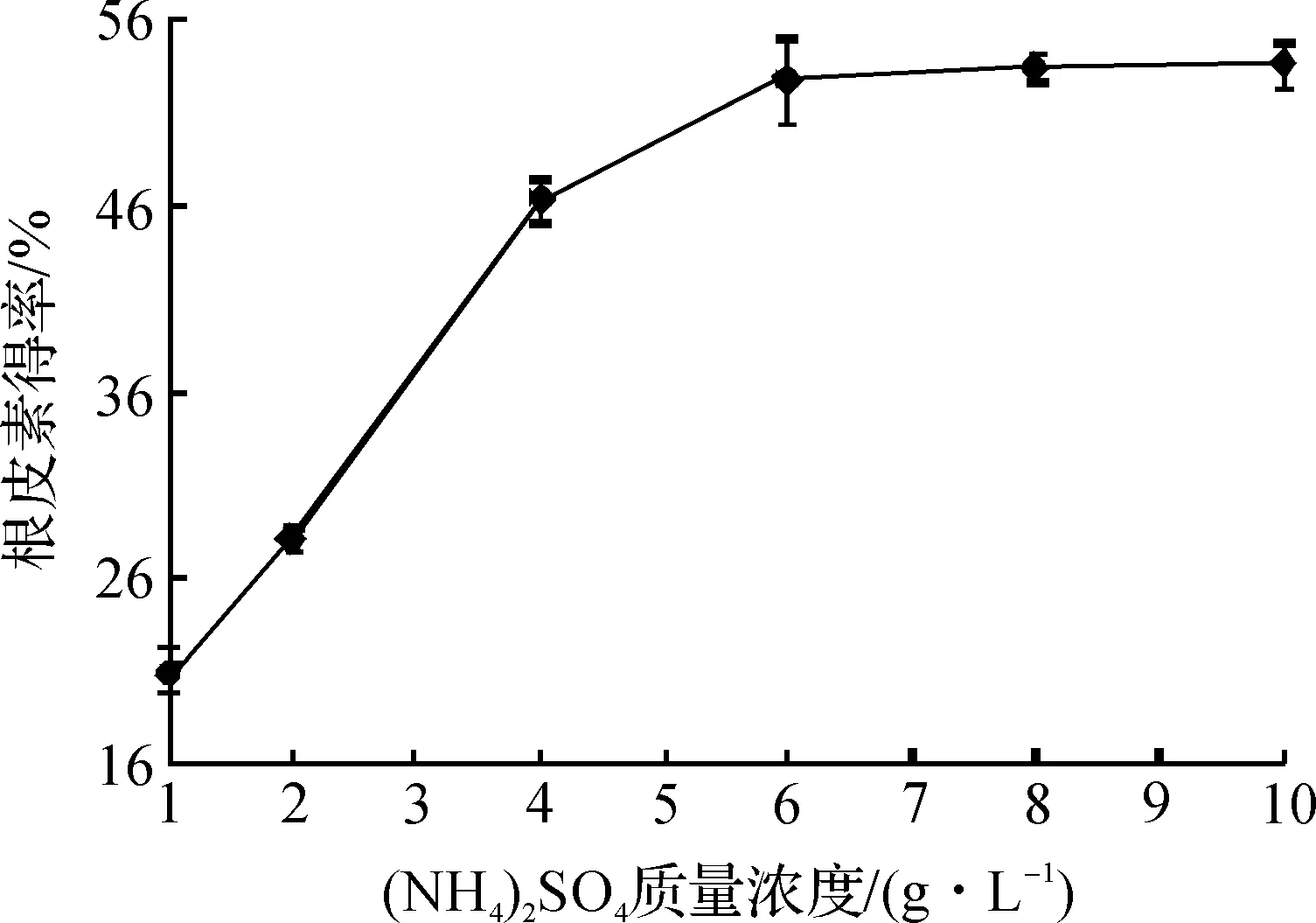
图5 (NH4)2SO4的质量浓度对根皮素转化得率的影响Fig.5 Effects of (NH4)2SO4 concentration on the yield of phloretin
由图5可知:在(NH4)2SO4质量浓度从1 g/L增加到6 g/L时,根皮素的转化得率随(NH4)2SO4质量浓度增加而提高,之后便不再增加,所以最佳的(NH4)2SO4质量浓度为6 g/L,此时根皮素的转化得率为52.7%.
2.3.3 培养基初始pH
不同初始pH对微生物的生长和产酶活性有很大的影响,便考察了产酶培养基初始pH对根皮素得率的影响.在产酶培养基组成为蔗糖2 g/L,(NH4)2SO46 g/L,NaCl 5 g/L,KH2PO45 g/L,MgSO41 g/L,MnSO41 g/L时,用浓度为2 mol/L的HCl或NaOH将培养基初始pH调成4~7.QL-9204菌株产酶培养制备的粗酶液转化根皮苷,在底物质量浓度为20 mg/L时,根皮素的转化得率见图6.

图6 培养基初始pH对根皮素转化得率的影响Fig.6 Effects of initial medium pH on the yield of phloretin
由图6可知:在培养基初始pH对QL-9204菌株产酶转化根皮苷为根皮素的得率有显著影响,在初始pH低于6时,随初始pH的升高,根皮素转化得率显著提高;初始pH为6时,得率最高;初始pH高于6之后,转化得率便显著下降.
2.4 转化条件的优化
2.4.1 底物的质量浓度
为了提高转化率和产率,首先对底物根皮苷质量浓度进行优化,底物的添加质量浓度分别为20,40,60,80,100,120 mg/L.QL-9204菌株产酶培养制备的粗酶液转化根皮苷,根皮素的转化得率见图7.
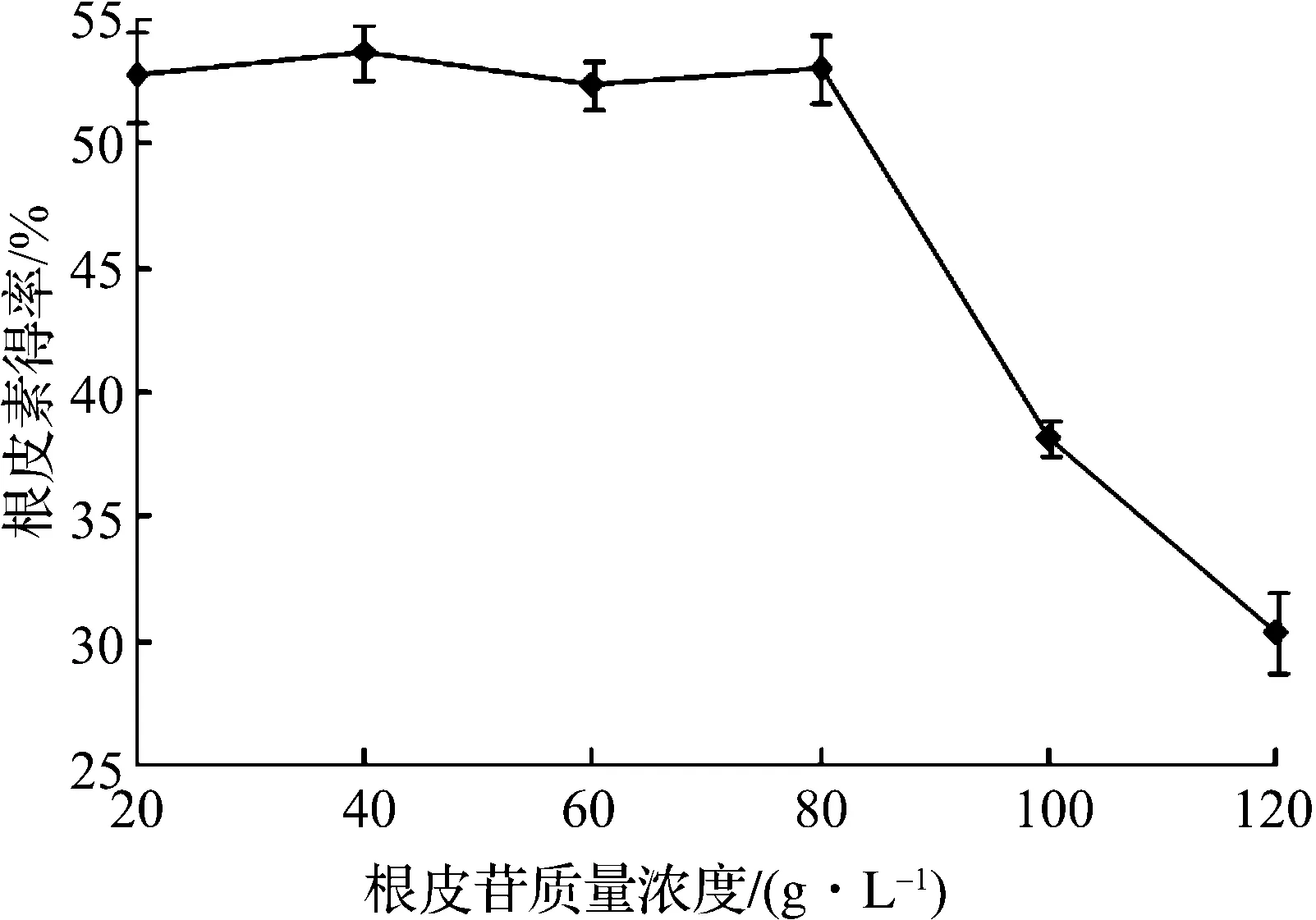
图7 根皮苷的质量浓度对根皮素转化的影响Fig.7 Effects of phlorizin concentration on the yield of phloretin
由图7可知:在根皮苷的质量浓度达到80 mg/L之前,根皮素的转化得率均能达到50%以上,之后便迅速下降,所以底物根皮苷的质量浓度需在80 mg/L以下.
2.4.2 转化时间
考察了转化时间对根皮素转化得率的影响,QL-9204菌株产酶培养制备的粗酶液转化根皮苷,在底物质量浓度为80 mg/L时,根皮素的转化得率见图8.
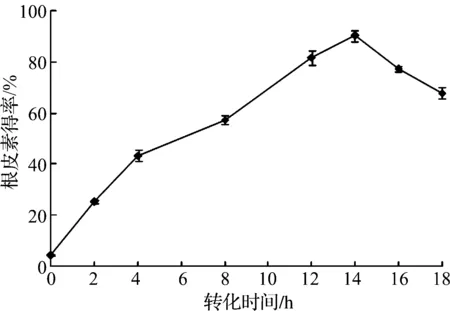
图8 转化时间对根皮素转化得率的影响Fig.8 Effects of bioconversion time on the yield of phloretin
由图8可知:随着转化时间的延长,根皮素的得率逐渐提高,转化14 h时,根皮素的得率达到最高,达90.3%;之后在显著下降,说明QL-9204菌株的粗酶液中存在根皮素的水解酶,转化时间过长则导致根皮素的水解.
考察转化温度和振荡转速对根皮素得率的影响,结果表明最佳转化温度仍然为30 ℃,振荡速度对转化得率无显著影响.重复批次实验结果表明:在底物根皮苷质量浓度为80 mg/L,30 ℃,250 r/min条件下转化14 h,根皮素的得率均能在90%以上.
3 结 论
近些年来,生物转化技术在天然产物化学中的应用,取得了丰硕的研究成果.将生物转化技术运用于中药成分的结构修饰,可以提高一些中药成分的生物活性或降低毒性和副作用,是实现中药现代化的重要途径之一.糖苷类化合物是许多中药的主要有效成分,但糖苷类化合物分子具有极性大、脂溶性差和分子量大的特点,不易透过肠壁粘膜被吸收.去除糖基的苷元产物极性小、脂溶性增加,更容易透过肠壁进入血液循环,进而发挥更好的药效.根皮苷大量存在于一些植物中,但生物活性远远不如根皮素,所以采用生物转化法将根皮苷转化为根皮素,是生产根皮素的有效途径之一.本研究从苹果皮微生物富集物中筛选到一株紫变青霉菌QL-9204菌株,该菌株能专一性的转化根皮苷生成根皮素,但几乎不产生水解苷元结果的酶,经产酶培养基和转化条件优化后,在底物根皮苷浓度为80 mg/L,根皮素的转化得率可达90.3%,显著高于已有的报道的59.01%转化率[17](底物质量浓度60 mg/L),所以本工艺具有方法简单、转化得高和成本低的优势,进一步研究可以增加底物质量浓度,提高产量,便具有一定的工业化应用价值.
[1] 李秉擘.具有生物活性的天然产物根皮素的合成与纯化的相关研究[D].杭州:浙江大学,2012.
[2] 王建新,周忠,王建国.根皮素抑酪氨酸酶活性研究[J].香料香精化妆品,2002(2):4-5.
[3] 陆晓宇,曾耀英,叶燕霞,等.根皮素的抗炎和免疫抑制作用(英文)[J].药学学报,2009(5):480-485.
[4] REZK B M, HAENEN, GRMM, et al. The antioxidant activity of phloretin: the disclosure of a new antioxidant pharmacophore in flavonoids[J]. Biochemical and biophysical research communications,2002,295(1):9-13.
[5] ABKIN S V, OSTROUMOVA O S, KOMAROVA E Y, et al. Phloretin increases the anti-tumor efficacy of intratumorally delivered heat-shock protein 70 kDa (HSP70) in a murine model of melanoma[J]. Cancer immunology immunotherapy,2015,65(1):1-10.
[6] LU M, KONG Q, XU X, et al. Evaluation of apoptotic and growth inhibitory activity of phloretin in BGC823 gastric cancer cell[J]. Tropical journal of pharmaceutical research,2015,14(1):27-31.
[7] 王会,刘政,吴汉东.根皮素对肝癌细胞HepG-2增殖和凋亡的影响[J].中国生化药物杂志,2015(7):39-42.
[8] 徐凯,吕海涛.苹果皮中根皮素的提取工艺研究[J].食品研究与开发,2009,30(12):109-112.
[9] 赵艳敏,王皎,宋光明,等.苹果树枝和叶中根皮苷及根皮素含量变化研究[J].食品研究与开发,2013(7):95-98.
[10] 彭学东,张梅,赵金召,等.一种天然根皮苷半合成制备根皮素工艺:中国,ZL201310238175.1[P].2013-06-17.
[11] 周金林,黄宝华,卢宇靖.一种根皮素的制备方法:中国,ZL 201310152063.4[P].2013-04-27.
[12] 王鸿,周峰,吴祺豪,等.甾体类化合物生物转化的研究进展[J].浙江工业大学学报,2015,43(5):556-561.
[13] 欧志敏,严琴英,杨根生.生物转化法水解牛蒡子苷制备苷元[J].浙江工业大学学报,2009,37(6):629-632.
[14] 於洪建,刘丹,孙华庚,等.酶解法生产根皮素的方法:中国,ZL200910228671.2[P].2009-11-23.
[15] 梅建凤,金航,李靓,等.生物转化法提高积雪草中积雪草酸的质量分数[J].浙江工业大学学报,2015,43(5):573-577.
[16] 沈萍,陈向东.微生物学实验[M].北京:高等教育出版社,2007:241.
[17] 马卫俊,延慧君,宋新波,等.根皮苷的微生物转化筛选及消耗率的测定[J].食品研究与开发,2014(8):107-110.
(责任编辑:陈石平)
Bioconversion of phlorizin to phloretin by a selectedPenicilliumpurpurescensstrain QL-9204
MEI Jianfeng, LI Liang, YI Yu, CHEN Jianshu, ZHANG Yanlu, YING Guoqing
(College of Pharmaceutical Science, Zhejiang University of Technology, Hangzhou 310014, China)
A bioconversion process was developed for the production of phloretin from phlorizin. First, microbial strains were isolated and screened from the enrichment of apple peel, and then the main composition and initial pH of the medium for producing enzyme, and bioconversion conditions were optimized for improving the bioconversion yield of phloretin. Some desired results were achieved. A strain ofPenicilliumpurpurescensdesignated as QL-9204 was selected from 11 fungus strains, which can specifically produce enzyme for bioconversion of phlorizin to phloretin. The optimum medium for producing enzyme was composed of 2 g/L sucrose, 6 g/L (NH4)2SO4, 5 g/L NaCl, 5 g/L KH2PO4,1 g/L MgSO4and 1 g/L MnSO4with the initial pH of 6. The strain QL-9204 after seed cultivation was inoculated in the medium and cultured for 5 d. The filtrate of the culture was collected and 80 mg/L of phlorizin was added in. The bioconversion was performed at 30 ℃, 250 r/min for 14 h. The molar of phlorizin could reach 90.3%. The developed process shown in this paper has advantages of simple operations, high productivity and low cost, which may be an effective way for the production of phloretin in the pharmaceuticals industry.
phloretin; phlorizin ; bioconversion;Penicilliumpurpurescens
2016-03-05
梅建凤(1973—),男,安徽天长人,副教授,博士,主要从事生物制药方向的研究,E-mail:mrion@zjut.edu.cn.
Q814.9
A
1006-4303(2016)06-0660-05
