一例多种病毒混合感染的实验室诊断及综合防制措施
2016-12-19杨凡李萍樊毅赵军陈盼朱玲徐志文
杨凡,李萍,樊毅,赵军,陈盼,朱玲,2,徐志文,2
(1.四川农业大学动物生物技术中心,四川成都611130;2.动物疫病与人类健康四川省重点实验室,四川成都611130)
一例多种病毒混合感染的实验室诊断及综合防制措施
杨凡1,李萍1,樊毅1,赵军1,陈盼1,朱玲1,2,徐志文1,2
(1.四川农业大学动物生物技术中心,四川成都611130;2.动物疫病与人类健康四川省重点实验室,四川成都611130)
2016年3月,彭州某猪场出现疑似猪蓝耳病病毒(PRRSV)、猪伪狂犬病病毒(PRV)、猪流行性腹泻病毒(PEDV)和猪传染性胃肠炎病毒(TGEV)混合感染严重疫情,猪群发病率和死亡率较高。为进一步确诊和提供科学的防控依据,采集10头繁殖障碍母猪(未曾注射PRRSV疫苗)血样,用IDEXX试剂盒进行猪瘟病毒(CSFV)、PRRSV和PRV gE抗体检测。同时采集2头流产胎儿(对应2头流产母猪)组织分别进行CSFV、PRRSV的RT-PCR检测和PRV gE的PCR检测,采集2头腹泻同时伴随神经症状的仔猪组织进行TGEV、PEDV、猪轮状病毒(RV)的RT-PCR检测和PRV gE的PCR检测。结果显示,母猪CSFV抗体阳性率达90%,对应流产胎儿未检出CSFV,表明无CSFV感染,免疫合格;PRRSV和PRV gE抗体阳性率达100%,对应流产胎儿均测出PRRSV和PRV,表明这两种病毒感染情况严重;2头仔猪PCR和RT-PCR结果提示均有PRV、PEDV和TGEV野毒感染,并根据以上检测结果提出紧急防控措施。
PRRSV;PRV gE;TGEV;PEDV;混合感染
2016年3月,彭州某猪场大量母猪(未曾注射猪蓝耳病疫苗)发生繁殖障碍,表现为流产,产死胎和木乃伊胎;2周龄以内仔猪突发呕吐、拉灰白色或黄绿色稀粪,腥臭味严重,且部分仔猪出现卧地不起、四肢如“划水状”神经症状,死亡率达95%以上。仔猪剖检发现肺淤血、水肿、肉变;脾肿大;小肠肠壁变薄、透明,肠内有灰绿色或黄白色黏稠液体;胃内含大量凝乳块;肾脏散在针尖大小出血点;全身淋巴结不同程度肿大、出血,尤其是肺门淋巴结和肠系膜淋巴结;脑充血、出血。初步诊断为猪蓝耳病病毒(Porcine reproductive and respiratory syndromevirus,PRRSV)、猪伪狂犬病病毒(Pseudorabies virus,PRV)、猪传染性胃肠炎病毒(Transmissiblegastroenteritis virus,TGEV)和猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)混合感染[1-4],可能还有猪轮状病毒(Rotavirus,RV)感染[5],为进一步确诊并为猪场拟定紧急防控措施,特采集样品进行实验室诊断。
1 材料与方法
1.1 试验时间与地点
试验于2016年3—4月在四川农业大学动物生物技术中心实验室进行。
1.2 试验试剂
Trizol细胞裂解液、RT-PCR反转录试剂盒、2× Taq PCR Master Mix、Taq HS酶、2×GC buffer和dNTP Mixture均购自宝生物工程(大连)有限公司;美国爱德士(IDEXX)猪瘟病毒(CSFV)、PRRSV和PRV gE抗体检测试剂盒,均购自四川佑策农业技术咨询有限公司;饱和酚、氯仿(氯仿和异戊醇体积比24∶1)、磷酸缓冲盐溶液(PBS)。
1.3 试验器材
美国Thermo Micro21R微量离心机购自赛默飞成都分公司;美国BIO-RAD酶标仪、PCR仪均购自成都百乐科技有限公司;Eppendorf(EP)管、10 mL注射器。
1.4 样品采集及处理
选取10头繁殖障碍母猪(编号1~10),耳缘静脉采血2~3 mL,室温静置1 h后自然析出血清[6],转移至无菌EP管中,带回实验室检测CSFV、PRRSV和PRV gE抗体。
无菌采集2头流产胎儿(编号A和B,对应1号和2号母猪)肺、脾脏和小脑,以检测CSFV、PRRSV、PRV gE;无菌采集2头腹泻同时伴随神经症状的仔猪(编号C和D)肺、脾脏、小肠及肠系膜淋巴结和三叉神经节,以检测PEDV、TGEV、RV。将组织剪碎、研钵研磨,加PBS制成1∶5组织悬液,置-20℃和37℃反复冻融3次,4℃3 000 r/min离心10 min,取上清液备用。
1.5 抗体检测
采用酶联免疫吸附试验(ELISA)方法,运用IDEXX公司抗体检测试剂盒,对分离的10头繁殖障碍母猪血清进行CSFV、PRRSV和PRV gE抗体检测。试验设置阴、阳性对照各2孔,并严格按照试剂盒说明书操作。
1.6 引物设计
CSFV、PRRSV和PRV gE引物均由动物生物技术中心实验室设计,参照文献[7]设计PEDV、TGEV和RV引物(表1)。所有引物均由生工生物工程(上海)股份有限公司合成。

表1 样品检测所用引物
1.7 病料总RNA抽提及RT-PCR扩增
取适量A、B胎儿和C、D仔猪病料的上清液,用Trizol法抽提病料总RNA,具体操作步骤参照文献[8]。按照反转录试剂盒说明书制备cDNA,RT-PCR反应体系10.0 μL:ddH2O 3.0 μL,2×Taq PCR Master Mix 5.0 μL,上游引物0.5 μL,下游引物0.5 μL,cDNA模板1.0 μL。反应程序:95℃预变性5 min;95℃变性30 s,53~57℃退火30 s,72℃延伸1 min,循环30次;72℃总延伸7 min。产物经1%琼脂糖凝胶电泳鉴定。
1.8 病料总DNA抽提及PCR扩增
取适量A、B胎儿和C、D仔猪病料制备的上清液,用饱和酚、氯仿法抽提病料总DNA,具体操作步骤参照文献[8]。PRV gE的PCR反应体系10.0 μL:2× GC buffer 4.5 μL,ddH2O 1.0 μL,dNTP 2.0 μL,DNA模板1.0 μL,PRV上游引物0.5 μL,PRV下游引物0.5 μL,Taq HS酶0.5 μL。反应程序:95℃预变性5 min;95℃变性30 s,60℃退火30 s,72℃延伸30 s,循环30次;72℃总延伸7 min。产物经1%琼脂糖凝胶电泳鉴定。
2 结果
2.1 ELISA检测结果
10头繁殖障碍母猪血清检测结果显示,CSFV阳性率达90%,PRRSV和PRV gE阳性率达100%,详见表2。

表2 母猪抗体检测结果
2.2 流产胎儿鉴定结果
2头流产胎儿经RT-PCR和PCR鉴定,提示均为CSFV阴性,高致病性蓝耳病病毒和PRV gE阳性(图1—图3)。
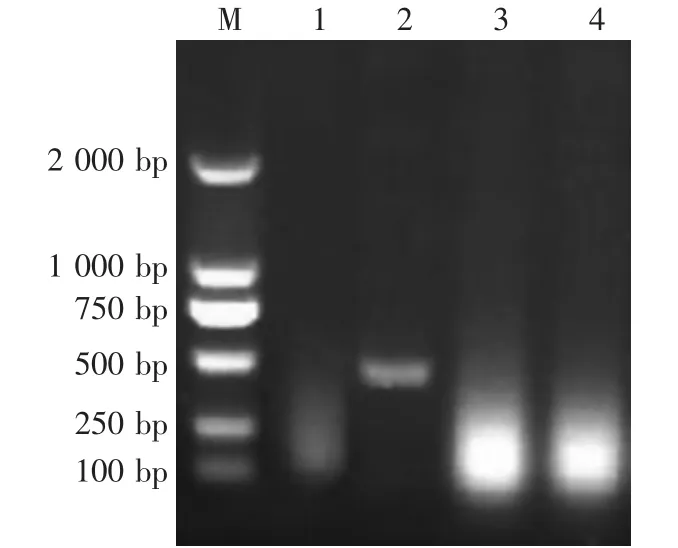
图1 CSFV RT-PCR鉴定结果

图2 PRRSV RT-PCR鉴定结果
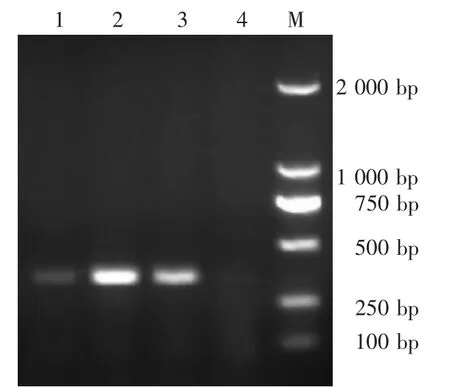
图3 PRV gE PCR鉴定结果
2.3 仔猪鉴定结果
检测结果提示,2头仔猪均为PEDV和TGEV阳性,RV阴性,PRV gE阳性(图4—图7)。
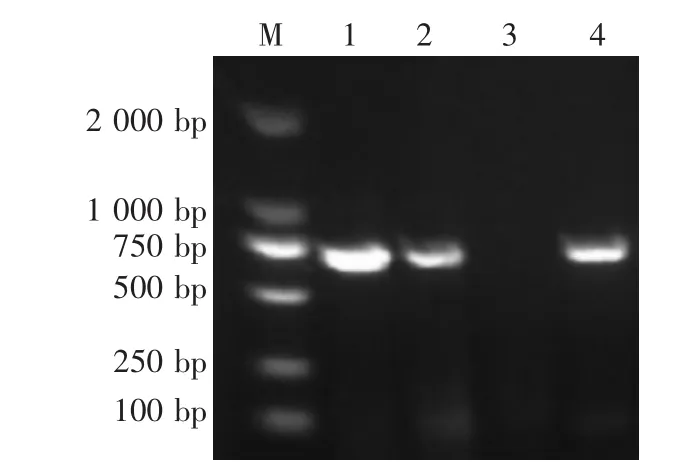
图4 PEDV RT-PCR鉴定结果
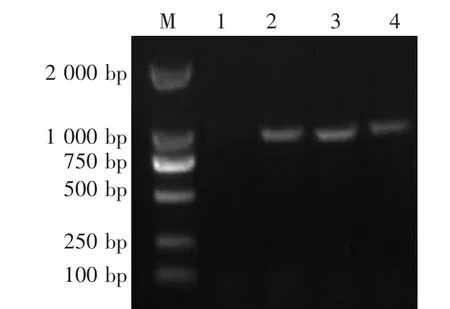
图5 TGEV RT-PCR鉴定结果
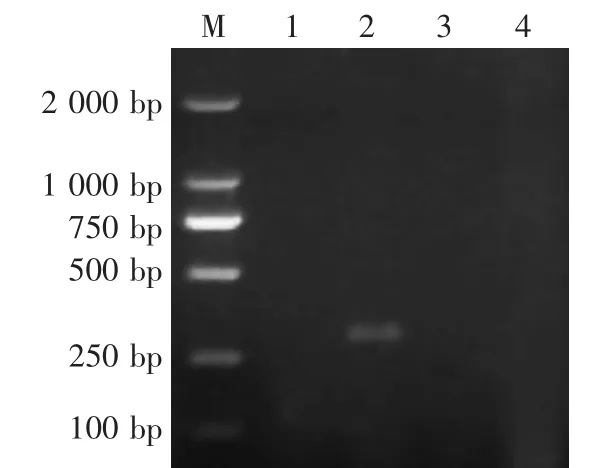
图6 RV RT-PCR鉴定结果
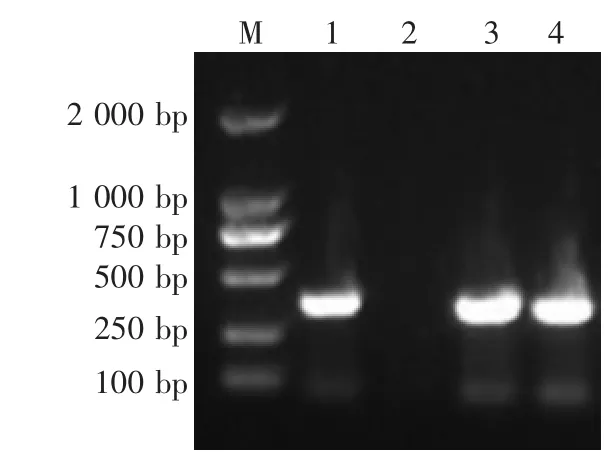
图7 PRV gE PCR鉴定结果
3 讨论
CSFV、PRRSV和PRV一直以来都是危害我国养猪业的重大传染病,几种病毒均可引起种公猪、母猪繁殖障碍。病毒可垂直传播给子代,导致母猪流产,产死胎、木乃伊胎和弱胎等,仔猪发病率和死亡率较高,感染猪耐过后一般发育状态不佳[1-2]。目前,CSFV和PRV一般通过注射疫苗来进行防控,但关于是否给猪群注射弱毒疫苗以预防PRRSV野毒感染,一直都是学术界讨论的热点。市售的CSFV疫苗一般包括脾淋苗和细胞苗[9],前者是经CSFV感染兔之后,经非适宜宿主弱化后,采集兔脾脏和淋巴结等制作而成,产生抗体所需剂量较大,成本高;后者是经细胞传代获得,抗原含量高,成本低廉,目前临床上一般将两种疫苗混合使用。如今所用的PRV疫苗,均缺失过gE毒力基因[10],因此通过ELISA技术即可诊断猪群是否感染野毒。本文采集的10头未曾注射过PRRSV疫苗的繁殖障碍母猪血样,采用IDEXX公司抗体检测试剂盒,进行CSFV、PRRSV和PRV gE检测,同时对1、2号母猪的流产胎儿采样检测CSFV、PRRSV和PRV gE,抗体检测结果显示,CSFV阳性率达90%,PRRSV和PRV gE阳性率达100%,PCR和RT-PCR结果显示CSFV阴性,PRRSV和PRV gE阳性,综合结果表明猪群可能未感染CSFV野毒,其抗体合格率也达到我国农业部规定以上(群体合格率≥70%),但母猪已感染PRRSV和PRV gE,并经胎盘屏障传播给胎儿,由此才能在胎儿组织中检测出这两种病毒。
2头腹泻并伴有神经症状仔猪的PCR和RTPCR检测结果提示,2头猪均有PEDV、TGEV和PRV野毒感染,与根据临床症状和病理解剖推论的初步诊断结果大致相符(RV阴性)。PEDV和TGEV是引起仔猪腹泻的主要病毒,各年龄猪均可发病,患病猪突发呕吐、严重腹泻,最终脱水死亡。PEDV主要感染10 d以内仔猪,死亡率高达100%,在群体中传播速度很快,尤其是在密闭、猪只集中的猪场,病理剖检主要是肠壁变薄、透明,黏膜出血,肠系膜淋巴结高度充血、肿大;对于TGEV,哺乳仔猪感染后死亡率相对较低,且传播速度也相对较慢,病理解剖可见胃底部出血严重,且胃内含有大量乳白色凝乳块[3-4]。临床调查结果表明,二者混合感染情况严重,且多发于寒冷季节,本次猪场发病即在3月份。RV感染症状与前两者相似,但发病情况相对较轻,致病性较强的主要为A群[5]。PRV野毒感染后,母猪和公猪均可出现繁殖障碍,成年猪一般呈隐性感染,可长期向外排毒,但仔猪感染率和死亡率较高,且出现诸如本试验中2头患病仔猪所表现出的四肢如划水样神经症状(PRV具强噬神经性)[2]。这几种病毒对仔猪危害巨大,一旦发病将造成猪场的严重损失,因此猪场平时采取的防控措施起着举足轻重的作用。
综合所有检测结果,发现该猪场为PRRSV、PRV、PEDV和TGEV多种病毒混合感染,建议立即展开紧急防御措施,避免造成更大损失。方案如下:第一,立即隔离饲养未发病猪群,对病死猪依照相关规定进行扑杀或焚烧掩埋,同时做好整个养殖场的消毒、防疫工作,以切断传染源和传播途径,且可以防止细菌继发感染。第二,采集未发病猪只的血液样品,运用ELISA技术监测猪群的PRV gE和gB抗体,立即淘汰gE抗体阳性猪,对可疑猪只隔离饲养,并采集血样进行重测,同时对PRV gB抗体阴性猪立即补免PRV疫苗,以刺激产生抗PRV抗体。第三,合理调节饲料配方和日喂量,可适当加入诸如黄芪多糖等可提升机体免疫力的药物,以增强机体抵抗力。
[1]刘国信.猪伪狂犬病、猪瘟、蓝耳病混合感染的诊治[J].畜牧市场,2010(12):55-56.
[2]许立华,王玲,芦银华,等.三种猪繁殖障碍性病毒混合感染的分子生物学调查[J].中国兽医科技,2004,34(7):40-43.
[3]颜其贵.猪腹泻病毒病概述[J].饲料与畜牧·规模养猪,2013(4):1-2.
[4]任玉鹏,陈弟诗,苏生禹,等.三种猪腹泻病毒性病原多重RT-PCR检测方法的建立及应用[J].中国兽医科学,2013(10):1047-1051.
[5]庞昕,紫家前,赵宏坤,等.猪轮状病毒感染研究进展[J].动物医学进展,2000(4):43-45.
[6]张丽娟,张桂芳,于宪仓,等.动物的血样采集和血清分离技术[J].中国动物保健,2011(7):33-34.
[7]Song D S,Kang B K,Oh J S,et al.Multiplex reverse transcription-PCR for rapid differential detection of porcine epidemic diarrhea virus,transmissible gastroenteritis virus,and porcine group A rotavirus[J].J Vet Diagn Invest,2006,18(3): 278-281.
[8]赵军,朱玲,徐志文.一例严重猪乙型脑炎与伪狂犬病混合感染的诊断[J].养猪,2016(1):108-110.
[9]文崇利,兰家暖,杨厚德,等.猪瘟细胞苗和脾淋苗免疫效果的对比试验[J].黑龙江畜牧兽医,2015(4):107-108.
[10]杨毅,李文刚,饶宝,等.猪伪狂犬病疫苗的研究进展[J].江西农业学报,2010,22(3):154-157.
(编辑:富春妮)
饮食对肠道细菌有重大影响
【美国每日科学网站4月28日报道】题:生活方式对肠道细菌有重大影响,肠道细菌又对健康有重大影响
吃吃喝喝影响着肠道细菌,可能对健康产生影响。荷兰格罗宁根大学/格罗宁根大学医学中心遗传学家西丝卡·韦门加在研究了食物和药物对人体肠道内细菌多样性的影响后得出了这个结论。该研究刊登在美国《科学》周刊上。
在这项研究中,研究人员采集了1 100余名“生命线”项目参与者的大便样本。该项目旨在监控荷兰北部16.5万名居民的健康状况。这些样本被用来分析肠道中细菌和其他微生物的DNA。除大便外,该研究还收集了参与者的饮食、用药和健康状况等信息。
这项研究的独特之处在于它着眼于普通人群,而以前的研究往往着眼于特定疾病的患者。此外,该研究涵盖的人群特别大并详细研究了他们的肠道DNA。
韦门加表示:“研究人员通常只剖析DNA中能区分不同菌种的一个特定区域。我们则绘制了完整的细菌DNA,以获得有关细菌类型的更详细信息。”
这种DNA分析有可能探究是哪些因素影响着微生物组(我们每个人的肠道细菌群落都是与众不同的)的多样性。
影响因素似乎很多。韦门加说:“比如,饮食会在肠道起作用。”
经常喝酸奶或脱脂乳的人拥有更加多样的肠道细菌。咖啡和葡萄酒也能增加多样性,全脂牛奶和高热量饮食则会使之减轻。
格罗宁根大学医学中心研究员、该研究论文第一作者亚历山德拉·热尔纳科娃说:“我们共发现了60个对多样性有影响的饮食因素,它们的确切影响还很难说。但多样性和健康之间确有相关性:越多样越好。”
此外,至少有19种药物—其中有些是广泛使用的—对微生物组的多样性有影响。该校研究人员先前的研究已经证明抗酸剂会减少多样性,而抗生素和糖尿病药物二甲双胍也有影响。
韦门加强调,这些都是重大发现,“疾病往往由多种因素引起,其中大部分因素是无法改变的,比如基因和年龄。但你可以通过调整饮食和用药来改变微生物组的多样性。一旦我们明白了其中的道理,那就会带来新的可能性。”
近来的研究证实了这一点的重要性。现在已经可以通过“粪菌移植”来治疗肥胖症,也就是把瘦人的肠道细菌植入肥胖患者的肠道。适当的饮食或特定的药物也许可以产生相同的效果。
目前,有关微生物组的研究很多,但这些研究往往看起来很难复制。因此,令人惊叹的是,同一期《科学》周刊刊登的比利时研究团队的研究结果与格罗宁根研究团队的结论有大约80%的一致率。
韦门加表示:“关键在于进行研究的方式。”很重要的一点是,大便样本由参与者自己速冻,并且研究人员收集时仍处于冷冻状态。“样本往往通过邮寄方式送达。如果那样的话,就会接触氧气和高温,而细菌在这些条件下是无法存活的。因此,《科学》周刊上这两篇论文为这个领域今后的研究确立了一个新标准。”
(转自参考消息[N],2016-05-03)
S858.28
A
1002-1957(2016)03-0113-04
2016-04-12
长江学者发展计划(IRT13083);四川省科技成果转化项目(2013NC0014)
杨凡(1992-),男,四川南充人,在读硕士研究生,主要从事动物传染病病原分子生物学研究.E-mail:abtcyf@126.com
徐志文,教授,主要从事动物传染病病原分子生物学研究.E-mail:abtcxzw@126.com
