猪细小病毒病的再认识与防控
2016-12-19左振华姚晶余庆王科文
左振华,姚晶,余庆,王科文
[硕腾(上海)企业管理有限公司,上海长宁200050]
猪病防制与保健
猪细小病毒病的再认识与防控
左振华,姚晶,余庆,王科文
[硕腾(上海)企业管理有限公司,上海长宁200050]
猪细小病毒(Porcine parvovirus,PPV)于1983年在我国首次被分离到,目前在全国各地都有流行,能导致母猪以产木乃伊胎、死胎、弱仔和流产、返情、不孕为主要特征的繁殖障碍,特别是对初产母猪,是引起母猪繁殖障碍的主要病原体之一。随着研究的深入,发现一些皮炎、肠炎、呼吸道问题的病例与PPV有关。本文将简要回顾猪细小病毒病,分析目前控制存在的问题,以及探讨如何控制PPV。
1 猪细小病毒简要回顾
猪细小病毒病最早由Mary和Mahncel于1966年发现,Cartwright等(1967)首次分离到PPV,并证明了它的致病作用。潘雪珠等(1983)在我国首次分离到PPV。
1.1 病毒主要特点
PPV属于细小病毒科,细小病毒亚科,细小病毒属,为反单链DNA病毒,包含大约5 000个碱基(Molitoret等,1983),至少有两个开放阅读框(Bergeronet等,1993和1996)。Hao等(2011)将中国发现的PPV基因型分为4个群,中国早期分离到的属于Ⅰ群,后来分离到的多属Ⅱ群,也有PPV3和PPV4被分离到。该病毒粒子直径大约28纳米,由60个结构蛋白分子(VP1和VP2)构成,其中VP2蛋白分子占到90%,为主要中和抗体目标蛋白,为无囊膜病毒。目前PPV只有1个血清型,在各种血清试验(中和试验与血凝抑制试验)中,所有分离毒株表现出高水平的交叉反应。
PPV主要在猪的心脏、肺脏、脾脏和性腺中复制。在母猪脏器中,主要攻击子宫,子宫内病毒含量最高,也破坏肺脏等呼吸器官和脾脏等免疫器官;在胎猪脏器中,病毒主要在心脏、肺脏、脾脏和性腺中复制,以性腺含量最高。对胎猪来说,破坏脾脏、性腺等,同时破坏心脏等核心器官,能造成死亡。它可以在PK-15、SPEV、ST等几个猪细胞系中生长。
PPV的适应性很强,热稳定性很好,可以抵抗90℃干热环境(湿热环境抵抗力差);当pH在3~10时,其感染性无明显变化,对酶、脂溶剂及有机溶剂具有很强的抵抗力,用0.5%漂白粉溶液、2%烧碱水溶液作用5分钟才可以杀死病毒。这些理化特性使得PPV可以在自然界长期、稳定、广泛存在。
PPV可通过母猪胎盘垂直感染胎儿,也可通过公猪精液、发病猪、带毒的器具、病毒污染的环境和鼠类等传播。
1.2 主要临床表现
猪细小病毒基因组差异较小,但病毒毒力有明显差异,根据其不同的致病性至少可分为5组,即非致病性毒株、对免疫不完全胎儿致病能导致胎儿死亡的毒株、对免疫不完全胎儿致病能引起皮炎的毒株、肠炎型毒株和呼吸道型毒株。临床表现为亚临床感染,母猪繁殖障碍,肠炎、皮炎、呼吸道问题等多种形式。
1.2.1 繁殖障碍型表现免疫母猪群出现繁殖损失的情况比较少,但是在未免疫母猪群或者免疫失败母猪群中,细小病毒会大面积暴发流产。猪细小病毒接种公猪、母猪,通常本身无临床表现,也无眼观病变,但可见微观病变。母猪的微观病变主要是子宫内膜、子宫肌层周围的血管广泛地存在单核细胞的血管套现象,在脑、脊髓、眼脉络血管周围也可见血管套现象;公猪在睾丸接种病毒后,引起生精上皮细胞的严重脱化,并伴有多核细胞的形成与脱落。
猪细小病毒的发病机理主要体现在病毒通过胎盘屏障感染胎儿的能力。但是,PPV是如何通过胎盘屏障的仍然不清楚。PPV通过胎盘屏障有3种可能:通过体液(血液或淋巴液)、通过逐渐感染胎盘细胞逐层突破、通过细胞(如巨噬细胞/淋巴细胞)运输(Mengeling等,2000)。因为胎盘细胞对细小病毒并不易感,而且也没有在胎盘细胞中看到细小病毒,所以第2种可能性很小。最可能的突破胎盘屏障的方法是通过免疫细胞的载体作用。有研究表明,在猪的淋巴组织中和胎儿的淋巴细胞中发现了细小病毒。一旦细小病毒进入胎儿体内,细小病毒利用胎儿的快速有丝分裂进行复制,病毒在胎儿的很多器官和组织中都能检测出,细小病毒对胎儿器官与组织没有倾向性。
母猪的繁殖障碍临床表现与感染时所处的妊娠阶段有关。母猪感染PPV以后,往往需要10~14天才能由子宫而感染胚胎或胎儿。如图1所示,如果胚胎在受精后6天内感染PPV,PPV没有能力突破透明带的保护,胚胎将不受影响;如果胚胎在开始骨化之前(妊娠6~35天)感染PPV,胚胎将死亡,出现充血、水肿、出血、体腔血性浆液的积存以及出血性变色和脱水后逐渐变暗(木乃伊化)被母体吸收(Mengeling等,1975),母猪出现妊娠停止而返情;如果胎儿在母猪妊娠35天以后和能够对PPV产生抵抗力的70天之前感染PPV,胎儿将死亡,这时胎儿已经骨化,母体不能完全吸收,会出现胎儿的木乃伊化。一般情况下,PPV感染胎儿为逐个、缓慢进行,如妊娠70天之前胎儿已全部感染,会出现妊娠70天以后母猪腹围减小而出现空怀和不孕,如妊娠70天之后仍有胎儿未被感染,将出现不同大小的木乃伊(图2)、活仔共存现象;如果胎儿在母猪妊娠70天以后接触PPV,胎儿将存活。
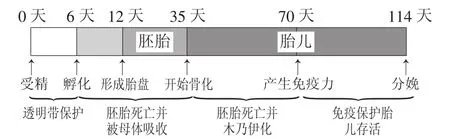
图1 胚胎、胎儿发育不同阶段感染PPV的结果

图2 不同发育时间感染PPV的胎儿死亡、木乃伊化
胎儿的病理变化往往是广泛性的,主要表现为发育器官细胞的坏死,在肺脏、肾、骨骼肌,尤其是肝脏和心脏常出现坏死与矿化,在肌肉组织和皮下可观察到出血。
1.2.2 肠炎型表现1983年夏季,S Dea在加拿大魁北克省猪场发现大批仔猪出现腹泻症状,仔猪大小集中在2~3周龄。病猪排泄量大、粪便形式为水样或黄痢,持续时间一般为1周,无呕吐现象,并且保持很好的食欲。研究人员通过多方认证发现,病料中有大量直径为18~26纳米的细小病毒样粒子存在,除轮状病毒外,排除了其它病毒和细菌的干扰,证明PPV与仔猪腹泻有一定关联,但PPV是否是腹泻产生的原发因素并未阐明。
Chea(2011)发现,在韩国猪细小病毒延长和诱导了地方性猪流行性腹泻(PED),认为感染PPV的仔猪会发生免疫抑制而对PEDV高度敏感。同时,他提到在韩国PED地方流行场,PEDV和PPV的共感染率高达46.6%。
2010年以后,我国猪群发生大范围的PED,给养猪业带来巨大损失,尚不清楚PPV是否像在韩国一样,对地方性的PED起到推波助澜的作用,但细小病毒科的另一个成员—博卡病毒(Boca virus)在腹泻猪粪便中常被分离到。翟少伦等(2010)报道该病毒在我国猪群存在高阳性率。
1.2.3 皮炎型表现Kresse等(1975)发现了PPV的一个新毒株—Kresse株,并随后进行了一些研究,确定其为皮炎型强毒株。1985年,Kresse等再一次对其致病性进行了系统研究,试验从患有严重皮肤炎症的猪体分离并培养PPV,用胎猪肾细胞系(FPK)和猪睾丸细胞系(ST)进行传代。用细胞毒和脚趾病变组织匀浆作为感染物,分别注射皮肤敏感部位(拱嘴、唇、舌、蹄上皮肤和脚趾间皮肤)或口服和同时腹腔注射,对12只同窝仔猪进行攻毒处理。试验发现,PPV作为唯一病原感染时,被感染猪拱嘴、舌和蹄部的皮肤出现了病变,临床表现为厌食、腹泻和结膜炎,证明PPV可以导致皮肤炎症。之后的多位学者在严重皮肤炎症的猪体病变部位分离到PPV(Kresse等,1986;Whitaker等,1990),并同时分离到金黄色葡萄球菌,分别得出这些病例中的严重皮肤炎症是PPV与细菌共同作用以及PPV侵入引起细菌继发感染的结论。
后来的学者(Lager等,1993)也证实PPV能够在受伤的皮肤中复制,但是并未发现明显的皮肤炎症和前面所述的渗出性皮炎或者口蹄处严重溃烂等现象。Kim等(2004)还从渗出性皮炎的回顾性研究中发现PCV2(圆环病毒2型)和PPV的共感染现象。
1.2.4 呼吸道型表现Kennedy等(2000)研究证实,仔猪单纯感染PCV2能导致PMWS(断奶仔猪多系统衰竭综合征),临床比例低而且温和,但是,双重感染PCV2和PPV的仔猪发生PMWS的机会高得多,临床也严重得多,肺部、淋巴、肝脏等器官病理病变更严重,PCV2在这些器官中的抗体滴度明显更高,说明PPV促进了PCV2的繁殖和病变表现。
2010年,Cheung等在和PCV2共感染的肺部发现PPV4,该毒株在中国猪群也被发现(Huang等,2010)。另外,Xiao等(2013)报道在美国的猪肺中发现PPV5毒株(但无临床表现)。至目前为止,对这些从猪呼吸道分离到的PPV的致病作用还缺乏进一步的研究。
2 目前控制存在的问题
2.1 PPV在阳性猪群广泛、持续存在
一方面,PPV经急性感染猪只的粪便与分泌物排毒后,对环境具有很高的耐受性,病毒在环境、污染栏舍与设备中可存活数月,并仍然具有感染性。
另一方面,母猪群通过免疫或者自然感染可获得很好的免疫力,但是,研究表明免疫母猪攻毒后的抗体滴度比未免疫猪上升更快,并且免疫母猪攻毒后仍然可以排毒,这说明PPV能够在免疫猪只体内复制(Józwik等,2009),母猪的免疫并不能完全阻止PPV在猪群的循环。
第三,PPV还可通过鼠类等多种途径传播病毒(Cartwright等,1967;Ruckerbauer等,1978)。
实际中,我们通过PPV血清调查发现(未发表),许多猪群的后备母猪尽管配种前已经免疫两次PPV疫苗,但是低胎龄母猪(3胎以下)仍有抗体上升的过程;另外,许多猪群在生长肥育阶段12~20周龄之间,有PPV抗体转阳过程。尽管我们尚不能确定它们对养猪生产的影响,但是很显然,PPV在这些猪群持续循环。
2.2 免疫效果容易受母源抗体干扰
母猪的母源抗体差异较大,可持续3~9个月,在母源保护存在的情况下免疫,往往会导致免疫失败。许多低胎龄母猪群阳性率较低,可能与免疫时间过早、受到母源抗体干扰有关。
2.3 共感染现象较为普遍
徐君等(2012)从四川省21个规模化猪场采集样品273份,利用PCR方法检测并分析了猪细小病毒和猪圆环病毒2型的单独感染及混合感染情况。检出PPV阳性猪场8个(占38.1%),阳性样本47份(占17.22%),并发现种猪的感染率较高,仔猪感染率相对较低;检出PCV2阳性猪场18个(占85.7%),阳性样本143份(占52.38%),并发现PCV2感染率随猪年龄的增长而升高,检出PPV和PCV2混合感染样品29份(占10.62%);同时检出PPV和PCV2阳性的猪场6个(占28.7%),混合感染主要集中在母猪和保育猪阶段;仅有3个猪场未检出PPV和PCV2病原,占14.3%。该结果说明PPV与PCV2感染及其混合感染在该地区流行广泛。
邬捷等(1986)国内首次报道了我国猪细小病毒与乙型脑炎病毒混合感染。随后相继(蔺文成等,2010)报道猪细小病毒经常与猪繁殖与呼吸综合征病毒(PRRSV)、伪狂犬病病毒、猪瘟病毒、猪链球菌、副猪嗜血杆菌和猪肺炎支原体等病原混合感染,并报道混合感染加重了疾病的严重程度。黄夏等(2007)也发现广西地区猪细小病毒与猪繁殖与呼吸综合征病毒、猪瘟病毒、猪圆环病毒2型和伪狂犬病病毒等4种病毒均有混合感染现象,混合感染样品占猪细小病毒阳性样品的48.00%。
笔者也临床发现多例临床出现较高死胎、流产的猪群在排除PRRSV、PRV、JEV(乙型脑炎病毒)等常见导致母猪繁殖障碍的病原后,确定为PPV和PCV2混合感染。
2.4 缺乏迅速确诊和血清学鉴别诊断
近年来,猪细小病毒的分子生物学诊断方法的研究进展迅速,为快速、准确诊断猪细小病毒病起到了重要的作用。但临床上诸多类似症状的疾病会干扰诊断,特别是与伪狂犬病、乙型脑炎和猪布鲁氏菌病的区别。如在临床上确实出现了木乃伊胎,应将几个这种胎儿(长度小于16厘米)或其肺脏送交实验室进行诊断。建议不要把大的(即妊娠超过70天)木乃伊胎、死胎和新生仔猪送到实验室检查,因为即便这些胎儿感染了细小病毒,它们的组织内也含有抗体,将干扰实验室的检测。
目前的血清学检测不能鉴别诊断野毒和疫苗刺激产生的抗体,给评估母猪群PPV的稳定状态带来一定的困难。
2.5 缺乏重视
近年来蓝耳病、伪狂犬病和圆环病毒病等繁殖障碍病单独或混合感染后对猪场造成了重大损失,转移了疾病防控核心,使防控焦点总是凝聚在蓝耳病、伪狂犬病和猪圆环病毒病这3大疾病之中,使之防控策略缺乏对猪细小病毒病的重视。
3 猪细小病毒的防控措施
3.1 制定科学的免疫程序
由于猪细小病毒的血清型单一,并具有较高的免疫原性,从而接种疫苗就能有效的防控猪细小病毒病。在早期的研究报告中,猪细小病毒疫苗的免疫为2次,一般间隔2~3周,随着疫苗生产工艺的改进,一次免疫也能达到良好的效果,免疫后的后备母猪在妊娠40天时用强毒攻击,可以获得完全保护(丁壮等,2006)。
Edwards等认为猪细小病毒疫苗只能用于没有母源抗体的猪,因为在田间条件下母源抗体可能在不同程度上干扰疫苗的效果。Paul等(1986)发现猪群在接种猪细小病毒灭活疫苗时,母源抗体水平低的猪与血清阴性猪的免疫应答完全一样,而中等水平的母源抗体对疫苗免疫有轻微干扰作用,高效价抗体对疫苗有明显的干扰作用。
吕建强等(2003)进行猪细小病毒母源抗体对灭活疫苗免疫效果影响的研究,结果证实不论母源抗体水平高低均不会明显抑制疫苗的主动免疫反应,但是具有低效价母源抗体猪的主动免疫抗体反应规律,与具有高效价母源抗体猪的主动免疫抗体反应规律不同。在母源抗体滴度大于1∶149.5时,灭活疫苗接种后抗体水平先降低然后上升,增幅只有1~3倍;而母源抗体滴度小于1∶25.6时,主动免疫抗体持续上升,母源抗体阴性的猪抗体增幅最大。根据猪细小病毒的流行病学特点,仔猪哺乳后2~3天即可在血液中检测到母源抗体,并于8~14天达到高峰,母源抗体可持续20~24周,因此多建议猪细小病毒疫苗的免疫接种时间应选择在20周左右。
目前用于防治猪细小病毒的疫苗主要为灭活疫苗、弱毒活疫苗。试验表明,猪细小病毒可被充分致弱,即使在怀孕期间不慎接种,也不可能引起繁殖障碍。尽管已有弱毒活疫苗在临床上使用,但由于猪细小病毒强毒的大量存在,我们不得不考虑病毒重组和弱毒返强。因此,我们建议最好使用灭活苗。
免疫程序。原则上,应在母源抗体消失后免疫后备母猪。对于单点生产猪场,我们可以根据PPV在猪群的流行状况把猪场分为两类,第一类是PPV基本稳定猪场,该类场生长猪群不存在或很少存在PPV循环,后备母猪免疫以前PPV抗体阴性;第二类是PPV不稳定场,该类场后备母猪或肥育猪多在10周龄以后某个阶段PPV抗体转阳。对于第一类猪场,后备母猪可在5月龄以后,配种前20天完成2次免疫,3胎之内母猪可在产后15天免疫1次;对于第二类猪场,为减少PPV的循环,后备种猪可以选择在20周龄进行免疫,之后3~4周再免疫1次,每胎母猪需在产后15天进行免疫1次,如有可能,可考虑一段时间内在合适的时间免疫生长肥育猪(具体免疫时间可视生长猪群的PPV抗体转阳时间而定)以减少PPV的循环。种公猪每年春秋两季分别进行免疫(仇铮等,2013)。对于两点或多点生产猪场,多可采用第一类猪场的免疫方式。
3.2 健全生物安全措施
如前所述,PPV对环境耐受性很强,在环境中几个月后仍具感染性。
对于PPV没有循环或阴性猪群,主要是防止PPV通过各种途径的传入。需做好的事项包括:1)外来人员流动的控制;2)抓好运输工具、物品流动的控制;3)强化卫生消毒;4)做好鸟类、鼠和昆虫等的控制;5)不从PPV阳性场引进带毒精液。
对于PPV存在循环的阳性猪群,要尽量减少场内污染物、感染猪的传播。需做好的事项包括:1)内部猪只流动控制,特别是肥育猪群流动的控制;2)加强内部人员的管理,特别是接触PPV循环的人员不能随意进入易感猪群;3)加强器具的管理,特别是在母猪群和生长肥育猪、后备种猪舍的器具被PPV污染的可能性较大,要加强管理;4)加强全进全出,尤其是针对生长猪舍;5)严格清洗、消毒程序,尤其对肥育猪上市以后猪舍严格的清洗、消毒程序,包括上市猪可能污染的过道,从而减少PPV的污染;6)做好灭鼠及鸟类、昆虫等的控制。
3.3 加强蓝耳病、伪狂犬病和圆环病毒病的防控,减少与猪细小病毒的混合感染
对于蓝耳病、伪狂犬病和圆环病毒病的控制可以参照《硕腾技术通报》第60、61和66期。控制好了其它病毒病感染,特别是蓝耳病、伪狂犬病和圆环病毒病,单独控制猪细小病毒就相对容易得多。
3.4 淘汰正在使用的阳性种公猪,加强引入后备猪的监控、隔离和驯化工作
按季度重复监控公猪精液是否带毒,对于带毒公猪予以淘汰,防止病毒传播而引起基础群生产波动。按计划引进所需要的后备种公猪或补充所需要的后备母猪时,首先,必须了解后备种猪的猪群是否存在猪细小病毒循环;其次,隔离饲养必须60天,并远离主生产区500米以上。如果后备母猪的猪群存在PPV循环,可考虑配合合适的驯化措施,例如,在隔离饲养2周后,接触老母猪或者种公猪的粪便3次/周,至少喂3周左右;或在隔离饲养3周后,和老公猪或母猪鼻对鼻接触,至少持续3周左右。之后,按免疫程序接种好疫苗。为安全起见,对于不存在PPV循环的猪群,强烈建议只使用疫苗免疫,而不使用粪便接触等其它驯化措施来控制PPV。
4 小结
综上所述,PPV是引起母猪繁殖障碍的主要病原体之一,可以导致敏感母猪妊娠早期胚胎死亡而返情以及产死胎、木乃伊胎和流产、不育等,还可能在腹泻、皮炎以及呼吸道疾病中扮演一定角色,以及与猪繁殖与呼吸综合征病毒和猪圆环病毒2型等常见病毒混合感染现象较为普遍存在,可能给养猪业造成更大损失。目前多数猪群同时存在多个疾病的情况下,应首先考虑有效控制PPV。免疫疫苗是控制猪细小病毒病的有效方式,在充分认识猪群PPV循环状况的情况下,选择稳定、有效的PPV疫苗和合理的免疫,配合生物安全和驯化等措施能有效地控制PPV。
(编辑:柳青)
S858.285.3
A
1002-1957(2016)03-0089-04
2016-04-02
左振华(1982),男,湖南永州人,硕士,主要从事养猪技术服务工作.E-mail:ZhenHua.Zuo@zoetis.com
