油松人工林下真菌群落对凋落物分解的影响
2016-12-19王巍伟
杨 晨,刘 勇,陈 晓,王巍伟
(北京林业大学 省部共建森林培育与保护教育部重点实验室,北京 100083)
油松人工林下真菌群落对凋落物分解的影响
杨 晨,刘 勇,陈 晓,王巍伟
(北京林业大学 省部共建森林培育与保护教育部重点实验室,北京 100083)
为探究真菌群落在凋落物分解进程中的影响,以在油松人工林中分离纯化而来的3株真菌Irpex lacteus(白囊耙齿菌)、Collybia subnuda(金钱菌属)和Trametes hirsuta(毛栓菌)为供试菌株,经组合形成不同真菌群落,以油松针叶、蒙古栎阔叶凋落物及两者混合形成3种类型分解基质,通过发酵纯培养的方法,测定了底物有机质量损失及发酵过程中羧甲基纤维素酶(CMCase)活性变化, 并验证了酶活性与底物降解的关系。结果表明:凋落物类型和真菌组合均显著影响凋落物分解,且两者之间存在交互作用;真菌多样性提高了凋落物的分解速率;凋落物混合产生了正面非加性效应,且这种效应主要由阔叶引起。质量损失率和纤维素酶活性呈现类似的规律,即同一凋落物类型下,组合菌群大于或等于单一菌群;同一真菌群落下,阔叶 > 混合 > 针叶。
真菌群落;凋落物类型;质量损失率;纤维素酶
森林凋落物作为养分的基本载体,在养分循环中是连接植物与土壤的“纽带”,其在促进森林生态系统正常的物质循环、养分平衡及维持生态系统功能中扮演着不可缺少的角色;凋落物分解是森林土壤物质转化的基础,是植物和微生物养分的主要来源,显著影响土壤呼吸,进而影响森林碳通量,在维持森林生态系统碳及养分循环中起着重要的作用[1-5]。微生物通过产生并优化分配 C、N、P 循环相关酶类进而影响凋落物的分解[6],因此,研究微生物及其产生的酶在分解过程中的变化,对了解森林凋落物分解的微观生态过程具有重要意义。而真菌由于能够分解其它微生物所不能分解的木质纤维素基质,而成为森林凋落物的主要分解者,并在森林生态系统养分循环中起着重要的作用[7]。目前,大量研究主要集中在森林凋落物分解过程的影响因素、养分释放和凋落物对土壤性质的影响上,近年来,越来越多的国内外学者更加关注微生物及其所产生的酶在凋落物分解过程中所起的作用[8-14]。但目前国内有关凋落物类型和微生物如何共同作用影响凋落物分解的研究相对较少。
本研究以真菌为切入点,以人工培养箱控制分解环境,在实验室对凋落物进行接种分解模拟实验,探究(1)凋落物类型和真菌组合是否交互影响凋落物分解?(2)不同真菌处理下,将凋落物混合是否有正面非加性效应?具体是由哪类凋落物分解加速引起?以期为完善凋落物分解机理提供科学依据。
1 材料与方法
1.1 试验地概况
试验地位于北京市延庆县刘斌堡乡营盘村北,该地区地貌为低山丘陵,属燕山山脉系统,山脉走向近东西向,平均海拔高度500 m,其中最高海拔为1 252 m(佛爷顶)。1978年春,沿等高线穴状整地,栽植2年生的油松苗,营造油松人工林,密度为3 770株/hm2。2001年通过下层抚育法对林分进行了间伐,2011年对原设置的固定样地进行了本底调查,对照(平均树高8.40 m、平均胸径12.96 cm、2 700株/hm2)、轻度(平均树高8.60 m、平均胸径12.84 cm、1 925株/hm2)、中度(平均树高9.63 m、平均胸径13.56 cm、1 700株/hm2)和强度(平均树高8.26 m、平均胸径12.62 cm、1 400株/hm2),其中对照密度与自疏后的油松人工林密度基本相同。林下主要分布的乔木有蒙古栎Quercus mongolica、灌木以鼠李Rhamnus davurica、榛Corylus heterophylla等为主,草本有披针叶苔草Carex lanceolata、黄精Polygonatum sibiricum及菊科Asteraceae等多种植物。
1.2 供试菌株和凋落物来源
课题组前期研究已分离纯化出3种林下优势腐生真菌,经分子鉴定分别为Irpex lacteus(白囊耙齿菌)、Collybia subnuda(金钱菌属)和Trametes hirsuta(毛栓菌)(下分别由a、b、c代替)。
在试验林分中选取树干通直,胸径约15 cm,树高约10 m的3株油松和7株林下蒙古栎作为凋落物收集目标,在生长季末期(落叶期),用高枝剪剪取树冠中层枯黄即将凋落的叶片带回实验室,混匀烘干灭菌后作为标准分解物质。
1.3 实验室凋落物接种分解试验
将收集的针叶凋落物裁成2 cm大小片段,阔叶凋落物裁成1 cm × 1 cm碎块,75 ℃条件下烘干至恒重,再进行环氧乙烷灭菌。灭菌后放入装有10 mL已灭菌的麦芽浸汁液体培养基的50 mL三角瓶内,每瓶放0.8 g凋落物作为分解基质,该分解基质分为3种类型,即针叶树分解基质(0.8 g针叶凋落物/三角瓶)、阔叶树分解物质(0.8 g阔叶凋落物/三角瓶)和针阔叶树混合分解物质(0.4 g针叶凋落物和0.4 g阔叶凋落物/三角瓶)。
在无菌操作台内打开纯培养a、b和c的培养皿,用已灭菌的打孔器(外径6 mm)在平板外围(菌丝生长旺盛区域)打孔,每一平板打孔20次,即得到20个长有菌丝的小圆片,将小圆片放入装有100 mL灭菌水的无菌匀浆仪,搅匀后即获得3种腐生真菌的菌悬液。按比例制作不同组合菌悬液,共8种,分别为CK(300 μL无菌水)、a(300 μL)、b(300 μL)、c(300 μL)、ab(a和 b 各150 μL)、ac(a和 c各 150 μL)、bc(b 和 b 各150 μL)、abc(a、b 和 c各 100 μL)。
将不同组合的菌悬液(8种)分别接入3类分解基质,置于人工培养箱内(温度25℃、湿度80%、无光照)。分解试验持续90 d,每隔20 d取样一次,最后一次隔30 d,共取样4次,每次每种真菌群落每种凋落物取样3瓶,共288瓶。
1.4 质量损失率计算和酶活力测定
往取样瓶中加入 5 mL 预冷的醋酸钠缓冲溶液(50 mmol,pH值6.0),置于25℃ 旋转摇床上、180 r/min 振荡 10 min。将混合液经烘干恒重的定性滤纸过滤,滤液用4℃ 冷冻离心机 10 000 g离心 10 min。取上层清液为粗酶液测定其相关酶的活性,离心管底部的沉淀与过滤后残渣一并烘干至恒重(75℃)[15]。
样品质量损失率(%)=[(样品的初始干重-样品处理后的干重)/样品初始的干重]×100%。
纤维素酶活力采用羧甲基纤维素钠盐(CMC-Na)酶活性测定方法,取0.1 mL粗酶液,加入1.9 mL羧甲基纤维素钠溶液,混匀后50℃水浴30 min,即刻加入1.5 mLDNS试剂,将加样的试管煮沸10 min,取出冷却到室温,蒸馏水稀释至25 mL,混匀,540 nm处测定其吸光值,以0.1 mL煮沸灭活后的粗酶液加1.9 mL羧甲基纤维素钠的溶液为对照,每个处理重复3次[16]。
1.5 数据分析方法
数据通过Excel 进行整理,用SPSS17.0统计分析软件进行数据的处理和分析,Sigmaplot12.5软件辅助作图,并利用One-Way ANOVA方差分析和T检验、Duncan多重比较法检验不同处理间的差异显著性。
2 结果与分析
2.1 总的凋落物质量损失
从表1交互作用分析表可以看出,在0~90 d的整个分解过程中,真菌组合和凋落物类型,均显著影响了凋落物的分解速率,且两者产生交互作用。

表1 真菌组合和凋落物类型对凋落物分解速率的交互作用分析Table 1 Interaction of fungi communities and litter types on litter decomposition rates
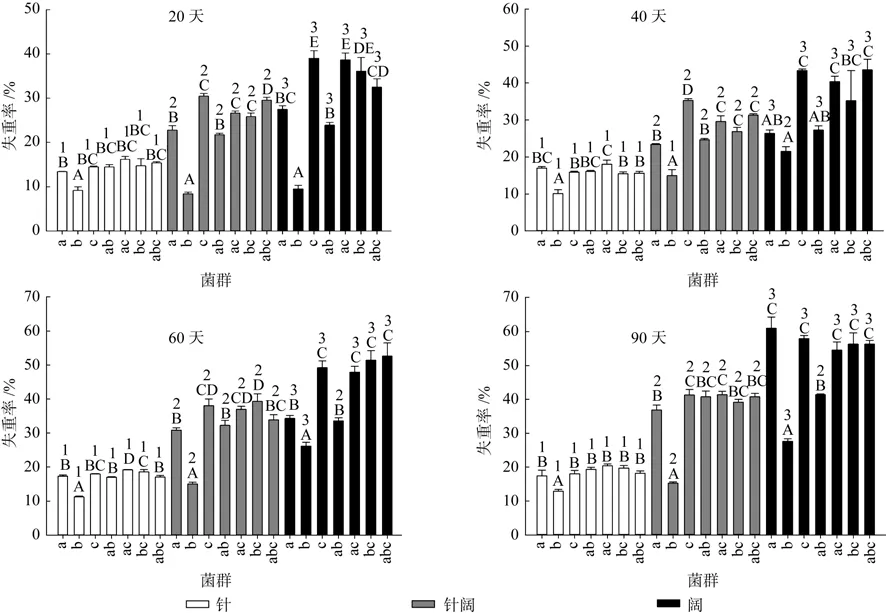
图1 真菌组合和凋落物类型对凋落物分解速率的影响Fig.1 Effect of fungi communities and litter types on litter decomposition rates
在整个凋落物分解过程中,凋落物的失重率随着时间的延长而不断增加。从9.17%~39.04%(20 d)到12.92%~60.96%(90 d)。
凋落物类型影响失重率,但在不同真菌组合条件下对失重率影响的规律不同。分解20 d时,a、c、ac、bc、abc菌处理下表现为阔叶>混合>针叶,ab菌处理下表现为混合=阔叶>针叶,而b菌处理下表现为三类凋落物之间没有差异;40 d时,a、c、ab、ac、bc、abc菌处理下表现为阔叶>混合>针叶,b菌处理下表现为阔叶>混合=针叶;60 d时,a、b、c、ac、bc、abc菌处理下表现为阔叶>混合>针叶,ab菌处理下表现为混合=阔叶>针叶;90 d时,表现与60 d类似。
真菌群落影响失重率,但在不同凋落物类型条件下对失重率影响的规律不同。在针叶凋落物类型下,分解20d时表现为a、c、ab、ac、bc、abc无差异,b菌处理下失重率较低;分解40 d时表现为ac引起的失重率最高,a、c、ab、bc、abc无差异,b菌处理下失重率最低;分解60 d时表现为ac>bc、c>a、ab、abc>b;分解90 d时表现为a、c、ab、ac、bc、abc显著高于b。在混合型凋落物类型下,分解20 d时表现为c、abc>ac、bc>a、ab>b;分解40 d时表现为c>ac、bc、abc>a、ab>b;分解60 d时表现为c、ac、bc、abc>a、ab>b;分解90 d时表现为a、c、ab、ac、bc、abc显著高于b。在阔叶凋落物类型下,分解20 d时表现为c、ac、bc、abc>ab>b;分解40 d时表现为c、ac、abc显著高于a、ab、b;分解60 d时表现为c、ac、bc、abc>a、ab>b;分解90 d时表现为c、a、ac、bc、abc>ab>b。
2.2 凋落物混合对凋落物分解速率的“带动作用”
从表2交互作用分析表中可以看出,在0~90 d的分解过程中,仅真菌组合对凋落物的分解产生影响,且没有交互作用;因此,将凋落物混合没有提高针叶凋落物的分解速率,而真菌对针叶凋落物分解的影响规律应与上一部分(1)中真菌组合对针叶失重率影响相同。
由表3交互作用分析表可以看出,不同的阔叶类型,菌群组合对凋落物分解均产生显著影响,且两者之间产生交互作用。表明凋落物混合影响了阔叶凋落物分解速率。

表2 真菌组合和针叶凋落物类型对针叶凋落物分解速率的交互作用分析†Table 2 Interaction of fungi communities and coniferous litter types on coniferous litter decomposition rates
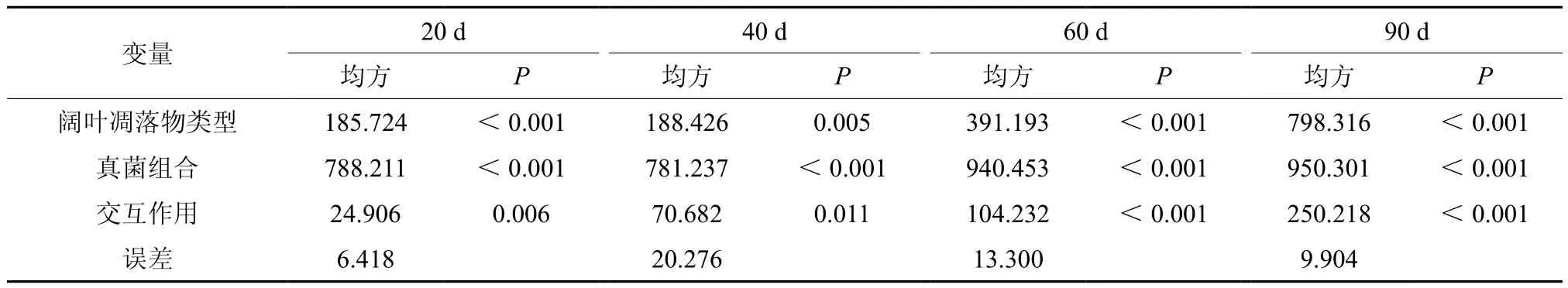
表3 真菌组合和阔叶凋落物类型对阔叶凋落物分解速率的交互作用分析Table 3 Interaction of fungi communities and deciduous litter types on deciduous litter decomposition rates
在0~90 d整个分解过程当中,a菌处理下0~60 d时混合类型中的阔叶的分解显著高于纯阔叶的分解,90 d时两者无差异;b菌处理下,0~20 d时两者无差异,20 d后纯阔叶的分解显著高于混合类型中的阔叶;c菌处理下0~60 d时混合类型中的阔叶的分解显著高于纯阔叶的分解,90 d时两者无差异;ab菌处理下整个分解过程中均表现为混合类型中的阔叶的分解显著高于纯阔叶的分解;ac菌处理下0~40 d时两者无差异,40 d后混合类型中的阔叶的分解显著高于纯阔叶的分解;bc菌处理下整个分解过程中均表现为两者无差异;abc菌处理下0~20 d时混合类型中的阔叶的分解显著高于纯阔叶的分解,20 d后两者无差异。
分解90 d后,ab、ac菌对混合类型中的阔叶的分解高于纯阔叶的分解;b菌对纯阔叶的分解显著高于混合中的阔叶;a、c、ab、abc菌群对两种类型阔叶的分解无差异。此外,可以得出只要有a、c菌存在,阔叶凋落物的失重率均高达60%左右。
2.3 纤维素酶活性
分解60 d时,对实验各处理取样并进行纤维素酶活性测定。从表4交互作用分析表可以看出,凋落物类型和真菌组合均对纤维素酶活产生影响,且之间存在交互作用。
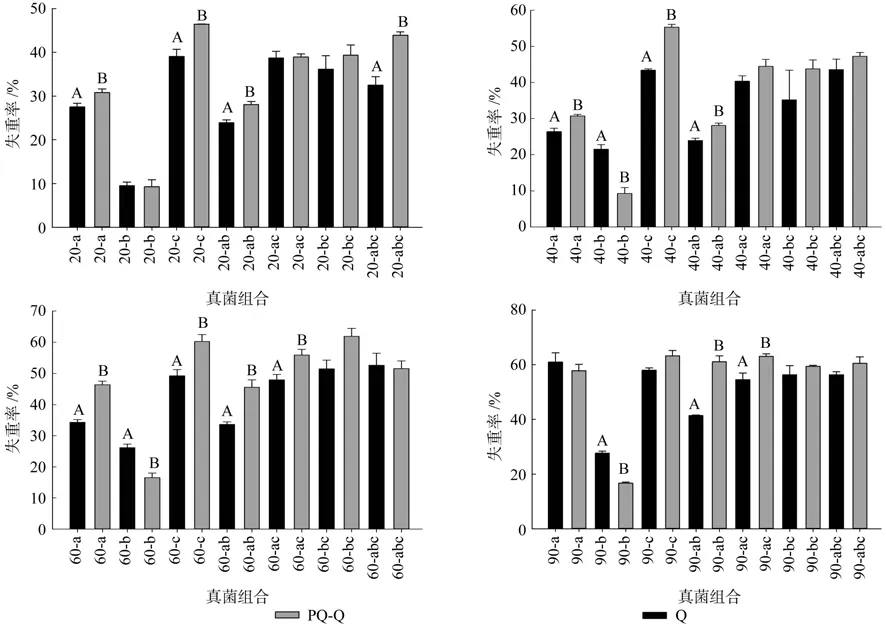
图2 不同真菌组合下混合凋落物对阔叶凋落物分解速率的带动作用Fig.2 Effect of litter mixture on deciduous litter decomposition rate under the decomposition of different fungi communities

表4 真菌组合和凋落物类型对纤维素酶活性影响的交互作用分析Table 4 Interaction of fungi communities and litter types on CMCase activities
从图3中可以得出,纤维素酶活与凋落物失重率总体趋势一致。
凋落物类型影响纤维素酶活性,且在不同真菌组合下存在差异。ac菌处理下表现为混合=阔叶>针叶,其余各真菌组合处理下均表现为混合>阔叶>针叶。

图3 真菌组合和凋落物类型对纤维素酶活性的影响Fig.3 Effect of fungi communities and litter types on CMCase activities
真菌群落影响纤维素酶活性,且在不同凋落物类型下存在差异。在针叶凋落物类型下,纤维素酶活性 c 、ac、bc、abc > a 、ab > b.在混合凋落物类型下,ac、abc >bc>c>a>ab>a.在阔叶凋落物类型下,abc>c、ac、bc>a、ab>b.由此可以得出,b菌分泌的纤维素酶活性在各类凋落物类型下均较低;只要有c菌存在,菌群中纤维素酶活性均维持在较高水平,含有a菌的组合次之,a、c菌与b菌组合显著提高了b菌的纤维素酶活性。
3 讨 论
3.1 凋落物类型、真菌组合对失重率的影响
森林凋落物的分解受气候因子、凋落物质量、土壤动物及微生物等多种因素的影响[17]。而在同一气候区域内,凋落物质量是主导因素,分解速率的差异主要体现在凋落物初始化学组成和叶的结构不同[18]。有研究发现,针叶树种的叶片大多厚革质,角质层较发达,含有较多的难分解成分(木质素、纤维素和单宁等) ,C/N 较高,不利于淋溶、土壤动物机械破坏和微生物降解等作用的发生;而阔叶树种枯落物的难降解成分相对较低,且其比表面积(SLA) 更大,利于微生物大量繁殖从而进行分解,因此一般针叶树种的分解速率会低于阔叶树种[19-20]。本实验中,在不同真菌组合分解条件下蒙古栎的凋落物分解速率显著高于油松针叶,与前人研究结果一致。真菌在凋落物分解过程中扮演重要角色且凋落物分解是一个极其复杂的过程,需要多种真菌共同协调发生[21-23],因此,真菌群落结构(如多样性)的变化也同样与凋落物分解紧密相关。从凋落物分解速率看,真菌群落结构的多样化显著提高了林下3类凋落物在整个分解过程中的分解速率。这与Bardgett和Shine的研究结果相似,即在控制其他分解条件相同的前提下,生物多样性有利于提高凋落物的分解速率[24]。另有研究表明凋落物的厚度影响凋落物分解,凋落物层厚度的增加会促进凋落物的分解[25]。本实验中称取相同质量的针叶、阔叶、针阔混合凋落物,其厚度呈现阔叶 > 针阔混合 >针叶,这样同质量的纯阔叶类型的凋落物的比表面积远大于针叶,为真菌提供了更充足的附着面,有利于微生物数量的增加,进而影响微生物对凋落物降解酶的分泌,进一步解释了失重率阔叶 > 针阔混合 > 针叶的规律。作为参与凋落物分解进程中最为重要的生物活性物质,酶活性涉及各类生物化学过程,与凋落物的分解密切相关,在很大程度上能反映出土壤 C、N、P 等养分循环状况,且因环境条件与凋落物类型的不同而差异[26-27]。 凋落物类型与分解进程对酶活性产生影响,主要原因可能是凋落物质量的不同和分解进程的推移会导致微生物量、结构组成以及生化代谢过程改变,从而使得相关微生物分泌的酶种类、数量及活性发生变化[12]。
从本研究结果中可得出,在不同真菌组合处理下,凋落物分解速率呈现阔叶 > 针阔混合 >针叶的规律;在不同类型的凋落物处理下,随着真菌结构的复杂化,组合菌群的凋落物分解速率大于或等于单一菌群,即真菌多样性的增加有利于凋落物的分解;此外,各处理的纤维素酶活性与凋落物类型和真菌结构变化规律类似。究其原因,可能是在分解过程中不同凋落物为真菌生长提供能量物质存在差异,影响群落中真菌生物量且不同真菌之间产生了协同作用,进而促进对凋落物降解酶的分泌,影响对其凋落物的分解。
3.2 混合型凋落物对凋落物分解的带动作用
由凋落物的失重率规律可以看出,将阔叶凋落物等比混入针叶凋落物后,分解速率没有简单的等于纯阔叶凋落物和纯针叶凋落物分解速率的平均,甚至在ac菌群处理下,分解中后期时混合型凋落物分解速率等于阔叶分解速率。这暗示着,将阔叶混入针叶凋落物对混合后的凋落物起到了提高分解速率的“带动作用”,即正面非加性效应。这里,非加性效应的利或弊是通过把混合凋落物中各类凋落物(针叶或阔叶)的分解速率与他们各自在单独分解时的分解速率的平均值进行比较来判断。究其原因,虽然单种凋落物能使真菌群落在前期大量增殖,但后期大多会出现由于资源不足而产生真菌之间互相抑制的现象,这使得真菌种群数量显著降低[28]。然而,凋落物混合后,养分的互补基本可以保证微生物生存环境的相对稳定,利于微生物的生长[29]。此外,这与Gartner、Hättenschwiler等所发表的观点也有相似之处,即将不同树种的凋落物进行混合,可以产生非加性效应,其可以是有利的,也可以是有弊的,但总体上以有利为主[30-31]。从实验结果可以得出,将凋落物混合在对针叶凋落物分解速率没有差异影响的同时,显著增加了阔叶凋落物的分解速率,因此凋落物混合后产生的正面非加性效应主要由阔叶凋落物分解速率加快引起,这可能与真菌对营养来源的选择密切相关[32],即相比于针叶,真菌更倾向于利用阔叶凋落物。
[1]汪思龙,陈楚莹.森林残落物生态学[M].北京:科学出版社,2010: 182-209.
[2]宋新章,卜 涛,张水奎,等.UV-B 辐射对青冈凋落叶化学组成和分解的影响[J].环境科学,2013,34(6): 2355-2360.
[3] Ge X, Zeng L, Xiao W,et al.Effect of litter substrate quality and soil nutrients on forest litter decomposition: A review[J].Acta Ecologica Sinica, 2013, 33(2): 102-108.
[4]郭剑芬,杨玉盛,陈光水,等.森林凋落物分解研究进展[J].林业科学,2006,42(4): 93-100.
[5]刘益君,闫文德,伍 倩,等.亚热带樟树人工林土壤呼吸对凋落物处理的响应[J].中南林业科技大学学报, 2015, 35(4):83-88.
[6] Waring B G.Exploring relationships between enzyme activities and leaf litter decomposition in a wet tropical forest[J].Soil Biology and Biochemistry, 2013, 64: 89-95.
[7]宋福强,范晓旭,张星星,等.三株丝状真菌分解樟子松凋落物酶活性[J].微生物学通报,2009,36(5): 635-639.
[8] Criquest S, Ferre E, Farnet A M.Annual dynamics of phosphatase activities in an evergreen oak litter: in fl uence of biotic and abiotic factors[J].Soil Biology and Biochemistry, 2004,36(7):1111-1118.
[9] Allison S D, Vitousek P M.Extracellular enzyme activities and carbon chemistry as drivers of tropical plant litter decomposition[J].Biotropica, 2004, 36(3): 285-296.
[10]Aubert M, Margerie P, Trap J,et al.Aboveground-belowground relationships in temperate forests: plant litter composes and microbiota orchestrates[J].Forest Ecology and Management,2010, 259(3): 563-572.
[11]张瑞清,孙振钧,王 冲,等.西双版纳热带雨林凋落叶分解的生态过程.Ⅲ.酶活性动态[J].植物生态学报, 2008, 32(3):622-631.
[12]陈法霖,郑 华,欧阳志云,等.土壤微生物群落结构对凋落物组成变化的响应[J].土壤学报,2011,48(3): 603-611.
[13]季晓燕,江 洪,洪江华,等.模拟酸雨对亚热带三个树种凋落叶分解速率及分解酶活性的影响[J].环境科学学报,2013,33(7): 2027-2035.
[14]宋 影,辜夕容,严海元,等.中亚热带马尾松林凋落物分解过程中的微生物与酶活性动态[J].环境科学, 2014,35(3):1151-1158.
[15]冯 乐.丝状真菌与外生菌根真菌对红松凋落物分解耦合关系的研究[D].哈尔滨:黑龙江大学, 2011.
[16]李杏春.小孔异担子菌及其引起腐朽病害的生物防治研究[D].北京:北京林业大学,2014.
[17]Ge X, Zeng L, Xiao W,et al.Effect of litter substrate quality and soil nutrients on forest litter decomposition: A review[J].Acta Ecologica Sinica, 2013, 33(2): 102-108.
[18]彭少麟,刘 强.森林凋落物动态及其对全球变暖的响应[J].生态学报,2002,22(9):1534-1544.
[19]胡亚林,汪思龙,黄 宇,等.凋落物化学组成对土壤微生物学性状及土壤酶活性的影响[J].生态学报, 2005,25(10):2662-2668.
[20]郭培培,江 洪,余树全,等.亚热带 6 种针叶和阔叶树种凋落叶分解比较[J].应用与环境生物学报, 2009,15(5): 655-659.
[21]Tian G, Kang B T, Brussaard RUSSAARD L.Biological effects of plant residues with contrasting chemical compositions under humid tropical conditions—decomposition and nutrient release[J].Soil Biology and Biochemistry, 1992, 24(10): 1051-1060.
[22]Osono T.Ecology of ligninolytic fungi associated with leaf litter decomposition[J].Ecological Research, 2007, 22(6): 955-974.
[23]Voříšková J, Baldrian P.Fungal community on decomposing leaf litter undergoes rapid successional changes[J].The ISME journal,2013, 7(3): 477-486.
[24]Baedgett R D, Shine A.Linkages between plant litter diversity,soil microbial biomass and ecosystem function in temperate grasslands[J].Soil Biology and Biochemistry, 1999, 31(2): 317-321.
[25]季晓燕,江 洪,洪江华,等.亚热带 3 种树种凋落叶厚度对其分解速率及酶活性的影响[J].生态学报, 2013, 33(6): 1731-1739.
[26]Fioretto A, Papa S, Curcio E,et al.Enzyme dynamics on decomposing leaf litter of Cistus incanus and Myrtus communis in a Mediterranean ecosystem[J].Soil Biology and Biochemistry,2000, 32(13): 1847-1855.
[27]Keeler B L, Hobbie S E, Kellogg L E.Effects of long-term nitrogen addition on microbial enzyme activity in eight forested and grassland sites: implications for litter and soil organic matter decomposition[J].Ecosystems, 2009, 12(1): 1-15.
[28]Lussenhop J.Mechanisms of microarthropod-microbial interactions in soil[M].Academic Press, 1992.
[29]Hansen R A.Effects of habitat complexity and composition on a diverse litter microarthropod assemblage[J].Ecology, 2000,81(4): 1120-1132.
[30]Gartner T B, Cardon Z G.Decomposition dynamics in mixedspecies leaf litter[J].Oikos, 2004, 104(2): 230-246.
[31]Hattenschwiler S, Tiunov A V, Scheu S.Biodiversity and litter decomposition in terrestrial ecosystems[J].Annual Review of Ecology, Evolution, and Systematics, 2005: 191-218.
[32]Handa I T, Aerts R, Berendse F,et al.Consequences of biodiversity loss for litter decomposition across biomes[J].Nature, 2014, 509(7499): 218-221.
Effect of fungal communities on litter decomposition underPinus tabulaeformisarti fi cial forests
YANG Chen, LIU Yong, CHEN Xiao, WANG Wei-wei
(Key Laboratory for Silviculture and Conservation of Ministry of Education,Beijing Forestry University,Beijing 100083, China)
To explore the effect of the fungal communities in the process of litter decomposition, three strains of fungus,Irpex lacteus,Collybia subnudaandTrametes hirsutaseparated and puri fi ed from Chinese Pine Plantations were as the tested strains, which Combined to form different fungal communities, pinus tabulaeformis coniferous and broad-leaved litter Mongolian oak and the mixed to form three types of zymolyte, the method of fermentation was used to assay the mass defect of zymolyte and the activies of carboxymethyl cellulase(CMCase) in fermenting process, and try to com fi rm the relationship between the activities of enzyme and the mass defect of zymolyte.The results showed that the litter types and fungus were signi fi cantly affect the litter decomposition, and there was interaction between them; Fungal diversity improves the rate of litter decomposition; Litter mixture produced positive than additive effect, and this effect is mainly caused by broadleaf.Mass loss and cellulase activity present a similar rule, namely under the same litter type, combination fl ora is greater than or equal to a single fl ora; under the same fungal community, broad-leaved > mixed > needles.
fungal community; litter types; mass loss rate; cellulose enzyme
10.14067/j.cnki.1673-923x.2016.07.008
http: //qks.csuft.edu.cn
S718.5
A
1673-923X(2016)07-0041-07
2015-09-04
国家自然科学基金项目(30972353)
杨 晨,硕士研究生
刘 勇,教授,博士,博士生导师;E-mail:lyong@bjfu.edu.cn
杨 晨,刘 勇,陈 晓,等.油松人工林下真菌群落对凋落物分解的影响[J].中南林业科技大学学报,2016,36(7):41-47.
[本文编校:吴 毅]
