内蒙古荒漠草原可培养放线菌的空间分布特征
2016-12-14贾美清刘成宝韩国栋金宝花张国刚
贾美清,刘成宝,许 帅,李 阳,韩国栋,金宝花,邹 玉,张国刚
(1.天津师范大学 a.天津市水资源与水环境重点实验室,b.生命科学学院,天津 300387;2.内蒙古农业大学生态环境学院,呼和浩特 010019)
内蒙古荒漠草原可培养放线菌的空间分布特征
贾美清1a,刘成宝1b,许 帅1b,李 阳1b,韩国栋2,金宝花1b,邹 玉1b,张国刚1b
(1.天津师范大学 a.天津市水资源与水环境重点实验室,b.生命科学学院,天津 300387;2.内蒙古农业大学生态环境学院,呼和浩特 010019)
为了解土壤放线菌在内蒙古荒漠草原生态系统中的功能,运用稀释平板涂布法和16SrRNA分子鉴定技术对该地区土壤可培养放线菌的空间分布及其与土壤环境的相关性进行分析.结果表明:0~10cm土层中可培养放线菌的数量最多,达到43.33×104~63.33×104CFU/g,远远超过另外2个土层;其次是10~20cm土层,其放线菌数量略高于20~30cm土层的数量.从0~30cm土层中共分离到26个放线菌菌株,其中15个菌株成功测序,属于链霉菌科的链霉菌属.0~30cm土壤中的优势菌为蓝色链霉菌,数量比例达到51.00%.可培养放线菌的数量与土壤含水量、速效磷、速效钾和有机质含量呈正相关,与pH值呈负相关(P<0.01),与土壤铵态氮和硝态氮含量均无统计学意义上的相关关系(P>0.05).
内蒙古荒漠草原;可培养放线菌;16S rRNA;土壤环境
荒漠草原是内蒙古草原的重要组成部分,也是我国重要的畜牧业基地,面积约1 130万公顷,占内蒙古草原区草地面积的10.7%,是草原区向荒漠区过渡的草原生态类型[1].荒漠草原处在一个脆弱的生态环境带上,与其他草原类型相比,其稳定性较差,对自然和人为的干扰较敏感[2].近年来,由于气候变化和人类不合理的开发利用,如过度放牧等,荒漠草原退化加剧,直接威胁着草地的畜牧业生产和人类自身在此地的生存环境.目前,国内外学者对内蒙古荒漠草原进行了大量研究,在植被和生产力、气候变化对草原生态系统、群落结构和土壤呼吸的影响等方面[3-7]取得了很大进展.在草原土壤微生物的生物量研究等方面也取得了一些成果[8-9],但缺乏从纯培养角度进行的放线菌在荒漠草原土壤中空间分布的研究.
土壤放线菌广泛存在于各种类型土壤中,甚至在非洲沙漠、北极永久冻土层、重金属污染地区以及营养贫乏环境中都有放线菌的存在.放线菌参与有机物质的分解和异养营养素循环,可以产生胞外酶分解多种蛋白质和脂类,也是抗生素等药物的主要来源.特殊生境中的放线菌在长期适应过程中可调整其次级代谢过程,产生结构新颖、活性独特的次级代谢产物,是重要的微生物资源之一[10].本研究运用稀释平板法和16S rRNA分子鉴定技术对内蒙古荒漠草原可培养放线菌的数量、物种组成及其与土壤环境的相关性进行分析,了解荒漠草原可培养放线菌的组成和空间分布,为放线菌在荒漠草原生态系统中的功能研究奠定基础.
1 材料与方法
1.1 样地概况
样地位于内蒙古自治区中部城市乌兰察布西北部的四子王旗(41°10′~43°22′N,110°20′~113°E),海拔1 456 m,植被类型为荒漠草原.该地区气候类型为中温带大陆性季风气候,年平均气温为3.4℃,6、7和8月份的月平均气温最高,多年平均值分别为21.5、24.0和23.5℃,≥10℃的年积温为2 200~2 500℃.多年平均降雨量为248 mm,年均蒸发量为2 947 mm,降水量主要集中在 6—9月份,占全年降水总量的70%以上.
1.2 样品采集和处理
土壤样品于2012年8月采自内蒙古四子王旗地区.在四子王旗随机设置6个1 m×1 m的样方,样方间隔2 m.在每个样方内用对角线采样法设4个采样点,每个采样点用土钻采集0~10、10~20、20~30 cm的土样各约50 g,分层混匀,采用四分法从每层混匀的土样中取1份.将所取土样分别均分为2份,用封口塑料袋密封,低温4℃下带回实验室,一份立即进行土壤理化性质的测定,另一份置于冰箱中,冷冻条件下保存备用.
1.3 仪器和试剂
1.3.1 仪器
连续流动分析仪(AA3,德国Seal公司);酸度计(PB-10,德国Sartorius公司);透射防护盖紫外分析仪及成像系统(UV215型,上海领成生物科技有限公司);PCR仪(TC-960F,瑞士Blue Marlin公司);紫外可见分光光度计(T6系列,北京普析通用仪器有限公司);火焰光度计(fp6431型,上海精密科学仪器有限公司).
1.3.2 试剂
Ezup柱式基因组DNA提取试剂盒(生工生物工程(上海)股份有限公司);EB染液(上海经科化学科技有限公司).
1.4 土壤理化性质的测定
按照文献[11]的方法进行土壤理化性质的分析测定:采用电位法测定土壤浸提液的pH,浸提液的质量浓度为0.4 mg/L;使用流动分析仪测定土壤浸提液的铵态氮和硝态氮,浸提液的质量浓度为0.2 g/L;采用105℃烘干比重法测定土壤含水量;采用重铬酸钾容量法-稀释热法测定土壤有机质含量;采用NaHCO3浸提土壤速效磷,钼蓝比色法测定速效磷含量;采用NH4OAC浸提速效钾,火焰光度法测定速效钾含量.
1.5 土壤可培养放线菌的分离培养
采用高氏一号培养基培养土壤放线菌.取0.5 g土样置于装有100 mL无菌水和无菌玻璃珠的锥形瓶中,150 r/min振荡30 min.取土壤悬液进行梯度浓度稀释,土壤悬液的质量浓度为1×10-4g/mL时放线菌计数的菌落数范围为30~300个,该质量浓度即为培养放线菌的土壤悬液最佳浓度.取0.2 mL该质量浓度下的土壤悬液,均匀涂布到直径为90 mm的平板上,同一样品分别设置3个重复.将平板置于28℃的恒温培养箱中培养7 d后,参考文献[12-14]进行放线菌的初步鉴定,并根据菌落特征对其进行分类、编号和菌落计数.最后挑选生长良好的菌落进行分离和纯化.
1.6 土壤可培养放线菌的分子鉴定
1.6.1 土壤可培养放线菌的16S rRNA的PCR扩增
挑取有代表性的放线菌菌株,用DNA提取试剂盒来提取菌落的DNA,以其为模板进行PCR扩增.引物为27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R
(5′-TACGGCTACCTTGTT ACGACTT-3′).PCR反应体系为50μL:10×EsBuffer(含Mg2+)5μL,dNTP4μL(各2.5 mmol/L),上游引物2 μL,下游引物2 μL,Tap Es DNA聚合酶0.5 μL(5 U/μL),模板10 μL(10 ng/μL),加超纯水至50 μL.PCR反应程序:94℃预变性5 min,94℃1 min、55℃45 s、72℃45 s,30次循环,最后72℃下延伸10 min.扩增后的PCR产物用质量分数为1.5%的琼脂糖凝胶电泳检测.
1.6.2 PCR产物测序分析
将电泳检测出的放线菌16S rRNA条带的PCR产物送交北京六合华大基因科技股份有限公司进行测序.将测序结果与GenBank数据库(http://www.ncbi. nlm.nih.gov)进行比对,下载高质量的最相似的序列进行系统发育分析.
1.7 数据处理
采用Excel软件处理数据,使用Spss13.0软件进行单因素方差(One-Way ANOVA)分析.采用LSD法比较不同土层中可培养放线菌数量的差异和土壤理化因子的差异是否具有统计学意义;利用Pearson相关检验各土壤理化因子与可培养放线菌的数量是否存在有统计学意义的相关性.
2 结果
2.1 可培养放线菌的数量
考察内蒙古荒漠草原土壤不同深度土层中的可培养放线菌的数量,结果如图1所示.

图1 不同土层可培养放线菌的数量Fig.1 Numberofculturableactinomycetesindifferentsoillayer
0~30cm土层中的可培养放线菌总量为60×104~108×104CFU/g.由图1可以看出,0~10 cm土层数量最多,为43.33×104~63.33×104CFU/g,同其他土层的差异具有高度统计学意义(P<0.01);10~20 cm土层的数量下降幅度较大,为7.67×104~27.67×104CFU/g;20~30 cm土层的可培养放线菌数量略低于10~20 cm土层的数量,为8.63×104~20.03×104CFU/g.由此可见,土壤中的可培养放线菌主要集中在0~10 cm土层,随着土层深度的增加,数量急剧下降.
2.2 可培养放线菌的结构特征
对分离出的可培养放线菌进行形态特征和16S rRNA基因序列的系统发育分析,结果如表1所示.

表1 分离出的土壤可培养放线菌与其关系最近的典型菌株间的系统发育关系Tab.1 Phylogenetic similarity between isolated culturable actinomycetes and their closest type strains
由表1可以看出,从内蒙古荒漠草原0~30 cm土壤中共分离到26个放线菌菌株.其中15个菌株成功测序,占已分离到的菌株种数的57.69%.通过形态特
征与基因序列分析,证实15个菌株均属于链霉菌科(Streptomycetaceae)、链霉菌属(Streptomyces).这些菌株在GenBank上与最相似菌株的相似度均大于98%.有11个菌株由于测序失败,因此定为未知菌株.
2.3 可培养放线菌在土壤中的分布
分析不同放线菌菌株在土壤中的分布情况,结果如表2所示.

表2 可培养放线菌所占比例Tab.2 Percentage of strains of culturable actinomycetes
由表2可以看出,在已明确分类地位的土壤放线菌菌株中,菌株FXJ1、FXJ14、FXJ20、FXJ39和FXJ61只分布在土壤的0~10 cm土层,其中菌株FXJ1和FXJ14的数量比例分别为3.13%和1.90%,其他3个菌株的数量比例均为1.30%.菌株FXJ3、FXJ33和 FXJ54只分布在0~20 cm土层.菌株FXJ2、FXJ18、FXJ21、FXJ38和FXJ73在0~30 cm的各土层中均有分布.在0~10 cm土层中,菌株FXJ73、FXJ2和FXJ54是可培养的优势菌群;在10~20 cm土层中,菌株FXJ2、FXJ18和FXJ21是可培养的优势菌群;在20~30 cm土层中,菌株FXJ73是可培养的优势菌群.在未知放线菌中,菌株FXJ11、FXJ62、FXJ67只在0~10 cm土层中有分布;菌株FXJ10、FXJ19、FXJ35、FXJ43、FXJ70在各土层中均有分布;菌株FXJ15和FXJ12在0~10cm和20~30cm土层内有分布,并且在20~30cm土层内的数量高于0~10 cm土层.分析不同土层中的优势菌群,结果发现,在0~10 cm土层内,FXJ35和FXJ67为优势菌群;在10~20cm土层内,菌株FXJ10和FXJ70为优势菌群;在20~30 cm土层内,菌株FXJ19和FXJ43为优势菌群.
总的来看,在0~30cm土层中,菌株FXJ73,即蓝色链霉菌的数量比例最高,达到51.00%,远远超过其他菌株;其次是未确定分类地位的FXJ10菌株,数量比例达到28.00%;再次是FXJ70、FXJ43和FXJ2,在土壤中的数量比例分别为25.88%、24.05%和24.11%.
2.4 可培养放线菌数量与土壤环境因子之间的关系
荒漠草原土壤理化性质的测定结果如表3所示.由表3可以看出,研究区域的土壤呈弱碱性,而且0~10 cm土层的碱性相对较弱.含水量由上到下逐渐减少,尤其是从10~20 cm到20~30 cm土层,含水量下降幅度较大.硝态氮、速效磷和速效钾的含量从上到下呈递减趋势,尤其是硝态氮和速效钾的含量在不同土层中的差异较大.铵态氮在10~20 cm土层中含量最高,有机质则是在0~10 cm土层中含量最高.
荒漠草原可培养放线菌的数量与土壤环境因子之间的相关性分析结果如表4所示.由表4可以看出,可培养放线菌的数量与土壤含水量、速效磷、速效钾和有机质含量呈正相关,相关性具有高度统计学意义P<0.01),与pH值呈负相关,相关性具有统计学意义(0.01<P<0.05).与铵态氮和硝态氮含量没有相关性.
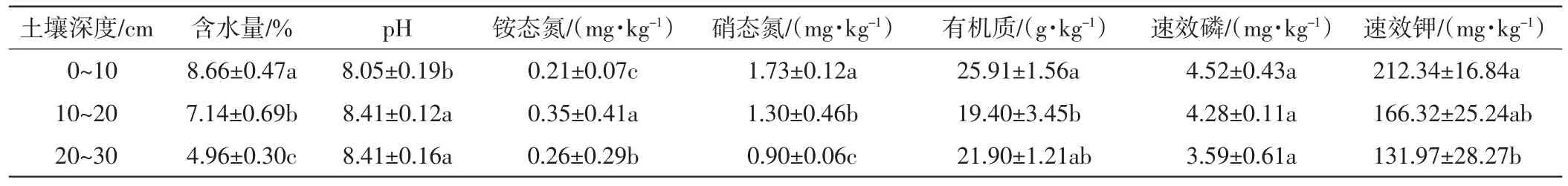
表3 不同深度土壤理化性质Tab.3 Soil physicochemical characteristics in different soil layer
%
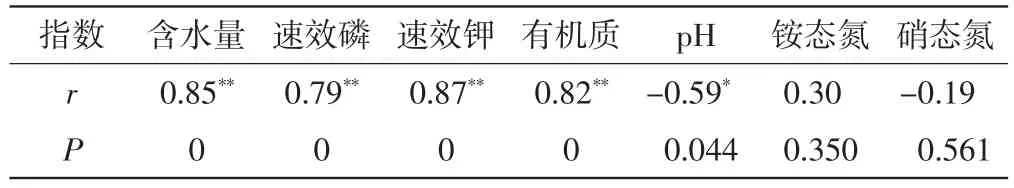
表4 可培养放线菌数量与土壤理化因子相关性分析Tab.4 Correlation analysis between culturable actinomycetes and soil physical chemical factors
3 讨论与结论
本研究以纯培养方法和基于16S rRNA基因序列的系统发育分析对内蒙古荒漠草原可培养放线菌的数量空间分布及其与土壤环境的相关性进行探讨.从0~30 cm土壤中共分离到26个菌株,其中15个菌株可确定到种,均属于链霉菌属;11个菌株由于测序失败,无法明确其分类地位.本研究结果证实了链霉菌属是荒漠草原可培养放线菌的优势类群,这与薛冬等[15]对肇庆星湖湿地可培养放线菌多样性的研究以及李海云等[16]对河西走廊酒泉地区盐碱土壤中可培养放线菌多样性的研究结果一致.对不同土层中可培养放线菌的数量分布特征进行研究,结果发现不同土层中放线菌的数量分布趋势为:0~10 cm>10~20 cm>20~30 cm.0~10 cm土层中可培养放线菌的数量显著高于其他2个土层.这可能是由于0~10cm土层中的水分和养分相对丰富,土壤通气性良好,即环境有利于放线菌的生长和繁殖,因此可培养放线菌数量最多.本研究中不同土层可培养放线菌的数量与土壤含水量、速效磷、速效钾、有机质含量呈正相关,这也证实了放线菌在土壤中的空间分布主要受土壤环境的影响.
[1]中国科学院内蒙古宁夏综合考察队.内蒙古植被[M].北京:科学出版社,1985. Inner Mongolia and Ningxia Research Team of Chinese Academy of Sciences.Vegetation of Inner Mongolia[M].Beijing:Science Press,1985(in Chinese).
[2]李德新.短花针茅荒漠草原动态规律及其生态稳定性[J].中国草地,1994(4):1-5. LI D X.Dynamics and ecological stability of Form.Stipa breviflora desert steppe[J].Grassland of China,1994(4):1-5(in Chinese).
[3]韩芳,牛建明,刘朋涛,等.气候变化对内蒙古荒漠草原牧草气候生产力的影响[J].中国草地学报,2010,32(5):57-65. HAN F,NIU J M,LIU P T,et al.Impact of climate change on forage potential climatic productivity in desert steppe in Inner Mongolia[J]. Chinese Journal of Grassland,2010,32(5):57-65(in Chinese).
[4]YU M,ELLIS J E,EPSTEINH E.Regional analysis of climate,primary production,and livestock density in Inner Mongolia[J].Journal of Environmental Quality,2004,33(5):1675-1681.
[5]韩芳.气候变化对内蒙古荒漠草原生态系统的影响[D].呼和浩特:内蒙古大学,2013. HAN F.Impact of Climate Change on Desert Steppe Ecosystem in Inner Mongolia[D].Hohhot:Inner Mongolia University,2013(in Chinese).
[6] 李元恒.内蒙古荒漠草原植物群落结构和功能对增温和氮素添加的响应[D].呼和浩特:内蒙古农业大学,2014. LI Y H.Responses of Plant Community Structure and Function to Warming and Nitrogen Addition in a Desert Steppe of Inner Mongolia[D]. Hohhot:Inner Mongolia Agricultural University,2014(in Chinese).
[7]刘涛,张永贤,许振柱,等.短期增温和增加降水对内蒙古荒漠草原土壤呼吸的影响[J].植物生态学报,2012,36(10):1043-1053. LIU T,ZHANG Y X,XU Z Z,et al.Effects of short-term warming and increasing precipitation on soil respiration of desert steppe of Inner Mongolia[J].Acta Phytoecologica Sinica,2012,36(10):1043-1053(in Chinese).
[8]JANA E C,LIDIA S W,ARLENE L P,et al.Response of soil microbial biomass and community composition to chronic nitrogen additions at Harvard forest[J].Forest Ecology and Management,2004,196(1):143-158.
[9]ALLENAS,SCHLESINGERW H.Nutrient limitations to soil microbial biomass,activity in loblolly pine forests[J].Soil Biology&Biochemistry,2004,36(4):581-589.
[10]冯鸽,许姗姗,王超,等.黄河三角洲滨海湿地非培养放线菌多样性[J].微生物学通报,2013,40(9):1570-1579. FENG G,XU S S,WANG C,et al.Actinobacterial diversity in a coastal wetland of the Yellow River Delta revealed by culture-independent approach[J].Microbiology China,2013,40(9):1570-1579(in Chinese).
[11]鲁如坤.土壤农业化学分析方法[M].北京:中国农业科技出版社,2000. LU R K.Methods of Soil Analysis[M].Beijing:Chinese Agricultural Press,2000(in Chinese).
[12]阎逊初.放线菌的分类和鉴定[M].北京:科学出版社,1992. YAN X C.Classification and Identification of Actinomycetes[M].Beijing:Science Press,1992(in Chinese).
[13]中国科学院微生物研究所.链霉菌鉴定手册[M].北京:科学出版社,1975. Institute of Microbiology,Chinese Academy of Sciences.Streptomyces Appraisal Manual[M].Beijing:Science Press,1975(in Chinese).
[14]刘志恒,姜成林.放线菌现代生物学与生物技术[M].北京:科学出版社,2004. LIU Z H,JIANG C L.Modern biology and biotechnology of Actinomycetes[M].Beijing:Science Press,2004(in Chinese).
[15]薛冬,赵国振,姚青,等.肇庆星湖湿地可培养放线菌多样性[J].微生物学报,2015,55(11):1485-1494. XUE D,ZHAO G Z,YAO Q,et al.Diversity of cultivable actinobacteria in Xinghu wetland sediments[J].Acta Microbiological Sinica,2015,55(11):1485-1494(in Chinese).
[16]李海云,胡磊,牛世全,等.河西走廊酒泉地区盐碱土壤中可培养放线菌多样性[J].生态学杂志,2015,34(2):367-372. LI H Y,HU L,NIU S Q,et al.Diversity of culturable actinomycetes in saline-alkali soil in Jiuquan region of Hexi Corridor[J].Chinese Journal of Ecology,2015,34(2):367-372(in Chinese).
(责任编校 纪翠荣)
Spatial distribution of culturable actinomycete in the desert steppe of Inner Mongolia,China
JIA Meiqing1a,LIU Chengbao1b,XU Shuai1b,LI Yang1b,HAN Guodong2,JIN Baohua1b,ZOU Yu1b,ZHANG Guogang1b
(1a.Tianjin Key Laboratory of Water Resources and Environment,1b.College of Life Sciences,Tianjin Normal University,Tianjin 300387,China;2.College of Ecology and Environmental Science,Inner Mongolia Agricultural University,Hohhot 010019,China)
To learn the function of soil actinomycete in the desert ecosystem in Inner Mongolia of China,the spatial distribution of culturable actinomycete and its correlation with soil factors were analyzed by dilution-plate method and 16S rRNA molecular identification technique.The results showed that the amount of actinomycete in 0-10 cm soil layer was 43.33× 104-63.33×104CFU/g,which was much more than those in 10-20 cm and 20-30 cm soil layers;the amount of actinomycete in 10-20 cm soil layer was in the second place,which was slightly more than that in 20-30 cm soil layer.26 strains were isolated from 0-30 cm soil,among which 15 strains were successfully sequenced and belonged to Streptomyces.Streptomyces cyaneus was the dominant strain in 0-30 cm soil layer,the percentage of which was up to 51.00%.The amount of culturable actinomycete was positively related to water content,available phosphorus,available potassium and soil organic matter content and negatively related with pH value,and the relationships had statistic significance(P<0.01).While it had no statistic correlations withandcontents of soil(P>0.05).
desert steppe of Inner Mongolia;culturable actinomycete;16S rRNA;soil environment.
Q142
A
1671-1114(2016)04-0050-05
2016-02-23
国家自然科学基金资助项目(31500365,31100330,31270502);天津市科技支撑重点资助项目(15ZCZDSF00410);天津市应用基础与前沿技术研究计划资助项目(12JCYBJC19700);天津市“用三年时间引进千名以上髙层次人才”资助项目(5KQM110006);天津师范大学引进人才基金资助项目(5RL111).
贾美清(1978—),女,实验师,主要从事土壤生态学方面的研究.
张国刚(1976—),男,副教授,主要从事土壤生态学方面的研究.
