抑制microRNA-22可通过调节SIRT1表达减轻氧化应激引起的血管内皮细胞损伤
2016-12-13陶庞琪刘永斌
李 陶庞 琪刘永斌
抑制microRNA-22可通过调节SIRT1表达减轻氧化应激引起的血管内皮细胞损伤
李 陶1庞 琪2刘永斌1
目的 探讨SIRT1及microRNA-22在氧化应激引起的血管内皮细胞损伤过程中的表达变化和机制。方法 使用20 µmol/L叔丁基过氧化氢(t-BHP)诱导人脐周静脉血管内皮细胞株(HUVEC)的氧化应激。Cell Tilter Blue细胞活性分析试验及流式细胞术检测氧化应激对HUVEC增殖及凋亡的影响。Western blot检测氧化应激状态下HUVEC SIRT1蛋白水平的变化,同时qRT-PCR分析氧化应激对HVEC microRNA-22水平的影响。通过转染microRNA-22 inhibitor抑制HUVEC的microRNA-22表达,并观察microRNA-22抑制对氧化应激状态下HUVEC SIRT1表达及细胞增殖的影响。结果 t-BHP诱导的氧化应激可诱导HUVEC的增殖抑制,且降低SIRT1的表达。氧化应激状态下,HUVEC的microRNA-22表达增高。抑制microRNA-22可以恢复氧化应激状态下HUVEC的SIRT1表达,减轻细胞增殖抑制。结论 microRNA-22通过调节SIRT1参与氧化应激引起的血管内皮细胞损伤,可作为动脉粥样硬化的潜在治疗靶点。
动脉粥样硬化;氧化应激;血管内皮损伤;microRNA;SIRT1
血管内皮细胞(vascular endothelial cell,VEC)的损伤是动脉粥样硬化(atherosclerosis,AS)发生发展的中心环节,既是促进AS初期粥样斑块形成的使动因素,又是AS恶化的重要原因之一[1-2]。近年来,关于氧化应激和血管内皮损伤关系的研究较为热门,一般认为氧化应激过程中产生的活性氧簇(reactive oxygen species,ROS)可导致VEC胞膜凋亡,进而导致血管内皮屏障功能丧失,脂质大量沉积于血管内皮下,形成粥样斑块。因此,抗氧化应激保护VEC有助于AS的防治[3-4]。沉默信息调节因子1(Silent mating-type information regulation 2 homolog,SIRT1)是NAD+依赖的组蛋白去乙酰化酶,参与细胞凋亡的调节并与细胞应激状态下的存活有关。既往研究认为SIRT1可以维持细胞的存活,具有抗凋亡作用,同时SIRT1是一种对氧化损伤敏感的蛋白[5]。但SIRT1是否在氧化应激造成的VEC损伤中扮演一定角色,还少有报道。microRNA是一类长度约20~24个核苷酸的非编码RNA,其可通过与靶基因mRNA序列的3'非翻译区互补,从而降解mRNA来实现对靶基因的转录后调控。现有研究证明,microRNA与很多人类疾病相关,包括AS[6]。因此调控microRNA水平,有可能成为治疗或缓解动脉粥样硬化的措施,通过调控microRNA水平来保护AS中的血管内皮损伤具有前景。生物信息学方法证实,microRNA-22可能以SIRT1为靶点。因此,本研究观察了氧化应激状态下VEC中SIRT1水平及microRNA-22水平的变化,同时明确了二者以氧化应激所致细胞损伤的关系,现报道如下。
1 材料和方法
1.1细胞培养
HUVEC细胞株培养采用添加10%胎牛血清的DMEM培养基。细胞消化采用0.25%胰酶(含0.02%EDTA的)。培养环境为37℃,5%CO2培养箱。
1.2细胞氧化应激的诱导
参考Khoo等人报道的方法[7],本研究使用20 μmol/L叔丁基过氧化氢(t-BHP)诱导HUVEC的氧化应激。根据是否使用t-BHP处理,将HUVEC细胞分为两组,分别为:对照组,即不采用任何刺激处理仅常规培养;t-BHP处理组,使用20 μmol/L t-BHP刺激24 h以模拟氧化应激状态。
1.3Cell Tilter Blue法分析氧化应激对HVEC增殖的影响
将上述两组细胞分别接种于96孔板,密度为每孔2×104个细胞。继续培养12 h、24 h、48 h及72 h,分别于上述时间点,弃去孔内原有液体,每孔加入DMEM稀释后的Cell Tilter Blue试剂(1:10)72 μL,同时设立空白对照孔(无细胞,仅含Cell Tilter Blue)避光孵育1 h后,使用荧光微板仪读取各孔荧光强度,并计算细胞存活率。
1.4Western Blot检测氧化应激对HVEC SIRT1蛋白表达水平的影响
将上述两组细胞分别接种于6孔板,密度为每孔1×105个细胞。继续常规培养24 h。收集各组细胞,提取蛋白样本。使用12%的聚丙烯酰胺凝胶进行电泳并转膜。转膜结束后,使用5%脱脂奶粉室温封闭30 min。采用大鼠源性抗人SIRT1抗体及大鼠源性抗人β-actin孵育膜2 h。TBS-T清洗以除去多余一抗。使用辣根过氧化物酶标记的二抗避光孵育膜2 h,TBS-T清洗以除去多于二抗,滴加ECL发光试剂,显影曝光,分析蛋白条带。
1.5qRT-PCR检测氧化应激对HVEC microRNA-22表达的影响
提取两组细胞中的总RNA,采用TaqMan microRNA反转录试剂盒将microRNA反转录为cDNA,采用上文所述方法,对cDNA进行扩增定量。2-△△CT法计算microRNA-22的相对水平(t-BHP处理组相对于对照组)表示,内参选用U6 RNA。
1.6转染microRNA 22 inhibitor抑制HUVEC内的microRNA-22表达
将t-BPH处理后的细胞种植于6孔板,密度为每孔1×105个细胞。当细胞汇合度达到70%时进行转染。转染采用HiperFect转染试剂,转染试剂与miRRNA-22 抑制剂的比例为3:1,miRRNA-22 抑制剂的终浓度为50 nmol/L。转染miRRNA-22 抑制剂阴性对照序列(microRNA inhibitor NG)作为阴性对照。转染48 h后,使用qRT-PCR验证转染效果,取microRNA-22受到抑制的细胞进行后续试验。
1.7microRNA-22抑制对氧化应激诱导的HVEC损伤的影响。
收集t-BPH处理+转染microRNA-22 inhibitor(或microRNA inhibitor NG序列)的HVEC细胞及仅经过t-BPH处理的HVEC细胞,按上文提到的方法,检测抑制micrRNA-22后,HVEC在氧化应激状态下的细胞存活情况,同时观察SIRT1在microRNA 22抑制后的表达变化。
1.8统计学处理
数据的统计学分析采用SPSS 15.0 软件。计量资料采用()表示,采用t检验。以P<0.05为差异具有统计学意义。
2 结果
2.1t-BHP诱导的氧化应激可抑制HVEC细胞的增殖
Cell Tilter Blue分析的结果显示,在24 h,48 h及72 h时间点,t-BHP处理组细胞的存活率分别为[1.3±0.12),(1.8±0.22)及2.2±0.30]均低于对照组[(1.7±0.1),(2.9±0.2)及(4.3±0.3)](P<0.05)(如图1)。

图1 t-BHP处理可以抑制HVEC的增殖
2.2t-BHP诱导的氧化应激抑制HVEC细胞SIRT1的表达
Western blot结果显示(如图2),t-BHP处理细胞24 h后,SIRT1的蛋白水平较对照组有所降低,提示t-BHP诱导的氧化应激可以抑制SIRT1的表达。
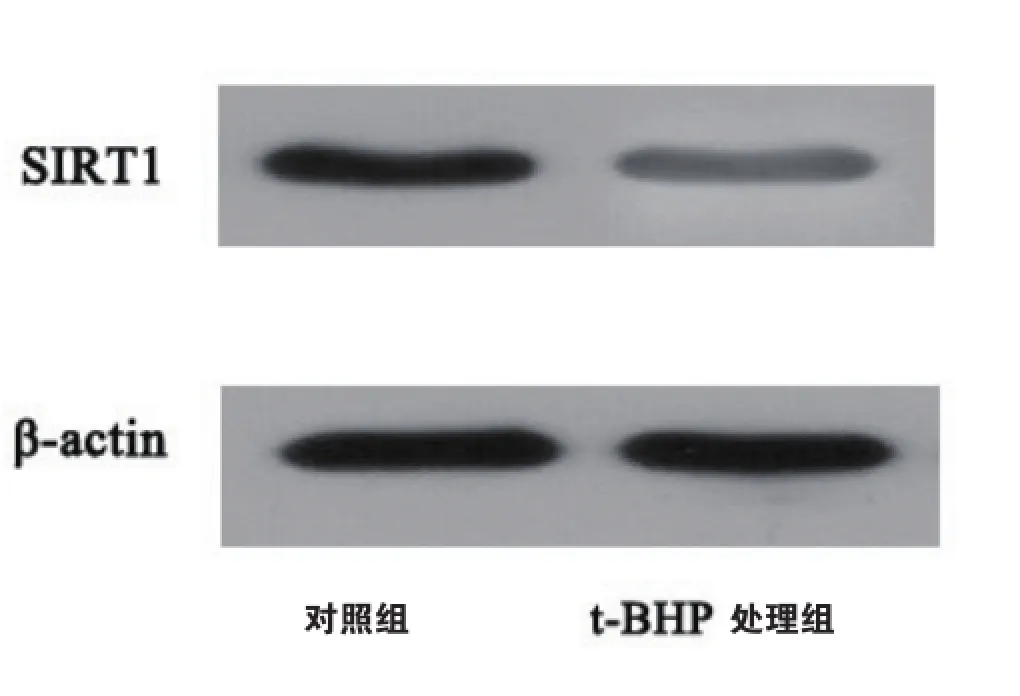
图2 t-BHP处理可以抑制HVEC SIRT1的蛋白水平
2.3t-BHP诱导的氧化应激增加HVEC细胞microRNA-22的水平
qRT-PCR结果显示(如图3),t-BHP处理组细胞的micorRNA-22(1.73±0.24)水平高于对照组(1.00±0.08),差异具有统计学意义(P<0.05),该结果提示t-BHP诱导的氧化应激可以增加HEVC microRNA-22的表达。
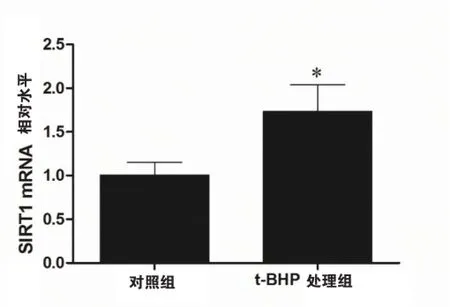
图3 t-BHP处理可以增加HVEC的microRNA-22水平
2.4抑制microRNA-22可增加氧化应激状态下HVEC SIRT1的表达并减轻其损伤
抑制microRNA-22可以增加氧化应激状态下HEVC细胞内的SIRT1表达(如图4)。同时,抑制microRNA-22还可以保护t-BHP诱导的氧化应激对HVEC的损伤,表现为细胞存活率增加(如图5)。
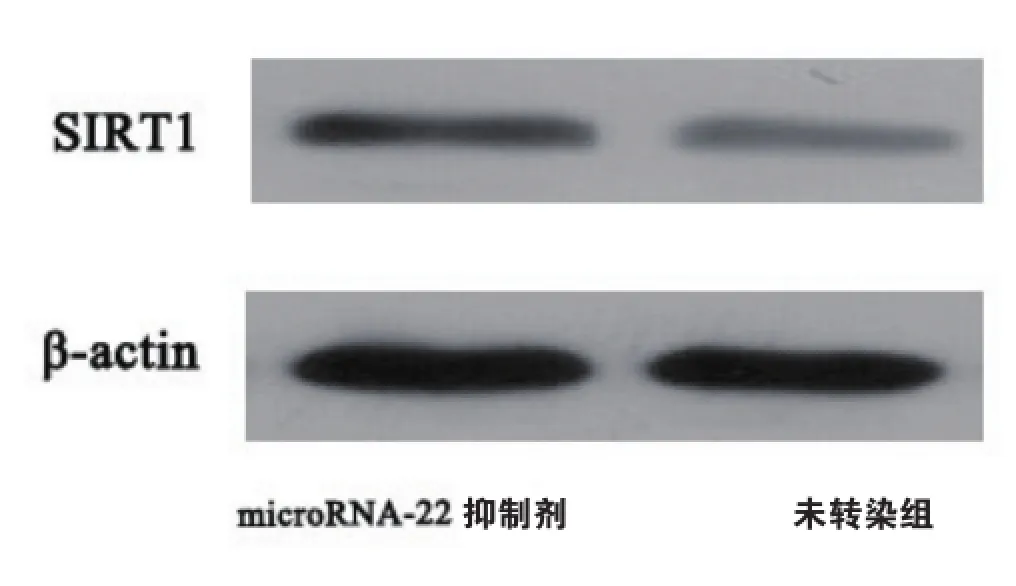
图4 microRNA-22 inhibitor转染可以增加氧化应激状态下HVEC的SIRT1蛋白水平
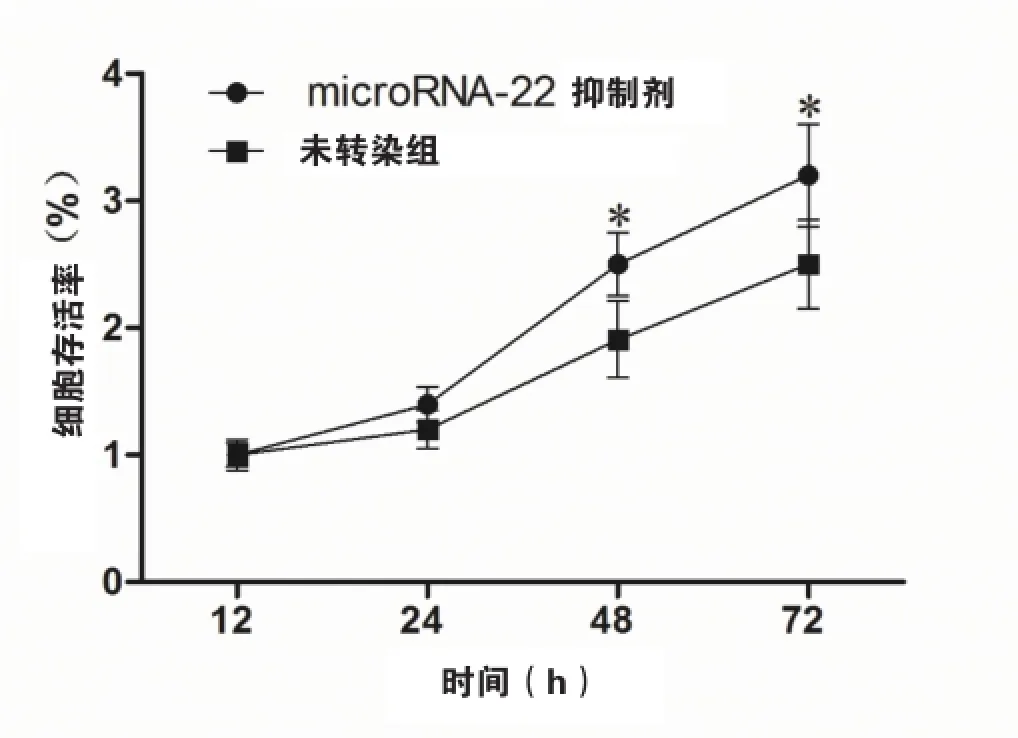
图5 microRNA-22 inhibitor转染可以增加氧化应激状态下HVEC的增殖注:*表示P<0.05
3 讨论
氧化应激是AS发生发展的关键环节,伴随从脂纹形成到粥样斑块破裂乃至血栓形成的整个过程[8]。VEC是血管的首道屏障,也是与血液直接接触的部位,因此是氧化应激损伤的主要目标。ROS对VEC具有直接毒性且作用广泛能诱发细胞凋亡[9]。除外ROS的直接毒性作用,ROS还可作用于一些细胞信号通路,调节相应基因的表达。如ROS可作用于炎性反应调控通路,诱导肿瘤坏死因子α,白细胞介素-1及干扰素-γ等致炎因子的释放,从而引起炎性反应。过度激活的炎性细胞又能释放更多的活性氧物质,从而形成局部恶性循环,加剧对细胞的损伤[10]。ROS还可影响蛋白质的磷酸化,作用于相应的信号通路,实现对细胞生物学行为的调控[11]。此外,ROS还可作用于一些转录因子,ROS可通过直接氧化转录因子或者影响上级通路蛋白的磷酸化修饰来间接作用于转录因子[12]。本研究的焦点之一为AS中氧化应激中产生的ROS对SIRT1表达的影响,以及这种关系对VEC凋亡的影响。SIRT1是sirtuin家族的成员之一,具有组蛋白脱乙酰酶的活性,参与细胞的生长,凋亡调控。一般认为,SIRT1具有抗凋亡作用,是细胞存活的保护因子。在肿瘤中,可检测到SIRT1的高表达,其可抑制肿瘤细胞的凋亡[13]。近期研究指出,SIRT1可以保护百草枯导致的肺泡上皮细胞损伤[14]。还有研究指出,SIRT1可以缓解心肌缺血再灌注过程中的氧化损伤[15]。SIRT1抑制凋亡的机制之一为SIRT1可以结合P53的乙酰化位点,导致P53去乙酰化失活,而后者是重要的凋亡促进因子[16]。此外SIRT1发挥抗凋亡作用的机制还包括对FOXO转录因子的调控[17]。本研究发现在氧化应激状态下,HVEC的SIRT1表达降低,提示不足的SIRT1表达可能是氧化应激导致VEC损伤凋亡的原因之一。此外,本研究还关注了相关microRNA在氧化应激处理前后的表达变化。使用t-BHP处理后,HVEC的microRNA-22水平增高,且与SIRT1的水平呈反比。更重要的是通过抑制microRNA-22的表达,SIRT1的水平得以恢复,且HVEC的凋亡减少。因此,我们认为氧化应激诱导的HVEC损伤与SIRT1的表达不足有关。下调microRNA-22可通过恢复SIRT1表达抑制氧化应激引起的血管内皮细胞凋亡。
[1] 李靓,谢巍.我国动脉粥样硬化基础研究近三年进展[J]. 中国动脉硬化杂志,2015,23(11):1182-1188.
[2] Gray SP,Jandeleit-Dahm KA.The role of NADPH oxidase in vascular disease--hypertension,atherosclerosis & stroke[J]. Curr Pharm Des,2015,21(41):5933-5944.
[3] Bo L,Jiang S,Xie Y,et al.Effect of Vitamin E and Omega-3 Fatty Acids on Protecting Ambient PM2.5-Induced Inflammatory Response and Oxidative Stress in Vascular Endothelial Cells[J]. PLoS One,2016,11(3):e0152216.
[4] Liu LL,Yan L,Chen YH,et al.A role for diallyltrisulfide in mitochondrial antioxidative stress contributes to its protective effects against vascular endothelial impairment[J]. Eur J Pharmacol,2014,15(725):23-31.
[5] Kim H,Lee KH,Park IA,et al.Expression of SIRT1 and apoptosis-related proteins is predictive for lymph node metastasis and disease-free survival in luminal A breast cancer[J]. Virchows Arch,2015,467(5):563-570.
[6] 梁斌,蒋晓.MicroRNA在胆固醇逆转运中的调节作用[J]. 中国动脉硬化杂志,2014,22(2):196-199.
[7] Khoo HE,Azlan A,Ismail A,et al.Inhibition of oxidative stress and lipid peroxidation by anthocyanins from defatted Canariumodontophyllum pericarp and peel using in vitro bioassays[J]. PLoS One,2014,9(1):e81447.
[8] Bashar T,Akhter N.Study on oxidative stress and antioxidant level in patients of acute myocardial infarction before and after regular treatment[J]. Bangladesh Med Res Counc Bull,2014,40(2):79-84.
[9] Chang H,Huang G,Liu L,et al.Protective effects of vitamin E on the vascular endothelial cells from oxidative injury by oxidized lowdensity lipoprotein in vitro[J]. Wei Sheng Yan Jiu,2003,32(6):576-578.
[10] Meng N,Zhao J,Su L,et al.A butyrolactone derivative suppressed lipopolysaccharide-induced autophagic injury through inhibiting the autoregulatory loop of p8 and p53 in vascular endothelial cells[J]. Int J Biochem Cell Biol,2012,44(2):311-319.
[11] Cao YJ,Zhang YM,Qi JP,et al.Ferulic acid inhibits H2O2-induced oxidative stress and inflammation in rat vascular smooth muscle cells via inhibition of the NADPH oxidase and NF-kappaBpathway[J]. IntImmunopharmacol,2015,28(2):1018-1025.
[12] Yun Y,Gao R,Yue H,et al.Synergistic effects of particulate matter(PM10)and SO2 on human non-small cell lung cancer A549 via ROS-mediated NF-kappaB activation[J]. J Environ Sci(China),2015,1(31):146-153.
[13] Hu A,Huang JJ,Li RL,et al.Curcumin as therapeutics for the treatment of head and neck squamous cell carcinoma by activating SIRT1[J]. Sci Rep,2015,24(5): 13429.
[14] Li S,Zhao G,Chen L,et al.Resveratrol protects mice from paraquat-induced lung injury: The important role of SIRT1 and NRF2 antioxidant pathways[J]. Mol Med Rep,2016,13(2):1833-1838.
[15] Ding M,Lei J,Han H,et al.SIRT1 protects against myocardial ischemia-reperfusion injury via activating eNOS in diabetic rats[J]. CardiovascDiabetol,2015,21(14): 143.
[16] Yang H,Yan B,Liao D,et al.Acetylation of HDAC1 and degradation of SIRT1 form a positive feedback loop to regulate p53 acetylation during heat-shock stress[J]. Cell Death Dis,2015,7(6): e1747.
[17] Choi HK,Cho KB,Phuong NT,et al.SIRT1-mediated FoxO1 deacetylation is essential for multidrug resistance-associated protein 2 expression in tamoxifen-resistant breast cancer cells[J]. Mol Pharm,2013,10(7):2517-2527.
Inhibition of microRNA-22 Could Antagonize the Injury Casedby Oxidative Stress in Vascular Endothelial Cells Via Targeting Sirt1
LI Tao1PANG Qi2LIU Yongbin11 Department of Cardiovascular,Lanzhou Petrochemical General Hospital,Lanzhou Gansu 730060,China,2 Department of Respiratory
Objective To investigate the change of SIRT1 and microRNA-22 expression in vascular endothelial cell injury induced by oxidative stress. Methods20 µmol/L t-BHP was used to induce oxidative stress injury. The proliferation and apoptosis of HUVEC under oxidative stress were detected with cell tilter blue assay and flow cytometry. The change of level SIRT1 was determined with Western blot. The level of microRNA-22 in HUVEC under oxidative stress was detected with qRT-PCR assay. The down-regulate of microRNA-22 in HUVEC,microRNA-22 inhibitor was transfected followed with cell tilter blue assay,the effect of microRNA-22 inhibition on HUVEC proliferation was observed. Results The oxidative stress caused by t-BHP could inhibit proliferation of HUVEC. Also,the level of SIRT1 decreased in HUVEC after treated with t-BHP. A high expression of microRNA-22 was observed in HUVEC under oxidative stress. Inhibition of microRNA-22 could recover the expression of SIRT1. Moreover,down-regulation of microRNA-22 could antagonize the proliferation inhibition induced by oxidative stress. Conclusion MicroRNA-22 could play a role in the HUVEC injury caused by oxidative stress via regulate SIRT1. It can be a potential therapy target for atherosclerosis.
Atherosclerosis,Oxitative stress,Vascular endothelial cell injury,MicroRNA,SIRT1
R541
A
1674-9316(2016)21-0023-04
10.3969/j.issn.1674-9316.2016.21.014
1兰州石化总医院心内科,甘肃 兰州 730060;2呼吸科 通讯作者:刘永斌,E-mail:liuybres@126.com
