西南地区夏块菌子实体内的细菌多样性分析*
2016-11-30李云龙彭一航燕腾巩合德
李云龙,彭一航,燕腾,巩合德
(西南林业大学生态旅游学院,云南昆明650224)
西南地区夏块菌子实体内的细菌多样性分析*
李云龙,彭一航,燕腾,巩合德**
(西南林业大学生态旅游学院,云南昆明650224)
以夏块菌(Tuber aestivum)为研究对象,采用传统室内分离培养的方式对其子实体内细菌菌株分离培养,并对比筛选,对云南省保山市和四川省会东县的夏块菌子实体内细菌多样性进行研究。结果表明,所分离出的细菌属于5门11属19种,其中,γ-变形菌门所占比例最大,为67%,假单胞菌属的Pseudomonas fuscovaginae为优势类群;厚壁菌门(Firmicutes)所占比例其次,为第二大群,以葡萄球菌属的Staphylococcus simiae、Staphylococcus warneri为优势类群。此外还分离得到拟杆菌门(Bacteroidetes)细菌22株,占9%;α-变形菌门细菌14株,占6%;β-变形菌门6株,占3%。
夏块菌;子实体;细菌;优势类群
块菌(truffles)是一大类地下生大型真菌的统称,因具有较高的营养价值且产地稀少,产量有限,而备受推崇。其中法国黑孢块菌与意大利白块菌更是块菌家族中的明星成员,素有“地下黄金”和“上帝的食物”的美誉,其价值与珍稀程度可见一斑[1]。从分类学上而言,块菌有广义与狭义之分,广义的块菌是指隶属于真菌界(Fungi)子囊菌门(Ascmyeotina)担子菌门(Basidiomyeotina)和接合菌门(Zygomyeotina)的不同种,狭义上的块菌是指子囊菌门中的块菌属(Tuber)所含种类。后者也是日常多为人们平时所认同的块菌,而众多经济价值极高的种类多在本属,本文所指块菌也只是狭义上的块菌种类[2-3]。
夏块菌(Tuber aestivum)是我国国产块菌中经济价值较高但发现较晚的一个种,《中国的经济真菌》名录中较早收录了夏块菌一词,并指出我国北方及西南地区有该种的分布,但无标本的引证[4]。随后大量研究者也都报道和介绍了该种,但同样无具体产地描述及标本。从确认该种在中国存在以后,国产夏块菌与欧洲块菌是否为同一种的争论从未间断,研究者各执一词,本文对此不予讨论。关于国产夏块菌的地理分布,2014年龙新华[5]分别对云南省保山市和四川省会东县的夏块菌进行详细报道,并有具体的采集记录及野外采集形态特征记录。笔者于2015年8月~10月分赴云南省保山市和四川省会东县实地采集夏块菌子实体,运用分子实验手段,对其子实体内的细菌进行室内培养,以期揭示夏块菌子实体内的细菌多样性,为筛选优势菌株及促栖菌(MHB)研究打下基础,进而加深人们对夏块菌的认识,并为夏块菌菌根合成乃至夏块菌的人工栽培提供参考,促进夏块菌的研究开发与保护。
1 材料与方法
1.1材料
以国产夏块菌为研究实验材料,新鲜子实体分别采自云南省保山市与四川省会东县,生境均为华山松(Pinus amandii)为优势树种的森林,且菌塘(块菌采集地点)均为块菌的多年固定生长点,距离与人类主要活动区域较远,受人类活动干扰较弱,干扰因素较少,较好地保持了块菌生长的原始生态环境。将发现的夏块菌子实体放入无菌袋,置于事先准备好的冰盒中保存,随后,对采集地的地理信息(地名、采集日期、经纬度、海拔)和生境信息(土壤、温湿度、林型、优势种、伴生树种)等进行详细记录。采集完毕后在实验室内将各地采集的子实体编号,见表1。

表1 样品采集信息Tab.1Samples information used in this study
1.2样品处理
1.2.1细菌的分离纯化与培养
采集到的子实体在实验室内进行编号处理后,使用无菌水对子实体表面进行冲洗,将泥土等冲洗干净之后,置于超净工作台至晾干,晾干后使用酒精(75%)或酒精灯对其进行表面消毒灭菌,而后徒手掰开子实体[7],并使用灭菌后的手术刀取菌肉0.5 g至装有灭菌完毕的4.5 mL NaCl(0.85%)的离心管中。在称量前对电子天平进行灭菌。将取好菌肉的离心管,使用高通量组织研磨仪进行研磨至组织块呈均匀糊状。随后在28℃的摇床中放置0.5 h,充分混匀,并将此时的菌液定义为10-1浓度的悬浊液。在超净工作台内用移液枪抽取1 mL的10-1的菌液至装有9 mL无菌水的离心管中,反复吹吸,定义此时悬浊液浓度为10-2。以此类推,得到10-3~10-6浓度的悬浊液[8-10]。将稀释完毕的10-4~10-6浓度的悬浮液均匀涂抹到TSA培养基上,之后放置在28℃生化培养箱中倒置培养约48 h。待培养基中细菌菌落长成后,用消毒完毕的牙签挑取单菌落至TSB培养液(TSA培养基不加琼脂)中培养,并对其菌落数(CFU)进行计数。
1.2.2细菌的筛选与纯化
将TSB培养基中的细菌菌液培养3 d~5 d后,将其在GeneAmp9700 PCR仪进行扩增(25 μL的细菌V3区),PCR扩增反应体系成分包括:2 μL 10× buffer(含Mg2+),0.5 μL dNTP(1 mmol·L-1),0.5 μL BSA(1%),1 μL MgCl2,0.5 U Taq Polymerase(Takara Taq,Takara Biotechnology,Dalian Co.Ltd., China),引物F341/R518各1 μL(5 μmol·L-1),DNA模板1 μL,加双蒸水补足至25 μL。扩增程序具体如下:95°C预变性5 min;94°C变性1 min,60°C退火1 min,72°C延伸1 min,共30个循环;72°C延伸10 min。PCR产物用1.2%琼脂糖凝胶电泳检测。放入紫外仪观察,选取条带较亮者送检。将检测结果进入BLAST进行比对,根据比对结果进行建树。
2 结果与分析
2.1微生物的计数
夏块菌子实体内细菌菌落数(CFU)统计结果见表2、表3。
2.2种类多样性
将分离培养的细菌送检后,以Korarchaeota(AF255604.1)、Uncultured Korarchaeota(KT453572.1)序列为外类群,根据检测细菌的16Sr-DNA序列,构建得出夏块菌子实体内细菌的系统发育树,见图1。
由图1可知,夏块菌子实体内可培养细菌主要分布于α-变形菌门、β-变形菌门、γ-变形菌门、拟杆菌门、厚壁菌门。
本次实验共得到可培养菌株233株,对其多样性进行分析发现,本次实验中分离所得细菌所占比例最大的类群是变形菌门。其中分离得到γ-变形菌门菌株157株,占总数的67%,为所占比例最大的一支。γ-变形菌门的细菌主要包括:假单胞菌属(Pseudomonas),占40%(63/157);布丘氏菌属(Buttiauxella),占24%(37/157);寡氧单胞菌属(Stenotrophomonas),占18%(28/157);埃希氏菌属(Escherichia),占11%(18/157);不动杆菌属(Acinetobacter),占7%(11/157)。此外,布丘氏菌(Buttiauxella agrestis)占25%(37/157),寡养单胞菌(Stenotrophomonas maltophilia)占18%(28/157),埃希氏杆菌(Escherichia vulneris)占11%(18/ 157),不动杆菌(Acinetobacter junii)占7%(11/ 157)。
除γ-变形菌门外,厚壁菌门是本次实验分离得到的另一大类群,占14%(33/233)。主要是葡萄球菌属Staphylococcus simiae、Staphylococcus warneri、 Staphylococcus hominis。本次实验还得到α-变形菌门细菌14株,占总菌株数的6%,其中短波单胞菌(Brevundimonas diminuta)、剑菌属与根瘤菌属(Ensifer/Sinorhiz obium)各7株。万山平[11]曾在攀枝花白块菌土壤中分离得到此类细菌,在一定程度上反映出块菌子实体内的细菌与其菌塘内细菌具有一定的相关性。β-变形菌门和拟杆菌门细菌分别占总数的3%和9%,以金黄杆菌属的Chryseobacterium vrystaatense为代表,拟杆菌门以马赛菌属的蒂莫内马赛菌(Massilia timonae)为主。
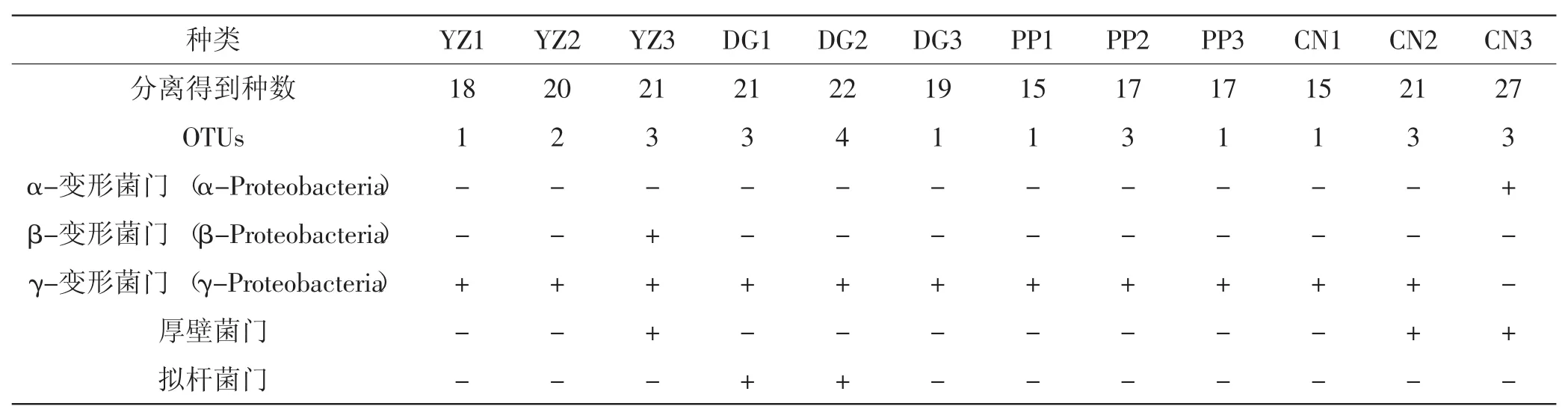
表2 12个夏块菌子囊果内筛选出的细菌及OTUsTab.2Number of bacterial isolates screened from 12 sporocarps of Tuber aestivum

表3 12个夏块菌子囊果内细菌的菌落数(CFU)Tab.3The bacterial CFU of 12 ascocarps of Tuber aestivum
3 讨论
本实验中采集了12个夏块菌子实体用作分析,结果表明12个子实体的生物量大致相同,共得5个门233株细菌,分布在α-变形菌门、β-变形菌门、γ-变形菌门、拟杆菌门、厚壁菌门,这与同类相关实验所得细菌分布大致相同[10,12-15]。
γ-变形菌门是本次实验中所得数量最多的一门,假单胞菌属是其优势类群。假单胞菌类群中多数与Pseudomonas rhizosphaerae、Pseudomonas japonica、Pseudomonas alkylphenolia、Pseudomonas entomophila相似度极高。假单胞菌属种类也常从块菌属中分离出来,分离自波式块菌中的假单胞菌中的一些类群具有抑制植物病原菌的作用,并通过控制纤维素分解、几丁质分解和蛋白水解的方式对波式块菌菌丝的生长和形态发育产生影响[16];此外Barbara Citterio等[17]的研究表明假单胞菌对于波式块菌子实体结构的构建与修复具有积极的影响作用。因此假单胞菌属是一种常见的优势种群,存在于块菌子实体内。
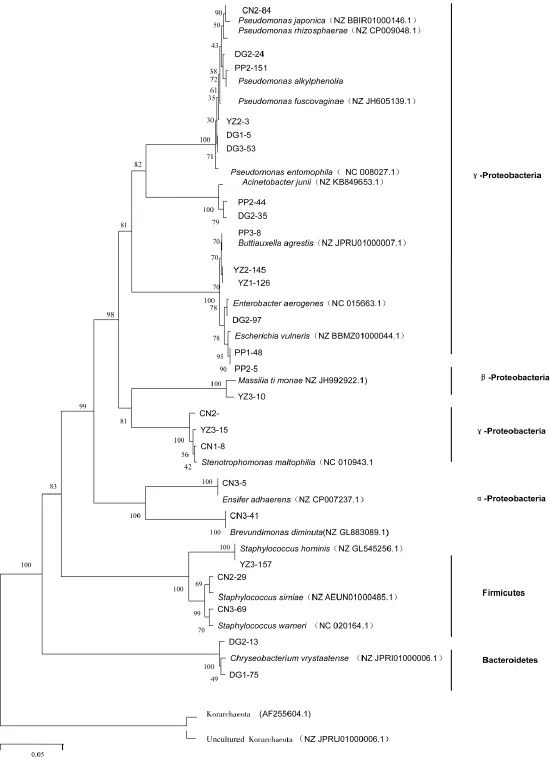
图1 基于夏块菌子实体内部分细菌16S rDNA构建的Neighbor-joining进化树Fig.1 Neighbor-joining tree based on 16S rDNA gene partial sequences of 21 OTUs isolated from a fruitbody of T.aestivum
厚壁菌门细菌在意大利块菌和波式块菌中同样存在,此外在微繁培养的植株根系中也有此类细菌。经研究表明,此属细菌在波式块菌菌丝生长过程中起到抗菌的作用;α-变形菌门剑菌属与根瘤菌属细菌在其他种类中经常被分离得到,此外此属细菌易与豆科植物产生共生联合,从而具有固氮功能,也就是为人所熟知的固氮细菌。而剑菌属与根瘤菌属正是α-变形菌门细菌中固氮细菌最具典型性的代表,对植物的营养过程甚至真菌的生长及子实体的发育具有重要影响[18]。
β-变形菌门细菌在波式块菌和意大利白块菌中也曾被分离得到。除了相关研究中分离得到绝大多数细菌之外,本实验也分离得到其他实验中较少出现的一些细菌,如杆菌门马赛菌属的蒂莫内马赛菌(Massilia timonae)。相比较而言,β-变形菌门的金黄杆菌在块菌子实体分离中较多地被分离出来,这与前人的结果相符,而拟杆菌门的细菌则较少地在块菌中分离得到,此外,此类细菌具有降解能力。笔者认为,此类细菌与块菌子实体的降解腐坏具有一定的联系。这对于丰富块菌子实体可培养细菌的种类及块菌的防腐与保存也具有一定的意义。
[1]郭尚,李渊,赵照林,等.块菌的研究现状、问题及展望[J].食用菌,2014(1):4-6.
[2]Pegler DN,Spooner BM,Yong TWK.British truffles:a revision of British Hypogeous fungi[M].UK:Royal Botanic Gardens,1993:1-216.
[3]陈应龙.块菌生态生理学研究[J].中国食用菌,2000(5):25-30.
[4]卯晓岚.中国经济真菌[M].北京:科学出版社,1998:1-762.
[5]龙新华,王丽,李树红,等.2种中国黑块菌的介绍及可持续发展研究[J].中国食用菌,2014,33(3):3-4.
[6]张介平,刘培贵.中华夏块菌及其生态学研究[J].食用菌学报,2015,22(1):34-40.
[7]Petruni O,Muller E.Die praktische Bedeutung der Endophyte forschung[J].Swiss Biotechnology,1986(4):11-14.
[8]Gazzanelli G,Malatesta M,Pianetti A,et al.Bacteria associated to fruiting bodies of the ectom ycorrhizal fungus Tuber borchii Vittad[J].Symbiosis,1999(26):211-219.
[9]Sbrana C,Agnolucci M,Bedini S,et al.Diversity of culturable bacterial populations associated to Tuber borchii ectomycorrhizas and their activity on T.borchii mycelial growth[J]. FEMS Microbiology Letter,2002(211):195-201.
[10]Barbieri E,Bertini L,Rossi I,et al.New evidence for bacterial diversity in the ascoma of the ectomycorrhizal fungus Tuber borchii Vittad[J].FEMS Microbiology Letters,2005 (247):23-25.
[11]万山平.国产白块菌微生物多样性及其在菌根合成中的应用[D].昆明:中国科学院昆明植物研究所,2013.
[12]Lee SH,Ka JO,Cho JC.Members of the phylum Acidobacteria are dominant and metabolically active in rhizosphere soil[J].FEMS Microbiology Letters,2008,285(2):263-269.
[13]Sbrana C,Bagnoli G,Bedini S,et al.Adhesion to hyphal matrix and antifungal activity of Pseudomonas strains isolated from Tuber borchii ascocarps[J].Canadian Jouenal Microbiology,2000,46(3):259-268.
[14]Barbieriet E,Guidi C,Bertaux J,et al.Occurrence and diversity of bacterial communities in the Tuber magnatum during truffle maturation[J].Environmental Microbiology,2007, 9(9):2234-2246.
[15]Barbieriet E,Ceccaroli P,Saltarelli R,et al.New evidence for nitrogen fixation within the Italian white truffle Tuber magnatum[J].Fugal Biology,2010,114(9):936-942.
[16]Cristiana Sbrana,Monica Agnolucci.Diverstity of culturable bacterial populations associated to Tuber borchii ectomycorrhizas and their cativity on Tuber borchii mycelial growth[J]. FEMS Microbiology Letters,2002,211(2):195-201.
[17]Barbara Citterio,Manuela Malatesta,Serafina Battistelli,et al.Possible involvement of Pseudomonas fluorescens and Bacillaceae in structural modifications of Tuber borchii fruit bodies[J].Can.J.Microbiol.,2001,47(3):264-268.
[18]Elena Barbieri,Paola Ceccaroli,Francesco Palma,et al.Vilberto stocchi edible ectomycorrhizal mushrooms[M].Berlin Heidelberg:Soil Biology,2013:125-141.
Bacteria Diversity Research on Tuber aestivum Fruiting Bodies from Southwest of China
LI Yun-long,PENG Yi-hang,YAN Teng,GONG He-de
(Ecotourism Faculty,Southwest Forestry University,Kunming 650224,China)
In this paper,taking Tuber aestivum as the research object,the bacteria diversity in T.aestivum fruiting bodies was carried out in the form of the tradition way.The fruiting bodies of T.aestivum were collected from Baoshan city(Yunnan province)and Huidong city(Sichuang province).The results revealed that the culturable bacteria,which belonges to 19 species and 11 genera in 5 phyla respectively.Most of the culturable isolations(67%)are affiliated to the γ-Proteobacteria,among of them,the dominated taxon is Pseudomonas fuscovaginae.The second major group is Firmicutes(14%),mainly with Staphylococcus simiae and Staphylococcus warneri as the dominant taxa.The rest of culturable bacterial isolates are members of Bacteroidetes (9%),α-Proteobacteria(6%),and β-Proteobacteria(3%).
Tuber aestivum;fruiting bodies;bacteria;dominant communities
S646.9
A
1003-8310(2016)04-0058-05
10.13629/j.cnki.53-1054.2016.04.015
国家自然科学基金青年科学基金项目(31200482)。
李云龙(1990-),男,硕士,主要从事生物地理学研究。E-mail:1158116277@qq.com
**通信作者:巩合德(1978-),男,博士,副教授,主要从事森林生态学研究。E-mail:gonghede3@163.com
2016-05-16
