不同抗氧化活性蔬菜汁对大鼠血清代谢组的影响
2016-11-12高蔚娜陈玉霞蒲玲玲韦京豫吴健全郭长江军事医学科学院卫生学环境医学研究所天津00050徐州空军学院江苏徐州22000天津市健康教育所天津000
高蔚娜,陈玉霞*,蒲玲玲,韦京豫,吴健全,郭长江,*(.军事医学科学院卫生学环境医学研究所,天津 00050;2.徐州空军学院,江苏 徐州 22000;.天津市健康教育所,天津 000)
不同抗氧化活性蔬菜汁对大鼠血清代谢组的影响
高蔚娜1,陈玉霞2,*,蒲玲玲1,韦京豫1,吴健全3,郭长江1,*
(1.军事医学科学院卫生学环境医学研究所,天津 300050;2.徐州空军学院,江苏 徐州 221000;3.天津市健康教育所,天津 300011)
目的:研究不同抗氧化活性蔬菜汁对大鼠血清代谢组的影响。方法:40只雄性Wistar大鼠,随机分为对照组、藕汁组、油菜汁组和黄瓜汁组,每组10 只,单笼饲养。对照组灌胃蒸馏水,蔬菜汁组灌胃相应的蔬菜汁。每只大鼠每天灌胃1 次,剂量为5 mL,实验周期为4 周。实验结束后,大鼠禁食过夜,球后静脉丛采血,离心分离血清,-20 ℃保存备用。运用基于核磁共振技术和模式识别技术的代谢组学方法,分析比较不同蔬菜汁灌胃后,大鼠血清代谢变化情况和相关代谢物的差异。结果:得分图显示对照组与各蔬菜汁组之间可以很好地分开,但各蔬菜汁组之间没有明显的界限,说明蔬菜汁改变了大鼠血清的代谢模式。其中,含量升高的物质包括乳酸(δ1.34、δ4.14)、胆碱(δ3.22)、β-羟丁酸(β-hydroxybutyrate,β-HB,δ1.22)和内消旋肌醇(δ3.54)。与对照组比较,灌胃藕汁后,血清中含量升高的物质主要有脯氨酸(δ3.38)、糖区物质(δ3.4、δ4.1),降低的物质主要有脂类(δ0.9、δ1.26、δ1.3);灌胃油菜汁后,血清中升高的物质主要有乙酰乙酸(δ2.14)、脯氨酸(δ3.38)、苏氨酸(δ3.58),降低的物质主要有脂蛋白(δ0.9、δ1.26、δ1.3);灌胃黄瓜汁后,含量升高的物质有苏氨酸(δ3.58),降低的物质主要有脂蛋白(δ0.9、δ1.26、δ1.3)。结论:具有不同抗氧化活性的蔬菜汁,如藕汁、油菜汁和黄瓜汁均可改变大鼠血清的代谢模式,这种作用是通过影响大鼠血清中糖类、脂类和蛋白质的代谢来实现的。
代谢组学;蔬菜;抗氧化性
蔬菜除了含有人体所需的维生素、矿物质、纤维素等营养素,还含有丰富的抗氧化物质,如VC、VE、类胡萝卜素和多酚类物质等,这些物质与蔬菜的抗氧化活性显著相关。实验前期以血浆铁还原能力(ferric reducing ability of plasma,FRAP)法检测了多种蔬菜的抗氧化能力,结果发现,体外抗氧化活性最强的蔬菜是藕,油菜次之,黄瓜最弱,其中多酚类物质对蔬菜的抗氧化能力有显著的贡献[1-2]。
代谢组学是继基因组学和蛋白质组学之后发展起来的一门学科,主要以各种代谢途径中的底物或产物中的低分子质量代谢物为研究对象,特别适合于食品、传统中药等复杂体系的研究与分析[3]。Guertin等[4]曾经用代谢组学的方法发现了多种蔬菜在人体内代谢生成的生物标志物;Aiso等[5]报道,短期服用含有小松菜的果蔬汁可增强中年男性的胆固醇代谢。由于具有不同抗氧化活性的蔬菜对血清代谢组影响的报道很少,本实验选择藕、油菜和黄瓜榨汁,给予大鼠灌胃4 周后,采用基于核磁共振技术的代谢组学方法,观察这3 种蔬菜汁对大鼠血清代谢模式的影响。
1 材料与方法
1.1 动物、材料与试剂
40 只健康成年雄性2~3月龄Wistar大鼠(动物生产许可证号:SCXK(军)2014-0001;动物使用许可证号:SYXK(军)2014-0004) 军事医学科学院实验动物中心。
新鲜的藕、油菜、黄瓜 天津市河西区三义庄菜市场。
重水(deuterium oxide,D2O) 美国CIA公司;2,2’,3,3’-三甲基甲硅烷基丙酸(3-(trimethysilyl) [2,2’,3,3’-2H4] propionate,TSP) 加拿大默克公司。
1.2 仪器与设备
UNITYINOVA 600MHz超导傅里叶变换1H核磁共振(nuclear magnetic resonance,NMR)波谱仪 美国瓦里安公司;Eppendorf 5418小型高速离心机 德国Eppendorf公司。
1.3 方法
1.3.1 动物处理
将大鼠按体质量随机分成4 组,每组10 只,单笼饲养。对照组灌胃蒸馏水,实验组分别灌胃藕汁、油菜汁和黄瓜汁。实验期间,每天购买新鲜蔬菜,分别用自来水、蒸馏水反复冲洗干净,晾干。将日常食用部分切成小片或段、块,混合均匀后称取一定质量,采用榨汁机榨汁后,取上层蔬菜汁备用。每天下午灌胃一次,每只大鼠灌胃剂量为5 mL,持续4 周。5 mL蔬菜汁相当于各蔬菜鲜质量分别为:藕汁11.4 g、油菜汁7.5 g、黄瓜汁7.0 g。实验期间大鼠自由摄食、饮水,每周称量体质量。实验结束时,大鼠禁食过夜,球后静脉丛采血,离心分离血清,-20 ℃保存备用。
1.3.2 NMR数据的采集
按照吴健全等[6]所述方法,从-20 ℃冰箱中取出血清,解冻后置于离心机中,14 000 r/min离心10 min;取上清300 μL,加入质量分数0.1%100 μL TSP重水溶液、200 μL D2O,混匀后于4 ℃冰箱保存备用。
测量时,在UNITYINOVA 600 MHz超导傅里叶变换1H 核磁共振波谱仪上调用T2-弛豫时间编辑和扩散编辑相关脉冲序列,采用预饱和2 s的方式抑制水峰,混合时间为0.15 s,选择的谱宽为8 000 Hz,采样点数32 k,累加次数64 次,预饱和频率和中心频率都在水峰位置。自由感应衰减信号经过32 k傅里叶变换转为一维NMR谱图。谱图以TSP为化学位移参考,设为δ0。调用VNMR软件中的程序,分别将δ0.5~4.5(CPMG)以及δ6.0~9.0(LED)(去除δ4.7~5.1)范围内的波峰,以δ0.04 为积分段进行分段积分。将积分数据归一化后,以Excel文件存储,用于模式识别分析。
1.4 数据处理
将NMR积分结果输入SIMCA P 10.0软件,采用正交信号矫正(orthogonal signal correction,OSC)或偏最小二乘-辨别分析(partial least-squares discriminant analysis,PLS-DA)指导性模式识别技术,得到得分图和因子载荷图,再结合NMR谱图对样品中代谢组变化进行分析。
2 结果与分析
2.1 血清代谢模式总体变化分析
由弛豫编辑谱(图1)可知,各组乳酸(δ1.34、δ4.14)含量均很高。采用PLS-DA方法对1H-NMR谱图积分值进行分析,得分图显示对照组与各蔬菜汁组之间区分明显,但各蔬菜汁组之间没有明显区分(图2A)。与对照组比较可知,藕汁、油菜汁和黄瓜汁均能改变大鼠血清的代谢模式,但各蔬菜汁之间血清的代谢模式没有明显区别。
因子载荷图表明,引起高场区(δ0.5~4.5)谱图各组之间差异的主要物质是β-羟丁酸、乳酸、胆碱、内消旋肌醇等,因为与对照组比较,这些物质的含量发生了明显的变化(图2B)。各组间芳香族区域(δ6~9)物质差异不大;与对照组比较,灌胃黄瓜汁后,甲酸盐含量降低;灌胃油菜汁后,组氨酸含量升高,其他3 组未知峰(δ6.05、δ6.07和δ6.26)变化明显。

图1 摄入不同蔬菜汁后大鼠血清600 MHzz1H NMR弛豫编辑谱图Fig. 1 600 MHz1H NMR relaxation editing spectra of rat serum after consumption of different vegetable juices


图2 摄入不同蔬菜汁后血清代谢物PLS-DA分析得分图(A)和因子载荷图(BB)Fig. 2 PLS-DA Scores plot of rat serum spectra after consumption of different vegetable juices (A) and PLS-DA loadings plot for metabolites (B)
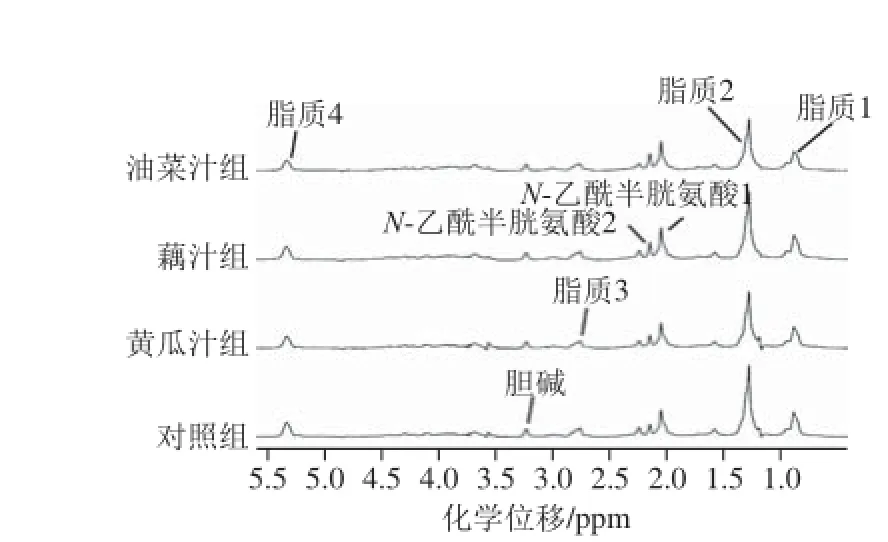
图3 摄入不同蔬菜汁后大鼠血清600 MHz H NMR扩散编辑谱图Fig. 3 600 MHz 1H NMR diffusion editing spectra of rat serum after consumption of different vegetable juices

图4 摄入不同蔬菜汁后血清代谢物OSC分析得分图(A)和因子载荷图(BB)Fig. 4 OSC Scores plot of rat serum spectra after consumption of different vegetable juices (A) and OSC loadings plot for metabolites (B)
扩散编辑谱(图3)中的信号主要为长链脂肪酸及脂蛋白信号。相对于对照组,黄瓜汁组和藕汁组脂质2含量升高,油菜汁组和藕汁组中N-乙酰糖蛋白含量升高,除了核磁共振图中确定的物质外,还发现1 种未知物质(δ1.23)含量升高。其余物质含量变化不明显,对积分值作OSC分析,得分图显示对照组与各蔬菜组之间可以很好地区分,但各蔬菜组之间没有明显的区分(图4)。说明3 种蔬菜汁对机体代谢存在相似的调节作用,可以引起相同代谢物的变化。
2.2 血清代谢模式分组变化分析
2.2.1 藕汁组与对照组之间的比较
进一步采用PLS-DA方法对各组1H NMR图进行对比。灌胃藕汁后,血清中升高的物质主要有乳酸(δ1.34、δ4.14)、—OCH2CH3(δ1.18)、胆碱(δ3.22)、β-羟丁酸(β-hydroxybutyrate,β-HB,δ1.22)、脯氨酸(δ3.38)、内消旋肌醇(δ3.54)、糖区物质(δ3.4~4.1);降低的物质主要有脂类(δ0.9、δ1.26、δ1.3)(图5)。

图5 摄入藕汁后血清代谢物PLS-DA分析得分图(A)和因子载荷图(B)Fig. 5 PLS-DA Scores plot of rat serum spectra after consumption of lotus root juice (A) and PLS-DA loadings plot for metabolites (B)
2.2.2 油菜汁组与对照组之间的比较
灌胃油菜汁后,血清中含量升高的物质主要有乳酸(δ1.34、δ4.14)、—OCH2CH3(δ1.18)、乙酰乙酸(δ2.14)、β-HB(δ1.22)、胆碱(δ3.22)、脯氨酸(δ3.38)、内消旋肌醇(δ3.54)、苏氨酸(δ3.58),含量降低的物质主要有脂蛋白(δ0.9、δ1.26、δ1.3)(图6)。


图6 摄入油菜汁后血清代谢物PLS-DA分析得分图(A)和因子载荷图(BB)Fig. 6 PLS-DA Scores plot of rat serum spectra after consumption of rape juice (A) and PLS-DA loadings plot for metabolites (B)
2.2.3 黄瓜汁组与对照组之间的比较
灌胃黄瓜汁后,血清中含量升高的物质有—OCH2CH3(δ1.18)、β-HB(δ1.22)、乳酸(δ1.34)、胆碱(δ3.22)、内消旋肌醇(δ3.54)、苏氨酸(δ3.58);含量降低的物质主要有脂蛋白(δ0.9、δ1.26、δ1.3)(图7)。

图7 摄入黄瓜汁后血清代谢物PLS-DA分析得分图(A)和因子载荷图(BB)Fig. 7 PLS-DA Scores plot of rat serum spectra after consumption of cucumber juice (A) and PLS-DA loadings plot for metabolites (B)
3 讨 论
代谢组学是对某一生物或细胞中所有低分子质量代谢产物进行定性和定量分析的科学,它通过检测活体系统对病理生理刺激或基因改变作出的动力学多参数代谢反应,评价体液、组织液及组织,如尿液、血液、血浆、唾液、脑脊髓液及组织中代谢物等的变化,从而推论出机体所处的状态[7-8]。代谢组学研究主要包括代谢物分析和数据分析两部分。数据采集技术包括核磁共振波谱分析技术(nuclear magnetic resonance,NMR)、质谱分析技术(mass spectrometry,MS)、色谱分析技术和光谱分析技术等;数据分析主要包括数据采集、原始数据前处理、以及借助生物信息学软件对获得的大量多维复杂数据进行降维处理并获取相关信息,找出反映样品内在机理的、整体性差异的生物标记物。数据分析主要分为两类,即监督分析法和非监督分析法[9]。本实验使用的PLS-DA分析法属于监督分析法。目前代谢组学已在微生物和植物研究、药物毒性和机理研究、疾病诊断、中药活性成分分析、药物代谢的组学分析、毒性基因组学、药理代谢组学、中药毒理学、临床和营养学[10-14]等领域广泛应用。在营养学方面,Mata-Espinosa等[15]利用高效液相色谱-电雾式检测器分析后发现,三油酸甘油酯、1,2-油酸-3-棕榈酸和1,2-油酸-3-甘油三亚油酸酯可作为区分橄榄油和植物油的鉴别性代谢物;Zhang Qi等[16]采用GC-MS结合多元统计分析对饮食诱导的高脂血症大鼠代谢物进行分析,发现β-羟基丁酸、酪氨酸和肌酸酐是潜在的生物标记物。
本研究结果表明,利用基于NMR的代谢组学技术,不同抗氧化活性的蔬菜汁作用于大鼠后,大鼠的血清代谢模式发生了改变,各蔬菜汁组都能与对照组很好地区别开来;各蔬菜汁组发生变化的内源性代谢物有很大的相似性,且与抗氧化性关系不明显。与对照组比较,蔬菜汁影响了大鼠血清中的糖类、脂类和蛋白质的代谢模式。灌胃蔬菜汁后,大鼠血清中β-羟丁酸、乙酰乙酸和胆碱水平升高,表明蔬菜中的某些物质促进了体内酮体的生成和脂肪酸氧化。胆碱、乙酰乙酸是甲胺途径的代谢物质,这2 种物质含量的改变表明蔬菜汁可影响脂质和胆固醇的代谢及转运[17];脯氨酸、苏氨酸等氨基酸水平的改变,提示蔬菜对蛋白质代谢具有调节作用;大鼠血清中的乳酸水平升高,表明灌胃蔬菜汁影响了大鼠体内的糖代谢过程。乳酸是葡萄糖酵解的产物,血清中乳酸含量升高说明大鼠体内的糖酵解作用增强,而有氧氧化可能受到一定程度的抑制研究显示,如果代谢过程中氧的消耗量增加,活性氧的生成就会增多,这可能会导致组织或细胞的氧化损伤[18]。
蔬菜中的胡萝卜、莴苣、菠菜、洋葱、甜椒、藕中都是多酚类化合物的良好来源[19-20]。研究表明,酚类物质可以被机体吸收利用[21],但对其吸收进入体内后对内源性代谢影响的报道并不多见。没食子酸(gallic acid,GA)是蔬菜中含量丰富的一种酚类化合物。研究结果显示,GA可影响非酒精性脂肪肝模型小鼠的脂代谢、糖代谢(糖酵解和糖异生)、氨基酸代谢和胆碱代谢,通过这些作用发挥GA的代谢保护作用[22]。表儿茶素(epicatechin,EC)是蔬菜中含有的另外一种酚类化合物。Solanky等[23]运用基于NMR的代谢组学研究发现EC可以使SD(Sprague Dawley)大鼠内源代谢物,如肌酐、牛磺酸、柠檬酸盐和α-酮戊二酸等水平发生明显变化,提示EC进入动物体内可影响内源性物质的代谢途径,表现为代谢能力降低、碳水化合物代谢水平下降。Kim等[24]用正常饲料、高脂饲料、高脂饲料+30%煮熟的大豆粉、高脂饲料+30% 72 h发酵的大豆粉处理后,各组小鼠的血清代谢模式能够很好地区分。PLS-DA分析结果显示,每组可以分开的主要原因是血清中的脂质代谢物,如可溶性卵磷脂和卵磷脂。因此含有大豆的食物,其中所富含的异黄酮可能有助于控制高脂饮食状态下的脂质代谢。番茄红素是多种蔬菜中含有的一种类胡萝卜素。Bernal等[25]的结果表明,高脂模型对照组与番茄汁干预组的抗氧化生物标记物和代谢模式显著不同,番茄汁中所含的番茄红素可能起到了关键性的作用。上述研究与本实验结果有类似之处,机体摄入多酚类物质、类胡萝卜素等物质后,机体的代谢模式发生了明显的变化,提示蔬菜中含有的这些物质可能是调节内源性代谢的重要物质。
综上所述,灌胃蔬菜汁能明显改变大鼠血清乳酸、β-羟丁酸、乙酰乙酸、胆碱、脯氨酸、苏氨酸等物质的含量水平,能改变外周血的代谢模式,糖类、脂类和蛋白质三大物质代谢有所改变,提示蔬菜中的某些物质对机体的物质代谢途径有调节作用,蔬菜中的多酚类物质、番茄红素等可能发挥了重要的作用,但各蔬菜汁之间的作用差别不明显;各蔬菜干预组大鼠内源性代谢的变化与相应蔬菜的抗氧化性关系不甚密切,这一点值得研究者深入探讨。
[1] 陈玉霞, 郭长江, 杨继军, 等. 不同抗氧化活性蔬菜汁对大鼠抗氧化功能的影响[J]. 中国预防医学杂志, 2010,11(7): 689-691.
[2] JI Linlin, WU Jianquan, GAO Weina, et al. Antioxidant capacity of different fractions of vegetables and correlation with the contents of ascorbic acid, phenolics and fl avonoids[J]. Journal of Food Science, 2011, 76(9): 1257-1261. DOI:10.1111/j.1750-3841.2011.02402.x.
[3] 朱超, 胡坪, 梁琼麟, 等. 代谢组学技术的整合运用及其在中药现代化中的应用展望[J]. 药学学报, 2008, 43(7): 683-689. DOI:10.3321/ j.issn:0513-4870.2008.07.003.
[4] GUERTIN K A, MOORE S C, SAMPSON J N, et al. Metabolomics in nutritional epidemiology: identifying metabolites associated with diet and quantifying theirpotential to uncover diet-disease relations in populations[J]. American Journal of Clinical Nutrition, 2014, 100(1): 208-217. DOI:10.3945/ajcn.113.078758.
[5] AISO I, INOUE H, SEIYAMA Y, et al. Compared with the intake of commercial vegetable juice, the intake of fresh fruit and komatsuna (Brassica rapa L.var. perviridis) juice mixture reduces serum cholesterol in middle-aged men: a randomized controlled pilot study[J]. Lipids in Health and Disease,2014,13:102. DOI:10.1186/1476-511X-13-102.
[6] 吴健全, 郭长江, 高蔚娜, 等. 小鼠负重游泳后血清代谢模式变化分析[J]. 中国应用生理学杂志, 2011, 27(1): 42-45.
[7] NICHOLSON J K, LINDON J C, HOLMES E. ‘Metabonomics’: understanding the metabolic responses of living systems to pathophysiological stimuli via multivariate statistical analysis of biological NMR spectroscopic data[J]. Xenobiotica, 1999, 29(11): 1181-1189. DOI:10.1080/004982599238047.
[8] MENNI C, ZHAI G, MACGREGOR A, et al. Targeted metabolomics profi les are strongly correlated with nutritional patterns in women[J]. Metabolomics, 2013, 9(2): 506-514. DOI:10.1007/s11306-012-0469-6.
[9] 阿基业. 代谢组学数据处理方法: 主成分分析[J].中国临床药理学与治疗学, 2010, 15(5): 481-489.
[10] DUARTE I F, ROCHA C M, GIL A M. Metabolic profiling of biofl uids: potential in lung cancer screening and diagnosis[J]. Expert Review of Molecular Diagnostics, 2013, 13(7): 737-748. DOI:10.1586 /14737159.2013.835570.
[11] LI Zhenyu, ZHI Haijuan, ZHANG Fusheng, et al. Metabolomic profi ling of the antitussive and expectorant plant Tussilago farfara L. by nuclear magnetic resonance spectroscopy and multivariate data analysis[J]. Journal of Pharmaceutical and Biomedical Analysis, 2013, 75: 158-164. DOI:10.1016/j.jpba.2012.11.023.
[12] CLAYTON T A, LINDON J C, CLOAREC O, et al. Pharmacometabonomic phenotyping and personalized drug treatment[J]. Nature, 2006, 440: 1073-1077. DOI:10.1038/nature04648.
[13] 黄群, 杨改红, 袁金斌, 等. 代谢组学在中药毒理学研究中的应用[J]. 中药新药与临床药理, 2014 , 25(3): 383-388. DOI:10.3969/ j.issn.1003-9783.2014.03.036.
[14] ASTARITA G, LANGRIDGE J. An emerging role for metabolomics in nutrition science[J]. Journal of Nutrigenetics and Nutrigenomics, 2013, 6(4/5): 181-200. DOI:10.1159/000354403.
[15] de la MATA-ESPINOSA P, BOSQUE-SENDRA J M, BRO R, et al. Discriminating olive and non-olive oils using HPLC-CAD and chemometrics[J]. Analytical and Bioanalytical Chemistry, 2011, 399(6): 2083-2092. DOI:10.1007/s00216-010-4366-4.
[16] ZHANG Qi, WANG Guangji, MA Bo, et al. Metabonomic profi ling of diet-induced hyperlipidaemia in a rat model[J]. Biomarkers, 2010, 15(3): 205-216. DOI:10.3109/13547500903419049.
[17] LOWIS S, EASTWOOD M A, BRYDON W G. The influence of creatinine, lecithin and choline feeding on aliphatic amine production and excretion in the rat[J]. British Journal of Nutrition, 1985, 54(1): 43-51. DOI:10.1079/BJN19850091.
[18] SOMANI S M, FRANK S, RYBAK L P. Responses of antioxidant system to acute and trained exercise in rat heart subcellular fractions[J]. Pharmacology Biochemistry Behavior, 1995, 51(4): 627-634. DOI:10.1016/0091-3057(94)00427-K.
[19] NACZK M, SHAHIDI F. Phenolics in cereals, fruits and vegetables: occurrence, extraction and analysis[J]. Journal of Pharmaceutical and Biomedical Analysis, 2006, 41(5): 1523-1542. DOI:10.1016/ j.jpba.2006.04.002.
[20] 严守雷, 王清章, 彭光华. 莲藕多酚抗氧化作用研究[J]. 中国粮油学报, 2005, 20(4): 77-81. DOI:10.3321/j.issn:1003-0174.2005.04.018.
[21] BARNES S, PRASAIN J, D'ALESSANDRO T, et al. The metabolism and analysis of isoflavones and other dietary polyphenols in foods and biological systems[J]. Food &Function, 2011, 2(5): 235-244. DOI:10.1039/c1fo10025d.
[22] CHAO J, HUO T L, CHENG H Y, et al. Gallic acid ameliorated impaired glucose and lipid homeostasis in high fat diet-induced NAFLD mice[J]. PLoS ONE, 2014, 9(2): e96969. DOI:10.1371/ journal.pone.0096969.
[23] SOLANKY K S, BAILEY N J C, ELAINE H, et al. NMR-Based metabonomic studies on the biochemical effects of epicatechin in the rat[J]. Journal of Agricultural and Food Chemistry, 2003, 51(14): 4139-4145. DOI:10.1021/jf025677f.
[24] KIM J, CHOI J N, CHOI J H, et al. Effect of fermented soybean product (Cheonggukjang) intake on metabolic parameters in mice fed a high-fat diet[J]. Molecular Nutrition & Food Research, 2013, 57(10): 1886-1891. DOI:10.1002/mnfr.201200700.
[25] BERNAL C, MARTÍN-POZUELO G, LOZANO A B, et al. Lipid biomarkers and metabolic effects of lycopene from tomato juice on liver of rats with induced hepatic steatosis[J]. Journal of Nutritional Biochemistry, 2013, 24(11): 1870-1881. DOI:10.1016/ j.jnutbio.2013.05.003.
Effects of Vegetable Juices with Different Antioxidant Capacities on Serum Metabolome in Rats
GAO Weina1, CHEN Yuxia2,*, PU Lingling1, WEI Jingyu1, WU Jianquan3, GUO Changjiang1,*
(1. Institute of Health and Environment Medicine, Academy of Military Medical Sciences, Tianjin 300050, China; 2. Xuzhou Air College, Xuzhou 221000, China; 3. Tianjin Institute of Health Education, Tianjin 300011, China)
Objective: To observe the effects of vegetable juices with different antioxidant capacities on rat serum metabolome. Methods: Forty male rats were divided randomly into four groups consisting of 10 animals each, including control, lotus root juice (LRJ), rape juice (RJ), and cucumber juice (CJ) groups. The rats from the control and experimental groups were respectively administered with distilled water and vegetable juices intragastrically at a dose of 5 mL/rat once daily for 4 weeks. At the end of the experime nt, all the rats were fasted overnight and blood samples were collected from the orbital plexus. The serum was separated and stored at -20 ℃ until analysis. A metabolomic approach based on nuclear magnetic resonance analysis was used to investigate the effects of different vegetable juices on the serum metabolome in rats. Results: Scores Plot demonstrated that the control and vegetable juices groups were separated successfully, while there were no distinctive lines among three vegetable juices groups. After being treated by vegetable juices, the serum metabonome in rats changed significantly. In the vegetable juices groups, lactate (δ1.34, δ4.14), choline (δ3.22), β-hydroxybutyrate (β-HB, δ1.22) and internal compensation inositol increased in comparison to control. After being gavaged with lotus root juice, serum proline (δ3.38) and metabolites of sugar area (δ3.4, δ4.1) rose, while lipids declined (δ0.9, δ1.26, δ1.3). After being intragastrically given rape juices, acetoacetic acid (δ2.14), proline (δ3.38) and threonine (δ3.58) was increased, while lipoprotein (δ0.9, δ1.26, δ1.3) was decreased. In the cucumber juice group, threonine (δ3.58) was increased (δ3.58), while lipoproteins (δ0.9, δ1.26, δ1.3) were decreased. Conclusion: Vegetable juices with different antioxidant capacities such as lotus root juice, rape juice and cucumber juice could lead to changes in the metabolic patterns of serum sugar, lipids and protein in rats.
metabolomics; vegetable; antioxidant capacity
10.7506/spkx1002-6630-201611042
R151.3
A
1002-6630(2016)11-0236-06
高蔚娜, 陈玉霞, 蒲玲玲, 等. 不同抗氧化活性蔬菜汁对大鼠血清代谢组的影响[J]. 食品科学, 2016, 37(11): 236-241. DOI:10.7506/spkx1002-6630-201611042. http://www.spkx.net.cn
GAO Weina, CHEN Yuxia, PU Lingling, et al. Effects of vegetable juices with different antioxidant capacities on serum metabolome in rats[J]. Food Science, 2016, 37(11): 236-241. (in Chinese with English abstract)DOI:10.7506/spkx1002-6630-201611042. http://www.spkx.net.cn
2015-08-19
达能膳食营养研究与宣教基金项目(DIC2009-09)
高蔚娜(1977—),女,副研究员,博士,研究方向为类黄酮物质的生物学活性。E-mail:gwn2004bo@126.com
*通信作者:陈玉霞(1976—),女,讲师,博士,研究方向为蔬菜水果的抗氧化性及功能。E-mail:cyx760010@163.com
郭长江(1963—),男,研究员,博士,研究方向为蔬菜水果类黄酮含量及生物学活性。E-mail:guocjtj@126.com
