制备亚麻籽油多层乳液及其稳定性研究
2016-11-12李进伟林传舟刘元法江南大学食品学院江苏无锡214122
李进伟,林传舟,刘元法(江南大学食品学院,江苏 无锡 214122)
制备亚麻籽油多层乳液及其稳定性研究
李进伟,林传舟,刘元法
(江南大学食品学院,江苏 无锡 214122)
采用静电层层自组装的方法制备亚麻籽油多层乳状液,确定二级乳液的组成为质量分数5.0%的亚麻籽油、质量分数0.45%的浓缩乳清蛋白、质量分数0.2%的果胶;三级乳液的组成为质量分数2.5%的亚麻籽油、质量分数0.225%的浓缩乳清蛋白、质量分数0.1%的果胶、质量分数0.2%的壳聚糖。同时结果表明亚麻籽油多层乳状液具有缓慢释放的效果和提高亚麻籽油消化吸收效率的作用。
亚麻籽油;静电层层自组装;多层乳液
亚麻籽油中不饱和脂肪酸含量高达90%,其中以α-亚麻酸含量最高(54%)。α-亚麻酸为n-3系人体必需脂肪酸,在体内可转化为二十碳五烯酸(eicosapentaenoic acid,EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA)[1],后两者都是组成神经细胞膜的重要成分,具有促进胎儿和婴儿大脑生长发育[2]、抗衰老[3-5]、增强记忆力、提高免疫力、改善和维持视力、预防脑血栓和心肌梗塞等生理功能[6-9],因此亚麻籽油作为绿色天然资源,是开发补充n-3不饱和脂肪酸的最经济来源,具有很好的开发应用前景。但由于亚麻籽油中不饱和脂肪酸含量过高,极容易被氧化,从而产生不良的风味甚至有害物质,影响亚麻籽油的货架期[10]。
层层自组装技术是指利用两种或多种高分子化合物之间的某种相互作用(如静电引力、共价键、氢键等),使其在模板物质表面逐层交替沉积,形成多层界面膜的一种技术[11-13]。近年来,采用层层自组装技术制备的微胶囊已经广泛应用于医药[14-16]、化学[17-18]、食品[19-21]、生物技术[22]及农业等方面。本实验采用静电层层自组装的方法制备多层乳液,并研究其释放的特性,以获得稳定的多层乳液。
1 材料与方法
1.1 材料与试剂
亚麻籽油 山东渤海实业股份有限公司。
浓缩乳清蛋白(whey protein concentrate,WPC)恒天然集团;果胶(酯化度75%,平均分子质量310 kD)、壳聚糖(脱乙酰度为75%~85%) 美国Sigma公司。
1.2 仪器与设备
EL20 pH计 梅特勒-托利多仪器有限公司;Ultra-Turrax T18高速分散器 德国IKa公司;高压均质机ATS工业系统有限公司;纳米粒度与Zeta电位仪 英国马尔文公司。
1.3 方法
1.3.1 壁材分子所带电荷性质的测定
分别配制质量分数为1%的果胶、壳聚糖、浓缩乳清蛋白溶液。将配制好的溶液用醋酸缓冲液稀释至0.01%,并用1 mol/L的HCl溶液调节pH值为3、4、5、6、7、8,通过纳米粒度及Zeta电位分析仪(zetasizer nano,ZS)测定不同pH值时壁材分子所带电荷(即Zeta电位)。
1.3.2 多层乳液的制备
初级乳状液的制备:在pH 7.0时,将亚麻籽油和质量分数为1%的浓缩乳清蛋白乳化剂缓冲溶液按质量比1∶9混合,高速剪切2 min,然后高压均质,40 MPa均质2 次,10 MPa均质1 次,制备组成为亚麻籽油质量分数10%、浓缩乳清蛋白质量分数0.9%,pH值为7的初级乳状液;
二级乳状液的制备:在pH值为7时,将初级乳状液和质量分数为1%的果胶溶液以及醋酸缓冲液混合,然后调节pH值至3.5,并用超声破坏絮凝,制备组成为亚麻籽油质量分数5%、浓缩乳清蛋白质量分数0.45%、果胶质量分数为0.2%、pH3.5的二级乳状液。
三级乳液的制备:在pH值为3.5时,将质量分数为1%的壳聚糖溶液以及醋酸缓冲液加入到制备的二级乳液中,制备组成为亚麻籽油质量分数2.5%、浓缩乳清蛋白质量分数0.225%、果胶质量分数0.1%、壳聚糖质量分数0.2%、pH3.5的三级乳液。
用去离子水以体积比1∶1 000稀释乳状液,通过纳米粒度及Zeta电位分析仪(Zetasizer nano-ZS)测定乳状液粒度,相对折射率和吸收率分别设定为1.590和0.001,测试温度为25 ℃。
1.4 体外模拟消化实验
1.4.1 模拟胃液消化实验
准确称取10 g胃蛋白酶置于1 000 mL的烧杯中,加水搅拌,用盐酸调节溶液pH值至2.0,加入2 g NaCl,搅拌,转移至1 000 mL容量瓶中,稀释定容至1 000 mL,配制模拟胃液。
量取100 mL人工胃液置于250 mL三角瓶中,加入准确称取的10 mL初级、二级、三级乳液,置于37 ℃恒温水浴中,搅拌转速为100 r/min左右(模拟肠胃蠕动状态),消化2 h,每隔20 min取样置于显微镜下观察。
1.4.2 模拟小肠脂肪体外消化
将乳液在模拟胃液中消化2 h之后,用磷酸缓冲液稀释,使亚麻籽油质量分数为0.5%,取30 mL,调节pH值至7.0,在37 ℃水浴振荡30 min,添加1.5 mL NaCl溶液(5.625 ×10-3mol/L),1 mL CaCl2溶液(0.75 × 10-3mol/L),2 mL胆盐(187.5 mg),2 mL胰脂肪酶(60 mg),最终总体积为37.5 mL。其中混合液NaCl 浓度为1.5×10-1mol/L 、CaCl2为2×10-2mol/L、胆盐为5 mg/mL,胰脂肪酶为1.6 mg/mL,pH值为7.0。釆用pH-stat滴定法用NaOH溶液进行滴定,测量其游离脂肪酸(free fatty acid,FFA)释放量。按下式计算脂肪消化率。
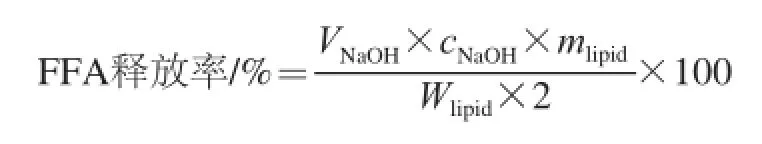
式中:VNaOH为中和游离脂肪酸所消耗NaOH的体积/L;cNaOH为所用NaOH的浓度/(mol/L);mlipid为消化反应中初始的油脂质量/g;Wlipid为亚麻籽油的摩尔质量870 g/mol。
2 结果与分析
2.1 不同pH值条件下果胶、壳聚糖、浓缩乳清蛋白分子所带电荷
采用静电层层自组装制备多层乳液,首先要测定各聚合电解质在不同pH值条件下的带电性质,以确定其吸附顺序。壳聚糖是自然界唯一带正电的天然多糖,因此壳聚糖分子在pH 3~8之间所带的电荷都为正。果胶是一种带有多个负电基团的天然多糖,其在pH3~8的范围内所带电荷都为负,因此可以与壳聚糖产生静电吸附;而浓缩乳清蛋白在pH值3、4的时候所带电荷为正,在pH值为5~8之间所带电荷为负(图1),这说明浓缩乳清蛋白的等电点在pH值为4~5之间,可以通过调节溶液的pH值使蛋白质带上不同的电荷,以此来达到所需要的带电情况。在静电层层自组装技术中,液滴表面的涂层是通过带电的液滴表面和溶液中带相反电荷的聚合电解质的相互吸引沉积形成的,因此,通过选择不同的乳化剂或者调节pH值,使初级乳液的液滴表面带电,之后通过依次加入带有相反电荷的聚合电解质调节pH值,使其吸附到液滴表面,从而制备多层包埋的亚麻籽油乳液。

图1 不同pH值条件下果胶、壳聚糖、浓缩乳清蛋白分子所带电荷Fig. 1 Zeta-potential of pectin, chitosan and WPC at different pH values
2.2 壁材质量分数的确定
在采用静电层层自组装制备多层乳液的过程中,首先是离子型的乳化剂在均质乳化的过程中快速地吸附到油滴表面,形成由小液滴组成的初级乳液,之后在体系中加入带相反电荷的聚合电解质,聚合电解质就会吸附到液滴表面形成具有两层界面层的二级乳液。重复以上程序,通过不断加入相反电荷的聚合电解质,制备具有三层或者更多层聚合电解质膜的油脂乳状液。
通过探讨添加不同质量分数的果胶对二级乳液平均粒径以及稳定性的影响,来确定制备乳液所需聚合电解质的最佳质量分数。当pH3.5时,添加质量分数为0%~0.30%的果胶,液滴质量分数分别为1.0%、3.0%、5.0%的二级乳液的稳定性如表1所示。

表1 果胶和液滴质量分数对二级乳液液滴稳定性的影响Table 1 Stability of the secondary emulsions as a function of droplet and pectin concentration
在pH值为3.5时,果胶分子所带电荷为负,其Zeta电位为-20 mV左右,而蛋白质包裹的脂肪滴表面所带电荷为正,其Zeta电位为20 mV左右,果胶分子会由于静电吸附作用吸附到液滴表面。在果胶质量分数为0%时,乳液都很稳定,说明蛋白质包埋的液滴表面所带的电荷较高,液滴之间的静电排斥作用较强,液滴不会产生聚结。当加入果胶之后,随着加入果胶质量分数的不同,乳液的稳定性会产生变化。例如,液滴质量分数为1% 的乳液,其在果胶质量分数为0%时很稳定,在果胶质量分数为0.02%时会产生聚结,乳液不稳定,在果胶质量分数为0.04%~0.10%之间,乳液很稳定,之后随着果胶质量分数的进一步增加,在0.20%~0.30%时,乳液又会出现絮凝,变得不稳定。液滴质量分数为5%时,乳液在果胶质量分数为0%~0.04%、0.20%~0.30%之间都很稳定,但是在果胶质量分数为0.06%~0.10%时会出现絮凝,液滴粒径增大,乳液不稳定,这是因为果胶质量分数不同时,乳液的液滴之间的桥连和损耗絮凝导致的。
2.3 制备二级乳液时果胶质量分数的确定
在制备二级乳液时,选取液滴质量分数为5.0%,通过添加不同质量分数的果胶,确定制备二级乳液时果胶的质量分数。

图2 添加不同质量分数果胶(00%~00..44%)二级乳液的稳定性Fig. 2 Stability of the secondary emulsions with different pectin concentrations (0%–0.4%)
由图2可知,当果胶质量分数为0%时,乳液很稳定,在放置1 周后不会出现分层,不会产生絮凝或者聚结,说明液滴之间存在较强的静电排斥作用。当果胶质量分数为0.1%时,此时乳液的平均粒径由200 nm变为9 000 nm,不同果胶浓度二级乳液的粒径和电位如图3所示,乳液出现严重絮凝并产生分层。这是因为在低质量分数果胶条件下,带负电的果胶分子吸附在带正电的液滴表面,中和了液滴原有的正电荷,液滴表面静电荷减少,甚至降为0,液滴之间的静电排斥作用减小,导致了乳液液滴的聚集。另外一种原因可能是由于果胶含量较低,乳液液滴通过果胶的桥连结构形成了聚结[69]。当果胶质量分数进一步增加达到0.2%时,更多带负电荷的果胶分子吸附到液滴表面,此时液滴表面被果胶分子完全覆盖住,液滴之间存在较强的静电和空间位阻排斥作用,从而产生稳定的乳液,此时二级乳液的粒径大约为600 nm。当果胶质量分数增加到0.4%时,乳液稳定性下降,说明此时的果胶质量分数过高,已经超过饱和吸附所需的含量,由于水相中未吸附的果胶过多而导致损耗絮凝,导致乳液的稳定性下降。

图3 添加不同质量分数果胶时二级乳液的粒径和Zetaa电位Fig. 3 Mean particle size and Zeta-potential of the secondary emulsions
在pH值为3.5时,果胶分子所带电荷为负,而覆盖蛋白质的液滴表面所带的电荷为正,此时,果胶分子会因为与液滴表面之间存在强的静电相互吸引作用而吸附到液滴表面。由图3可知,添加不同质量分数果胶时,液滴Zeta电位的变化情况,说明果胶分子吸附到液滴的浓缩乳清蛋白表面层上。在果胶质量分数为0%时,浓缩乳清蛋白包裹的液滴表面的Zeta电位大约为23 mV,因为此时吸附在液滴表面的蛋白质处于等电点以下,浓缩乳清蛋白所带电荷为正。随着果胶质量分数的增加,液滴的Zeta电位会逐渐变小,在果胶质量分数为0.1%时,液滴表面的Zeta电位接近0,说明液滴表面所带的净电荷几乎为0,因为带负电的果胶分子吸附到带正电的蛋白质表面上,此时果胶含量还不足以完全覆盖液滴表面,电荷相互中和,导致液滴所带静电荷减少。之后随着果胶含量的增加,液滴表面的Zeta电位转变为负值,最终基本达到一个稳定值,此时二级乳液表面的Zeta电位大约为-0 mV。这些数据说明果胶分子吸附到由浓缩乳清蛋白稳定的液滴表面上,并且逐渐达到饱和。
在加入壳聚糖之前,要确保溶液中游离的果胶很少或者不存在,否则就会在溶液中发生相互作用,从而干扰界面层上聚合电解质层的形成。所以,选择添加质量分数为0.2%的果胶。因此,亚麻籽油二级乳液的组成为亚麻籽油质量分数5.0%、浓缩乳清蛋白质量分数0.45%、果胶质量分数0.2%。
2.4 制备三级乳液时壳聚糖质量分数的确定
在制备三级乳液时,同样通过探讨添加不同质量分数的壳聚糖对三级乳液液滴电荷(Zeta电位)、平均粒径以及乳液稳定性的影响来确定所需壳聚糖的最佳含量。添加不同质量分数壳聚糖的三级乳液稳定性如图4所示。

图4 添加不同质量分数壳聚糖的三级乳液稳定性Fig. 4 Stability of the tertiary emulsions with different chitosan concentrations
由图5可知,在制备三级乳液时,壳聚糖的质量分数对三级乳液的粒径、Zeta电位以及乳液稳定性的影响与制备二级乳液时果胶质量分数对二级乳液的影响基本相同。在pH值为3.5时,壳聚糖分子所带电荷为正(Zeta电位大约为40 mV),而表面覆盖果胶分子的液滴表面所带的电荷为负(Zeta电位大约为-35 mV),此时,壳聚糖分子会因为与液滴表面之间存在强的静电相互吸引作用而吸附到液滴表面。在壳聚糖质量分数为0%时,表面覆盖果胶分子的液滴表面的Zeta电位大约为-35 mV,随着壳聚糖含量的增加,液滴的Zeta电位会发生改变,在壳聚糖质量分数为0.1%时,液滴表面的Zeta电位转变为正值,之后随着壳聚糖含量的增加继续增大,最后,在壳聚糖质量分数达到0.2%之后趋于稳定。这些数据说明壳聚糖分子吸附到表面覆盖果胶的二级乳液液滴表面,并且逐渐达到饱和,得到稳定的亚麻籽油三级乳液。
三级乳液液滴的粒径和Zeta电位如图5所示,在不添加壳聚糖时,此时乳液很稳定,不会产生絮凝或者聚结,说明液滴之间存在较强的静电排斥作用。在壳聚糖质量分数为0.05%时,由于静电中和效应,液滴之间静电排斥作用力变弱,液滴容易发生聚结;另外壳聚糖含量较低,还不足以完全覆盖液滴表面,由于两个或者多个带负电的液滴共享一个带正电的壳聚糖分子,形成桥连结构而产生聚集。导致乳液稳定性下降,此时乳液的平均粒径由600 nm变为10 000 nm,乳液出现严重絮凝并产生分层。当壳聚糖质量分数进一步增加超过0.15%时,Zeta电位增大,乳液重新变的稳定,乳液液滴的平均粒径下降,此时三级乳液由于表面吸附了一层壳聚糖,粒径较二级乳液的粒径大,粒径大约为1 000 nm。
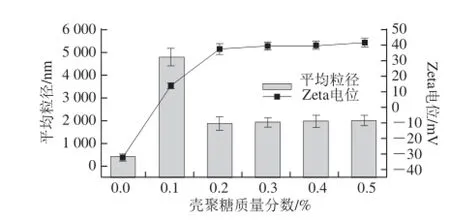
图5 三级乳液液滴的粒径和Zetaa电位Fig. 5 Mean particle size and Zeta-potential of the tertiary emulsions
当壳聚糖含量进一步增加时,可能会由于水相中未吸附的壳聚糖过多而导致损耗絮凝,导致乳液的稳定性下降,故选择壳聚糖的质量分数为0.2%。因此,亚麻籽油三级乳液的组成为亚麻籽油质量分数2.5%,浓缩乳清蛋白质量分数 0.225%,果胶质量分数0.1%,壳聚糖质量分数0.2%。
2.5 亚麻籽油多层乳液体外模拟消化
有研究表明,多层乳液由于在油滴表面形成了一层较厚且致密完整的界面膜,并且由于聚合电解质的带电性质,能够延缓芯材物质在人体内的释放速率,从而达到在体内缓慢释放的效果,提高芯材物质的消化吸收效率[23-24]。本实验采用体外模拟消化的方法,通过观察乳液在模拟胃液中的状态变化,以及亚麻籽油在模拟肠液中的消化速率,来研究对多层包埋对芯材物质的释放特性。
2.5.1 亚麻籽油多层乳液在模拟胃液中的消化情况


图6 各级乳液在模拟胃液中的显微镜图片(×40000)Fig. 6 Micrographs of emulsions in simulated gastric juice (×400)
通过显微镜观察,各级乳液在模拟胃液中的显微镜图如图6所 示,在人工胃液中初级乳液开始是均匀地分散在模拟胃液中,经过40 min之后,液滴会出现聚集,这可能是因为浓缩乳清蛋白被胃液中的蛋白酶分解掉了,使得油滴的界面膜破坏,乳液体系不在稳定。而二级乳液在80 min之后液滴才变得不明显,说明果胶层能够对浓缩乳清蛋白层起到保护作用,使胃蛋白酶分解浓缩乳清蛋白的速度减慢。三级乳液在120 min之后仍然能观察到很均匀的液滴存在,并没有完全崩解,说明三级乳液的液滴上的界面层在胃液中2 h之内没有被完全消化掉,三层包埋的亚麻籽油多层乳液在模拟胃液中存在的时间最长,说明多层乳液在胃液中具有缓释性。
2.5.2 亚麻籽油多层乳液在模拟肠液中游离脂肪酸的释放率
甘油三酯在消化过程中,会分解释放出FFA和单甘脂,测定各个样品在消化过程中不同时刻的FFA的释放率,可以直观地反映各种样品在消化过程中的消化率和消化过程[25]。实验分别测定了不同消化时间内(0~200 min)初级、二级、三级乳液乳液中脂肪酸的释放率,进而比较其消化情况,所得实验结果乳液中FFA的释放率如图7所示。

图7 乳液中FFA的释放率Fig. 7 Release rate of free fatty acids in the emulsions
由图7可知,所有的乳液中的亚麻籽油在2 h内基本都能被消化,说明聚合电解质层不会阻止肠道对亚麻籽油的消化吸收。但是,具有不同聚合电解质层的乳液,其包埋的亚麻籽油的消化速率有所不同。其中初级乳液的消化速率最快,二级乳液的消化速率比初级乳液的消化速率要慢,可能是因为果胶的存在会对液滴起到一定的保护作用,对脂肪酶的吸附起到一定的屏蔽作用,所以二级乳液中亚麻籽油的消化速率要比初级乳液要慢一些。三级乳液中亚麻籽油的消化速率最慢,这是因为果 胶和壳聚 糖可以在油滴表面形成一个较厚的界面膜,从而能够阻止脂肪酶与油滴之间的接触。此外,壳聚糖还能够与胆酸盐结合,从而降低体系溶解消化产物的能力,进一步减缓脂肪的消化。但是,三级乳液最终也会被完全消化,这可能是因为聚合电解质多糖层从油滴表面上解析下来,或者壳聚糖自身被消化掉。结果表明,多层乳液不会阻止脂肪的消化,但是多层包埋的亚麻籽油的消化速率会有所降低,从而可以实现缓释的效果。
3 结 论
确定了二级乳液的组成为亚麻籽油质量分数5.0%、浓缩乳清蛋白质量分数0.45%、果胶质量分数0.2%;三级乳液的组成为亚麻籽油质量分数2.5%、浓缩乳清蛋白质量分数0.225%、果胶质量分数0.1%、壳聚糖质量分数0.2%;多层乳液对芯材具有一定的 控释效果,能够延缓亚麻籽油在模拟胃肠道中的消化速率。
[1] CONNOR W E. Importance o f n-3 fatty acids in health and disease[J]. The American Journal of Clinical Nutrition, 2000, 71(1): 171S-175S. DOI:000084614800002.
[2] 吴素萍. 亚麻籽中α-亚麻酸的保健功能及提取技术[J]. 中国酿造, 2010, 29(2): 7-11. DOI:10.3969/j.issn.0254-5071.2010.02.003.
[3] RUBILAR M, MORALES E, CONTRERAS K, et al. Development of a soup p owder enriched with microencapsulated linseed oil as a source of omega-3 fatty acids[J]. European Journal of Lipid Science and Technology, 2012, 114(4): 423-433. DOI:10.1002/ejlt.201100378.
[4] SCHAEFER E J, BONGARD V, BEISER A S, et al. Plasma phosphatidylcholine docosahexaenoic acid content and risk of dementia and Alzheimer disease: the framingham heart study[J]. Archives of Neurology, 2006, 63(11): 1545-1550. DOI:10.1001/ archneur.63.11.1545.
[5] OOMAH B D, MAZZA G. Bioactive components of fl axseed: occurrence and health benefi ts. 2000[M]//SHAHIDI F, HO C T. Phytochemicals and Phytopharmaceuticals. Urbara: AOCS Press. 1999: 106-121.
[6] 胡晓军, 郭忠贤, 赵毅. 亚麻籽油降血脂作用的研究[J]. 粮食加工, 2005, 30(3): 49-51. DOI:10.3969/j.issn.1007-6395.2005.03.017.
[7] 林非凡,谭竹钧. 亚麻籽油中α-亚麻酸降血脂功能研究[J]. 中国油脂, 2012, 37(9): 44-47. DOI:10.3969/j.issn.1003-7969.2012.09.011.
[8] MOZAFFARIAN D, WU J H Y. Omega-3 fatty acids and cardiovascular disease effects on risk factors, molecular pathways, and clinical events[J]. Journal of the American College of Cardiology, 2011, 58(20): 2047-2067. DOI:10.1016/j.jacc.2011.06.063.
[9] GALLARDO G, GUIDA L, MARTINEZ V. Microencapsulation of linseed oil by spray drying for functional food application[J]. Food Research International, 2013, 52(2): 473-482. DOI:10.1016/ j.foodres.2013.01.020.
[10] 邓乾春, 禹晓, 黄庆德, 等. 亚麻籽油的营养特性研究进展[J].天然产物研究与开发, 2010, 22(4): 715-721. DOI:10.3969/ j.issn.1001-6880.2010.04.040.
[11] IIER R K. Multilayers of colloidal particles[J]. Journal of Colloid and Interface Science, 1966, 21(6): 569-594. DOI:10.1016/0095-8522(66)90018-3.
[12] KELLER S W, JOHNSON S A, BRIGHAM E S, et al. Photoinduced charge separation in multilayer thin films grown by sequential adsorption of polyelectrolytes[J]. Journal of the American Chemical Society, 1995, 117(51): 12879-12880. DOI:10.1021/ja00156a034.
[13] DECHER G. Fuzzy nanoassemblies: toward layered polymeric multicomposites[J]. Science, 1997, 277: 1232-1237. DOI:10.1126/ science.277.5330.1232.
[14] AI H, FANG M, JONES S A, et al. Electrostatic layer-bylayer nano-assembly on biological microtemplates: platelets[J]. Biomacromolecules, 2002, 3(3): 560-564. DOI:10.1021/bm015659r.
[15] GEORGIEVA R, MOYA S, HIN M, et al. Permeation of macromolecules into polyelectrolyte microcapsules[J]. Biomacromolecules, 2002, 3(3): 517-524. DOI:10.1021/bm010164n.
[16] SCHULER C, CARUSO F. Decomposable hollow biopolymer-based capsules[J]. Biomacromolecules, 2001, 2(3): 921-926. DOI:10.1021/ bm010052w.
[17] CARUSO F, TRAU D, MOHWALD H, et al. Enzyme encapsulation in layer-by-layer engineered polymer multilayer capsules[J]. Langmuir, 2000, 16(4): 1485-1488. DOI:10.1021/la991161n.
[18] TRAU D, RENNEBERG R. Encapsulation of glucose oxidase microparticles within a nanoscale layer-by-layer fi lm: immobilization and biosensor applications[J]. Biosens Bioelectron, 2003, 18(12): 1491-1499. DOI:10.1016/S0956-5663(03)00119-2.
[19] OGAWA S, DECKER E A, MCCLEMENTS D J. Influence of environmental conditions on the stability of oil in water emulsions containing droplets stabilized by lecithin-chitosan membranes[J]. Journal of Agricultural and Food Chemistry, 2003, 51(18): 5522-5527. DOI:10.1021/jf026103d.
[20] WANG Y, ANGELATOS A S, CARUSO F. Template synthesis of nanostructured materials via layer-by-layer assembly[J]. Chemistry of Materials, 2008, 20: 848-858. DOI:10.1021/cm7024813.
[21] CARVALHO A G S, SILVA V M, HUBINGER M D. Microencapsulation by spray drying of emulsifi ed green coffee oil with two-layered membranes[J]. Food Research International, 2013, 61: 236-245. DOI:10.1016/j.foodres.2013.08.012.
[22] CARUSO F, MOHWALD H. Preparation and characterization of ordered nanoparticle and polymer composite multilayers o n colloids[J]. Langmuir, 1999, 15(23): 8276-8281. DOI:10.1021/la990426v.
[23] MCCLEMENTS D J, YAN L. Structured emulsion-based delivery systems: controlling the digestion and release of lipophilic food components[J]. Advances in Colloid and Interface Science, 2010, 159(2): 213-228. DOI:10.1016/j.cis.2010.06.010.
[24] MUN S, DECKER E A, MCCLEMENTS D J. Infl uence of emulsifi er type on in vitro digestibility of lipid droplets by pancreatic lipase[J]. Food Research International, 2007, 40(6): 770-781. DOI:10.1016/ j.foodres.2007.01.007.
[25] MCCLEMENTS D J, DECKER E A, PARK Y. Controlling lipid bioavailability through physicochemical and structural approach es[J]. Critical Reviews in Food Science and Nutrition, 2008, 49(1): 48-67. DOI:10.1080/10408390701764245.
Preparation and Stability of Multilayer Emulsions of Linseed Oil by Electrostatic Layer-by-Layer Deposition
LI Jinwei, LIN Chuanzhou, LIU Yuanfa
(School of Food Science and Technology, Jiangnan University, Wuxi 214122, China)
This study investigated the preparation of multilayer emulsions of linseed oil by electrostatic layer-by-layer deposition. The fi nal composition of the secondary emulsion was 5.0% linseed oil, 0.45% whey protein and 0.2% pectin; and the tertiary emulsion was composed of 2.5% linseed oil, 0.225% whey protein, 0.1% pectin, and 0.2% chitosan. The multilayer emulsion technology is effective in controlling the release rate of linseed oil in the body.
linseed oil; layer-by-layer self-assembly; multilayer emulsions
10.7506/spkx1002-6630-201611001
TS225.1;R151.3
A
1002-6630(2016)11-0001-06
李进伟, 林传舟, 刘元法. 制备亚麻籽油多层乳液及其稳定性研究[J]. 食品科学, 2016, 37(11): 1-6. DOI:10.7506/spkx1002-6630-201611001. http://www.spkx.net.cn
LI Jinwei, LIN Chuanzhou, LIU Yuanfa. Preparation and stability of multilayer emulsions of linseed oil by electrostatic layer-by-layer deposition[J]. Food Science, 2016, 37(11): 1- 6. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201611001. http://www.spkx.net.cn
2015-07-13
国家自然科学基金面上项目(31571878;31171703);2013年粮食公益性行业科研专项(201313011-7-3)
李进伟(1972—),男,副教授,博士,主要从事脂质科学研究。E-mail:jwli@jiangnan.edu.cn
