ZD制剂对非开放性软组织损伤模型小鼠肌肉中IL-1β表达的影响
2016-11-01李云章
高 鑫,李云章
(内蒙古农业大学兽医学院,内蒙古 呼和浩特 010018)
ZD制剂对非开放性软组织损伤模型小鼠肌肉中IL-1β表达的影响
高 鑫,李云章
(内蒙古农业大学兽医学院,内蒙古 呼和浩特 010018)
旨在评价ZD制剂对非开放性软组织损伤模型小鼠肌肉中IL-1β表达的影响。利用文献报道的方法,制备小鼠非开放性软组织损伤模型。于造模后第2天开始进行给药治疗,正常组和模型组小鼠不给予任何处理。于造模初期和治疗期间观察各组小鼠的精神活动状态及肉眼病理学变化。于造模第2天和第7天,运用免疫组化法检测各组小鼠损伤局部肌肉组织中IL-1β的表达情况。结果表明,模型组小鼠在造模初期出现精神沉郁、跛行等现象,损伤局部的肌肉组织出现肿胀和皮下淤血等现象。治疗后,小鼠肌肉组织病变明显减轻。造模第2天,模型组、阳性药物对照组、ZD制剂治疗组小鼠肌肉组织中的IL-1β表达量显著高于正常组(P<0.05)。造模第7天,阳性药物对照组、ZD制剂治疗组小鼠肌肉组织中的IL-1β表达量显著低于正常组(P<0.05)。综上提示,ZD制剂对小鼠的非开放性软组织损伤具有缓解作用,其作用机理可能与抑制炎性介质的表达有关。
ZD制剂;小鼠;软组织损伤;肌肉;免疫组化;IL-1β
软组织损伤是指皮肤、皮下浅深筋膜、肌肉、肌腱、腱鞘、韧带、关节囊、滑膜囊、椎间盘、周围神经血管等组织受到各种急性外伤原因造成的病理性损害。急性软组织损伤的常规治疗方法是冷敷,对减轻炎症反应、缓解疼痛、消除肿胀及早期功能恢复有一定的疗效[1],但是局部冷疗的使用时间和温度没有一定的限制,持续冷疗有冻伤的危险,存在一定的风险性。ZD制剂作为一种治疗软组织损伤的复合中药制剂,在临床治疗上获得了较好的效果,但ZD制剂发挥抗炎作用的机制目前还不明确。该研究旨在通过评价ZD制剂对软组织损伤模型小鼠肌肉中IL-1β表达的影响,为阐明ZD制剂发挥抗炎作用的机制提供依据。
1 材料与方法
1.1 实验动物及分组 健康昆明种小鼠48只,雌雄各半,体重 18~20 g,合格证件编号:SCXK(蒙)2002-0001。将48只小鼠随机分成正常组、模型对照组、阳性药物对照组和ZD制剂治疗组,每组12只,雌雄各半。实验动物于试验开始前一周进行饲养环境的适应,雌雄小鼠分笼饲养。采取自然光照,室温25℃左右,自由摄食和饮水。水为清洁水,每日更换新鲜水。
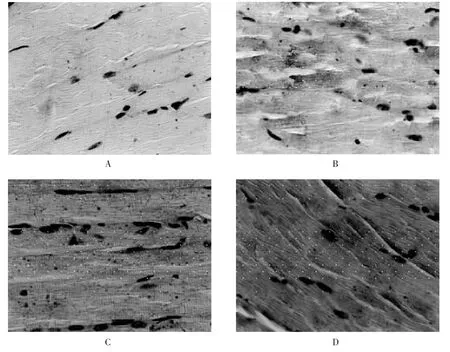
图1 造模第2天各组小鼠肌肉组织中IL-1β表达情况
1.2 主要试剂 免疫组化EliVision super试剂盒、加强型DAB显色试剂,购自福州迈新生物开发有限公司。兔抗鼠IL-1β多克隆抗体,购自Abcam公司。
1.3 ZD制剂的制备 将乳香、没药、当归、红花等12味中药按照比例粉碎成粉末并进行煎煮,先文火加热,然后逐渐加大火力至沸腾,重复3次,每次40 min。将药渣压榨、过滤、浓缩,配成含1 g/mL生药的中药提取原药药液。取白凡士林、单硬脂酸甘油酯、硬脂酸及液体石蜡加热融化为油相。将甘油、蒸馏水和药液混合加热,然后加入三乙醇胺和山梨酸钾溶解为水相。将水相缓慢加入到油相中,然后加入透皮剂冰片和氮铜,在室温下继续搅拌,直至呈黄色半固体,冷凝后即得均匀细腻的W/O型含药软膏。制成的ZD制剂生药含量为0.32 g/g[2]。
1.4 非开放性软组织损伤模型的制备及治疗 参照周国林等[3]报道的方法制备小鼠非开放性软组织损伤模型,模型制备过程如下:于造模前1天,利用8%的硫化钠对小鼠臀部及大腿部位进行脱毛[4],若有因脱毛损伤皮肤的小鼠,剔除不用;将小鼠侧卧式固定在软组织打击器上,对准大腿中部的外侧软组织,用50 g砝码从15 cm高度自由下落,连续打击10次,每只小鼠仅打击1条右腿[5]。打击后肉眼即可见打击部位皮下出现淤血,数分钟后,触摸该部位可发现明显的肿胀。
于造模第2天开始给药,将按摩乳涂抹于阳性药物对照组小鼠患处,将ZD制剂涂抹于ZD制剂治疗组小鼠患处,每日2次,共治疗5 d。正常组和模型对照组小鼠不给予任何处理。
1.5 小鼠精神活动状态及肉眼病理学观察 于造模初期和治疗期间观察各组小鼠的精神活动状态,观察指标包括小鼠的精神状态,对外界刺激反应的敏感程度,采食、饮水量,自主活动次数,毛色、毛质等。同时肉眼观察各组小鼠软组织损伤局部的病理学变化,包括肿胀、淤血、切开后有无出血现象等。
1.6 免疫组化法检测小鼠肌肉中IL-1β的表达于造模第2天和第7天的相同时间点,各组分别取6只小鼠处死,以打击部位为中心,进行肌肉取材,放入福尔马林中固定[6]。肌肉组织用福尔马林固定48 h后,采用常规方法进行脱水、浸蜡、包埋、切片。然后使用二甲苯脱蜡,梯度酒精水化。用3%的H2O2溶液孵育15 min,PBS洗涤3次,每次5 min。滴加1∶500浓度的兔抗鼠IL-1β多克隆抗体,4℃过夜,PBS 洗涤 3 次,每次 5 min。 DAB 显色[7],PBS 充分洗涤。用苏木素复染1 min,流动水冲洗10 min常规脱水,用中性树胶封片。

图2 造模第7天各组小鼠肌肉组织中IL-1β表达情况
1.7 免疫组化结果观察 用Olympus显微成像系统对切片进行观察,低倍镜下定位后,拍照采集图像。采用IPP(Image-Pro Plus)6.0图像分析软件对IL-1β免疫组化染色的阳性表达进行定量分析。将图像中呈现黄色或棕黄色的区域作为AOI(area of interest)进行光密度测定分析,测量平均光密度(AOD,average optical density)值[8]。 每只小鼠取 1块肌肉进行免疫组化染色,每块肌肉均染色3张,从每个组织块的免疫组化染色切片中随机选取1张,使用Olympus倒置显微镜进行图像采集,每张切片随机拍摄4个不重叠视野的照片(400×),并采用IPP 6.0软件计算每个视野阳性染色的AOD值。每个观察时间各组小鼠分别得到24组试验数据,均用于统计学分析。
1.8 数据统计与分析 采用SPSS 16.0软件,利用单因素方差分析法对各组小鼠肌肉组织中IL-1β的表达量进行统计学分析,采用Duncan氏法对各组平均数进行多重比较,P<0.05时认为差异显著。
2 结果与分析
2.1 小鼠精神活动状态的观察 正常组小鼠无明显变化。模型组小鼠在造模初期精神沉郁,对外界刺激反应不敏感,采食量减少,自主活动次数减少,毛色变暗、毛质凌乱,跛行。治疗后,阳性药物对照组和ZD制剂治疗组小鼠与模型组相比较,精神活动状态有所改善,自主活动次数有所增加。
2.2 肉眼病理学变化的观察 正常组小鼠肌肉组织的外观和颜色均正常,未见充血、水肿。造模后,模型组小鼠肌肉组织出现明显的肿胀和皮下淤血现象[9],造模后24 h最明显;肌肉切开后有血液。治疗后,阳性药物对照组和ZD制剂治疗组小鼠肌肉组织肿胀逐渐消退,淤血逐渐消散,病变明显减轻。
2.3 小鼠肌肉组织中IL-1β的表达情况 免疫组化检测发现,正常组小鼠肌肉组织中的细胞间质仅见少量的棕黄色颗粒。造模第2天,模型组小鼠的细胞质、细胞核中均可见棕黄色和褐色颗粒,阳性药物对照组和ZD制剂治疗组小鼠均可见大量的阳性着色细胞,模型组和2个药物治疗组的阳性着色细胞明显多于正常组(见图1A~D)。由表1可知,造模第2天,模型组、阳性药物对照组、ZD制剂治疗组小鼠的AOD值均显著高于正常组 (P<0.05),模型组、阳性药物对照组、ZD制剂治疗组小鼠的AOD值之间的差异均不显著(P>0.05),表明模型组、阳性药物对照组、ZD制剂治疗组小鼠肌肉组织中的IL-1β表达量显著高于正常组(P<0.05),但三者之间IL-1β的表达量差异不显著(P>0.05)。由图2和表1可知,造模第7天,模型组小鼠的AOD值显著高于正常组(P<0.05)、阳性药物对照组和ZD制剂治疗组,而阳性药物对照组和ZD制剂治疗组小鼠的AOD值虽高于正常组小鼠,但差异不显著 (P>0.05),提示ZD制剂和阳性对照药物能够显著降低非开放性软组织损伤模型小鼠肌肉组织的IL-1β表达量(P<0.05)。此外,ZD制剂治疗组小鼠的AOD值与阳性药物对照组相比差异不显著(P>0.05),提示ZD制剂对于模型小鼠肌肉组织中IL-1β表达的抑制作用与阳性对照药物相似。
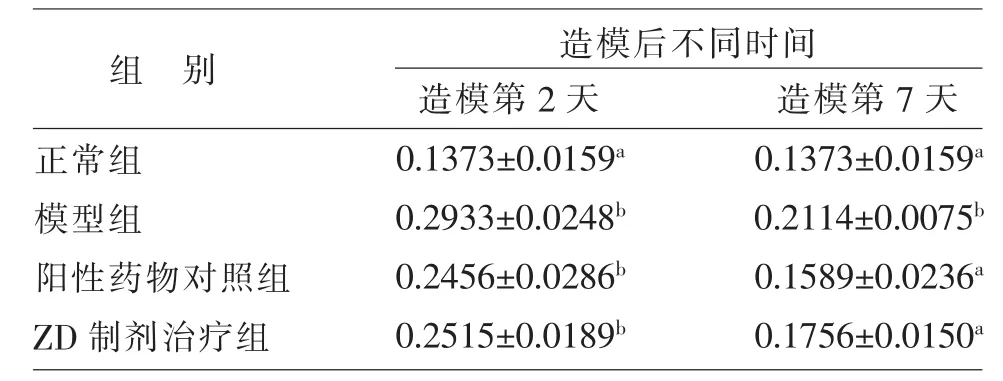
表1 造模后不同时间各组小鼠肌肉组织中IL-1β免疫组化染色阳性AOD值
3 讨论
软组织发生损伤后,机体通过体液、神经和内分泌系统等方面的调节,使内环境能够保持相对稳定的状态,这主要与损伤组织的自身修复有关,而软组织的自身修复过程需要多种细胞核生长因子的参与。目前,对于软组织损伤后组织修复情况的研究,最直接的方法是对损伤后的组织进行病理组织学检查[9]。免疫组化方法可以辅助病理诊断、指导治疗、评估预后[10],因此,应用该方法能够对损伤的肌肉组织进行有效的预后评价。石蜡切片在染色过程中不易掉片[11],具有染色后细胞形态清晰、着色强度高、阳性斑块显色明显、假阳性结果出现率较低等优点[12]。
该研究采用免疫组化EliVision二步法对急性软组织损伤后7 d内2个时间点IL-1β的表达情况进行分析发现,正常肌肉组织内可见阳性细胞表达,但表达强度较弱。损伤后的肌肉组织中阳性细胞的表达强度较高,在造模第2天时,模型组的阳性信号表达量最高,损伤后的肌肉组织中阳性细胞表达量随着时间的延长而减少。造模第7天,模型组、阳性药物对照组、ZD制剂治疗组小鼠肌肉组织中IL-1β的表达量较造模第2天有所下降。此外,造模第7天,阳性药物对照组和ZD制剂治疗组小鼠肌肉组织中IL-1β的表达量显著低于模型组(P<0.05),提示ZD制剂的体内抗炎作用可能是通过抑制炎性介质的表达来实现的。
[1]张博,罗从风.骨科相关软组织损伤局部冷疗[J].国际骨科学杂志,2009,30(5):293-295.
[2]柏合.自制外用中药软膏对实验小鼠急性软组织损伤的初步研究[D].呼和浩特:内蒙古农业大学,2012.
[3]周国林,姚全胜,潘玉英.一种动物软组织损伤的实验方法[J].中国药理学报,1991,7(5):396-397.
[4]齐越峰,卢建秋,赵兴玮,等.正骨散对实验性损伤局部软组织炎性细胞的影响[J].中国骨伤,2008,21(10):774-775.
[5]张爱平,林燕萍,王和鸣,等.纳米相陶瓷远红外线治疗急性软组织损伤动物模型实验研究 [J].福建中医学报,2001,11(1):20-21.
[6]马恒辉,周晓军.提高免疫组化染色质量的相关处理和操作[J].临床与实验病理学杂志,2011,27(7):760-762.
[7]张卫琴.免疫组化技术在病理诊断中的应用[J].安徽医药,2012,16(11):1700-1702.
[8]杨志金.超声波促进大鼠骨骼肌挫伤修复的实验研究[D].重庆:第三军医大学,2010.
[9]魏优秀,李贺伟,周伟,等.治伤软膏外敷治疗大鼠急性软组织损伤的实验研究 [J].中国中医骨伤科杂志,2009,17(8):8-9.
[10]李丽华.病理免疫组化染色方法质量控制应注意的问题[J].局解手术学杂志,2008,17(6):434-435.
[11]黄照权,李春英,李华,等.免疫组织化学EnvisionTM二步染色法的应用[J].铁道医学,1999,27(6):410-411.
[12]陈勤,周君,胡冠宇.石蜡切片免疫组化过程中存在的问题及解决方法 [J].安徽大学学报:自然科学版,2009,33(2):85-88.
ZD Preparation Inhibits the Inflammation Caused by Closed Soft Tissue Injuries in Mice by Reducing the Expression of IL-1β
GAO Xin,LI Yun-zhang
(College of Veterinary Medicine,Inner Mongolia Agricultural University,Hohhot 010018, China)
This study was conducted to evaluate the effect of a traditional Chinese medicine compound ZD preparation on the expression of IL-1β in muscle of closed soft tissue injured mice.The soft tissue injured model in mice was prepared by the reported methods.The mice were treated by ZD preparation and positive control drugs at the 2ndday after modeling,but the mice in healthy group and model group
no treatment.The health situation and pathological changes of the mice were observed by naked eyes during the early stage of modeling and therapy.On days of 2 and 7 of modeling,the immunohistochemistry assay was employed to evaluate the expression of IL-1β in the injured muscle tissue.The results showed that the symptoms of depression and claudication were observed in mice of model group,and swelling as well as subcutaneous congestion was also observed in the injured muscle tissue.After treatment,the mice with soft tissue injuries achieved remission of symptoms.At the 2ndday of modeling,the expression of IL-1β in the injured muscle tissue of mice in model group,positive control drugs treatment group and ZD preparation treatment group was significantly higher than that in the normal muscle tissue of mice in healthy group(P<0.05).At the 7thday of modeling,significantly reduced expression of IL-1β in the injured muscle tissue of mice in positive control drugs treatment group and ZD preparation treatment group was found compared with that in the normal muscle tissue of mice in healthy group (P<0.05).The combined data suggests that ZD preparation inhibits the inflammation caused by closed soft tissue injuries in mice by reducing the expression of IL-1β.
ZD preparation;mice;soft tissue injuries;muscle;immunohistochemistry;IL-1β
S853.74
A文章顺序编号:1672-5190(2016)04-0001-04
2016-04-05
项目来源:国家自然科学基金项目(31360629)。
高鑫(1989—),女,硕士研究生,主要研究方向为赛马肢蹄病。
李云章(1956—),男,教授,博士生导师,主要研究方向为赛马肢蹄病和奶牛疾病。
(责任编辑:赵俊利)
