人工抗菌肽MA-D4的原核表达及其生物活性鉴定
2016-10-26刘诚
刘诚
(1.广西大学新闻传播学院,广西南宁530004;2.亚热带农业生物资源保护与利用国家重点实验室,广西南宁530004)
人工抗菌肽MA-D4的原核表达及其生物活性鉴定
刘诚1,2*
(1.广西大学新闻传播学院,广西南宁530004;2.亚热带农业生物资源保护与利用国家重点实验室,广西南宁530004)
为研究人工抗菌肽MA-D4的高效制备方法,检测其体外生物活性,探索该抗菌肽作为新型抗菌药物的应用前景和开发潜力,本试验设计人工抗菌肽MA-D4的氨基酸序列,并采用大肠杆菌偏嗜性密码子设计编码该抗菌肽的核苷酸序列;采取重叠区扩增基因拼接法合成目的基因,构建原核表达载体,并转化至大肠杆菌中诱导表达;表达产物经肠激酶酶切处理和镍离子亲和层析纯化后,进行体外生物活性检测。结果表明,人工抗菌肽MA-D4具备较强的广谱抗菌活性,可抑制革兰氏阳性菌和阴性菌,同时不具有溶血活性。综上所述,人工抗菌肽MA-D4在食品防腐、疾病治疗等方面具有良好的应用前景,极具开发潜力。
抗菌肽;MA-D4;原核表达;生物活性
抗菌肽是一类由宿主产生的能够抵抗外界病原体感染的小分子多肽,是生物天然免疫防御系统的重要组成部分,由特定基因编码产生,具有广谱抗菌活性(刘诚等,2011)。抗菌肽广泛存在于各种生物体内,在微生物、植物和动物体中均有发现并成功分离获得。但生物体内抗菌肽含量较低,直接提取的工艺要求高、难度大,无法应用于规模化生产。人工化学合成虽可获得与天然抗菌肽一致的氨基酸序列,但是常常不能形成正确的空间结构,且因成本昂贵,使其目前仅停留在实验室试验阶段。通过基因工程途径合成人工抗菌肽是规模化生产制备的理想选择。研究表明,杂合不同抗菌肽分子可以有效改善其生物活性,消除或降低其细胞毒性和溶血活性(谢海伟等,2012)。本试验将抗菌肽Magainin和Dermaseptin-4杂合并进行高效表达,以期为相关研究提供理论依据。
1 材料和方法
1.1质粒、菌株原核表达质粒pET-32a(+)、基因工程菌E.coli BL21(DE3)pLysS和E.coli DH5α,均购自默克化工技术(上海)有限公司;金黄色葡萄球菌(10384)、枯草芽孢杆菌(21744)购自中国工业微生物菌种保藏管理中心;绿脓杆菌、猪链球菌2型和炭疽杆菌由湖南农业大学分子免疫学与微生物学实验室保存。
1.2主要试剂限制性内切酶、DNA分子量Marker,均购自宝生物工程(大连)有限公司;蛋白质分子量Marker购自Fermentas公司;Taq PCR Mastermix、DNA凝胶回收试剂盒、质粒抽提试剂盒,均购自天根生化科技(北京)有限公司;肠激酶(Z01003)购自南京金斯瑞生物科技有限公司;其他试剂均为分析纯级产品。
1.3设计抗菌肽MA-D4氨基酸序列和MA-D4基因根据GenBank中的抗菌肽Magainin(No. 474452717)和Dermaseptin-4(No.P84924.1)成熟肽氨基酸序列,将抗菌肽Magainin第21位的甲硫氨酸(Met)替换成色氨酸(Trp),设计出人工抗菌肽MA-D4的氨基酸,序列如下所示,下划线为肠激酶识别位点。

参照Hoffmann等(1996)的方法,采用大肠杆菌偏嗜性密码子设计编码抗菌肽MA-D4的核苷酸序列,并在两端分别添加核酸限制性内切酶XhoI和BamHI识别位点,形成MA-D4基因,共有204bp,序列如下所示,下划线分别为核酸限制性内切酶XhoI和BamHI的识别位点。
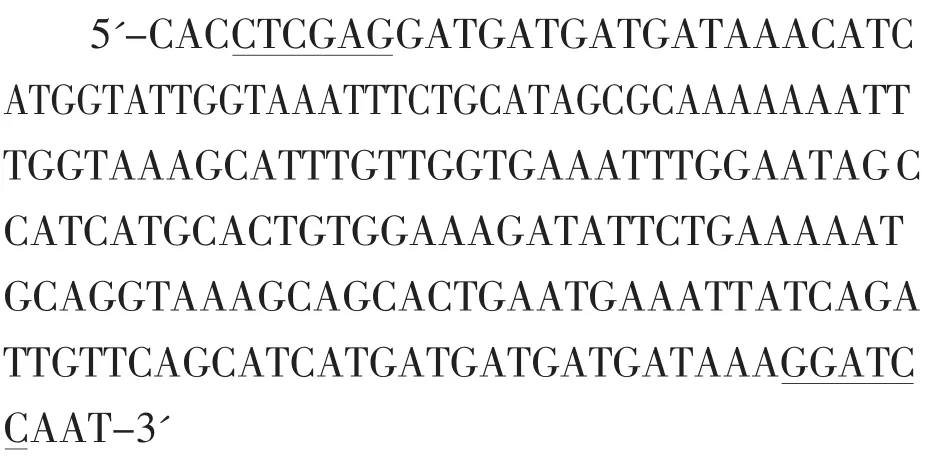
1.4MA-D4基因合成和原核表达载体构建利用DNAStar软件,设计两两互补的4条PCR引物(表1)。其中P1与P2之间、P2与P3之间、P3与P4之间均有15个核苷酸互补。由广州英骏生物有限公司合成上述引物。

表1 合成MA-D4基因的PCR引物
采用重叠区扩增基因拼接法,多步PCR获得人工抗菌肽MA-D4基因。先以P1和P2为引物扩增MA-D4基因前半部分序列MA-D4-Q,再以P3和P4为引物扩增MA-D4基因后半部分序列MA-D4-H,最后以前两次PCR产物为模板,P1和P4为引物扩增获得完整的MA-D4基因。反应体系(50 μL):2×Taq PCR Mastermix 25 μL,上游引物和下游引物各1.0 μL,ddH2O 23 μL。PCR程序:95℃预变性5 min;94℃变性30 s,58℃退火30 s,72℃延伸30 s,循环30次;72℃终延伸10 min。反应结束后使用1.0%琼脂糖凝胶进行DNA电泳分析,产物置于-20℃保存。
使用XhoI和BamHI核酸限制性内切酶对PCR产物和原核表达质粒pET-32a(+)同时进行双酶切操作。纯化酶切产物后,将MA-D4基因片段与pET-32a(+)质粒连接,构建原核表达载体,并转化至E.coli DH5α中。利用氨苄西林(Amp)挑选疑似阳性菌,由深圳华大基因科技服务有限公司测序确认。将阳性菌扩大培养后,使用质粒抽提试剂盒提取重组质粒P-MA-D4。最终将P-MA-D4转化至E.coli BL21(DE3)pLysS中,即为E-MA-D4。
1.5人工抗菌肽MA-D4诱导表达与获取纯化选取在氨苄西林(Amp)LB固态培养基上的单个阳性菌落,振荡培养过夜。翌日,以1∶100体积比转移至200 mL添加有0.1%氨苄西林(Amp)的LB液态培养基中继续培养,直至OD600nm值达到0.5~0.6时,按照1.0 mmol/L终浓度添加IPTG诱导EMA-D4表达。
添加IPTG 6 h后,4℃、5000 r/min离心10 min收集菌体,使用PBS清洗三次,再利用超声波裂解菌体。因预试验鉴定融合蛋白为可溶蛋白形式,4℃、12000 r/min离心15 min收集上清液。使用肠激酶按下述酶切体系对上清液进行酶切处理:10×Buffer 10.0 μL,ddH2O 38.0 μL,上清液50.0 μL,肠激酶2.0 μL,23℃放置20 h。
利用Thermo Scientific公司的HisPur Ni-NTA Spin Purification Kit,通过镍离子亲和层析纯化获得人工抗菌肽MA-D4。按说明书预处理树脂柱后,加入与High-capacity nickel-IMAC resin等量的酶切处理过的上清液,置于4℃环境中结合1 h后,梯度洗脱蛋白,分段收集洗脱液,进行SDS-PAGE检测。使用Bradford法检测人工抗菌肽MA-D4溶液浓度(汪家政和范明,2000)。
1.6人工抗菌肽MA-D4生物活性检测
1.6.1最小抑菌浓度和最低杀菌浓度测定通过微量稀释法测定人工抗菌肽MA-D4对于大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)、枯草芽孢杆菌(Bacillus subtilis)、绿脓杆菌(Pseudomonas aeruginosa)、猪链球菌2型(Streptococcus suis 2)和炭疽杆菌(Bacillus anthracis)的最小抑菌浓度(MIC)和最低杀菌浓度(MBC)。具体试验步骤参照Duclohier(2006)的方法:将试验菌株制备成106cfu/mL的菌液,分别加入96孔细胞培养板内,每孔90 μL。使用PBS将人工抗菌肽MA-D4溶液分别稀释成40.0、20.0、10.0、8.0、6.0、4.0、2.0、1.0、0.5 μg/mL,并加入96孔细胞培养板内,每孔10 μL。设置空白对照组仅含LB液态培养基,条件对照组为仅含有试验菌株的菌液,酶切对照组为添加有未经肠激酶处理的上清液和试验菌株的菌液。置于37℃培养箱中过夜,翌日测定每孔的OD600nm值。可完全抑制细菌生长的最低溶液浓度即为人工抗菌肽MA-D4针对该试验菌株的MIC。将MIC以上的组按1∶100比例接种LB液态培养基,并取其中100 μL均匀涂布在LB固态培养基上,置于37℃培养箱中12 h后,进行菌落计数。固态培养基上少于5个菌落的最高溶液浓度即为人工抗菌肽MA-D4针对该试验菌株的MBC。
1.6.2溶血活性测定对健康小鼠进行眼球采血,将获得的小鼠血液与阿氏液等比例混合,2000 r/min离心5 min后弃去上清液。使用10倍体积的生理盐水洗涤小鼠红细胞3次后,使用生理盐水将其稀释成2%浓度的红细胞悬液。将人工抗菌肽MA-D4制备成不同浓度的稀释液,与红细胞悬液混合,37℃孵育30 min后,2000 r/min离心5 min,测定上清液于540 nm的吸收值。使用生理盐水作为阴性对照组,使用1%Triton X-100作为阳性对照组,按照540 nm吸收值计算人工抗菌肽MA-D4溶血率(石伟等,2015)。
2 结果
2.1人工抗菌肽MA-D4基因的多步PCR扩增分别取三次PCR的产物各10 μL,使用1.0%琼脂糖凝胶进行DNA电泳分析。由图1可见,100~250 bp间有特异性条带,符合预期结果,即为MA-D4基因片段。

图1 人工抗菌肽MA-D4基因的多步PCR扩增
2.2测序经深圳华大基因科技服务有限公司测序,确认所获得的MA-D4基因序列与试验设计完全一致。
2.3人工抗菌肽MA-D4的获取与纯化收集上清液后,使用肠激酶酶切处理,并通过镍离子亲和层析法获得纯化的人工抗菌肽MA-D4溶液。由图2可知,经过纯化处理后,4.6~10.0 kD处有明显的蛋白条带,符合试验设计大小,即为人工抗菌肽MA-D4。通过Bradford法测定其蛋白浓度为486.75 μg/mL。

图2 人工抗菌肽MA-D4的镍离子亲和层析纯化结果
2.4人工抗菌肽MA-D4的生物活性检测
2.4.1最小抑菌浓度和最低杀菌浓度使用微量稀释法测定人工抗菌肽MA-D4对于大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌、绿脓杆菌、猪链球菌2型和炭疽杆菌的MIC分别为0.5、1.0、1.0、0.5、1.0、4.0 μg/mL;MBC分别为1.0、2.0、2.0、1.0、2.0、6.0 μg/mL。未经肠激酶处理的融合蛋白针对所有试验菌株均不能表现出生物活性。
2.4.2溶血活性阴性对照组的溶血率为0%,阳性对照组的溶血率为100%,按照540 nm吸收值计算不同浓度下人工抗菌肽MA-D4的溶血率,结果见图3。由图3可知,当人工抗菌肽MA-D4浓度分别为5、10、20、40、80、160、320、400 μg/mL时,溶血率依次为0.78%、1.23%、1.96%、2.15%、2.97%、3.72%、6.45%、6.81%。

图3 人工抗菌肽MA-D4的溶血活性检测
3 讨论
本试验采用重叠区扩增基因拼接法,通过设计4条末端互补的PCR引物,分三步合成人工抗菌肽MA-D4基因。其两端带有的核酸限制性内切酶XhoI和BamHI识别位点为构建原核表达载体提供黏性末端;肠激酶识别位点可将人工抗菌肽MA-D4从诱导表达的融合蛋白中分离;His标签则可使人工抗菌肽MA-D4通过镍离子亲和层析法得到纯化。
绝大多数生物都具备某种程度的密码子偏嗜性,大肠杆菌极少利用TAG等8个密码子(郑彬琼,2009;李永春等,2006)。本试验设计的引物均在采用大肠杆菌利用频率较高的密码子构成,以期大肠杆菌原核表达系统中实现密码子最佳化,从而进行高水平表达。
pET-32a(+)原核表达质粒中带有硫氧还蛋白(Trx)标签,可促进表达高产量的可溶性融合蛋白,并能催化蛋白质二硫键还原,帮助蛋白质正确折叠(王媛媛等,2008)。因人工抗菌肽MA-D4分子量较小,仅占融合蛋白的36.15%,对其进行融合表达既能实现融合蛋白的可溶性表达,又能避免蛋白酶作用,提高稳定性(Hsu等,2013;Wang等,2013)。
通过对人工抗菌肽MA-D4的体外生物活性检测,发现其对以大肠杆菌为代表的革兰氏阴性菌、以猪链球菌2型为代表的革兰氏阳性菌和目前耐药性最严重的金黄色葡萄球菌均具有生物活性,说明人工抗菌肽MA-D4具有广谱抗菌活性(刘诚等,2012)。
人工抗菌肽MA-D4浓度为400 μg/mL时,溶血率仅为15.6%,推测其针对小鼠红细胞的HC50值应远远超出400 μg/mL,而人工抗菌肽MA-D4发挥生物活性的浓度仅需1.0~6.0 μg/mL,由此可以认为其不表现溶血活性。
综上所述,人工抗菌肽MA-D4具备较强的广谱抗菌活性,可抑制革兰氏阳性菌和革兰氏阴性菌,同时不具有溶血活性。其制备方法高效,纯化过程简单,生产成本低廉,适用于规模化生产。因此,人工抗菌肽MA-D4可作为一类新型抗菌药物,在食品防腐、疾病治疗等方面将具有良好的应用前景和开发潜力。
[1]李永香,李宏,王芳平.大肠杆菌同义密码子重复序列中密码子的使用[J].内蒙古工业大学学报(自然科学版),2006,1:5~11.
[2]刘诚,黎满香,卢帅,等.抗菌肽Dermadistinctin-K的原核表达及生物活性鉴定[J].中国兽医科学,2012,5:517~522.
[3]刘诚,黎满香,卢帅,等.抗菌肽研究进展[J].动物医学进展,2011,3:94~99.
[4]石伟,李彩云,陈玉清.蜂毒肽Melittin对小鼠红细胞溶血效应及影响机制分析[J].南京师大学报(自然科学版),2015,2:86~92.
[5]汪家政,范明.蛋白质技术手册[M].2000.166~183.
[6]王媛媛,韩红辉,杜冰,等.一种新型肝癌免疫毒素的表达、纯化及初步鉴定[J].现代免疫学,2008,2:110~115.
[7]谢海伟,孙兰萍,王娣,等.抗菌肽(tachyplesinⅠ)串联基因的构建、表达及抗菌活性[J].高校化学工程学报,2012,4:640~647.
[8]郑彬琼.大肠杆菌同义密码子偏好性概述[J].硅谷,2009,1:3~24.
[9]Duclohier H.Bilayer lipid composition modulates the activity of dermaseptins,polycationic antimicrobial peptides[J].Eur Biophys J,2006,35(5):401~409.
[10]Hoffmann J A,Reichhart J M,Hetru C.Innate immunity in higher insects[J].Curr Opin Immunol,1996,8(1):8~13.
[11]Hsu M F,Yu T F,Chou C C,et al.Using Haloarcula marismortui bacteriorhodopsin as a fusion tag for enhancing and visible expression of integral membrane proteins in Escherichia coli[J].PLoS One,2013,8(2):56363.
[12]Sambrook J,Sambrook J,Green M R.Molecular cloning:a laboratory manual[M].4th ed.ed.Cold Spring Harbor,N.Y.:Cold Spring Harbor Laboratory Press,2012:3.
[13]Wang W,Luo J,Xu L,et al.Expression of scFv-Mel-Gal4 triple fusion protein as a targeted DNA-carrier in Escherichia Coli[J].Cell Biochem Funct,2013,31(8):698~706.
The test was conducted to study the efficient preparation methods of artificial antibacterial peptide MA-D4 and detect its biological activity in vitro,explore the application prospect and development potential of antibacterial peptide MA-D4 as a new type of antibacterial drug.The amino acid sequence of artificial antibacterial peptide MA-D4 was designed,and the nucleotide sequence coding antibacterial peptide MA-D4 was designed by using E.coli preferred codon;MA-D4 gene was spliced by overlap extension,then the prokaryotic expression vector was constructed and transformated;after the treatment of enterokinase and Ni ion affinity chromatography,the expression product was performanced the further detection of biological activity.The results showed that artificial antibacterial peptide MA-D4 had broad-spectrum antibacterial activity,could inhibit gram-positive bacterium and gram-negative bacteria,as well as had no hemolytic activity.The results indicated that artificial antibacterial peptide MA-D4 had good application prospect and development potential in such aspects as food preservative,disease treatment.
antibacterial peptide;MA-D4;prokaryotic expression;biological activity
S816.7
A
1004-3314(2016)02-0030-04
10.15906/j.cnki.cn11-2975/s.20160207
