冬季大鹏澳海域微表层浮游植物色素特征的日变化研究
2016-10-20陈飞羽王小冬马长江王朝晖
陈飞羽, 江 涛, 2, 张 玲, 王小冬, 马长江, 王朝晖
冬季大鹏澳海域微表层浮游植物色素特征的日变化研究
陈飞羽1, 江 涛1, 2, 张 玲1, 王小冬1, 马长江3, 王朝晖3
(1. 暨南大学赤潮与海洋生物学研究中心, 广东广州 510632; 2. 农业部海洋渔业可持续发展重点实验室, 中国水产科学研究院黄海水产研究所, 山东青岛266071; 3.暨南大学水生生物研究所, 广东广州 510632)
于2013年12月3日清晨、正午、傍晚采集了大亚湾大鹏澳海域3个站位的微表层和次表层水样, 经过三级分级过滤(小型: >20 μm; 微型: 2.7~20 μm; 微微型: <2.7 μm)后, 对其进行高效液相色谱(HPLC)色素分析, 通过藻类色素化学分类法(CHEMTAX)分析不同浮游植物对Chl的贡献, 研究了微表层及次表层光合色素粒径特征及浮游植物群落结构差异。结果表明, 冬季大亚湾海域水体中存在的浮游植物光合色素主要有17种, 以岩藻黄素和Chl含量较高。微表层总Chl平均浓度为0.797 μg/L, 略高于次表层的0.714 μg/L, 不存在显著性差异(>0.05); 微表层和次表层Chl含量清晨最高, 傍晚次之, 正午最低。微表层不同粒径浮游植物对Chl的贡献率从大到小依次为小型、微型、微微型浮游植物, 分别为80.7%, 10.1%和9.2%。CHEMTAX分析结果得出, 冬季该海域硅藻占绝对优势, 甲藻、定鞭藻、青绿藻、蓝藻、隐藻所占比重相差不大。微表层中定鞭藻、青绿藻和蓝藻等较小粒径浮游植物种群所占比重高于次表层, 说明相对于次表层, 微表层中的浮游植物群落有小型化趋势。
微表层; 浮游植物; 光合色素; 粒级结构; 大鹏澳
海洋微表层是海洋与大气之间相互作用的重要界面(传统上被定义为海洋表面1~1000 μm的水层), 与其他水层相比, 微表层具有独特的物理、化学和生物性质[1]。微表层在海气交换、通量计算、气候变化等方面都发挥重要作用[2-4]。研究表明, 海洋微表层对营养盐、有机化合物、重金属及微生物等均有明显的富集作用[2, 5-6]。微表层中浮游植物群落结构及生物量与次表层不同[7], 微表层浮游植物的光合作用能改变海-气物质交换[3], 微表层中群落结构的变化对高营养级具有特定的意义, 许多栖息于微表层中的无脊椎动物幼虫、浮游动物等需要依赖微表层中的浮游植物而生存[7-8]。由此可见, 海洋微表层在海洋生物地球化学循环中起到了重要作用, 有关微表层的研究也显得颇具意义。
微表层位于水体表面, 紫外线强, 温度高, 随着微表层环境因子的日变化[9], 浮游植物群落结构也会发生变化以适应其生长环境。Carilson[10]曾发现, 与其他水层相比, 微表层浮游植物在白天受到光抑制从而导致叶绿素(Chl)减少, 而夜晚则发生富集。大多数微表层浮游植物群落结构的研究以显微观察为基础[11-12], 然而这种方法存在一定的弊端[13], 如一些缺少明显形态特征、容易破碎以及细胞直径很小的种类在显微镜下难以鉴定, 并且操作耗时, 需要专业的分类学知识。高效液相色谱(HPLC)色素分析技术避免了此类弊端, 根据不同浮游植物类群含有的特征色素进行分类。目前, 基于浮游植物特征色素来研究微表层浮游植物群落结构的研究较少[7]。
本研究于2013年12月3日在大鹏澳海域, 对微表层和次表层进行了日变化的调查分析, 研究了光合色素的分布及其表征的浮游植物群落组成结构, 以期揭示微表层对浮游植物光合色素的富集程度和日变化规律, 为海洋微表层的深入研究提供参考。
1 材料与方法
1.1 采样点的设置
于2013年12月3日(冬季), 在大亚湾大鹏澳海域设置3个采样位点(图1), 分别于清晨(6: 00)、正午(12: 00)、傍晚(18: 00)进行调查。St.1位于牡蛎养殖区, St.2位于渔排养殖区, St.3位于非养殖区(对照)。St.3站位水体交换条件较好, 受养殖区影响较小(图1)。
1.2 样品的采集与分析
次表层样品用5L WB-PM有机玻璃采水器采集离水面0.5 m的水层水样。微表层采样方法较多, 目前最广泛应用的几种采样方法, 包括玻璃板法(采集厚度60~100 μm)、金属筛网法(200~400 μm)、以及转筒采样器(70~100 μm)等。玻璃板法受风速和海浪的影响较大, 而金属筛网法可以适应不同的气候条件, 且和玻璃板法相比, 金属筛网法更适合研究微表层浮游植物各参数的富集[14], 因此本文微表层样品使用筛网法进行采集, 具体方法如下: 将孔径为1.0 mm的不锈钢网筛镶在40 cm×50 cm的铝框中, 筛网取样器垂直没入海面下, 然后将筛网垂直轻轻提起, 附在网格上的水膜逐渐脱离网格, 微表层水样流入样品瓶中。重复此过程直至收集到所需水样体积, 取样量除以取样次数和筛板表面积即得微表层厚度(200 μm±10 μm)。同时, 用Digital LuxmeterZDS-10W照度仪现场测量光照强度, 置于水面以上测得值作为微表层的光照强度, 于 0.5 m水层测得值为次表层光照强度; ProPlus型YSI仪现场测量次表层水温、盐度等理化因子, 微表层待取样后测定其盐度。水样采集后, 经200 μm筛娟滤除大型浮游植物和浮游动物干扰后, 在弱真空(<0.03 MPa)条件下依次经20 μm孔径尼龙滤膜(Millipore公司), 2.7 μm孔径玻璃纤维滤膜(GF/D, Whatman公司)及0.7 μm孔径玻璃纤维滤膜(GF/F, Whatman公司)进行分级过滤, 过滤后将滤膜折叠用锡纸包裹迅速保存于液氮罐中直至实验室分析。
1.3 色素的HPLC分析
色素提取方法参考Zapata等[15]。将冷冻的滤膜剪碎, 用3 mL的95%甲醇萃取, 并在冰水浴中超声处理8 min, 随后3 000 g离心3 min, 然后将萃取物通过尼龙滤膜针筒滤器(0.22 μm孔径)以除去细胞和滤膜碎屑, 取200 μL的萃取液和67 μL的Milli-Q水(Millipore)混合, 混合后立即进行分析, 进样量为100 μL。所有操作均在低光、低温条件下进行以减少光合色素降解。
光合色素分析采用Agilent 1200液相色谱仪(Agilent公司, 美国), 色谱柱为Waters Symmetry C8柱(Eclipse XDB, 150 mm×4.6 mm, 3.5 μm粒径), 采用DAD检测器进行检测(波长设为430 nm和440 nm)。流动相的配制和流速等参数均参考Zapata等[15]。色素标准品购自丹麦DHI公司。色素的定性定量分析采用外标法。
1.4 色素的CHEMTAX分析
浮游植物不同类群对Chl的贡献率用矩阵分析软件CHEMTAX计算得出[16]。本文采用分级过滤的色素浓度加和作为水体总色素浓度(以T-表示, 见1.5), 应用于CHEMTAX分析。CHEMTAX软件是根据各种藻类初始色素与叶绿素的比值, 利用最陡下降算法反复地优化一个包含每一种藻类的色素比值矩阵, 来定量的确定浮游植物群落组成和丰度。各浮游植物类群的特征光合色素与叶绿素比值初始值依据参考文献[16-17]。分析的八种浮游植物类群包括: 硅藻(diatoms)、甲藻(dinoflagellates)、青绿藻(prasionophytes)、蓝藻(cyanobacteria)、金藻(chrysophytes)、绿藻(chlorophytes)、隐藻(crypophytes)和定鞭藻(haptophytes)。
1.5 计算与数据分析
Pico级浮游植物传统上定义为粒径小于2.0 μm, 但近年来现场调查中常以粒径小于3.0 μm作为Pico级浮游植物[18]。Pico级浮游植物生物量一般不高, HPLC测定有一定难度。为了获得更大体积水样过滤量以测定Pico级浮游植物, 本文采用玻璃纤维滤膜(GF/D膜, 2.7 μm; GF/F膜, 0.7μm)进行Nano和Pico水样过滤[19]。因此本文将3个级别的浮游植物定义为: 粒径大于20 μm的浮游植物为micro-phytoplankton; 粒径在2.7~20 μm的浮游植物为nano-phytoplankton; 粒径小于2.7 μm浮游植物为pico-phytoplankton。对应的不同粒径级别的色素也均以micro-、nano-、pico-表示, 浮游植物总色素(以T-表示)为以上三者的总和。微表层浮游植物光合色素的富集系数(Enrichment Factor, EF)定义为微表层浮游植物光合色素浓度与同一站位次表层浮游植物光合色素浓度之比, 富集率(EF%)则为富集系数大于1.0的样品所占的百分比。
2 结果
2.1 研究海域环境特征
光照强度在正午达到最高值(表1), 清晨和傍晚几乎为0, 微表层光照强度明显高于次表层。需要提出的是, 由于采样时间较晚, 清晨St.3光照强度明显高于其他两个站点。温度变化范围在18.9~20.3℃(表1), 正午和傍晚相差不大, 清晨略低, St.3显著高于St.1和St.2。微表层的盐度略低于次表层(表1)。

表1 大鹏澳海域微表层和次表层温度、光照强度、盐度的日变化
2.2 浮游植物色素组成和分布
调查结果显示, 大亚湾海域水体中存在的浮游植物特征色素主要有17种, 包括叶绿素(Chlorophyll, Chl)、叶绿素(Chlorophyll, Chl)、叶绿素2(Chlorophyll2, Chl2)、脱镁叶绿素(Pheophorbide, Pheide)、岩藻黄素(Fucoxanthin, Fuco)、多甲藻素(Peridinin, Peri)、硅甲藻黄素(Diadinoxanthin, Diadino)、硅藻黄素(Diatoxanthin, Diato)、19’-丁酰基氧化岩藻黄素(19’-Butanoyloxyfucoxanthin, But-fuco)、19’-己酰基氧化岩藻黄素(19’-Hexanoyloxyfucoxanthin, Hex-fuco)、新黄素(Neoxanthin, Neo)、别藻黄素(Alloxanthin, Allo)、玉米黄素(Zeaxanthin, Zea)、叶黄素(Lutein, Lut)、青绿素(Prasinoxanthin, Pras)、紫黄素(Violaxanthin, Viola)、β, β-胡萝卜素(β, β-Carotene, ββ-Car)。
Chl常用于表征浮游植物的生物量。微表层的总Chl(T-Chl)平均浓度为0.797 μg/L±0.683 μg/L, 略高于次表层的0.714 μg/L±0.540 μg/L, 不存在显著性差异(<0.05)。大亚湾海域微表层和次表层Chl的浓度变化如图2所示。从图中可以看出, 微表层和次表层的T-Chl浓度变化一致, 均呈正“V”型变化趋势, 但微表层中T-Chl正午与清晨和傍晚的差异高于次表层。清晨T-Chl浓度最高(微表层和次表层分别为1.30 μg/L和0.99 μg/L), 傍晚次之(分别为0.69 μg/L和0.65 μg/L), 正午最低(分别为0.40 μg/L和0.50 μg/L)。清晨(6: 00)小型浮游植物(micro-Chl)占绝对优势, 而正午(12: 00)和傍晚(18: 00)micro-Chl所占比重显著降低。微表层的micro-Chl、nano-Chl和pico-Chl分别占T-Chl的80.7%, 10.1%和9.2%, 次表层分别为81.1%、11.8%和7.1%, 显示小型浮游植物在群落中占有主要优势, micro-Chl平均浓度的变化趋势与T-Chl浓度变化趋势一致。
Fuco通常作为硅藻的特征色素, 在微表层和次表层均有大量分布, 但不存在显著性差异, 其浓度变化范围为0.56~2.99 μg/L(图3), 平均浓度为1.28 μg/L; micro-Fuco及nano-Fuco的平均浓度在正午均最低(数据未给出); St.3站Fuco浓度明显高于St.1和St.2, 且以micro-Fuco(小型硅藻)占主导地位, 而St.1和St.2以nano-Fuco(微型硅藻)居多, pico-Fuco(微微型硅藻)三个站位所占比重均较小; Fuco在St.3微表层呈明显正“V”型变化趋势, 次表层则清晨最高, 正午和傍晚浓度接近, St.1和St.2无明显时间变化。Hex-Fuco(定鞭藻的特征色素)含量也较高, 平均浓度均在0.10 μg/L左右, 最高值出现在清晨, 微表层和次表层只在傍晚pico-级别存在显著性差异(< 0.05)。总的来讲, Hex-Fuco以nano-和pico-级别占绝对优势(图4A), 符合定鞭藻粒径特征。Peri含量较低, 平均浓度为0.05 μg/L, micro-Peri及nano-Peri的平均浓度在正午达到最低值(数据未给出), 此外, 和Chl相同, St.3浓度显著高于St.1和St.2(图4B); 傍晚含量较清晨和正午高, 次表层St.3除外。Pras是青绿藻的特征色素, 以pico-级别占主要地位, 平均浓度为0.02 μg/L, St.3浓度均显著低于St.1和St.2(图4C), 说明青绿藻在St.3较少, St.2正午达到最高值, 而其他站位在傍晚含量最高, 微表层中Pras浓度通常高于次表层, St.3除外。Zea、Allo、Neo、Viol、Chl含量均较低, 平均浓度均在0.01 μg/L左右, 在此不做描述。
2.3 浮游植物群落组成及丰度
CHEMTAX计算结果显示, 大亚湾海域浮游植物种群较为丰富, 硅藻在浮游植物群落结构中占绝对优势(图5), 绿藻和金藻较少出现。微表层中硅藻、甲藻、定鞭藻、青绿藻、蓝藻、隐藻对浮游植物生物量的贡献率分别为69.8%、6.7%、7.2%、5.2%、5.0%和3.8%, 次表层分别为69.1%、10.5%、4.8%、4.3%、3.3%和6.3%。从数值上来讲, 相对于次表层, 微表层中硅藻、定鞭藻、青绿藻、蓝藻对Chl的平均贡献较高, 而甲藻、隐藻则较低。具体来讲, 硅藻通常在清晨和傍晚微表层丰度高于次表层, 甲藻一般在清晨微表层高于次表层。隐藻、蓝藻、青绿藻在傍晚所占比重最高。除隐藻在次表层清晨与正午和傍晚均有显著性差异(<0.05)外, 其余差异不显著。
2.4 微表层对光合色素的富集作用
微表层对不同粒径的Chl在清晨均发生富集(表2), 平均富集系数高达6.63, 除pico-Chl外, 其他粒径富集率均为100%, 而傍晚只有pico-Chl存在富集, 正午无富集。对Fuco来讲, 在清晨和傍晚具有明显的富集作用, 富集系数均大于1, 且富集率均在66.7%以上, Diadino、Dt与Fuco相同(数据未给出)。微表层对Peri、Allo的富集多数发生在清晨, Zea集中在清晨和傍晚, pico-和T-Zea除外(清晨均无富集)。Hex-Fuco在微表层的浓度与次表层的相差不大。微表层对Pras均有明显的富集作用。
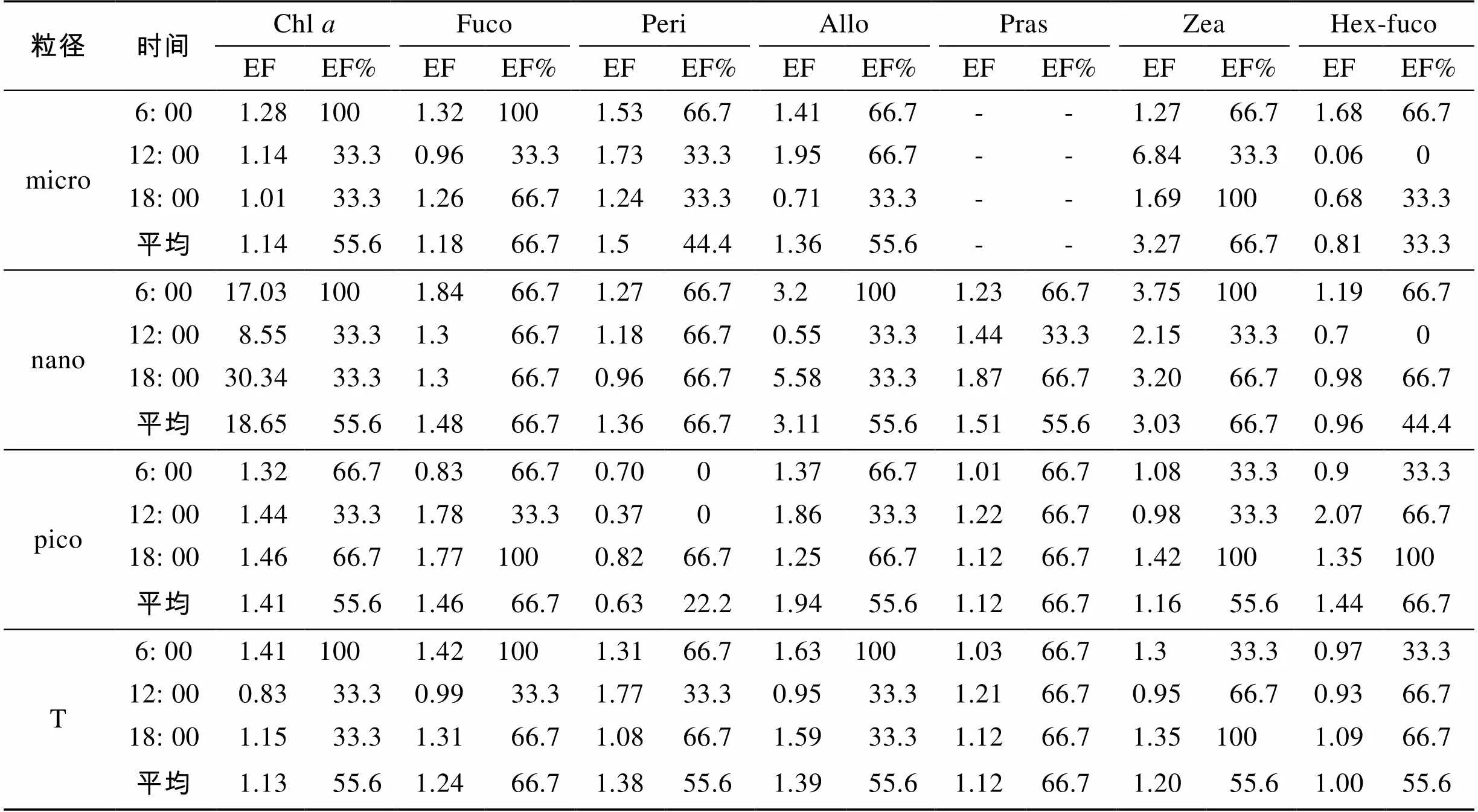
表2 大鹏澳海域微表层对浮游植物特征光合色素的富集系数与富集率
注: EF 表示富集系数; EF%表示富集率%; “-”表示“无
3 讨论
有关大鹏澳海域浮游植物群落结构的研究较多, 但主要是利用显微镜观察来分析浮游植物种类和数量[11-12, 20]。本文在此海域利用光合色素化学分类法(CHEMTAX)研究了微表层和次表层浮游植物群落结构的差异, 结果显示, 该海域存在硅藻、甲藻、定鞭藻、青绿藻、蓝藻和隐藻等六个门类的浮游植物。硅藻在浮游植物种群结构中占优势, 这与以往的研究结果一致[11-12], 但有关定鞭藻、青绿藻和蓝藻等nano和pico级别的浮游植物却报道很少。本研究结果表明, 定鞭藻、青绿藻、蓝藻和隐藻等每个门类的浮游植物对Chl的贡献率在3%~7%。Furuya等[21]、何学佳等[22]均采用光合色素CHEMTAX分析了东海和厦门港海域的浮游植物群落结构, 结果表明东海海域隐藻、定鞭藻等较小粒径的浮游植物类群对生物量有较大贡献, 厦门西海域定鞭金藻占总生物量的4.5%~37.4%。由此可见, nano和pico级浮游植物门类在我国亚热带海域对总生物量的贡献不可低估。
本研究发现, 微表层中定鞭藻、青绿藻和蓝藻等较小的浮游植物所占比重高于次表层, 说明相对于次表层, 微表层中的浮游植物群落有小型化趋势, 这可能与较小的浮游植物细胞的低沉降率(相对于较大的浮游植物细胞来讲)及鞭毛藻较强的运动能力有关[23]。王朝晖等[12]也发现微表层浮游植物群落结构与其他水层存在一定差异。微表层与次表层中的光合色素种类组成相同, 微表层在各种物理、化学和生物因素的作用下, 如风浪、海洋涡流、浮游植物的迁移能力、浮游动物的摄食、自养型浮游植物的生长等[7], 与次表层有很强的物质交换, 同时说明微表层中的浮游植物起源于次表层。但微表层和次表层的浮游植物光合色素所占的百分比不同, 因此不同光合色素的富集程度不同。
微表层对大多数浮游植物不同粒径光合色素均具有明显的富集作用。小型硅藻主要在清晨发生富集, 而微型硅藻在一天中均呈现富集, 马长江在同期的调查中, 通过传统的显微镜观察法发现微表层对优势硅藻具有明显的富集作用[24], 与本研究结果一致, 在一定程度上说明了HPLC色素分析结果的可靠性。冬季甲藻的特征色素Peri含量较低(多为micro-级和nano-级Peri), 与马长江研究结果一致, 甲藻的特征色素Peri在清晨富集现象较强[24]。先前研究表明, 微表层对蓝藻的富集率达到100%[25], 而本研究中对蓝藻特征色素Zea的平均富集率约为56.7%, 本研究中蓝藻的特征色素Zea主要为pico-级粒径, 而Wang等研究利用显微镜镜检观察到的蓝藻主要为鞘丝藻属和颤藻属[25], 粒径较大, 由于传统显微观察容易忽略粒径较小的藻类如聚球藻, 因此造成结果的不一致。此外, St.3位于湾口, 靠近核电站, 其水温均高于其他站位, 在冬季更适合浮游植物生长[26], 且12月属于牡蛎养殖期, 浮游植物是养殖区内的牡蛎的重要饲料, 因此湾外浮游植物生物量显著高于湾内, 且由于养殖区牡蛎的摄食作用显著降低了甲藻的密度[27-28], 使养殖区Peri显著低于湾口。
由于正午的高光照强度以及高紫外辐射能够对浮游植物色素体产生伤害, 导致冬季微表层中Chl含量均降低[10, 23], 此外, micro-级和nano-级粒径色素如Fuco、Peri在正午浓度也显著降低, 表明硅藻、甲藻以受到光照强度的影响较大, 而pico-级粒径色素包括Pras、和Hex-fuco却未发现此现象。研究表明, 微微型浮游植物在寡营养海域占据优势地位, 且高温低盐的条件下能够促进其生长繁殖, 耐受高温及高辐射的能力比较大的浮游植物强[29-30], 由于其特殊的生物和物理特性, 微表层的高光照强度可能并不能对其产生较大的影响。值得注意的是, 我们发现微表层和次表层水体中micro-级Allo浓度呈现相反趋势, 正午micro-级Allo从次表层迁移到微表层, 清晨和傍晚无明显趋势, 这与先前的研究结果是一致的[23, 31]。研究发现, 隐藻(Cryptomonas marssonii)在白天经常聚集在表层和次表层, 而在夜间1m以上的水层中几乎没有被发现[31], Brunet等也发现不同粒径大小的Allo在一定水深的水层中有显著的12 h周期变化[23], 因此推测这可能是由于隐藻的趋光性而造成垂直迁移的结果。
4 结论
(1) 大鹏澳海域水体中共检出17种浮游植物光合色素, 主要色素种类有叶绿素、岩藻黄素、多甲藻素、19’-己酰基氧化岩藻黄素、青绿素、别藻黄素、玉米黄素等。其中以岩藻黄素和叶绿素的含量较高。
(2) 冬季大亚湾海域微表层总Chl浓度略高于次表层, 其浓度变化以清晨总Chl浓度最高, 傍晚次之, 正午最低。小型浮游植物是该海区生物量的主要贡献者。
(3) 冬季大鹏澳海域中硅藻是主要的浮游植物类群, 甲藻、定鞭藻、青绿藻、蓝藻和隐藻所占比重相差不大。
(4) 微表层浮游植物群落中定鞭藻、青绿藻和蓝藻等较小的浮游植物种群所占比重高于次表层, 说明相对于次表层, 微表层中的浮游植物群落结构有小型化趋势。
[1] Liss P S, Duce R A. The sea surface and global change[M]. Cambridge University Press, 1997.
[2] Hardy J T. The sea surface microlayer: biology, chemistry and anthropogenic enrichment[J]. Progress in Oceanography, 1982, 11(4): 307-328.
[3] Frew N M, Bock E J, Uwe S, et al. Air-sea gas transfer : its dependence on wind stress, small-scale roughness, and surface films[J]. Journal of Geophysical Research Oceans, 2004, 109(C8): 371-375.
[4] Wurl O, Miller L, Röttgers R, et al. The distribution and fate of surface-active substances in the sea-surface microlayer and water column[J]. Marine Chemistry, 2009, 115(1): 1-9.
[5] Sieburth J M N, Willis P J, Johnson K M, et al. Dissolved organic matter and heterotrophic microneuston in the surface microlayers of the North Atlantic[J]. Science, 1976, 194(4272): 1415-1418.
[6] Aller J Y, Kuznetsova M R, Jahns C J, et al. The sea surface microlayer as a source of viral and bacterial enrichment in marine aerosols[J]. Journal of aerosol science, 2005, 36(5): 801-812.
[7] Montes-Hugo M A, Alvarez-Borrego S. Differences in photosynthetic pigment signatures between phytoneuston and phytoplankton communities in a coastal lagoon of Baja California[J]. Marine Biology, 2007, 151(4): 1225-1236.
[8] Harvey G W. Microlayer collection from the sea surface: A new method and initial results1[J]. Limnology and Oceanography, 1966, 11(4): 608-613.
[9] Kuznetsova M, Lee C, Aller J, et al. Enrichment of amino acids in the sea surface microlayer at coastal and open ocean sites in the North Atlantic Ocean[J]. Limnology and oceanography, 2004, 49(5): 1605-1619.
[10] Carlson D J. Phytoplankton in marine surface microlayers[J]. Canadian Journal of Microbiology, 1982, 28(11): 1226-1234.
[11] 宋淑华, 王朝晖, 付永虎, 谷阳光. 大亚湾大鹏澳海域微表层浮游植物群落研究[J]. 海洋环境科学, 2009, 2: 181-185. Song Shuhua, Wang Zhaohui, Fu Yonghu, et al. Research on phytoplankton community atmicro-layer in Dapengao area of Daya Bay[J]. Marine Environmental Science, 2009, 2: 181-185.
[12] Wang Z H, Song S H, Qi Y Z. A comparative study of phytoneuston and the phytoplankton community structure in Daya Bay, South China Sea[J]. Journal of Sea Research, 2014, 85: 474-482.
[13] Brewin R J W, Sathyendranath S, Lange P K, et al. Comparison of two methods to derive the size-structure of natural populations of phytoplankton[J]. Deep Sea Research Part I: Oceanographic Research Papers, 2014, 85: 72-79.
[14] Agogué Hélène, Casamayor Emilio O, Joux Fabien, et al. Comparison of samplers for the biological characterization of the sea surface microlayer[J]. Limnology & Oceanography Methods, 2004, 2(7): 213-225.
[15] Zapata M, Rodriguez F, Garrido J L. Separation of chlorophylls and carotenoids from marine phytoplankton: a new HPLC method using a reversed phase C8 column and pyridine-containing mobile phases[J]. Marine Ecology Progress Series, 2000, 195: 29-45.
[16] Mackey M D, Mackey D J, Higgins H W, et al. CHEMTAX-a program for estimating class abundances from chemical markers: application to HPLC measurements of phytoplankton[J]. Marine Ecology Progress Series., 1996, 144: 265-283.
[17] Wang L, Huang B, Liu X, et al. The modification and optimizing of the CHEMTAX running in the South China Sea[J]. Acta Oceanologica Sinica, 2015, 34(2): 124-131.
[18] Vaulot D, Eikrem W, Viprey M, et al. The diversity of small eukaryotic phytoplankton (≤3 μm) in marine ecosystems[J]. FEMS Microbiology Reviews, 2008, 32(5): 795-820.
[19] David U. Hernández-Becerril, Aldo Aquino-Cruz, David A. Salas-De-León, et al. Studies on picophytoplankton in the southern Gulf of Mexico: pigment analysis and potential importance of the picoeukaryote Prasinophyte Micromonas pusilla[J]. Marine Biology Research, 2012, 8(4): 331-340.
[20] 孙翠慈, 王友绍, 孙松, 等. 大亚湾浮游植物群落特征[J]. 生态学报, 2006, 26(12): 3948-3958. Sun Cuici, Wang Youshao, Sun Song, et al. Analysis dynamics of phytoplankton community characteristics in Daya Bay[J]. Acta Ecologica Sinica, 2006, 26(12): 3948-3958.
[21] Furuya K, Hayashi M, Yabushita Y, et al. Phytoplankton dynamics in the East China Sea in spring and summer as revealed by HPLC-derived pigment signatures[J]. Deep Sea Research Part II Topical Studies in Oceanography, 2003, 50(2): 367-387.
[22] 何学佳, 高亚辉, 彭兴跃. 应用光合色素标记物研究2001年2~6月厦门西海域浮游植物群落结构[J]. 应用海洋学学报, 2010, 29(2): 228-233. He Xuejia, Gao Yahui, Peng Xingyue. Phytoplankton community structure in western Xiamen waters from February to June 2001 from analysis of photosynthetic pigment[J]. Journal of Oceanography in Taiwan Strait, 2010, 29(2): 228-233.
[23] Brunet C, Lizon F. Tidal and diel periodicities of size-fractionated phytoplankton pigment signatures at an offshore station in the southeastern English Channel[J].Estuarine Coastal and Shelf Sciences, 2003, 56: 833-843.
[24] 马长江, 王朝晖, 杨雪, 等. 冬季大亚湾微表层浮游植物群落结构与DNA指纹的日变化[J]. 海洋科学, 2015, 39(9): 1-9. Ma Changjiang, Wang Zhaohui, Yang Xue, et al. Daily changes of the DNA fingerprints and community structure of phytoplankton in Daya Bay in winter[J]. Marine Sciences, 2015, 39(9): 1-9.
[25] Wang Z H, Song S H, Qi Y Z. A comparative study of phytoneuston and the phytoplankton community structure in Daya Bay, South China Sea[J]. Journal of Sea Research, 2014, 85: 474-482.
[26] 刘胜, 黄晖, 黄良民, 等. 大亚湾核电站对海湾浮游植物群落的生态效应[J]. 海洋环境科学, 2006, 25(2): 9-12. Liu Sheng, Huang Hui, Huang Liangmin, et al. Ecological response of phytoplankton to the operation of Daya Bay nuclear power station[J]. Marine Environment Science, 2006, 25(2): 9-12.
[27] Wetz M S, Lewitus A J, Koepfler E T, et al. Impact of the eastern oyster Crassostrea virginica on microbial community structure in a salt marsh estuary[J]. Aquatic Microbial Ecology, 2002, 28 (1): 87-97.
[28] Huang C H, Lin H J, Huang T C, et al. Responses of phytoplankton and periphyton to system- scale removal of oyster - culture rack s from a eutrophic tropical lagoon[J]. Mar. Ecol. Prog. S er. , 2008, 358: 1-12.
[29] Ning X, Cloern J E, Cole B E. Spatial and Temporal Variability of Picocyanobacteria Synechococcus sp. in San Francisco Bay[J]. Limnology & Oceanography, 2000, 45 (3): 695-702.
[30] Paerl H W, Huisman J. Blooms Like It Hot[J]. Science, 2008, 320 (5872): 57-58.
[31] Smolander U, Arvola L. Seasonal variation in the diel vertical distribution of the migratory alga Cryptomonas marssonii (Cryptophyceae) in a small, highly humic lake[J]. Hydrobiologia, 1988, 161(1): 89-98.
Daily changes of phytoplankton community structures revealed by pigment signatures in the sea surface microlayer at Daya Bay in winter
CHEN Fei-yu1, JIANG Tao1, 2, ZHANG Ling1, WANG Xiao-dong1, MA Chang-jiang3, WANG Zhao-hui3
(1. Research center for Harmful Algae and Marine Biology, Jinan University, Guangzhou 510632, China; 2.Yellow Sea Fisheries Research Institute, Chinese Fisheries Science Academy, Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture, Qingdao 266071, China; 3. Institute of Hydrobiology, Jinan University, Guangzhou 510632, China)Received:Aug.25, 2015
Sea surface microlayer; Phytoplankton; Photosynthetic pigments; Size structure; Dapeng Cove
The aim of this study was to understand the characteristics of size-fractioned pigments and differences in the phytoplankton community between the sea surface microlayer (SML) and subsurface water (SSW). Water samples from the SML and SSW were collected in the early morning, at midday, and in the late afternoon on December 3, 2013, in the Dapeng Cove of Daya Bay. The samples were then filtered into three differently sized fractions (micro, nano, and pico), and phytopigments were determined individually by high-performance liquid chromatography. Seventeen phytopigments were detected, with the most abundant being Fucoxanthin (Fuco)and chlorophyll(Chl). The average concentration of Chlat the SML was 0.797 μg/L, higher than that for SSW (0.714 μg/L), and there was no significant difference between the SML and SSW values (0.05). The highest Chlconcentration was found in the morning and then in the late afternoon, and the lowest was found at midday. The phytoplankton in the SML was dominated by micro-Chl, accounting for 80.7% of the total Chlconcentration, followed by nano-Chl, (10.1%) and pico-Chl(9.2%). Therefore, the phytoplankton community in the SML was dominated by diatoms, and the proportion of other species showed similar low values. The proportion of haptophytes, prasinophytes, and cyanobacteria in the SML was higher than that in the SSW, suggesting that the phytoplankton community structure in the SML had a trend of miniaturization.
Q178.53
A
1000-3096(2016)07-0091-09
10.11759/hykx20150825001
2015-08-25;
2015-09-28
国家自然科学基金项目(41276154); 中国水产科学研究院黄海水产研究所级基本科研业务费项目(20603022015002); 农业部南海渔业资源开发利用重点实验室开放基金(LSF2014-04); 农业部东海与远洋渔业资源开发利用重点实验室开放基金(2014K04)
[Foundation: National Natural Science Foundation of China, No.41276154; Basal Research foundation of Yellow Sea Fisheries Research Institute, No. 20603022015002; Open Foundation of Agriculture Department South China Sea Fishery Resources Development and Utilization Key Laboratory , No. LSF2014-04; Open Foundation of Agriculture Department East China Sea and Ocean Fishery Resources Development and Utilization Key Laboratory, No. 2014K04]
陈飞羽(1992-), 女, 山东菏泽人, 硕士研究生, 研究方向为藻类生态学, E-mail: chenfeiyu0927@126.com, 电话: 15521328768;江涛,通信作者, 副研究员, E-mail: jiangtaojnu@163.com
(本文编辑: 康亦兼)
