微冻保鲜方法对带鱼品质及组织结构的影响
2016-10-18杨水兵余海霞李钰金胡亚芹
胡 玥,杨水兵,余海霞,李钰金,李 珊,胡亚芹,*
(1.浙江大学食品与营养系,浙江省农产品加工技术研究重点实验室,馥莉食品研究院,浙江 杭州 310058;2.浙江大学舟山海洋研究中心,浙江 舟山 316021;3.中国海洋大学食品科学与工程学院,山东 青岛 266003;4.泰祥集团山东省海洋食品营养研究院,山东 荣成 264309)
微冻保鲜方法对带鱼品质及组织结构的影响
胡玥1,2,杨水兵2,余海霞2,李钰金3,4,李珊1,胡亚芹1,2,*
(1.浙江大学食品与营养系,浙江省农产品加工技术研究重点实验室,馥莉食品研究院,浙江 杭州 310058;2.浙江大学舟山海洋研究中心,浙江 舟山 316021;3.中国海洋大学食品科学与工程学院,山东 青岛 266003;4.泰祥集团山东省海洋食品营养研究院,山东 荣成 264309)
以舟山东海带鱼为原料,分别于冷藏(4 ℃)、微冻贮藏(-3 ℃)和冻藏(-18 ℃)3 种低温条件下,研究贮藏30 d内带鱼的pH值、电导率、挥发性盐基氮(total volatile basic nitrogen,TVB-N)值、硫代巴比妥酸(thiobarbituric acid,TBA)、盐溶性蛋白含量、Ca2+-ATPase活性等理化指标变化,结合带鱼感官评价,比较微冻保鲜方法与其他2 种不同低温保鲜方式对带鱼品质的影响,并观察其肌肉微观组织结构变化。结果表明:随着贮藏时间的延长,3 种低温保鲜方式下带鱼的pH值呈现先下降后上升的趋势;电导率、TBA值、TVB-N值都随贮藏时间的延长而逐渐升高;盐溶性蛋白含量、Ca2+-ATPase活性和感官评分都随着贮藏时间的延长呈现下降趋势,其中冻藏方式下带鱼品质保持较好,其次为微冻保鲜,冷藏条件下带鱼品质下降最快。观察其肌肉微观组织发现,短期贮藏以微冻组样品细胞完整性最好,而长期贮藏时冻藏方法维持其结构完整效果最好。
带鱼;微冻;品质;感官评价;组织结构
鱼类味道鲜美、营养丰富、高蛋白、低脂肪,深受人们青睐。然而新鲜的鱼肉类,自身含有多种营养成分,在加工、贮藏、包装、运输和销售等过程中,极易腐败变质,即使是冷冻贮藏鱼肉制品,保质期也受微生物活动的影响[1-3]。据统计,全球每年大概有30%的水产品因腐败变质而无法食用[4],因此水产品的保鲜尤为重要。
目前常用的保鲜方法主要有低温保鲜、化学保鲜、气调保鲜、电离辐射保鲜等,其中低温保鲜技术在水产品保鲜中应用最广泛。常用的低温保鲜技术有冷藏保鲜、冰温保鲜、微冻保鲜以及冻结等[5]。冷藏保鲜是使用历史最久、最广泛的保鲜方法,温度一般为0~4 ℃,保鲜时间因鱼种而异,通常为3~5 d。冰温保鲜的温度范围是-2~0 ℃,其贮藏期一般为冷藏保鲜的1.4 倍[6],但因其温度范围狭小,不易控制温度恒定,目前未得到广泛应用。微冻保鲜温度范围一般在-3~-2 ℃,通常是将温度保持在水产品初始冻结点以下的1~2 ℃[7],其货架期相比冷藏能延长1.4~5 倍[8],但此方法操作技术要求高,特别是对温度控制要求严格。冻藏保鲜利用低温将水产品的中心温度降至-15 ℃以下,然后保藏在-40~-18 ℃范围内,极大地延长了水产品货架期,一般能保藏数月甚至1 a[9]。
带鱼(Trichiurus haumela)属辐鳍鱼纲、鲈形目、带鱼科、带鱼属,以西太平洋和印度洋居多,我国沿海各省均可见并以东海产量最高,是我国四大经济鱼类之一。带鱼体内含有丰富的优质蛋白质,脂肪含量高于一般鱼类且多为不饱和脂肪酸,其鳞和银白色油脂层中含有6-硫代鸟嘌呤与丰富的微量元素,深受人们欢迎。带鱼捕获后即刻死亡,贮运期间易受微生物及内源酶的作用而腐败变质,影响其品质。目前带鱼主要以冰藏方式贮运销售,保鲜期较短;而使用普通低温冻藏方法虽能长久保持带鱼品质,但易导致其蛋白质变性,破坏肌肉组织结构,从而影响产品品质和口感;微冻保鲜所需温度区域介于冷藏和冻结之间,其货架期比冻藏产品短,但微冻条件下带鱼体内产生的冰晶较少,对细胞损伤小,在一定的贮藏期内,能较好地保持带鱼的风味和新鲜程度。
近年来,因其良好的保鲜效果,微冻保鲜技术越来越受重视,已广泛应用于各种淡水鱼、海鱼及虾等水产品的研究。Liu Dasong等[10]对草鱼肉在微冻(-3±0.2) ℃和冰藏0 ℃保鲜中理化品质变化研究发现,与冰藏保鲜相比,微冻保鲜下的草鱼品质变化较小。陈思等[11]研究冷藏及微冻条件下鲢鱼片变质变化发现,与冷藏相比,微冻能明显延长白鲢鱼片的货架期。阙婷婷等[12]对比乌鳢在微冻保鲜和冻藏保鲜过程中理化、感官指标及微观组织结构变化发现,在短的贮藏期内,微冻保鲜相对冻藏能更好保持鱼肉品质及其组织结构的完整性。但目前关于带鱼微冻保鲜研究鲜见报道。
本实验以舟山东海带鱼为实验材料,采用冷藏(4 ℃)、微冻贮藏(-3 ℃)、冻藏(-18 ℃)3 种贮藏方法,以鱼肉pH值、电导率、挥发性盐基氮(total volatile basic nitrogen,TVB-N)值、硫代巴比妥酸(thiobarbituric acid,TBA)值、盐溶性蛋白含量、Ca2+-ATPase活性等理化指标,结合带鱼在贮藏过程中感官评价,比较微冻保鲜与其他2 种不同低温保鲜方式对带鱼品质的影响,并观察其肌肉组织的微观结构变化,为水产品保鲜技术研究提供理论依据。
1 材料与方法
1.1材料与试剂
新鲜舟山东海带鱼,购于浙江省舟山市沈家门水产码头,选取长度约70 cm,厚度约1.5 cm,腹部饱满,腮色鲜红、眼球饱满、鳞片完整、体表光滑无黏液的新鲜带鱼,放入装有碎冰的泡沫盒中运回实验室。
柠檬酸、柠檬酸钠、KOH、KCl、NaOH、KH2PO4、K2HPO4、HClO3、液氮、CuSO4(均为分析纯) 国药集团化学试剂有限公司。
1.2仪器与设备
L93-2L温度记录仪 杭州路格科技有限公司;BC/BD-629HAN冰柜 青岛海尔有限公司;UV-1800PC紫外-可见分光光度计 海美普达有限公司;TGL-16G高速台式离心机 上海安亨科学仪器厂;EF20KpH计梅特勒托利多(上海)仪器有限公司;XBLL-23A绞肉机上海帅佳电子科技有限公司;AR124CN分析天平 美国Ohaus公司;H-PTH-225BK可程式高低温湿试验箱深圳市宏瑞新达科技有限公司;YD202A石蜡切片机、D-A智能型生物组织摊片机机、YD-B智能型生物组织烤片机 浙江省金华益迪医疗设备厂;DKS-12电热恒温水浴锅 嘉兴市中新医疗仪器有限公司;MODEL UB200i显微镜 重庆澳普光电技术有限公司。
1.3方法
1.3.1实验处理
将新鲜带鱼去头、尾、内脏,低温流水清洗干净,进行真空包装后分别置于-18 ℃(D组)、-3 ℃(W组)、4 ℃(L组)条件下不同低温保鲜贮藏。
1.3.2冻结曲线测定[13]
将带鱼去掉内脏后,放入冰柜(-18 ℃)中速冻,将设定好程序的自动温度记录仪的温度探头插入鱼背肌肉中,记录温度随时间变化的曲线即带鱼冻结曲线图,根据该图判断其冻结点,并得出微冻温度,测定3 次。
1.3.3指标测定
1.3.3.1pH值测定
称取10 g绞碎的带鱼鱼肉,加入100 mL去离子水,混匀静置30 min后过滤,取滤液测定pH值,每个样品重复测定3 次,取平均值[14]。
1.3.3.2电导率测定
称取5 g绞碎的带鱼鱼肉,加入45 mL去离子水,混匀静置30 min后过滤,取滤液测定电导率,每个样品重复测定3 次,取平均值。
1.3.3.3TVB-N值测定
参照GB/T 5009.44—2003《肉与肉制品卫生标准的分析方法》中半微量定氮法测定。
1.3.3.4TBA值测定
参考胡庆兰[15]的方法,略有改动。取10 g绞碎的带鱼肉,加入50 mL 7.5%的三氯乙酸(含有0.1%乙二胺四乙酸溶液)溶液,振摇30 min后双层滤纸过滤2 次。过滤后取5 mL上清液,加入5 mL 0.02 mol/L TBA溶液,沸水浴中保存40 min并取出冷却1 h。取上清液,加入5 mL氯仿摇匀,静置分层后取上清液。分别在532 nm和600 nm波长处测定吸光度(A532nm、A600nm),TBA值计算见公式(1):

式中:m为带鱼质量。
1.3.3.5Ca2+-ATPase活性测定[15]
取2 g绞碎的鱼肉加入20 mL预冷的高离子强度盐溶液(0.1 mol/L KCl-0.01 mol/L Na2CO3-0.04 mol/L NaHCO3),再加入20 mL冰水稀释,振荡均匀后4 000 r/min离心10 min。离心后倒去上层清液,取沉淀物,重复上面步骤3 次,得到肌原纤维沉淀物,定容至100 mL,所得的肌原纤维悬浊液用来测Ca2+-ATPase活性和蛋白质含量。
Ca2+-ATPase活性测定参考董开成等[16]的方法。在试管中加入2.5 mL 20 mmol/L Tris-HCl(pH 7.0)、1.0 mL 0.05 mol/L CaC12、1.0 mL 4 mol/L KCl、1.5 mL 6.67 mmol/L ATP-Na2和4 mL制备好的肌原纤维蛋白酶液,置于28 ℃的水浴锅中反应30 min,加入肌原纤维蛋白酶液时开始计时,最后加入1.0 mL 15%的三氯乙酸终止反应。空白对照组自反应开始时加1.0mL 15%的三氯乙酸溶液。反应终止后用滤纸过滤,滤液定容至100 mL。用钼酸铵法在640 nm波长处测定吸光度。Ca2+-ATPase活性计算见公式(2):

式中:A为1 mL反应液生成的磷酸量/μmol;B为空白值/μmol;t为反应时间/min;酶蛋白量为1 mL反应液所含的酶量/mg;m为酶蛋白质量/g。
1.3.3.6盐溶性蛋白含量测定
称取2 g带鱼肉2 份,分别加入20 mL高离子磷酸缓冲溶液(0.5 mol/L KCl-0.01 mol/L NaH2PO4-0.03 mol/L Na2HPO4)和20 mL低离子磷酸缓冲液(0.025 mol/L NaH2PO4-0.025 mol/L Na2HPO4),搅拌均匀后,前者静置3 h,后者静置1h。静置后分别在4 000 r/min离心10 min,取上清液,加入10 mL 15%三氯乙酸使蛋白质沉淀,再加入20 mL 1 mol/L NaOH溶解蛋白质,最后分别以高离子磷酸缓冲液和低磷酸缓冲液定容到50 mL。用双缩脲法测定蛋白质含量。测得盐溶性蛋白含量为高盐溶液中蛋白质含量减去低盐溶液中蛋白质含量。
1.3.4感官评定

表1 带鱼感官评定标准Table1 Criteria for sensory evaluation of Trichiurus haumela
感官评定方法参考蓝蔚青等[17]的评定方法。请10 位经过专业培训的感官评定员,根据制作的感官评定表(表1)对处理好的样品感官性状进行评价。生鱼片制作需进行解冻清洗切片,考察色泽、气味、组织形态和肌肉弹性,根据评分小组对其敏感程度,设定每项权重分别为0.2、0.3、0.2、0.3;熟鱼片需将带鱼片真空包装后高温蒸煮15 min,考察气味、滋味和质地,同上设定每项权重分别为0.4、0.3、0.3,计算加权平均分。其中满分为10 分,非常好为9~10 分,好为6~8 分,较差为3~5 分,非常差为0~2 分,6 分以上为新鲜度良好。
1.3.5带鱼肌肉组织石蜡切片
参照鲁珺等[18]的方法,在带鱼背部肌肉(离头部约3 cm处)取样,大小为3 mm×3 mm×6 mm,从垂直于肌原纤维伸展方向的横切,于明视野光学显微镜下观察其肌肉微观组织结构。
2 结果与分析
2.1带鱼冻结曲线

图1 带鱼冻结曲线Fig.1 Freezing curve of Trichiurus haumela
图1为带鱼在-18 ℃冻结过程中温度变化曲线,温度记录仪每隔1 min记录一次温度。从图1可以发现,刚清洗完的带鱼温度为10 ℃左右,刚进入低温装置,鱼体温度下降较快,当温度达到0 ℃以下时下降速度变慢,随后在冻藏30 min时带鱼的冻结曲线中出现了一个拐点,这个拐点温度为-1.9 ℃,判定此温度为带鱼的冻结点。根据微冻的定义规定贮藏温度为冻结点以下-2~-1 ℃,为方便控制选择微冻温度-3.0 ℃。
2.2pH值的变化分析
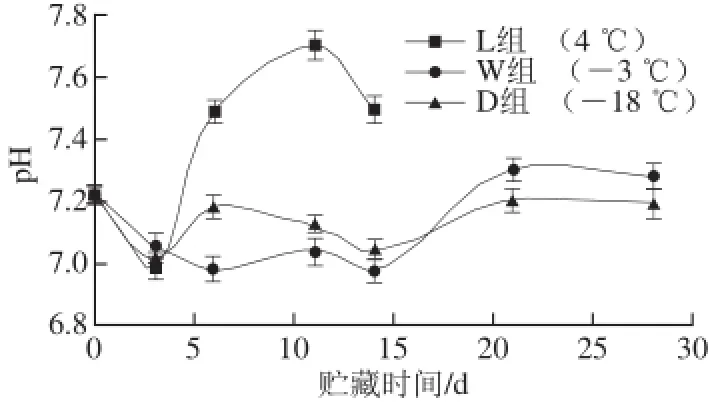
图2 带鱼在不同低温贮藏过程pH值的变化Fig.2 Changes in pH value of Trichiurus haumela during storage at different temperatures
水产品肌肉pH值的变化与其鲜度密切相关,因此水产品贮藏期间肌肉的pH值也可以作为评价其新鲜度的一项指标。如图2所示,随着贮藏时间的延长,3 种贮藏条件下的带鱼pH值均呈现先下降后上升的趋势。这是因为在贮藏初期,肌肉中的糖原和ATP等物质分解产生酸性物质,使得pH值下降,而后随着贮藏时间的延长,鱼肉中蛋白质在微生物的作用下分解产生碱性物质,其pH值逐渐回升[19]。
其中,冷藏的L组pH值下降最快,在第3天就下降至6.99。而微冻的W组pH值直到第6天才下降至最低为6.98,其pH值在贮藏前期14 d内呈现缓慢下降的趋势,直到14 d之后pH值开始上升。这是由于贮藏初期,微冻条件下鱼体肌肉中糖原酵解与ATP分解都受到抑制,减慢了pH值的下降速率,同时鱼体内外微生物以及鱼体内源酶的活动也受到抑制,影响了贮藏期内pH值的上升速率;而冻藏条件下,鱼体内水分冻结,生成的冰晶对细胞造成了一定的机械损伤,鱼肉受微生物作用而使pH值回升。L组pH值先下降、后迅速上升,在第6天便已达到7.49,超过新鲜带鱼的pH值7.22。冻藏的D组pH值大致呈现先下降后上升趋势,在贮藏前期pH值迅速下降,后期缓慢上升,并有一定波动,但其pH值在整个贮藏期间变化较小,贮藏28 d时pH值才升至7.19,可见贮藏温度高低对pH值变化有很大的影响。从图2可知,在贮藏前期,相比其他2 种保鲜方式,微冻保鲜效果更好,pH值变化最慢;但在长期贮藏中,冻藏条件下pH值变化最慢。
2.3电导率的变化分析

图3 带鱼在不同低温贮藏过程中电导率的变化Fig.3 Changes in conductivity of Trichiurus haumela during storage at different temperatures
如图3所示,随着贮藏时间的延长,3 种贮藏条件下的带鱼电导率均呈现上升的趋势。这是因为在贮藏过程中,鱼肉蛋白质和脂肪等被微生物分解成大量小分子物质,产生大量离子,从而使鱼肉浸出液导电能力增强,贮藏时间越长鱼肉被分解程度越高,分解产物越多导电能力越强,鱼肉的新鲜度越差。
其中,冷藏的L组电导率上升最快,在第6天就达到了1 688 μS/cm,微冻的W组到第28天的时候上升至1 624 μS/cm,而冻藏的D组第28天时电导率值仅上升至1 566 μS/cm。而且在贮藏前期14 d内,W组和D组鱼肉电导率均呈现缓慢上升趋势。这表明鱼肉的电导率与贮藏温度密切相关,贮藏温度越高,其电导率越大。
2.4TVB-N值的变化分析

图4 带鱼在不同低温贮藏过程中TVB-N值的变化Fig.4 Changes in TVB-N of Trichiurus haumela during storage at different temperatures
TVB-N常作为评价水产品品质好坏的一个重要指标,来评定鱼类的初期腐败程度。我国SC/T 3102—2010《鲜、冷带鱼水产》标准规定:一级品:TVB-N≤13 mg/100 g,合格品:TVB-N≤30 mg/100 g。如图4所示,随着贮藏时间的延长,3 种贮藏方式下的带鱼TVB-N值均呈现上升的趋势。这是因为带鱼在贮藏期内,由于内源酶和微生物的共同作用,蛋白质和非蛋白质物质分解产生挥发性的氨及胺类等碱性含氮物质[20],一般认为TVB-N值越低则样品新鲜度越高。由图4可知,冷藏L组的TVB-N值上升速率明显高于微冻W组和冻藏D组,在第3天时其 TVB-N值已经达到15.85 mg/100 g,可划分为合格品;而其在11 d的TVB-N值为29.56 mg/100 g,已接近合格品界限值。W组在前11 d时TVB-N值增长较快,在第3天时TVB-N值已达13.57 mg/100 g,超过一级品界限值,在贮藏后期其增长速度放缓,直到第28天时TVB-N值为28.59 mg/100 g,还属于合格品。D组在整个贮藏期内TVB-N值增长速度相对较慢,在贮藏第28天时,TVB-N值为20.26 mg/100 g,远低于W组和D组,且D组TVB-N值在整个贮藏期内一直低于21 mg/100 g。这表明,贮藏过程中鱼体温度影响了TVB-N值增加,低温条件下能够抑制微生物生长和内源酶作用,减缓鱼肉内含氮化合物的分解,温度越低,其抑制效果越好,在3 种保鲜方式中,冻藏条件下鱼肉TVB-N值最低,其次是微冻,冷藏效果最差。
2.5TBA值的变化分析
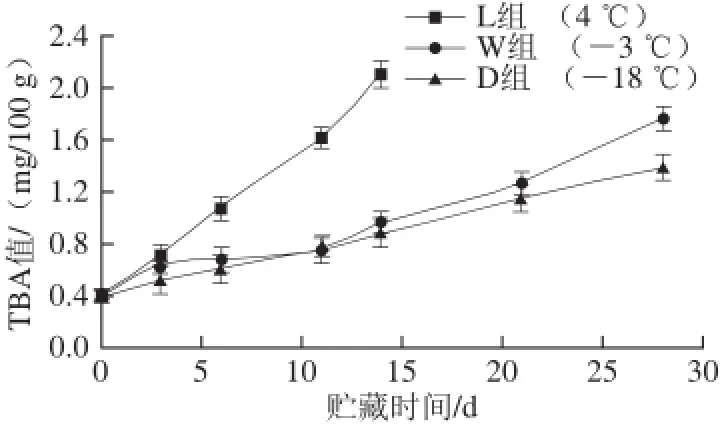
图5 带鱼在不同低温贮藏过程中TBA值的变化Fig.5 Changes in TBA of Trichiurus haumela during storage at different temperatures
如图5所示,随着贮藏时间的延长,3 种贮藏方式下的带鱼TBA值均呈现上升的趋势。这是由于带鱼是一种高蛋白高脂肪的鱼类,且其脂肪酸大多为不饱和脂肪酸,极易与空气中的氧气发生氧化反应产生氧化降解产物丙二醛[21]。贮藏14 d时,冷藏L组、微冻W组和冻藏D组的TBA值从最初新鲜带鱼的0.41 mg/100 g分别增加至2.11、0.96、0.89 mg/100 g,到最后贮藏28 d时W组和D组增加至1.76 mg/100 g和1.38 mg/100 g。从图5可以发现,贮藏过程中L组TBA值升高速率最快,远大于W组和D组,而在前10 d,W组的TBA值升高速率与D组相差不大,但后期增长较L组快,可能是因为贮藏前期微冻温度条件下微生物和酶的作用受到抑制作用显著,但在贮藏后期,由于冰晶对细胞破坏作用,导致鱼肉脂肪更易发生氧化。贮藏温度影响带鱼TBA值变化,温度越低,其TBA值增长越慢,3 种保鲜方式中,冻藏效果最佳。
2.6Ca2+-ATPase活性变化分析
鱼肉的主要成分是肌原纤维蛋白,它主要由肌球蛋白和肌动蛋白组成,两者在ATP的存在下生成肌动球蛋白。肌球蛋白能分解ATP酶活性,当鱼肉蛋白质在冷藏、加热过程中产生变性时,会导致ATP酶活性的降低或消失。Ca2+-ATPase活性表征肌球蛋白头部性质[21],是带鱼在冷冻贮藏过程中蛋白质性质的一个重要指标,其活性值越高,说明鱼肉蛋白质性质越稳定,冷冻变性程度越小,品质也越好[22]。
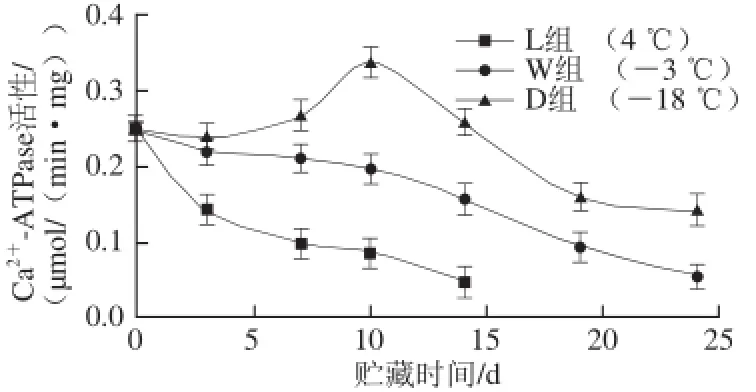
图6 带鱼在不同低温贮藏过程中Ca2+-ATPase活性的变化Fig.6 Changes in Ca2+-ATPase activity of Trichiurus haumela during storage at different temperatures
如图6所示,随着贮藏时间的延长,3 种贮藏方式下的带鱼Ca2+-ATPase活性均呈现下降的趋势。其中,冷藏的L组酶活性下降最快,在10 d就已下降至0.982 μmol/(min·mg),而冻藏的D组酶活性下降最慢,贮藏24 d后,Ca2+-ATPase活性才达0.139 μmol/(min·mg),远低于此时W组酶活性。微冻的W组酶活性在贮藏前10 d内缓慢下降,之后急剧下降,说明在微冻贮藏初期,鱼体肌肉中ATP分解受到抑制,减慢了Ca2+-ATPase活性下降速率。由图6可知,D组的Ca2+-ATPase活性下降速率较L组和W组缓慢,可能是因为冻藏过程中肌原纤维蛋白的空间结构破坏较小,肌原纤维蛋白更稳定,从而其Ca2+-ATPase活性较高[18],冷藏过程中则是由于鱼肉蛋白受微生物作用明显,肌原纤维蛋白分解导致其Ca2+-ATPase活性迅速下降,也有研究[23]表明,离子浓度对肌球蛋白Ca2+-ATPase活性下降速率有影响,浓度越大,其活性下降越快。实验表明,贮藏时鱼体温度越低,酶活性下降越慢,这与董开成等[16]对小黄鱼的研究结果一致。同时从图6可以发现,D组酶活性在贮藏前10 d内呈现稍微上升的趋势,然后缓慢下降,这可能是在冻藏过程中酶发生了部分解聚作用,使得肌动蛋白和肌球蛋白结合比较强,导致前期其活性的增高。
2.7盐溶性蛋白含量变化分析
鱼贝类等水产品的肌肉蛋白质可根据蛋白质对溶剂的不同溶解性分为水溶性蛋白、盐溶性蛋白和不溶性蛋白3 种。存在于肌肉细胞中,构成有担负特殊收缩功能的肌原纤维蛋白,可用高浓度的盐溶液提取出来,所以也称为盐溶性蛋白质,占整个肌肉蛋白质的60%~75%。盐溶性蛋白含量主要体现的是肌动球蛋白杆部性质的变化,而肌动球蛋白是构成肌原纤维的主要成分,因此在一定程度上可以反映肌原纤维蛋白质的变性程度[24]。

图7 带鱼在不同低温贮藏过程中盐溶性蛋白含量的变化Fig.7 Changes in salt soluble protein content of Trichiurus haumela during storage at different temperatures
如图7所示,随着贮藏时间的延长,3 种贮藏方式下的带鱼盐溶性蛋白含量均呈现下降的趋势。其中,冷藏的L组盐溶性蛋白含量下降最快,贮藏第8天时的盐溶性蛋白含量为26.12 mg/g,较0 d下降了50%,微冻的W组到第20天时盐溶性蛋白含量才下降至27.35 mg/g,而冻藏的D组盐溶性蛋白含量一直缓慢下降,并明显高于L组和W组,且在整个贮藏期间的盐溶性蛋白含量均高于30 mg/g,到24 d时盐溶性蛋白含量为32.52 mg/g,较0 d才下降了38%。这表明带鱼鱼肉的盐溶性蛋白含量下降速率与贮藏温度密切相关。在低温贮藏过程中,由于鱼肉肌原纤维蛋白发生变性,其盐溶性蛋白含量会发生变化。微冻组由冷冻引起的蛋白变性程度较冻藏组低,但其盐溶性蛋白含量下降速率却较冻藏组快,冷藏组下降最快,可能是由于这2 组温度相对偏高,微生物对鱼肉蛋白分解程度较高,这也与TVB-N值变化相吻合。且Jiang等[25]发现ATP降解产物ADP、AMP、IMP对鱼肉蛋白质有保护作用,使其盐溶性蛋白含量下降变慢,而HxR和Hx会促进盐溶性蛋白含量的下降。
2.8感官评定分析
感官评定是判断食品质量的重要手段之一,它是根据评定人员的五官感觉来对食品的色泽、香气和风味以及质构等特性进行打分,然后根据打分结果来得出食品质量的优劣[16]。

图8 带鱼在不同低温贮藏过程中生鱼片(A)和熟鱼片(B)感官评分的变化Fig.8 Changes in sensory evaluation scores of raw (A) and cooked (B)Trichiurus haumela fillet during storage at different temperatures
不同保鲜方式下,带鱼生鱼片和熟鱼片感官评分见图8。随着贮藏时间的延长,3 种贮藏方式下的带鱼片感官均呈下降趋势。其中,在贮藏前10 d,微冻的W组感官评分明显高于同时期冷藏的L组评分,且略高于冻藏的D组,这表明微冻保鲜方法在短时间内贮藏时能较好地保持鱼肉品质;而在11 d后,W组感官迅速下降,在第28天时感官评分远低于D组,这可能是由于微冻贮藏后期,冰晶对带鱼细胞破坏较大,使带鱼品质很快下降。L组感官在前6 d便迅速下降至较差的程度,而D组贮藏28 d时其感官还处于较好状态。图8所示带鱼生鱼片和熟鱼片感官评分有较好的一致性,均表明短期贮藏时微冻保鲜方式较优,但在长期贮藏时,温度较低的冻藏保鲜方式更能保持带鱼品质良好。
2.9肌肉微观组织结构分析
微生物的作用、酶的作用、氧化作用以及机械损伤是食品变质的主要因素,在低温条件对其肌肉组织损伤最大的是酶的作用和机械损伤。冻结以及贮藏过程中形成的冰晶是对肌肉组织造成损伤的主要因素。冰晶形成主要有两个过程,首先是形成晶核,然后晶核再逐渐形成冰晶[26]。刚冻结完的产品其冰晶是不稳定的,并且全部的冰晶大小并不是均匀一致的,在冻藏的过程中,小的冰晶会逐渐减少,而大的冰晶会逐渐产生[27],冰晶的数目减少而冰晶的体积变大,冰晶的变大会对产品带来很大的影响,会使有些肌纤维挤压在一起,产生局部断裂,会使肌肉细胞受到局部损伤,蛋白质变性[28],造成营养和风味以及持水性下降。

图9 带鱼在不同低温贮藏过程中肌肉微观组织结构的变化Fig.9 Changes in microstructure of Trichiurus haumela during storage at different temperatures
不同低温贮藏过程中,带鱼肌肉横切面的微观组织结构如图9所示。新鲜样细胞大小均匀,结构完整,细胞之间的缝隙比较均匀。贮藏7 d后,微冻的W组样品细胞间隙略有增大,但较冻藏的D组小,而冷藏的L组细胞间隙明显增大,且细胞间出现了较大程度的挤压变形,表明其肌肉组织结构破坏较为严重,这可能是在微生物和酶的作用下肌原纤维蛋白降解变性,导致肌原纤维间的缝隙增大,破坏其组织结构的完整性。此时W组细胞较其他两组完整,可能是由于微冻温度下,带鱼细胞内水分部分冻结,产生的细小冰晶对细胞组织结构破坏小,而冻藏条件下,鱼体内水分结冰、体积膨胀,细胞内生成大小不一的冰晶,对其产生了一定的机械损伤。贮藏28 d后发现,W组肌肉组织结构损伤严重,细胞遭到破坏,细胞间隙形成巨大的空洞,而此时D组细胞完整性较好,仅有部分位置细胞间隙较大,这可能是由于随着贮藏期的延长,微冻保藏下的带鱼细胞内细小的冰晶逐渐长成大冰晶,引起细胞内部结构的变位和破坏,使肌肉纤维扭曲变形甚至断裂,D组则因为冻结速率快,在后期贮藏过程中细胞内冰晶大小变化缓慢,组织结构完整性较好。这也与带鱼的理化性质变化及感官评价结论较为一致,表明在短时间的保藏期内,微冻保鲜方法能较好地保持带鱼的品质和微观组织结构完整,但长期贮藏下,冻藏方法更好。
3 结 论
通过分别测定贮藏在冷藏(4 ℃)、微冻贮藏(-3 ℃)和冻藏(-18 ℃)3 种低温条件下的带鱼的各项理化指标并结合感官评分,发现不同保鲜方式下的带鱼在贮藏期间品质变化存在较大差异,在贮藏30 d时,冻藏条件下的带鱼品质保持较好,其次是微冻保藏下的带鱼,冷藏带鱼品质下降最快。但在贮藏前期10 d左右时,微冻贮藏的带鱼理化指标及感官评分与冻藏带鱼差别不大,其感官评分甚至优于冻藏带鱼,可能是由于微冻条件下带鱼体内仅有极少部分冰晶产生,细胞损伤小、汁液流失较少,对鱼肉质构影响不大,能较好保持带鱼的风味。而在贮藏后期微冻带鱼品质下降较快可能是由于肌肉理化性质发生不可逆变化,导致其综合品质迅速下降。带鱼肌肉微观组织结构观察显示,在短时期保藏时微冻方法能较好地保持其结构完整性,而冻藏则是能够在长期保藏条件中保持其结构完整。综上,微冻保鲜技术对带鱼短期贮藏有较好的效果,能较好保持其理化性质及感官品质,且其温度较冻藏高,能节省能量;但长期贮藏运输过程中,其保藏效果较冻藏差。
随着人们生活水平的不断提高,消费者对食品的新鲜程度要求愈来愈高,传统的冻藏方式已无法完全满足消费者的需求,因此深入研究水产品保鲜技术具有十分重要的意义。传统工业冻藏方式与实验室冻藏方式略有差异,常对产品先进行镀冰衣,再通过-35 ℃或以下的低温速冻,并最终贮藏在-18 ℃,这种处理方式下,鱼类等水产品货架期更长,但此方法并不能有效改善冻藏产品在贮藏前期的品质变化,而微冻保鲜技术下的产品处于部分冻结状态,可减少产品的冷冻和解冻程序,防止产品因解冻造成的汁液流失,并且能降低能源和劳动力成本,大大减少加工中运输成本与环境因素的影响。但目前微冻保鲜技术对设备要求较高,微冻贮藏期间温度的微小波动就会造成水产品的组织结构破坏而导致品质下降,特别是在长期贮藏过程中的影响较大,因此需要进一步优化微冻保鲜工艺,在保持水产品新鲜程度的同时提高其货架期。
[1] FERNÁNDEZ K, ASPE E, ROECKEL M. Scaling up parameters for shelf-life extension of Atlantic Salmon (Salmo salar) fillets using superchilling and modified atmosphere packaging[J]. Food Control,2010, 21(6): 857-862. DOI:10.1016/j.foodcont.2009.11.016.
[2] FERNÁNDEZ K, ASPE E, ROECKEL M. Shelf-life extension on fillets of Atlantic Salmon (Salmo salar) using natural additives,superchilling and modified atmosphere packaging[J]. Food Control,2009, 20(11): 1036-1042. DOI:10.1016/j.foodcont.2008.12.010.
[3] DUUN A S, RUSTAD T. Quality of superchilled vacuum packed Atlantic salmon (Salmo salar) fillets stored at -1.4 and -3.6 degrees[J]. Food Chemistry, 2008, 106(1): 122-131. DOI:10.1016/ j.foodchem.2007.05.051.
[4] GHALY A E, DAVE D, BUDGE S, et al. Fish spoilage mechanisms and preservation techniques: review[J]. American Journal of Applied Sciences, 2010, 7(7): 859-877. DOI:10.3844/ajassp.2010.859.877.
[5] GALLART-JORNET L, RUSTAD T, BARAT J M, et al. Effect of superchilled storage on the freshness and salting behaviour of Atlantic salmon (Salmo salar) fillets[J]. Food Chemistry, 2007, 103(4): 1268-1281. DOI:10.1016/j.foodchem.2006.10.040.
[6] 刘志鸣, 万金庆, 王建民. 日本冰温技术发展史略[J]. 制冷与空调,2005, 20(3): 70-74. DOI:10.3969/j.issn.1671-6612.2005.03.020.
[7] DUUN A S, RUSTAD T. Quality changes during superchilled storage of cod (Gadus morhua) fillets[J]. Food Chemistry, 2007, 105(3): 1067-1075. DOI:10.1016/j.foodchem.2007.05.020.
[8] MAGNUSSEN O M, HAUGLAND A, TORSTVEIT HEMMINGSEN A K, et al. Advances in superchilling of food: process characteristics and product quality[J]. Trends in Food Science and Technology, 2008,19(8): 418-424. DOI:10.1016/j.tifs.2008.04.005.
[9] 阙婷婷, 刘文娟, 陈士国, 等. 水产品低温保鲜技术研究现状[J]. 中国食品学报, 2013, 13(8): 181-189.
[10] LIU D, LIANG L, XIA W S, et al. Biochemical and physical changes of grass carp (Ctenopharyngodon idella) fillets stored at -3 and 0 degrees C[J]. Food Chemistry, 2013, 140(1/2): 105-114. DOI:10.1016/ j.foodchem.2013.02.034.
[11] 陈思, 李婷婷, 李欢, 等. 白鲢鱼片在冷藏和微冻条件下的鲜度和品质变化[J]. 食品科学, 2015, 36(24): 297-301. DOI:10.7506/spkx1002-6630-201524055.
[12] 阙婷婷, 郑家闻, 陈士国, 等. 微冻保鲜与冻藏保鲜对乌鳢品质的影响[J]. 中国食品学报, 2015, 15(6): 136-147. DOI:10.16429/j.1009-7848.2015.06.019.
[13] 俞静芬, 赵培城, 丁玉庭. 鳙鱼近微冻保鲜过程中的品质变化特性[J]. 食品工业科技, 2007, 28(7): 186-188. DOI:10.13386/ j.issn1002-0306.2007.07.054.
[14] GOU Jingyu, LEE H Y, AHN J. Effect of high pressure processing on the quality of squid (Todarodes pacificus) during refrigerated storage[J]. Food Chemistry, 2009, 119(2): 471-476. DOI:10.1016/ j.foodchem.2009.06.042.
[15] 胡庆兰. 带鱼制品的玻璃化转变及其品质变化研究[D]. 杭州: 浙江大学, 2014: 16-17.
[16] 董开成, 杨水兵, 余海霞, 等. 不同预冻条件对小黄鱼品质的影响[J]. 现代食品科技, 2015, 31(2): 225-231 DOI:10.13982/ j.mfst.1673-9078.2015.2.037.
[17] 蓝蔚青, 谢晶. 酸性电解水与溶菌酶对冷藏带鱼品质变化的影响[J]. 福建农林大学学报(自然科学版), 2013, 42(1): 100-105. DOI:10.13323/j.cnki.j.fafu(nat.sci.).2013.01.021.
[18] 鲁珺, 余海霞, 杨水兵, 等. 液氮速冻对银鲳鱼品质及微观结构的影响[J]. 现代食品科技, 2015, 31(4): 210-216. DOI:10.13982/ j.mfst.1673-9078.2015.4.034.
[19] JIANG S T, LEE T C. Changes in free amino acids and protein denaturation of fish muscle during frozen storage[J]. Journal of Agricultural and Food Chemistry, 1985, 33(5): 839-844. DOI:10.1021/ jf00065a018.
[20] CLAUDIA R L, ANTONIO M. Sensory and biochemical aspects of quality of whole big eye tuna (Thunnus obesus) during bulk storage in controlled atmospheres[J]. Food Chemistry, 2004, 89(3): 347-354. DOI:10.1016/j.foodchem.2004.02.041.
[21] 施海峰, 高键, 应杰, 等. 水溶性壳聚糖对鱼糜制品保鲜效果的影响[J]. 南方水产科学, 2011, 7(4): 49-54. DOI:10.3969/ j.issn.2095-0780.2011.04.008.
[22] 郑薇薇. 海藻糖对防止淡水鱼糜蛋白冷冻变性的研究[D]. 吉林: 吉林农业大学, 2011: 23-24.
[23] OKADA T, OHTA F, INOUE N, et a1. Denaturation of carp myosin B in KCl solution during frozen storage[J]. Bulletin of the Japanese Society of Scientific Fisheries, 1985, 51(11): 1887-1892. DOI:10.2331/ suisan.51.1887.
[24] 刘美华. 大黄鱼微冻保鲜的研究[D]. 福州: 福建农林大学, 2004: 26-27. DOI:10.7666/d.y629232.
[25] JIANG S T, HWANG B S, TSAO C Y. Effect of adenosine nucleotides and their derivatives on the denaturation of myofibrillar proteins in vitro during frozen storage at -20 ℃[J]. Journal of Food Science, 1987, 52(1): 117-123.
[26] CAI Luyun, WU Xiaosa, LI Xiuxia, et al. Effect of different freezing treatments on physicochemical responses and microbial characteristics of Japanese sea bass (Lateolabrax japonicas) fillets during refrigerated storage[J]. LWT-Food Science and Technology, 2014, 59(1): 122-129. DOI:10.1016/j.lwt.2014.04.062.
[27] BADII F, HOWELL N K. Changes in the texture and structure of cod and haddock fillets during frozen storage[J]. Food Hydrocolloids,2002, 16(4): 313-319. DOI:10.1016/S0268-005X(01)00104-7.
[28] 金剑雄, 贺志军, 王文辉. 鱼在冻藏中的冰结晶与肌纤维变化的研究[J]. 浙江海洋学院学报(自然科学版), 2000, 19(2): 118-121. DOI:10.3969/j.issn.1008-830X.2000.02.004.
Effect of Superchilling on the Quality and Muscle Tissue Structure of Trichiurus haumela
HU Yue1,2, YANG Shuibing2, YU Haixia2, LI Yujin3,4, LI Shan1, HU Yaqin1,2,*
(1. Zhejiang Key Laboratory for Agro-food Processing, Fuli Institute of Food Science, Department of Food Science and Nutrition,Zhejiang University, Hangzhou 310058, China; 2. Ocean Research Center of Zhoushan, Zhejiang University, Zhoushan 316021,China; 3. College of Food Science and Engineering, Ocean University of China, Qingdao 266003, China;4. Ocean Food Nutrition Research Institute of Shandong Taixiang Group, Rongcheng 264309, China)
The effects of superchilling and two other low-temperature treatments on the quality of Trichiurus haumela during a storage period of 30 days were comparatively investigated. T. haumela was stored at 4, -3 and -18 ℃, respectively. During storage, physicochemical properties such as pH value, conductivity, thiobarbituric acid (TBA), total volatile basic nitrogen (TVB-N), salt soluble protein content and Ca2+-ATPase activity were determined as well as sensory attributes. Then,we observed the microstructure changes of Trichiurus haumela muscle tissue. The results showed that with the extension of storage time, the pH value decreased first and then increased; conductivity, TBA and TVB-N progressively increased, while salt soluble protein content, Ca2+-ATPase activity and sensory attribute decreased gradually. The results indicated that of the three low-temperature preservation methods, -18 ℃ was the best for maintaining the quality of T. haumela, followed by -3 ℃. The quality of T. haumela decreased most quickly at 4 ℃. Microstructure observations showed that cell integrity was best maintained upon short-term storage at -3 ℃ while -18 ℃ was more beneficial in the case of long-term storage.
Trichiurus haumela; superchilling; quality; sensory attribute; muscle tissue structure
10.7506/spkx1002-6630-201618046
TS254.4
A
1002-6630(2016)18-0290-08
胡玥, 杨水兵, 余海霞, 等. 微冻保鲜方法对带鱼品质及组织结构的影响[J]. 食品科学, 2016, 37(18): 290-297. DOI:10.7506/spkx1002-6630-201618046. http://www.spkx.net.cn
HU Yue, YANG Shuibing, YU Haixia, et al. Effect of superchilling on the quality and muscle tissue structure of Trichiurus haumela[J]. Food Science, 2016, 37(18): 290-297. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201618046. http://www.spkx.net.cn
2015-12-18
“十三五”国家重点研发计划项目(2016YFD0400102)
胡玥(1991—),女,硕士研究生,研究方向为水产品加工。E-mail:huyue45151@163.com
胡亚芹(1972—),女,教授,博士,研究方向为水产品加工与贮藏。E-mail:yqhu@zju.edu.cn
