响应面试验优化超声波辅助提取山杏种皮黑色素工艺及其抗氧化活性
2016-10-18李红姣李巨秀
李红姣,李巨秀*,赵 忠*
(1.西北农林科技大学林学院,西部环境与生态教育部重点实验室,陕西 杨凌 712100;2.河北农业大学林学院,河北 保定 071000;3.西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
响应面试验优化超声波辅助提取山杏种皮黑色素工艺及其抗氧化活性
李红姣1,2,李巨秀3,*,赵忠1,*
(1.西北农林科技大学林学院,西部环境与生态教育部重点实验室,陕西 杨凌 712100;2.河北农业大学林学院,河北 保定 071000;3.西北农林科技大学食品科学与工程学院,陕西 杨凌 712100)
以山杏种皮黑色素得率为考察指标,在单因素试验的基础上采用Box-Behnken方法,通过响应面设计优化超声波辅助提取山杏种皮黑色素的工艺,并对山杏种皮黑色素的自由基清除能力、螯合金属离子能力、抗脂质过氧化等抗氧化活性进行了测定。结果表明,提取温度、料液比、NaOH浓度这3 个因素对提取效果均有显著影响(P<0.05),超声波辅助提取山杏种皮黑色素的最优工艺为NaOH浓度0.33 mol/L、料液比1∶10(g/mL)、提取温度63.07 ℃,山杏种皮黑色素得率可达4.14%。山杏种皮黑色素具有较强的螯合金属离子的能力,对羟自由基也有一定的清除作用,能显著抑制大鼠肝脏自发性以及H2O2和Fe2+-VC诱导的脂质过氧化反应,但铁还原能力、体外清除1,1-二苯基-2-苦肼基(DPPH)自由基和2,2’-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐自由基(ABTS+·)的能力较弱。
超声波辅助提取;山杏种皮;黑色素;响应面法;抗氧化
黑色素普遍存在于生物界,是一类结构复杂多样的酚类或吲哚类生物大分子色素的总称[1],在医药、化妆品、食品、电子等领域有着广泛的应用前景[2]。目前,黑色素既可以通过酪氨酸或其衍生物的氧化进行化学合成,也可以从动植物材料中提取,还可以利用微生物合成[3-4]。姚增玉[5]从山杏种皮中提取出了黑色素,得率达到4.73%,而李巨秀等[6]将山杏种皮黑色素得率提高到了7.2%。相比而言,植物黑色素安全性较高,应用范围更广。
天然黑色素是黑色食品中的主要活性成分[7],具有抗氧化、延缓衰老、增强免疫力、促进造血功能、保护心血管、抗动脉粥样硬化等功能特性[8-13],可开发成保健食品或食品添加剂等。黑色素能有效地清除活性氧自由基[14],这是其保护生物大分子如 DNA免受氧化损伤的重要原因。笔者前期研究[15-16]证明山杏种皮黑色素能有效抵抗紫外辐照和抑制晚期糖基化终末产物的形成,防止相关疾病的发生。这些都与黑色素的抗氧化活性有关。因此研究黑色素的抗氧化特性,对黑色素的开发有现实的指导意义。
超声波辅助提取法应用超声波强化提取植物的有效成分,是一种物理破碎过程,其原理主要是利用超声空化等性质增大物质分子运动频率和速率,增加溶剂穿透力,提高有效成分的溶出速度和溶出次数,同时超声波的热效应使水温基本在60 ℃左右,对原料有水浴作用,缩短了提取时间,具有提取时间短、提出率高、低温提取有利于保护有效成分等优点[17]。
本研究采用响应面法优化山杏种皮中黑色素的提取工艺,并分别通过测定山杏种皮黑色素清除1,1-二苯基-2-苦肼基(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基能力、清除2,2’-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate),ABTS)自由基(ABTS+·)能力、铁还原能力、金属离子螯合能力和清除羟自由基的能力,分析山杏种皮黑色素的体外抗氧化活性;建立肝组织匀浆-脂质过氧化模型,研究山杏种皮黑色素的抗脂质过氧化活性。
1 材料与方法
1.1材料与试剂
山杏仁产自甘肃平凉,手工去皮,自然条件下风干备用。
抗坏血酸、DPPH、2,4,6-三(2-吡啶)-1,3,5-三嗪(2,4,6-tri(2-pyridyl)-s-triazine,TPTZ)、ABTS、合成黑色素 美国Sigma公司;Trolox 美国Cayman公司;其他试剂均为国产分析纯。
1.2仪器与设备
FA-1004型电子天平 上海精科天平有限公司;KQ-500DE型超声波清洗机 舒美昆山市超声波仪器有限公司;HH-6型数显恒温水浴锅、85-2型恒温磁力搅拌器 国华电器有限公司;DZF型真空干燥箱 北京科伟永兴仪器有限公司;PHS-3C型酸度计 方舟科技有限公司;SC-3610型低速离心机 安徽中科中佳科学仪器有限公司;424 UV1101型分光光度计、F-4500 FL型荧光光谱仪 日本岛津公司。
1.3方法
1.3.1山杏种皮黑色素的提取
黑色素的提取流程见图1。

图1 山杏种皮黑色素提取工艺流程图Fig.1 Flow chart for the extraction process of MTWA
1.3.2超声辅助提取山杏种皮黑色素的单因素试验
分别考察了提取剂NaOH浓度、料液比、超声波功率、提取时间和提取温度对黑色素得率的影响。以山杏种皮黑色素得率作为考察指标,确定5 个因素的适宜范围。
1.3.3响应面法对超声辅助提取山杏种皮黑色素工艺的优化
根据Box-Behnken设计原理和单因素试验结果,选择提取温度、料液比和NaOH浓度3个因素,以黑色素得率为响应值设计了三因素三水平的响应面优化试验。Box-Behnken试验因素及水平设计见表1。

表1 响应面分析因素与水平Table1 Factors and levels used for RSA
1.3.4黑色素溶液的配制
将100 mg纯化干燥后的山杏种皮黑色素和合成黑色素用50 mL质量分数0.2%的氨水在氮气保护下超声辅助溶解,用旋转蒸发仪减压抽去氨气,直至pH值达7.5,最后用去离子水稀释至所需质量浓度。
1.3.5DPPH自由基清除能力的测定
分别取1 mL不同浓度的Trolox标准液,与4.5 mL100 μmol/L的DPPH甲醇溶液,充分混匀,避光静置30 min后,用无水甲醇调零,在517 nm波长条件下测其吸光度,重复3 次,以Trolox浓度为横坐标,清除率为纵坐标做标准曲线。用不同浓度的山杏种皮黑色素溶液和合成黑色素的溶液代替Trolox,实验方法与制作标准曲线相同,计算对DPPH自由基的清除率,从而计算相对应的Trolox当量。其中,对照组用无水甲醇代替DPPH甲醇溶液,空白组用蒸馏水代替黑色素溶液。按公式(1)计算DPPH自由基清除率:

式中:A2为对照组吸光度;A1为实验组吸光度;A0为空白组吸光度。
1.3.6铁还原能力的测定
取1 mL不同浓度的FeSO4溶液,与4.5 mL TPTZ工作液混合,旋涡振荡后,置于避光处37 ℃反应 10 min,用水调零,在593 nm波长条件下测定吸光度,重复3 次,以FeSO4溶液浓度为横坐标,以铁还原力为纵坐标,制作标准曲线。用不同浓度的山杏种皮黑色素溶液和合成黑色素的溶液代替FeSO4溶液,实验方法与制作标准曲线相同,计算相对应的FeSO4当量。其中,对照组用蒸馏水代替TPTZ工作液,空白组用蒸馏水代替黑色素溶液。按公式(2)计算铁还原能力:

式中:A2为对照组吸光度;A1为实验组吸光度;A0为空白组吸光度。
1.3.7ABTS+·清除能力的测定
取1 mL不同浓度的Trolox标准液与4.5 mL ABTS工作液,漩涡振荡后,室温避光反应6 min,用无水乙醇调零,在734 nm波长条件下测其吸光度,重复3 次,以Trolox标准液浓度为横坐标,ABTS+·清除率为纵坐标,制作相关曲线。用不同浓度的山杏种皮黑色素溶液和合成黑色素的溶液代替Trolox,实验方法与制作标准曲线相同,计算相对应的Trolox当量。其中,对照组用无水乙醇代替ABTS工作液,空白组用蒸馏水代替黑色素溶液。按公式(3)计算ABTS+·清除率:

式中:A2为对照组吸光度;A1为实验组吸光度;A0为空白组吸光度。
1.3.8螯合金属能力的测定
取1 mL不同浓度的EDTA溶液,与3.7 mL无水甲醇,振荡混匀,加入0.1 mL 2 mmol/L的FeCl2溶液,混匀,30 s后加入0.2 mL 5 mmol/L的菲啰嗪,避光反应20 min,562 nm波长条件下测吸光度,重复3 次,以EDTA浓度为横坐标,金属离子螯合能力为纵坐标,制作标准曲线。用不同浓度的山杏种皮黑色素溶液和合成黑色素的溶液代替EDTA,实验方法与制作标准曲线相同,计算山杏种皮黑色素溶液和合成黑色素的溶液的螯合金属离子的能力,从而计算相对应的EDTA当量。其中,对照组用蒸馏水代替FeCl2溶液和菲啰嗪,空白组用蒸馏水代替黑色素溶液。按公式(4)计算金属离子螯合能力:

式中:A2为对照组吸光度;A1为实验组吸光度;A0为空白组吸光度。
1.3.9羟自由基清除能力测定
在10 mL的比色管中依次分别加入5.00 mL pH 7.4的磷酸盐缓冲溶液、0.3 mL 1.14 mmol/L CuSO4溶液、1.20 mL 0. 925 mmol/L苯甲酸和1.00 mL 97 μmol/L VC溶液,稀释至刻度并摇匀,在室温条件下放置90 min。在激发波长和发射波长分别为294 nm和414 nm条件下测定相对荧光强度[18],以此分析羟自由基清除能力。
1.3.10山杏种皮黑色素抑制脂质过氧化活性作用
1.3.10.1 山杏种皮黑色素对自发性肝脏脂质过氧化反应的抑制作用
参考皮建辉等[19]的方法,稍作改进。健康小鼠禁食过夜后脱颈锥处死,迅速取出肝脏组织,置于预冷的生理盐水中冲洗后,冰浴研磨制成5%组织匀浆,取肝脏匀浆1.5 mL分装于试管中,向各反应试管中分别加入0、0.1、0.2、0.3、0.4、0.5 g/L的山杏种皮黑色素溶液0.1 mL(对照组用生理盐水代替),用生理盐水补充至总体积2 mL,混匀后37℃水浴中振荡温育,启动肝脏脂质过氧化反应,当反应120 min后,各试管中加入1.5 mL 20%三氯乙酸终止反应。3 500 r/min离心10 min,取上清液2 mL,加入1.5 mL 0.67%硫代巴比妥酸,95℃水浴15 min显色,取出冷却至室温,测定其532 nm波长处的吸光度。吸光度越大表明丙二醛的生成越多,脂质过氧化反应越强烈。
1.3.10.2 山杏种皮黑色素对H2O2诱导的肝脏脂质过氧化反应的抑制作用
取肝脏匀浆1.5 mL分装于试管中,向各反应试管中分别加入0、0.1、0.2、0.3、0.4、0.5 g/L的山杏种皮黑色素溶液0.1 mL(对照组用生理盐水代替),在体系中加入H2O250 μL,用生理盐水补充至总体积2 mL,混匀后37 ℃水浴中振荡温育,诱导启动肝脏脂质过氧化反应,后续测定方法同1.3.10.1节。
1.3.10.3 山杏种皮黑色素对Fe2+-VC诱导的肝脏脂质过氧化反应的抑制作用
取肝脏匀浆1.5 mL分装于试管中,向各反应试管中分别加入0、0.1、0.2、0.3、0.4、0.5 g/L的山杏种皮黑色素溶液0.1 mL(对照组用生理盐水代替),在体系中加入终浓度分别为1、10 mmol/L的FeSO4·7H2O和VC溶液总共50 μL,用生理盐水补充至总体积2 mL,混匀后37 ℃水浴中振荡温育,诱导启动肝脏脂质过氧化反应,后续测定方法同1.3.10.1节。
1.4统计分析
采用Excel 2010软件统计分析数据,数据表示方式为“±s”。采用单因素Duncan法进行多重比较,以SPSS 18.0软件进行显著性分析。
2 结果与分析
2.1单因素试验结果

图2 超声波功率对山杏种皮黑色素得率的影响Fig.2 Effect of ultrasonic power on melanin yield
2.1.1超声波功率对山杏种皮黑色素得率的影响由图2可以看出,黑色素得率随着超声波功率的增大而增大。在超声波功率为500 W(100%)时有最大值。这可能是由于超声波对细胞膜的破坏作用随着功率的增大而增大,溶出物增多,功率增大不会使提取物中部分黑色素结构显著破坏,因此选500 W为后续试验条件。
2.1.2料液比对山杏种皮黑色素得率的影响

图3 料液比对山杏种皮黑色素得率的影响Fig.3 Effect of solid-to-solvent ratio on melanin yield
由图3可看出,料液比对山杏种皮黑色素得率有显著的影响,黑色素得率随着溶剂用量的增大而逐步增大,到1∶15(g/mL)时黑色素得率达到最大值,因此,选择1∶10、1∶15、1∶20(g/mL)作为进一步试验的提取料液比。
2.1.3NaOH浓度对山杏种皮黑色素得率的影响
由图4可以看出,NaOH浓度对黑色素得率有显著影响,随着NaOH浓度的增大,黑色素得率也不断增大,当NaOH浓度增大到0.3 mol/L时取得最大值,此后黑色素得率随着NaOH浓度的增大而减小,可能是由于当NaOH浓度过高时,山杏种皮黑色素的生物活性受到破坏,而且还会带来不必要的能源损耗。综合考虑,选择0.2、0.3、0.4 mol/L作为后续优化试验条件。

图4 NaOH浓度对山杏种皮黑色素得率的影响Fig.4 Effect of sodium hydroxide concentration on melanin yield
2.1.4提取时间对山杏种皮黑色素得率的影响
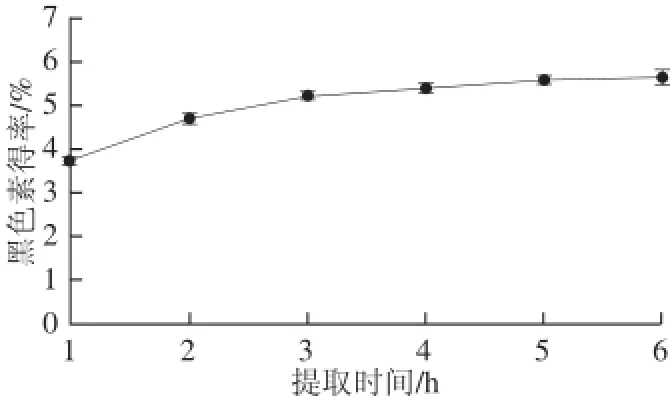
图5 提取时间对山杏种皮黑色素得率的影响Fig.5 Effect of extraction time on melanin yield
由图5可以看出,提取时间在3 h内黑色素得率随时间延长而增加的较快,可能是随时间延长黑色素溶解出来更多。3 h之后增大速率变小,可能是时间过长溶解出来的蛋白质等杂质较多,或者提取时间过长超声波作用会使提取物中部分黑色素的结构受破坏。
2.1.5提取温度对山杏种皮黑色素得率的影响

图6 提取温度对山杏种皮黑色素得率的影响Fig.6 Effect of extraction temperature on melanin yield
由图6可以看出,当提取温度升高时,得率升高,但超过70 ℃后,得率增加不大,而且温度升得过高不但会导致成本增加还会造成色素降解。为确定多条件下综合作用时的最佳提取条件选择45、60、75 ℃作为优化试验条件。
2.2响应面试验结果
根据Box-Behnken试验设计原理,选择提取温度、料液比和NaOH浓度3 个因素,共17 个试验点的响应面分析试验,试验设计与结果见表2,方差分析结果见表3。

表2 响应面试验设计与结果Table2 Program and experimental results of RSA

表3 回归方程方差分析结果Table3 Analysis of variance of regression equation
由表3可知,模型的P值小于0.05,失拟项P>0.05,不显著,说明模型拟合良好,试验误差小,可以用来预测各因素对黑色素得率的影响。根据表3中各因素P值的大小可知,提取温度、料液比和NaOH浓度对黑色素提取影响均达到P<0.05的显著水平,且显著性大小为NaOH浓度>料液比>提取温度,NaOH浓度的二次项对黑色素的提取也存在极显著影响。建立二次响应面回归模型,经回归拟合后,各试验因素对响应值的影响可用以下函数表示:
Y=-3.81+0.19A-0.25B+0.36C+0.125AB-0.01AC+ 0.05BC-0.15A2+0.04B2-0.54C2
山杏种皮中黑色素超声波辅助提取的优化条件为:取10.00 g山杏种皮原料,NaOH浓度0.33 mol/L、料液比1∶10(g/mL)、提取温度63.07 ℃。山杏种皮黑色素得率可达4.14%。
2.3山杏种皮黑色素的抗氧化活性
2.3.1DPPH自由基的清除能力

图7 山杏种皮黑色素对DPPH自由基清除能力Fig.7 DPPH radical scavenging ability of melanins
由图7可知,随着黑色素质量浓度的增大,清除DPPH自由基的Trolox当量也随之增大。山杏种皮黑色素和合成黑色素清除DPPH自由基的IC50分别为33.13 mg/L和8.88 mg/L,Trolox当量分别为2.72、10.14 μmol/mg。与合成黑色素相比,山杏种皮黑色素对DPPH自由基的清除活性较低,这与姚增玉等[20]的研究结果一致。
2.3.2铁还原能力

图8 山杏种皮黑色素的铁还原能力Fig.8 Ferric reducing ability of melanins
由图8可知,随着黑色素质量浓度的增大,铁还原能力的FeSO4当量也随之增大。山杏种皮黑色素和合成黑色素铁还原力的IC50分别为18.85 mg/L和4.87 mg/L,FeSO4当量分别为7.74、29.95 μmol/mg。与合成黑色素相比,山杏种皮黑色素铁还原力较低,姚增玉等[20]也报道了山杏种皮黑色素铁还原能力比2,6-二叔丁基对甲酚(butylated hydroxytoluene,BHT)和VC弱。
2.3.3ABTS+·的清除能力
由图9可知,随着黑色素质量浓度的增大,清除ABTS+·的Trolox当量也随之增大。山杏种皮黑色素和合成黑色素清除ABTS+·的IC50分别为11.29 mg/L和3.67 mg/L,Trolox当量分别为5.99、18.44 μmol/mg。与合成黑色素相比,山杏种皮黑色素对ABTS+·的清除活性较低,即其抗氧化活性较弱。

图9 山杏种皮黑色素对ABTS+·清除能力Fig.9 ABTS+· scavenging ability of melanins
2.3.4螯合金属离子能力

图10 山杏种皮黑色素对金属离子螯合能力Fig.10 Metal-chelating ability of melanins
由图10可知,随着黑色素质量浓度的增大,螯合金属离子的EDTA当量也随之增大。山杏种皮黑色素和合成黑色素螯合金属离子的IC50分别为18.43 mg/L和50.83 mg/L,EDTA当量分别为2.71、0.98 μmol/mg。与合成黑色素相比,山杏种皮黑色素对金属离子的螯合能力较高。较强的螯合金属离子的能力,这预示着在生物体内它可以清除重金属和过渡金属离子的毒害[21],在工业方面可用于提取重金属以及污染治理。
2.3.5羟自由基清除活性
羟自由基是一种活性较强、危害较大的活性氧自由基,在生物体内能与蛋白质、DNA、脂类糖类等发生反应,破坏这些物质的功能[22]。由图11可见,苯甲酸本身没有荧光(曲线1),苯甲酸在VC和Cu2+的作用下产生羟基苯甲酸,在pH 7.4的磷酸盐缓冲溶液中,羟基化苯甲酸有一激发波长296 nm、发射波长414 nm的荧光峰(曲线2)[18],由于山杏种皮黑色素对羟自由基的清除使得荧光强度下降(曲线3),并且随着山杏种皮黑色素质量浓度的增大,荧光强度减小,表明山杏种皮黑色素对羟自由基有较强的清除活性。姚增玉等[20]研究也表明山杏种皮黑色素清除羟自由基能力与BHT无显著差异而高于VC。

图11 山杏种皮黑色素抑制羟自由基生成荧光光谱Fig.11 Fluorescence spectra showing the inhibitory effect of MYWA on hydrolyxyl radical
2.3.6山杏种皮黑色素抑制脂质过氧化活性作用
H2O2、Fe2+-VC等自由基引发剂均可激发脂质过氧化反应,明显增加丙二醛的生成量。氧化剂H2O2中含有活性氧,在一定条件下可生成活性更强的羟自由基,可引发脂质过氧化作用,并形成过氧化脂质(lipid peroxidation,LPO)。LPO大部分由肝细胞产生,其分解也主要在肝脏。丙二醛是LPO的主要降解产物,其含量可反映脂质过氧化的程度[19]。在Fe2+-VC自由基发生系统中,由VC所引起的三价铁离子到亚铁离子的循环促使超氧阴离子、H2O2、羟自由基的生成,诱发多不饱和脂肪酸氧化,产生脂氧自由基和脂过氧自由基,再引发链式、支链式反应,使多不饱和脂肪酸进一步发生过氧化[23]。

图12 山杏种皮黑色素抑制脂质过氧化活性结果Fig.12 Inhibition of lipid peroxidation by MTWA
由图12可见,H2O2和Fe2+-VC均能显著诱导大鼠肝脏脂质过氧化反应,且H2O2的诱导能力明显强于Fe2+-VC。不同质量浓度的山杏种皮黑色素溶液对大鼠自发性肝脏脂质过氧化以及H2O2和Fe2+-VC诱导脂质过氧化均具有明显的抑制作用,随着山杏种皮黑色素质量浓度的增大,抑制作用增强,在0.3 g/L时,山杏种皮黑色素对自发性肝脏脂质过氧化已经达到极显著的抑制作用(P<0.01)。而对于H2O2和Fe2+-VC诱导脂质过氧化反应,0.2 g/L的山杏种皮黑色素已经起到了显著抑制作用(P<0.05)。
3 讨论与结论
山杏仁皮是山杏仁深加工过程中的下脚料,采用NaOH提取法提取山杏种皮黑色素的最优工艺为NaOH浓度0.4 mol/L、提取温度80 ℃、提取时间6 h、液料比20∶1(mL/g),得率最大值为7.2%[6],而超声波辅助提取的最优工艺为NaOH浓度0.33 mol/L、料液比1∶10(g/mL)、提取温度63.07 ℃,其山杏种皮黑色素得率可达4.14%。超声波辅助提取的方法耗时较短、提取剂浓度小、用量少、温度低、提取条件较为温和。从研究结果看,对于不同的提取方法,对山杏种皮黑色素得率影响最大的条件都是提取温度,超声波辅助提取的温度较低,可能是超声波辅助提取山杏种皮黑色素黑色素得率低的原因。姚增玉[5]认为黑色素的氧化程度越低,抗氧化活性就越高。因此,较短的提取时间、较温和的提取条件,能缩短黑色素与空气的接触时间,降低其氧化程度,保证黑色素的抗氧化活性。
自由基是人体正常代谢的产物,可以促进细胞增殖,刺激白细胞和吞噬细胞,杀灭细菌,消除炎症,分解毒物[9,24]。但是,由环境污染、农药、食品添加剂、酒精、吸烟等外来因素引发的外源性自由基及人体新陈代谢失衡导致体内的自由基过量,可以引起生物体脂类、蛋白质和核酸等分子的过氧化损伤。尽管人体自身具有抗氧化化合物和酶等抗氧化平衡系统以克服活性氧和自由基的伤害,但这些抗氧化物质的量仍然不足。BHT和叔丁基羟基茴香醚(butyl hydroxyanisole,BHA)等人工合成抗氧化剂已普遍用于食品工业,但其安全性和毒性越来越受到关注,欧美等一些国家已禁止或限量使用这些抗氧化剂。姚增玉等[20]的研究表明山杏种皮黑色素具有较强的抗氧化能力,可以明显抑制β-胡萝卜素-亚油酸乳化液的氧化褪色,具有强的清除羟自由基能力,其效果接近BHT而高于VC,清除超氧阴离子自由基能力超过BHT和VC。山杏种皮黑色素既可以作为氢供体,清除DPPH自由基,但清除能力低于BHT和VC,也可作电子供体,将Fe3+还原为Fe2+,还原能力高于BHT和VC。而本研究表明,山杏种皮黑色素具有较强的螯合金属离子的能力和清除羟自由基的能力,能显著抑制大鼠肝脏自发性以及H2O2和Fe2+-VC诱导的脂质过氧化反应,进一步证明了山杏种皮黑色素的抗氧化能力。尤其是较强的螯合金属离子的能力,预示着在生物体内它可以清除重金属和过渡金属离子的毒害,在工业方面可用于提取贵重金属以及污染治理。
山杏种皮黑色素的这些抗氧化能力,为其保护生物大分子如DNA免受氧化损伤奠定了基础[25]。山杏种皮黑色素能有效抵抗紫外辐射、抑制糖基化反应也是能有效清除自由基、抗氧化反应的结果[15-16]。
[1] 徐磊. 短梗霉黑色素的分离提取及其结构分析[D]. 大连: 大连理工大学, 2006.
[2] LIGONZO T, AMBRICO M, AUGELLI V, et al. Electrical and optical properties of natural and synthetic melanin biopolymer[J]. Journal of Non-Crystalline Solids, 2009, 355(22/23): 1221-1226. DOI:10.1016/ j.jnoncrysol.2009.05.014.
[3] BAFTEH P R, SIEGESMUND M, HANNEKEN S, et al. Protective effects of ss-carotene and melanin against protoporphyrine IX-induced phototoxicity in the photo hen’s egg test[J]. Photodermatology,Photoimmunology and Photomedicine, 2012, 28: 12-16. DOI:10.1111/ j.1600-0781.2011.00630.x.
[4] 张金萍, 王敬文, 杜孟浩. 以酪氨酸为底物酶促合成黑色素的研究[J].天然产物研究与开发, 2006(18): 12-15.
[5] 姚增玉. 山杏种皮黑色素提取及其性质研究[D]. 杨凌: 西北农林科技大学, 2008.
[6] 李巨秀, 李红姣, 赵忠, 等. 山杏种皮黑色素提取工艺优化[J]. 食品科学, 2012, 33(8): 11-14.
[7] 应超. 黑色食品中黑色素的研究现状[J]. 科学教育, 2010, 16(1): 95-96.
[8] HERRLING T, JUNG K, FUCHS J. The role of melanin as protector against free radicals in skin and its role as free radical indicator in hair[J]. Spectrochim Acta Part A, Molecular and Biomolecular Spectroscopy’s Latest Table of Contents, 2008, 69(5): 1429-1435. DOI:10.1016/j.saa.2007.09.030.
[9] DIRAVIYAM T, RADHAKRISHNAN M R A R. Antioxidant activity of melanin pigment from Streptomyces species D5 isolated from desert soil,Rajathan, India[J]. Drug Invention Today, 2011, 3(3): 12-13.
[10] DONG C, YAO Y. Isolation, characterization of melanin derived from Ophiocordyceps sinensis, an entomogenous fungus endemic to the Tibetan Plateau[J]. Journal of Bioscience Bioengineering, 2012,113(4): 474-479. DOI:10.1016/j.jbiosc.2011.12.001.
[11] GANESH K C, MONGOLLA P, POMBALA S, et al. Physicochemical characterization and antioxidant activity of melanin from a novel strain of Aspergillus bridgeri ICTF-201[J]. Letters in Applied Microbiology,2011, 53(3): 350-358. DOI:10.1111/j.1472-765X.2011.03116.x.
[12] 张名位, 郭宝江, 池建伟, 等. 黑米皮提取物的体外抗氧化作用与成分分析[J]. 中国粮油学报, 2005, 20(6): 49-54. DOI:10.3321/ j.issn:1003-0174.2005.06.013.
[13] 张莲姬, 崔泰花. 泥鳅鱼黑色素抗氧化作用[J]. 食品研究与开发,2010, 31(8): 11-14. DOI:10.3969/j.issn.1005-6521.2010.08.004.
[14] ROZANOWSKA M, SAMA T, LAND E J, et al. Free radical scavenging properties of melanin-interaction of eu- and pheomelanin models with reducing and oxidising radicals[J]. Free Radical Biology and Medicine, 1999, 26: 518-525. DOI:10.1016/S0891-5849(98)00234-2.
[15] 李红姣, 张双凤, 李巨秀, 等. 山杏种皮黑色素对果蝇的紫外辐射保护作用[J]. 食品科学, 2012, 33(21): 285-289.
[16] 李红姣, 赵忠, 李巨秀. 山杏种皮黑色素抑制晚期糖基化末端产物的研究[J]. 中国粮油学报, 2015, 30(2): 50-56.
[17] 顾文秀, 谢为明, 夏文水, 等. 超声波提取乌饭树叶色素及其稳定性的研究[J]. 林产化学与工业, 2005, 25(4): 74-78. DOI:10.3321/ j.issn:0253-2417.2005.04.018.
[18] 李晓燕, 刘志洪, 蔡汝秀. 黑色素对羟基自由基清除活性的研究[J]. 四川大学学报(自然科学版), 2003, 10(6): 1132-1136. DOI:10.3969/j.issn.0490-6756.2003.06.031.
[19] 皮建辉, 胡朝暾, 郑晴, 等. 金樱子多糖体外抗脂质过氧化和红细胞溶血作用研究[J]. 怀化学院学报, 2012, 31(5): 11-16. DOI:10.3969/ j.issn.1671-9743.2012.05.003.
[20] 姚增玉, 李科友, 赵忠, 等. 山杏种皮黑色素的抗氧化活性[J]. 林业科学, 2007, 43(10): 59-63. DOI:10.3321/j.issn:1001-7488.2007.10.010.
[21] MATUSZCZYK M, BUSZMAN E, PILAWA B, et al. Cd2+effect on free radicals in Cladosporium cladosporioides-melanin tested by EPR spectroscopy[J]. Chemical Physics Letters, 2004, 394(4/5/6): 366-371. DOI:10.1016/j.cplett.2004.07.013.
[22] LEE J, KOO N, MIN D. Reactive oxygen species, aging, and antioxidative nutraceuticals[J]. Comprehensive Reviews in Food Science and Food Safety, 2004, 3(1): 21-33. DOI:10.1111/j.1541-4337.2004.tb00058.x.
[23] 蔡秀成, 郭英, 陈秋丽. 芦荟的体外抗脂质过氧化作用[J]. 食品科学,2001, 22(7): 83-85. DOI:10.3321/j.issn:1002-6630.2001.07.023.
[24] BALLABIO C, RESTANI P. Lipids in functional foods, nutraceuticals and supplements[J]. European Journal of Lipid Science and Technology, 2012, 114(4): 369-371. DOI:10.1002/ejlt.201200111.
[25] GENG J, YU S B, WAN X, et al. Protective action of bacterial melanin against DNA damage in full UV spectrums by a sensitive plasmidbased noncellular system[J]. Journal of Biochemical and Biophysical Methods, 2008, 70(6): 1151-1155. DOI:10.1016/j.jprot.2007.12.013.
Response Surface Optimization of Ultrasonic-Assisted Extraction of Melanin from Testae of Wild Apricots and Its Antioxidant Activities
LI Hongjiao1,2, LI Juxiu3,*, ZHAO Zhong1,*
(1. Key Laboratory of Environment and Ecology in Western China, Ministry of Education, College of Forestry, Northwest A&F University,Yangling 712100, China; 2. College of Forestry, Hebei Agricultural University, Baoding 071000, China;3. College of Food Science and Engineering, Northwest A&F University, Yangling 712100, China)
In this work, we isolated melanin from the testae of wild apricots (MTWA) by ultrasonic-assisted extraction. The optimization of the extraction process was carried out using by the combined use of one-factor-at-a-time method and response surface analysis (RSA) with Box-Behnken experimental design. Then the antioxidant activities of MTWA were analyzed including free radical scavenging capacity, metal ion-chelating capacity and lipid peroxidation inhibition. The results showed that the optimal extraction conditions were determined as follows: NaOH concentration, 0.33 mol/L;temperature, 63.07 ℃; time, 3 h; and solid-to-solvent ratio, 1:10 (g/mL). Under these conditions, the maximum yield of MTWA of 4.14% was obtained. The in vitro antioxidant tests showed that MTWA had weaker 1,1-diphenyl-2-picrylhydrazyl(DPPH) and 2,2’-azinobis-(3-ethylbenzthiazoline-6-sulphonate), radical scavenging activities and ferric reducing ability. However,compared with synthetic melanin, MTWA had much stronger metal ion-chelating ability. MTWA also had stronger hydroxyl radical-scavenging activity and provided significant inhibition of lipid peroxidation induced by H2O2and Fe2+-VC.
ultrasnic-assisted extraction; wild apricot testae; melanin; response surface analysis; antioxidant activities
10.7506/spkx1002-6630-201618005
S789.9
A
1002-6630(2016)18-0026-08
李红姣, 李巨秀, 赵忠. 响应面试验优化超声波辅助提取山杏种皮黑色素工艺及其抗氧化活性[J]. 食品科学, 2016,37(18): 26-33. DOI:10.7506/spkx1002-6630-201618005. http://www.spkx.net.cn
LI Hongjiao, LI Juxiu, ZHAO Zhong. Response surface optimization of ultrasonic-assisted extraction of melanin from testae of wild apricots and its antioxidant activities[J]. Food Science, 2016, 37(18): 26-33. (in Chinese with English abstract)DOI:10.7506/spkx1002-6630-201618005. http://www.spkx.net.cn
2016-03-03
国家林业公益性行业科研专项(200904020)
李红姣(1987—),女,博士,研究方向为森林食品和林产品加工。E-mail:lihongjiao0103@163.com
李巨秀(1972—),女,副教授,博士,研究方向为食品化学和功能食品。E-mail:juxiuli@msn.com赵忠(1958—),男,教授,博士,研究方向为森林培育理论与技术。E-mail:zhaozh@nwsuaf.edu.cn
