高油酸油菜研究现状、存在的问题及发展建议
2016-10-10张振乾胡庆一官春云
张振乾,胡庆一,官春云
(湖南农业大学农学院,长沙 410128)
高油酸油菜研究现状、存在的问题及发展建议
张振乾,胡庆一,官春云*
(湖南农业大学农学院,长沙 410128)
高油酸菜油具有很好的营养保健功能,其品质可与茶油、橄榄油等高级食用植物油媲美,对于改变我国食用植物油自给不足、促进油菜产业升级等方面有很好的作用。总结了国内外相关研究机构在高油酸油菜方面的研究动态及应用情况,同时对油酸的遗传特性、高油酸油菜选育途径(小孢子培养、远缘杂交、诱变和转基因技术)和分子生物学研究进展进行了综述,并针对当前存在的问题提出了一些建议。
油菜;高油酸;遗传;育种
高油酸油菜是指种子中油酸含量大于75%的油菜品种。高油酸菜油具有以下优点:①降低超重人群的心血管疾病和血浆中的低密度脂蛋白胆固醇含量,有利于人体心血管健康,对心脏起保护作用。②高油酸油在高温下不易氧化变质,保质期长,加热到较高温度时不冒烟,烹饪时间减少,损耗也较少,非常适用于家庭烹调及要求存放时间长的快餐食品类和糕点类;同时,其煎炸产品还拥有较好的香味。③用高油酸油生产的生物柴油稳定性强,点火温度低,冬季操作性能好。
高油酸菜油是可与茶油、橄榄油媲美的高级食用植物油,且油菜种植简单易行,可有效提高我国高级食用植物油的供给水平;同时依据优质优价原则,农民的种植积极性将大幅提高,可有效增加我国油菜种植面积,改变我国食用植物油严重依赖进口的局面。为了更好的发展高油酸油菜,促进油菜产业的可持续发展,本文综述了高油酸油菜研究的最新进展,归纳了目前高油酸油菜研究的一些情况,并提出了一些建议和意见。
1 油菜高油酸研究现状
1.1国外高油酸油菜发展情况
1992年,Auld等[1]利用EMS诱变获得世界上第一个油菜高油酸突变体。1995年,第一个高油酸油菜品种(油酸含量81%)由Rücker和Röbbelen选育成功[2]。1992年,芬兰开始白菜型油菜的高油酸育种研究[3]。2004年,欧洲第一个获得注册的HOLL油菜品种‘SPLENDOR’(油酸含量76.48%)问世[4],随之,V140OL、V141OL、V161OL(油酸含量均高于75%)等高油酸常规品种相继推出,主要用于订单农业生产[5]。2004年,加拿大Cargill种子公司CNR604(油酸含量75%)、CNR603(油酸含量85%)等品系参加品比试验[6]。2006年,澳大利亚投放了两个高油酸品种,2007年又推出替代品种[7]。这些品种的培育为高油酸品种进入初具规模的生产应用创造了条件。
1.2国内高油酸油菜发展情况
我国高油酸油菜研究从21世纪初开始,与国外相比虽然起步晚但发展速度快。湖南农业大学、华中农业大学及浙江省农科院等单位都开展了品种培育及分子机理方面的研究。2006年,湖南农业大学采用辐射诱变方法得到高油酸突变体[8],通过多年的定向培养,2015年已经得到48个性状稳定的高油酸品系,2个材料参加区试,10个材料参加品比试验;并同步与湖南省春云农业科技股份有限公司及湖南盈成油脂工业有限公司联合开展了订单农业生产示范。此外,华中农业大学2012年在江陵县马家寨乡建立高油酸油菜籽生产基地;浙江省农业科学院培育出油酸含量接近80%的新品系‘浙油20’,推出了“爱是福”高油酸健康菜籽油[9];并使高油酸品种产量水平得到进一步提高,新育成的高油酸品系‘I10’产量和株型接近主栽品种‘浙双72’,2010年转让给浙江农科粮油股份有限公司进行产业化开发[10],并于2015年通过浙江省品种审定,成为我国第一个高油酸油菜新品种——‘浙油80’。安徽省农业科学院作物研究所2011年与大平集团和巨兴大平油料合作社合作,由巨兴大平油料合作社生产试种高油酸油菜。由于品种审定标准出台较晚,审定通过的高油酸油菜新品种较少,我国迄今尚无在生产上大面积应用的高油酸油菜品种[9]。
2 高油酸油菜育种研究情况
2.1常规方法
一般常用定向选择(从现有的高油酸材料中选择油酸含量较高的材料。该方法周期长,且不能创造新品种和新的类型)或杂交转育(含高油酸性状的材料间进行杂交,并在其杂种后代中通过选择而育成纯合品种)的方法培育高油酸油菜,具体如表1。
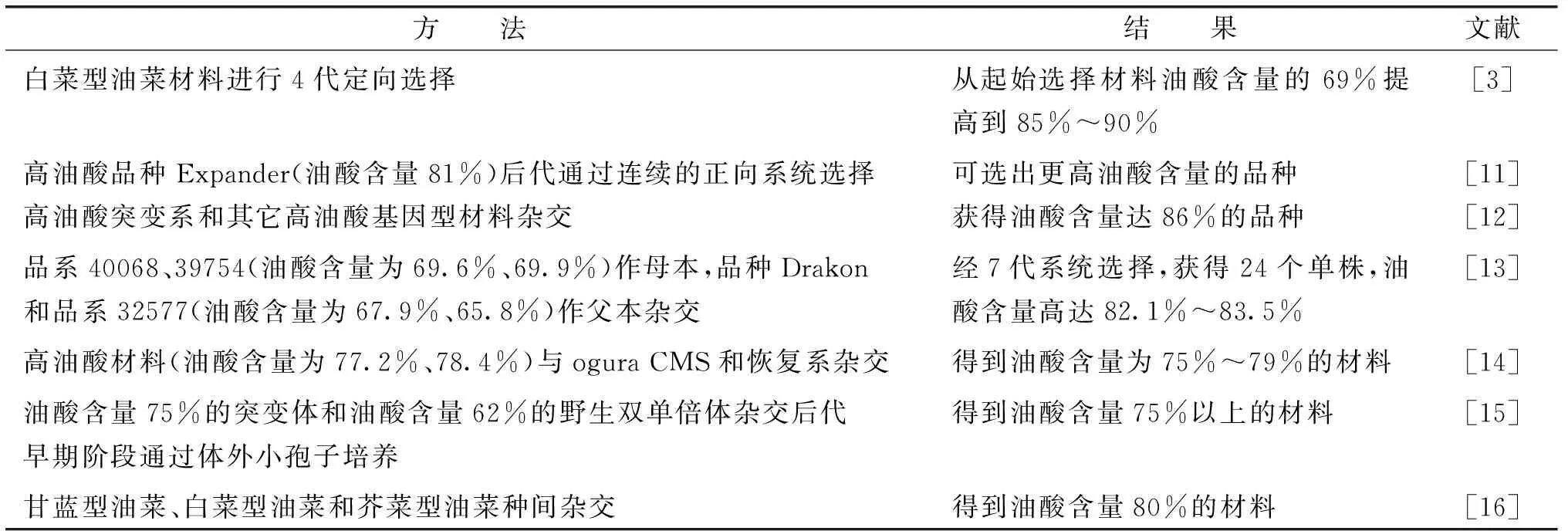
表1 常规方法培育高油酸油菜的研究情况Table 1 The breeding situation of high oleic acid rapeseed by traditional methods
2.2高油酸油菜育种材料早期筛选
王敬乔等[17]发现,可通过将叶片置于含有次氯酸钠和吐温的混合溶液中,观察叶片氧化变白的快慢,在早期阶段区分具有高油酸性状的FAD2基因突变体。高建芹等[18]研究发现,除花期外,各生育期营养器官与生殖器官中的油酸相对含量呈极显著正相关,可通过检测营养器官的油酸含量预测和筛选种子高油酸含量。
2.3诱变
诱变是当前高油酸油菜育种材料创新的主要方法,包括物理诱变和化学诱变。大多数高油酸突变都是由“A”插入或氨基酸替代引起的[19]。主要有两个突变机制:一是控制油酸脱饱和生成亚油酸的Δ12-油酰脱饱和酶基因FAD2中发生了一个或多个核苷酸突变,产生了终止密码子,导致翻译过程中肽链的过早终止,使所翻译的多肽不能作为有活性的脱饱和酶起作用,油酸因此不能脱饱和生成亚油酸而大量积累[8,20];二是FAD2基因中的核苷酸突变引起所编码的Δ12-油酰脱饱和酶FAD2中氨基酸的改变,影响蛋白质的折叠和空间结构,进而影响酶的活性或酶与底物结合的能力,最终导致高油酸突变体的产生[21~23]。
2.3.1化学诱变
化学诱变产生点突变的频率较高,诱发染色体畸变相对较少且多为显性突变体,对油料作物脂肪酸品质改良具有一定的特异性[24]。
化学诱变多采用甲基磺酸乙酯(EMS)。Auld等[1]利用EMS诱变,分别获得了油酸含量88%以上的甘蓝型油菜突变体X-82 M3、M4株系及亚油酸、亚麻酸含量大幅降低的白菜型油菜突变体M-30,将M-30与低芥酸亲本Tobin杂交,F4株系油酸含量超过87%。Rücker和Röbbelen利用诱变方法培育出高油酸品种Expander(油酸含量达81%)[25];通过诱变甘蓝型冬油菜品种Wotan,使得油酸含量由60.3%提高到80.3%[26]。Spasibionek[27]用EMS处理甘蓝型冬油菜种子,对脂肪酸组成发生显著变化的M2代种子再次处理,筛选出2个油酸含量76%左右的突变体。湖南农业大学用1.5%的EMS处理甘蓝型油菜品种湘油15号,从M2代筛选到一株油酸含量达71%的高油酸植株[20],多代自交筛选后得到油酸含量80%以上的材料。黄永娟等[23]也利用EMS诱变得到高油酸油菜突变体。
此外,还有利用其它诱变剂获得高油酸材料的报道。加拿大通过8 mM亚硝酸乙酯的二甲亚酸溶液处理油菜品种Regent Topas和Amdor,获得油酸含量为78%的突变系[28]。和江明等[29]用秋水仙碱溶液处理经200 mg/kg EMS诱变的甘蓝型油菜小孢子24 h,用NLN 13培养基进行小孢子培养,得到了一份油酸含量为80.3%的突变材料。
2.3.2物理诱变
物理诱变一般采用60Co照射。官春云等[8]用8万~10万伦琴60Coγ射线辐射湘油15号干种子,对辐射后代进行连续选择。由于高油酸突变体FAD2基因中DNA分子中发生鸟嘌呤转换为腺嘌呤,经过几个世代才能完成,因此直到M5多数植株油酸含量在70%以上,最高油酸含量达93.5%。
此外,西南大学利用航天诱变方法也获得了油酸含量为87.22%的甘蓝型油菜突变体[30]。
2.4基因工程方法
在植物体内,Δ12-油酰脱饱和酶FAD2是油酸合成与积累的重要调控位点[31]。目前常用反义表达和RNA干扰(RNA interference,RNAi)等[32]方法对其进行调控,以获得较高的油酸含量,尤其是RNA干扰技术,在拟南芥中证明了其作用后[33],在油料作物脂肪酸组成改良方面获得了突破性进展[34],相关研究见表2。
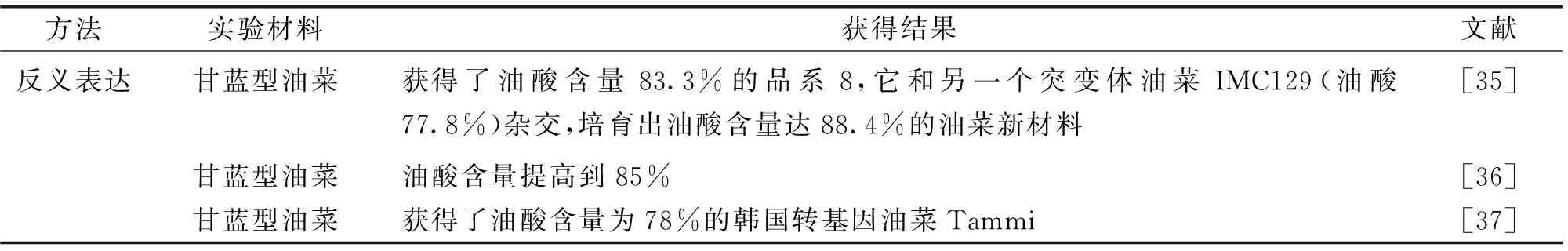
表2 利用基因工程技术获得高油酸材料的研究进展Table 2 The study advances of high oleic rapeseed materials obtained by gene engineering technology
(续表2)

方法实验材料获得结果文献油菜子叶柄内获得了转基因植株[38]RNA干扰甘蓝型油菜油酸含量达到89%[39]甘蓝型油菜构建了甘蓝型油菜FAD2基因的ihpRNA表达载体,获得转基因植株,19个单株种子油酸含量大于75%,有11个单株种子油酸含量大于80%[40~42]甘蓝型油菜油酸含量83.9%的无筛选标记转基因油菜新种质,且这种新种质未表现出高油酸突变体的一些不良农艺性状[43]低芥酸转基因株系和甘蓝型油菜FAE1基因和FAD2基因的协同干涉,获得了高油酸(油酸含量75%)、低芥酸和低多不饱和脂肪酸的转基因材料[44]甘蓝型油菜油菜试管苗的带柄子叶为外植体,得到9株抗PPT苗[45]构建了甘蓝型油菜FAD2、FAD3、FATB基因共干扰载体,转入甘蓝型油菜中双9号,2株油酸含量在75%以上[46]构建了FAD2与FAE1基因双干扰载体,获得144株抗性再生植株[47]转基因植株FFRP4-4油酸含量提高到85%,F1代种子油酸含量在80%以上,饱和脂肪酸10%,芥酸未检出[48]
2.5分子标记辅助选择
利用与控制油酸含量的基因紧密连锁的分子标记对携带有高油酸基因的植株进行早期选择[25],可以减少大田选择的工作量,增加育种的选择反应和成本效益[49]。目前,已鉴定的油酸含量有RAPD(random amplified polymorphic DNA,随机扩增多态性DNA)、SNP (single nucleotide polymorphism,单核苷酸多态性)、SSR (Simple Sequence Repeats,简单重复序列)和AFLP(amplified fragment length polymorphism,扩增片段长度多态性)等标记。
2.5.1RAPD标记
Tanhuanpää等[50]在白菜型春油菜中发现8个RAPD标记与油酸含量有关,其中最合适的标记是OPH-17,这些标记也位于LG6并与油酸位点相应的FAD2基因连锁。Sharma等[51]利用芥菜型油菜重组自交系发掘出7个与油酸含量显著相关的RAPD标记,其中3个标记在连锁群LG9上连锁,另外各有2个标记在连锁群LG1和LG17上连锁。将2个油酸含量QTL作图在连锁群LG9和LG1上,2个位点总共解释32.2%的油酸含量变异,其中连锁群LG9上的主要QTL解释油酸含量变异的28.5%,定位于RAPD标记OPF 081000和OPI 101000之间。Javidfar等[52]在甘蓝型油菜中鉴定出6个相互独立的油酸含量RAPD标记,其中UBC2830可解释43%的油酸含量遗传变异。
2.5.2SNP标记
Hu等[21]发现甘蓝型油菜FAD2突变基因中发生了单核苷酸变异,基于这一单核苷酸差异,开发了FAD2突变等位基因特异的SNP标记并在连锁群N5上作图,该图可解释76.3%的油酸含量变异。Tanhuanpää等[22,53]开发了一个白菜型春油菜油酸含量相关的SNP标记,发现野生型和高油酸的FAD2基因位点只有一个核酸序列差异,导致一个氨基酸改变。SNP标记对油酸含量选择比SCAR标记更为有效[52],而且,采用PCR产物直接染色而不是电泳的方法可使等位基因特异检测进一步简化。Falentin等[54]根据突变体和野生型等位基因的序列差异,开发两个SNP标记,分别对应FAD2C基因和FAD2A基因的突变。Yang等[55]以SW Hickory(油酸含量大约为78%)×JA177(油酸含量64%)F1花蕾进行小孢子培养获得DH群体。QTL定位表明,控制油酸含量的主效QTL位于甘蓝型油菜的A5连锁群上,可解释89%的表型变异。
2.5.3SSR标记
王欣娜[56]以低油酸高亚麻酸10L421和高油酸低亚麻酸10L422亲本杂交获得的F2群体为材料,在A1、A5、Cl和C5连锁群定位到油酸含量相关的标记,其中A5和A1连锁群上的标记分别解释18.6%和9.5%表型变异。刘列钊等[30]对航天诱变高油酸突变体材料系进行标记,发现A05和A01染色体上的FAD2位点发生双隐性突变,两位点对表型的遗传变异贡献率分别达到31.1%和29.4%,为主效位点。陈伟等[57]在SWHickory×JA177产生的SJDH群体的A5染色体上定位到1个控制油酸含量的主效QTL,可解释油酸表型变异的85.3%;并利用该QTL两侧的SSR标记BRMS007和BRGMS630进行辅助育种,获得了油酸含量高且遗传背景基本恢复为JA177的改良单株。Zhao等[58]以德国冬油菜品种Sollux和中国高油材料构建DH群体作图,发现7个油酸含量相关的QTL,解释59%的遗传变异。Smooker等[59]的研究表明,SSR标记比区间作图法和多个QTL定位方法更有效。
湖南农业大学用高油酸油菜品系HOP和甘蓝型油菜湘油15号为父母本,在A5和C5连锁群上各检测到1个油酸含量主效QTL,这2个QTL能解释60%~70%油酸含量变异,其中位于A5连锁群的QTL效应值较大,与FAD2基因紧密连锁[60];在N5连锁群上标记分析发现1个控制油酸的QTL,处于CNU398与CN53之间,LOD值为4.83,贡献率达到59.37%[61];构建了导入A5、C5两个油酸QTL及只分别导入一个油酸QTL的BC2F1株系,背景回复率达90%以上[62]。
2.5.4AFLP标记
Lionneton等[63]筛选到2个油酸含量QTL,位于连锁群LG2上E4M1_4处的QTL解释51.8%的油酸含量变异,位于连锁群LG6上E1M2_6处的QTL解释9.5%的油酸含量变异。Schierholt等[12]对来自7488×DH11.4Samoutai后代进行AFLP分子标记研究,筛选到3个引物组合(E32M61、E38M62、E35M62),在亲本系及群体种子之间各表现为一个多态性带。将这3个AFLP标记(E32M61-141、E38M62-358、E35M62-256)用于F2群体作图,发现它们与高油酸等位基因连锁。最紧密连锁的AFLP标记E32M61-141距高油酸位点3.7 cM,可用于对高油酸性状分子选择的标记。在Brassica基因组中fad2位点在A基因组第15个连锁群上,在油菜LG15中的fad2位点是一个作用拷贝(图1)。
2.5.5其它方法
此外还有利用TRAP(target region amplified polymorphism,利用靶位区域扩增多态性)[64]和RFLP(Restriction Fragment Length Polymorphism,限制性内切酶片段长度多态性)[65]等方法对油酸含量进行的标记。
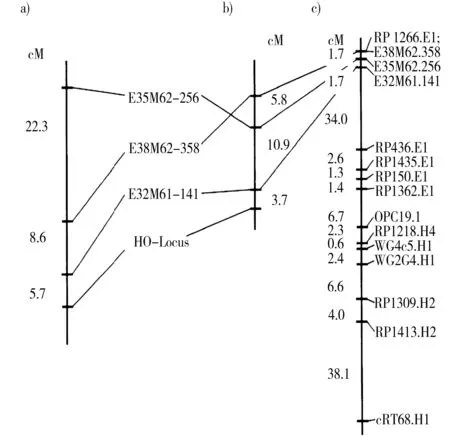
图1 利用HO突变体群体构建的遗传连锁图(Schierholt A et al,2000)Fig.1 The genetic linkage map of HO mutation populations注:a)7488×DH 11.4 Samourai;b)19661×DH 11.4 Samourai;c)the corresponding LG15 of the mapping population DH 11.4 Samourai DH Mansholts Hamburger Raps of Uzunova et al.(1995) with integrated AFLP markers (Ecke et al.unpublished results)。
3 遗传规律
油酸含量受硬脂酸和亚油酸含量影响。促进油酸减饱和基因有两个:FAD2基因(存在内质网中)和FAD6基因(存在叶绿体中)[28](图2)。油酸含量从60%到近90%不等的事实也说明高油酸性状遗传比较复杂。
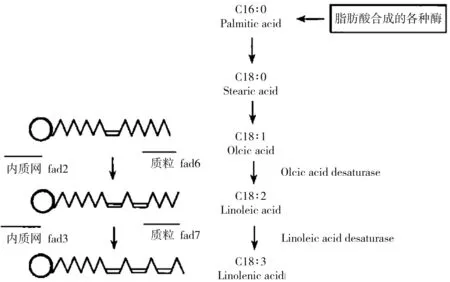
图2 脂肪酸生物合成示意图Fig.2 The figure of fatty acid synthesis
近年来有大量高油酸遗传特性方面的研究,如表3所示。

表3 高油酸遗传特性研究Table 3 Study about the genetic characteristics of high oleic acid rapeseed
由表3可以看出,高油酸遗传特性研究主要有3种观点:多基因控制,多基因控制和受环境影响,单基因控制。多数研究认为油酸遗传特性由多基因控制。遗传结果不尽相同,可能与试验材料的不同有关。
4 高油酸油菜研究
4.1产量与农艺性状
Hitz等[35]发现,高油酸突变体IMC129(油酸含量77.8%)农艺性状较好,但再次突变(油酸含量87%)后,植株农艺性状较差,可能是由于该突变体叶片和根系等器官中的油酸含量相应提高,使其在较低温度下种植时会出现明显的生长发育障碍,也有可能是由于FAD2基因突变改变了叶片表面蜡的沉积结构并增大了叶片表层的溶液渗透性[17]。
浙江省农科院培育的“浙油80”生产试验比对照减产3.7%,产油量比对照增加0.4%,差异不显著。周银珠[75]和黄永娟等[23]研究认为,高油酸性状对油菜主要农艺产量性状没有明显的不利影响。本实验室的研究也发现,高油酸品系与普通油酸品系间产量差异未达到显著水平[82,83],且2014、2015年度的品比试验结果也发现其产量与普通品种无明显差异。
Guguin等[5]报道,HOLL杂交种产量比HOLL常规种高15%以上,最好的HOLL杂交种产量与当家双低杂交种非常接近。油菜种子油酸含量与种子产量是否呈负相关,目前还不是很清楚,但现在鉴定的有些品系(组合)产量降低并不明显[28],可通过育种的努力来补偿产量的降低[68]。Antje等[84]发现,高油酸冬油菜(油酸含量大于75%)产量与叶子和种子中的油酸含量呈负相关,油酸含量高会延迟种子发芽。
4.2油酸与含油量及其它脂肪酸含量之间的关系
Möllers等认为油酸含量和含油量呈正相关[68],可提高0.6%的含油量[84];Zhao等[58]也认为脂肪酸组分与含油量之间有密切关系。但Smooker等[59]及本实验室的研究都认为,高油酸油菜的油酸含量与含油量并无线性关系。因此,油酸含量与含油量之间的关系仍需进一步研究。
油酸含量与其它脂肪酸含量间关系的研究较多,但目前尚无一致结论。Zhao等[58]认为油酸含量与芥酸、亚油酸含量和含油量负相关。阎星颖[76]发现油酸与其他脂肪酸呈极显著负相关;尚国霞[80]发现硬脂酸与油酸含量呈正相关,棕榈酸与油酸含量呈负相关,与亚油酸、亚麻酸呈极显著负相关;Guy等[85]发现芥酸含量对油酸含量有显著影响。
4.3环境及栽培因素对高油酸性状的影响
油酸是由一些主效基因控制的遗传性状(99%)[59],种子中的油酸含量在不同环境下均能稳定表达[86,87],高油酸性状表达是稳定的[72],同时还受到环境及栽培因素影响。
4.3.1O3对油酸含量的影响
Karine等[88]研究了对流层O3升高对春油菜(甘蓝型油菜品种)的影响,在一个开顶式气室进行了3年试验。在整个生长季节,每天有8 h,O3浓度比环境浓度增加20和40 ppb。结果显示:O3浓度对春油菜种子质量特性有影响,其中油酸含量显著降低。本实验室研究也发现低温处理会导致油酸减饱和反应的活性降低。
4.3.2栽培措施对油酸含量的影响
Baux等[89]发现,HOLL冬油菜品种产量低于常规品种,但与品比试验预期值接近,农民采用适当的栽培管理措施对决定油菜最终品质起到关键性作用。
本实验室发现,氮肥施用量与油酸含量负相关;在一定范围内,施用磷肥、钾肥有利于油菜油酸含量的提高,过量则降低油酸含量;硫肥施用量与油酸含量正相关[90]。
4.4生物学机制研究
4.4.1FAD2基因相关研究
FAD2基因是油酸合成的关键基因,提高油酸含量可通过降低油酸脱氢酶FAD2的活性来获得[35]。FAD2基因是功能保守的基因,各物种之间的序列具有较高的相似性[73]。
梁会娟等[91,92]构建了油菜FAD2基因的RNAi植物表达载体。Yang等[55]在高油酸亲本SW Hickory中BnaA.FAD2.a(LG A5)拷贝发现一个4 bp的插入,该突变造成开放阅读框的移码,最终导致提前终止密码子,属于一种新的高油酸等位基因。BnaA.FAD2.a基因在脂肪酸合成最为旺盛的种子发育中后期(14~25 d)表达量急剧上升,为营养生长时期的7~20倍。Suresha等[93]发现,FAD2基因表达量与早期的开花后15 d和晚期的开花后45 d种子发育阶段相比,开花后30 d表达量上升。低温处理下表达量提高1倍以上,而较高温度处理上升3倍以上。本实验室研究发现,油菜授粉后25~40 d为油酸形成期[94];利用近等基因系材料授粉后25 d种子构建了SSH文库,得到480个克隆,其中88个基因为油酸含量的上调基因,18个为下调基因,大部分基因与代谢和调控相关[95];构建了授粉后25 d种子的均一化文库,滴度为2.61×106cfu/mL,重组率100%,插入片段长度在800~2000 bp[96];从甘蓝型油菜中克隆了fad2基因一段2374 bp的上游序列,并用5-RACE技术确定了fad2基因的转录起始位点,通过启动子分析以及顺式作用元件分析,确定fad2基因的基本启动子在-220~-1 bp区域,还发现fad2基因启动子序列中含有一段1254 bp的内含子,该内含子序列中包含多个种子特异性表达特异性元件和植物激素响应元件,FAD2基因受脱落酸调控,在-538~-544 bp处的脱落酸响应元件使fad2基因在脱落酸的处理下提高了表达水平[97];克隆了1个FAD2拷贝基因,定位到C1染色体上,命名为BnFAD2-C1,其开放阅读框为1155 bp。采用RACE技术获得了175 bp的5′ UTR序列和212 bp的3′ UTR序列。采用荧光定量PCR检测发现,BnFAD2-C1在根、花和角果皮中仅保持本底水平的表达,在种子发育中期呈现高效表达,具有种子特异性诱导表达的特征,茉莉酸可能在BnFAD2-C1基因的表达过程中发挥一定的调控作用[98]。
此外,陈松等[99]发现,W-4的T2代单株的基因组含有一个T-DNA拷贝,T-DNA左边界序列完全整合到油菜基因组中,仅有1个碱基由G转换成了A,而右边界则缺失了包括RB border在内的62个碱基。陈松等[100]还比较了转基因高油酸油菜品系W-4的T5、T6和T7种子以及非转基因对照Westar种子中的脂肪酸组成,结果表明油菜种子中FAD2基因下调表达对种子的脂肪酸合成与积累影响较大,其不仅显著降低种子中多不饱和脂肪酸含量,增加油酸的含量;而且也显著降低饱和脂肪酸含量,并促进长链单烯酸的合成。
4.4.2FAD2基因拷贝数的研究
FAD2基因以多拷贝形式存在,不同拷贝之间在碱基序列和氨基酸序列上存在一定差异[66]。多拷贝现象对分子育种有不利影响,如在转基因植物中,插入外源基因的拷贝数过多,则会导致表达不稳定甚至转基因沉默现象[101,102]。相关研究如表4所示。

表4 油菜FAD2基因拷贝数的研究Table 4 Study about the number of fad2 gene copies of rapeseed
由表4可知,目前多认为油菜FAD2基因为多拷贝,但具体的拷贝数仍需进一步研究。
4.4.3基因芯片方面研究
本实验室采用基因芯片技术检测到差异表达基因562个,上调表达基因194个,下调表达基因368个,以基因芯片中油菜上调基因NM_100489和下调基因NM_130183为材料,用实时荧光定量方法验证基因芯片的结果,二者完全相符。丙酮酸激酶、果糖二磷酸、酰基传递/酰基ACP硫脂酶、作用于酯键的水解酶、Δ9硬脂酰-乙酰载体蛋白去饱和酶(ADS1)、Δ9酰基-油脂减饱和酶2(ADS2)、ω-3脂肪酸减饱和酶(FAD3)等被鉴定为差异表达基因。硬脂酸(18∶0)减饱和形成油酸的FAD1基因在表达时明显上调,可能在油酸合成中也发挥重要作用[106]。采用超表达方法研究发现,SAD(FAD1)和FAD3基因对油酸形成积累确有一定影响。
4.4.4蛋白质组学方面研究
本实验室还以湘油15号品种(对照)和高油酸油菜7 d幼苗为材料提取蛋白质,进行双向电泳分析,共发现277个差异点,126个点的差异在2~4倍之间,对其中50个点进行MALDI-TOF/TOF 4800串联质谱分析,42个差异点鉴定成功,分别为磷酸核酮糖羧化酶(23个)及其前体蛋白(4个)、黑芥子酶(2个)、ATP合酶亚基蛋白(4个)、叶绿体a/b结合蛋白(2个)及其它蛋白(7个),并对差异蛋白对应的基因(15个)进行荧光定量PCR验证,有4个基因的表达量在高油酸油菜幼苗中增加,3个降低[107];以一组高油酸油菜近等基因系自交授粉后20~35 d的种子为材料,分别进行了转录组和同位素相对标记与绝对定量技术分析,结合前人研究发现,基因表达或蛋白表达发生显著变化的基因gi|260505503(多聚半乳糖醛酸酶抑制蛋白)、gi|226346102(HSR203J类蛋白)和gi|470103214(钙调蛋白类)与抗病相关;而gi|297843222(结合蛋白)、gi|18397961(2-铁,2-硫-铁氧化还原类蛋白)、gi|196052306(还原型烟酰胺腺嘌呤二核苷酸脱氢酶亚基)、gi|18423437(还原型烟酰胺腺嘌呤二核苷酸脱氢酶(辅酶)1α-复形5)和gi|297794581(激酶家族蛋白)等基因为差异显著[108]。
5 高油酸油菜研究中的主要问题
5.1高油酸油菜育种研究进展缓慢
国内外双低油菜从育成到实现双低化均为10多年时间,而自1995年世界上第一个高油酸品种[11]问世至今,国外有报道的品种不足10个,国内目前也仅有一个新品种,进展较为缓慢。主要原因:①品种适应性、增产潜力还在进一步研究。②企业新产品的推出和广大市民对高油酸菜油认识的提高还需一定时间。③宣传不够。今后应从发展高油酸油菜有利于保障我国食用油安全,提高国民健康水平和企业产品提质等方面进行宣传。
5.2高油酸遗传改良途径有待进一步拓宽
目前培育高油酸油菜主要采用化学诱变方法,但也有研究表明,辐射[8]或太空诱变[30]方法也可得到性状稳定的高油酸油菜材料,这为诱变育种提供了新的思路。分子标记育种方法有RAPD标记、SNP标记、SSR标记和AFLP标记等。SNP标记被称为第三代DNA分子标记技术,有望成为最重要、最有效的分子标记技术,在分子育种中广泛应用。
5.3油菜高油酸生物学机理研究需进一步加强
目前多数研究认为,油菜高油酸性状遗传主要受基因型影响,为多个基因控制,甘蓝型油菜控制油酸性状的主效基因位于A5连锁群。但刘列钊等[30]在A5、C5连锁群上都发现了主效基因,可能是由于育种材料不同引起的。因此在今后的研究中也要综合考虑不同的材料。此外,高油酸遗传性状还受环境和栽培措施影响等方面的研究都还需进一步加强。
此外,油酸合成的关键基因的研究多集中在FAD2基因。FAD2基因为多拷贝,有一些拷贝是无功能的假基因,但具体拷贝数的多少及各个拷贝的功能仍需要进一步研究。
油脂的积累和脂肪酸的合成是一个庞大的网络,FAD2基因表达机理与很多因素有关,所以在继续探索FAD2基因的调控表达作用机理的同时,还要进一步研究十六碳烯酸、二十碳烯酸含量及芥酸含量对油酸含量积累的影响作用。
6 建议
(1)加快品种培育进程。要综合利用各种育种方法及分子标记技术,同时结合一些早期鉴定的方法辅助育种,加快育种进程。
(2)弄清油酸合成的分子机理。深入研究FAD2基因对油酸合成的调控作用,包括其拷贝数及每个拷贝的功能等;同时搞清其它脂肪酸合成对油酸的影响。
(3)利用各种新技术进行新基因发掘。充分利用即将完成的油菜基因组测序结果,采用基因组学和蛋白质组学新技术,研究基因表达谱变化情况,结合生物信息学分析,发掘出FAD2以外影响油酸合成的新基因。
(4)加快推广开发进程。种子管理部门要高度重视高油酸油菜发展,充分认识到高油酸油菜是油菜产业继双低油菜后的又一次新机遇;加大对高油酸油菜材料在区试等方面的支持力度,加快新品种的培育和审定及后续推广。
(5)坚持优质优价原则,提高农民种植积极性。在生产实践中,依照优质优价原则,适当提高高油酸油菜籽的收购价格,增加农民种植效益,提高其生产积极性,迅速扩大高油酸油菜种植面积,促进油菜产业进一步发展,提高我国食用油自给水平。
[1]Auld DL,Heikkinen MK,Erickson DA,et al.Rapeseed mutants with reduced levels of polyunsaturated fatty acids and increased levels of oleic acid[J].Crop Science,1992,32(3):657 -662.
[2]Rücker B,Röbbelen G.Impact of low linolenic acid content on seed yield of winter oilseed rape[J].Plant Breeding,1996,115:226-230.
[3]周永明.油菜品质遗传改良的进展和动态[J].国外农学—油料作物,1996(1):1-6.
[4]Jean P,Despeghel H,Busch CS,et al.欧洲第一个高油酸低亚麻酸冬油菜品种——“SPLENDOR”[A].12届国际油菜大会摘要集[C].武汉,2007.GP-2-13,GP-2-14.
[5]Guguin N,Lehman L,Richter A,et al.Breeding and development of HOLL winter oilseed rape hybrids[A].Proc 13thIntern Rapeseed Congress[C].Prague,Czech,2011.566-568.
[6]官春云.2004年加拿大油菜研究情况简介[J].作物研究,2005,19(3):123-125.
[7]Laura M,Wayne B,Phil S,et al.High oleic,low linolenic (HOLL) specialty canola development in Australia[A].The 12thInternational Rapeseed Congress[C].Wuhan,China,2007.22-24.
[8]官春云,刘春林,陈社员,等.辐射育种获得油菜(Brassicanapus)高油酸材料[J].作物学报,2006,32(11):1625-1629.
[9]杜海,郎春秀,王伏林,等.油菜种子油酸含量的遗传改良[J].核农学报,2011,25(6):1179-1183.
[10]张冬青.浙江省优质油菜育种进展[J].浙江农业科学,2015,56(5):650-654.
[11]Guan C,Chen S,Li X,et al.Preliminary report of breeding for high oleic acid content inBrassicanapus[A].Proceedings of International Symposium on Rapeseed Science[C].New York:Science Press,2001.
[12]Schierholt A,Becker HC,Ecke W.Mapping a high oleic acid mutation in winter oilseed rape (BrassicanapusL.)[J].Theoretical and Applied Genetics,2000,101(5-6):897-901.
[13]Gorlov SL,Bochkaryova EB,Efimenko SG,et al.Conventional breeding for high-oleic and low-linolenicBrassicanapusoil profile[A].Proc 13thIntern Rapeseed Congress[C].Prague,Czech,2011.584-585.
[14]Spasibionek S,Mikolajczyk K,Poplawska W,et al.Breeding of oilseed rape for new seed oil quality[A].Proc 13thIntern Rapeseed Congress[C].Prague,Czech,2011.569-572.
[15]Christian M,Beate R,Dieter S,et al.In vitro selection for oleic and linoleic acid content in segregating populations of microspore derived embryos ofBrassicanapus[J].Euphytica,2000,112:195-201.
[16]文雁成,鲁丽萍,张书芬,等.利用十字花科种间杂交创造甘蓝型油菜种质资源的研究[J].河南农业科学,2014,43(6):30-34.
[17]王敬乔,陈薇,曾黎琼,等.Δ12-脂肪酸去饱和酶基因(fad2)突变对油菜叶片表面结构和透性的影响[J].植物生理与分子生物学学报,2003,29(3):192-198.
[18]高建芹,浦惠明,龙卫华,等.高油酸甘蓝型油菜油酸积累动态[J].中国油料作物学报,2012,34(4):359-365.
[19]López Y,Nadaf HL,Smith OD,et al.Isolation and characterization of the △12-fatty acid desaturase in peanut (ArachishypogaeaL.) and search for polymorphisms for the high oleate trait in Spanish market-type lines[J].Theor Appl Genet,2000,101:1131-1138.
[20]张宏军,肖钢,谭太龙,等.EMS处理甘蓝型油菜(Brassicanapus)获得高油酸材料[J].中国农业科学,2008,41(12):4016-4022.
[21]Hu X,Sullivan-Gilbert M,Gupta M,et al.Mapping of the loci controlling oleic and linolenic acid contents and development offad2 andfad3 allele-specific markers in canola (BrassicanapusL.)[J].Theor Appl Genet,2006,113:497-507.
[22]Tanhuanpää P,Vilkki JP,Vihinen M.Mapping and cloning ofFAD2 gene to develop allele-specific PCR for oleic acid in spring turnip rape (Brassicarapassp.oleifera)[J].Mol Breed,1998,4:543-550.
[23]黄永娟,张凤启,杨甜甜,等.EMS诱变甘蓝型油菜获得高油酸突变体[J].分子植物育种,2011,9(5):611-616.
[24]Barro F,Escobar JF,Vega MDL,et al.Doubled haploid lines ofBrassicacarinatawith modified erucic acid content through mutagenesis by EMS treatment of isolated microspores[J].Plant Breeding,2001,120:262-264.
[25]Rücker B,Röbbelen G.Development of high oleic acid rapeseed[A].Proc 9th Intern Rapeseed Congress[C].Cambridge,UK,1995.389-391.
[26]Rücker B,Röbbelen G.Mutants ofBrassicanapuswith altered seed lipid fatty acid composition[A].Proc 12thInt Symp Plant Lipids[C].Dordrecht,Kluwer Academic Publishers,1997.316-318.
[27]Spasibionek S.New mutants of winter rapeseed (BrassicanapusL.) with changed fatty acid composition[J].Plant Breeding,2006,125:259-267.
[28]官春云.油菜高油酸遗传育种研究进展[J].作物研究,2006,20(1):1-8.
[29]和江明,王敬乔,陈薇,等.用EMS诱变和小孢子培养快速获得甘蓝型油菜高油酸种质材料的研究[J].西南农业学报,2003,16(2):34-36.
[30]刘列钊,王欣娜,阎星颖,等.航天诱变高油酸甘蓝型油菜突变体分子标记的筛选[J].中国农业科学,2012,45(23):4931-4938.
[31]Hernandez ML,Mancha M,Martinez-Rivas JM. Molecular cloning and characterization of genes encoding two microsomaI oleate desaturases (FAD2) from olive[J].Phytochemistry,2005,66(12):1417-1426.
[32]张振乾,肖钢,谭太龙,等.高油酸油菜研究进展及其前景展望[J].作物杂志,2009(5):1-6.
[33]Stoutjesdijk PA,Singh SP,Liu Q,et al.HpRNA-mediated targeting of theArabidiosisFAD2 gene gives highly efficient and stable silencing[J].Plant Physiology,2002,129:1723-1731.
[34]张秀英,皇甫海燕,陈菁菁,等.高油酸油菜的研究进展及前景[J].作物研究,2007,21(5):654-656,661.
[35]Hitz WD,Yadav NS,Reiter RS,et al.Reducing polyunsaturation in oils of transgenic canola and soybean[A].In:Kader JC,Mazliak P.Plant Lipid Metabolism[C].Dordrecht:Kluwer Academic Publishers,1995.506-508.
[36]Töpfer R,Martini N,Schell J.Modifications of lipid synthesis[J].Science,1995,268:681-686.
[37]Jung JH,Kim H,Go YS,et al.Identification of functionalBrFAD2-1 gene encoding microsomal delta-12 fatty acid desaturase fromBrassicarapaand development ofBrassicanapuscontaining high oleic acid contents[J].Plant Cell Rep,2011,30(10):1881-1892.
[38]董娜,林良斌,马占强.农杆菌介导反义油酸脱饱和酶基因转化甘蓝型油菜[J].分子植物育种,2004,2(5):655-659.
[39]Stoutjesdijk PA,Hurlestone C,Singh SP,et al.High-oleic acid AustralianBrassicanapusandB.junceavarieties produced by co-suppression of endogenous Δ12-desaturases[J].Biochem Trans,2000,28(6):938-940.
[40]陈松,张洁夫,陈锋,等.甘蓝型油菜种子特异性表达fad2基因的ihpRNA载体构建[J].中国油料作物学报,2006,28(3):251-256.
[41]陈松,浦惠明,张洁夫,等.农杆菌介导法将fad2基因的ihpRNA表达框转入甘蓝型油菜[J].江苏农业学报,2008,24(2):130-135.
[42]陈松,浦惠明,张洁夫,等.转基因高油酸甘蓝型油菜新种质的获得[J].江苏农业学报,2009,25(6):1234-1237.
[43]陈苇,李劲峰,董云松,等.甘蓝型油菜Fad2基因的RNA干扰及无筛选标记高油酸含量转基因油菜新种质的获得[J].植物生理与分子生物学学报,2006,32(6):665-671.
[44]杜海.油菜种子脂肪酸组成的遗传调控及转基因油菜脂肪酸含量异交稳定性研究[D].杭州:浙江师范大学硕士学位论文,2012.
[45]陈菁菁.用RNA干扰的方法对甘蓝型油菜油酸相关基因的功能的研究[D].长沙:湖南农业大学硕士学位论文,2010.
[46]刘睿洋.甘蓝型油菜FAD2、FAD3、FATB基因共干扰载体的构建及其遗传转化[D].长沙:湖南农业大学硕士学位论文,2012.
[47]彭琦,张源,双桑,等.甘蓝型油菜FAD2与FAE1基因双干扰RNAi载体的构建[J].生物技术通报,2007(5):163-166.
[48]Peng Q,Hu Y,Wei R,et al.Simultaneous silencing ofFAD2 andFAE1 genes affects both oleic acid and erucic acid contents inBrassicanapusseeds[J].Plant Cell Rep,2009,29:317-325.
[49]Laga B,Seurinck J,Verhoye T,et al.Molecular breeding for high oleic and low linolenic fatty acid composition inBrassicanapus[J].Pflanzenschutz-Nachrichten Bayer,2004,57:87-92.
[50]Tanhuanpää P,Vilkki JP,Vilkki HJ.Mapping of a QTL for oleic acid concentration in spring turnip rape (Brassicarapassp.oleifera)[J].Theor Appl Genet,1996,92:952-956.
[51]Sharma R,Aggarwal RAK,Kumar R,et al.Construction of an RAPD linkage map and localization of QTLs for oleic acid level using recombinant inbreds in mustard (Brassicajuncea)[J].Genome,2002,45:467-472.
[52]Javidfar F,Ripley VL,Roslinsky V,et al.Identification of molecular markers associated with oleic and linolenic acid in spring oilseed rape (Brassicanapus)[J].Plant Breeding,2006,125:65-71.
[53]Tanhuanpää P,Vilkki J.Marker-assisted selection for oleic acid content in spring turnip rape[J].Plant Breeding,1999,118:568-570.
[54]Falentin C,Brégeon M,Lucas MO,et al.Identification of fad2 mutations and development of Allele-Specific Markers for High Oleic acid content in rapeseed (BrassicanapusL.)[A].Biotechnology:Gene Cloning and Functional Analysis[C].Science Press USA Inc,2007.117-119.
[55]Yang QY,Fan CC,Guo ZH,et al.Identification ofFAD2 andFAD3 genes inBrassicanapusgenome and development of allele-specific markers for high oleic and low linolenic acid contents[J].Theor Appl Genet,2012,125:715-729.
[56]王欣娜.甘蓝型油菜高油酸分子标记的筛选[D].重庆:西南大学硕士学位论文,2012.
[57]陈伟,范楚川,钦洁,等.分子标记辅助选择改良甘蓝型油菜种子油酸和亚麻酸含量[J].分子植物育种,2011,9(2):190-197.
[58]Zhao J,Dimov Z,Becker HC,et al.Mapping QTL controlling fatty acid composition in a doubled haploid rapeseed population segregating for oil content[J].Mol Breeding,2008,21:115-125.
[59]Smooker AM,Wells R,Morgan C,et al.The identification and mapping of candidate genes and QTL involved in the fatty acid desaturation pathway inBrassicanapus[J].Theor Appl Genet,2011,122(6):1075-1090.
[60]杨燕宇,杨盛强,陈哲红,等.无芥酸甘蓝型油菜十八碳不饱和脂肪酸含量的QTL定位[J].作物学报,2011,37(8):1342-1350.
[61]陈哲红.甘蓝型油菜油酸性状的遗传与QTL定位[D].长沙:湖南农业大学硕士学位论文,2009.
[62]张浩文.甘蓝型油菜高油酸分子标记辅助育种[D].长沙:湖南农业大学硕士学位论文,2012.
[63]Lionneton E,Ravera S,Sanchez L,et al.Development of an AFLP-based linkage map and localization of QTLs for seed fatty acid content in condiment mustard (Brassicajuncea)[J].Genome,2002,45:1203-1215.
[64]Yan XY,Li JN,Wang R,et al.Mapping of QTLs controlling content of fatty acid composition in rapeseed (Brassicanapus)[J].Genes Genom,2011,33:365-371.
[65]Burns MJ,Barnes SR,Bowman JG,et al.QTL analysis of an intervarietal set of substitution lines inBrassicanapus:(i) Seed oil content and fatty acid composition[J].Heredity,2003,90:39-48.
[66]肖钢,张宏军,彭琪,等.甘蓝型油菜油酸脱氢酶基因(fad2)多个拷贝的发现及分析[J].作物学报,2008,34(9):1563-1568.
[67]Schierholt A,Rucker B,Becker HC.Inheritance of high oleic acid mutations in winter oilseed rape (BrassicanapusL.)[J].Crop Sci,2001,41:1444-1449.
[68]Möllers C,Schierholt A.Genetic variation of palmitate and oil content in a winter oilseed rape doubled haploid population segregating for oleate content[J].Crop Sci,2002,42:379-384.
[69]索文龙,戚存扣.甘蓝型油菜油酸含量的主基因+多基因遗传分析[J].江苏农业学报,2007,23(5):396-400.
[70]费维新,陈凤祥,李强生,等.甘蓝型油菜高油酸材料的正反交遗传研究[J].安徽农业科学,2007,35(7):1927,1929.
[71]伍新玲.利用诱变技术改良油菜脂肪酸组成及油酸含量遗传研究[D].武汉:华中农业大学硕士学位论文,2004.
[72]Schierhoft A,Becker HC.Enviromental variability and heritability of high oleic acid content in winter oilseed rape (BrassicanapusL.)[J].Plant Breeding,2001,120:63-66.
[73]马霓.高油酸的甘蓝型油菜与诸葛菜属间杂交新材料的细胞学和遗传学研究[D].武汉:华中农业大学硕士学位论文,2006.
[74]Velasco L,Nabloussi A,De Haro A,et al.Development of high-oleic,low-linolenic acid Ethiopian-mustard (Brassicacarinata) germplasm[J].Theor Appl Genet,2003,107:823-830.
[75]周银珠.甘蓝型油菜油酸和亚麻酸的遗传分析及油酸与部分农艺及品质性状的通径分析[D].重庆:西南大学硕士学位论文,2011.
[76]阎星颖.甘蓝型油菜油脂QTL定位及油酸脱氢酶FAD2基因的克隆和分子进化[D].重庆:西南大学博士学位论文,2012.
[77]申爱娟,陈松,周晓婴,等.转基因甘蓝型油菜品系W-4高油酸性状遗传分析[J].江苏农业学报,2013,29(2):261-265.
[78]官梅,李栒.油菜(Brassicanapus)油酸性状的遗传规律研究[J].生命科学研究,2009,13(2):152-157.
[79]费维新,吴新杰,李强生,等.甘蓝型油菜高油酸材料的遗传分析[J].中国农学通报,2012,28(1):176-180.
[80]尚国霞.甘蓝型油菜高油酸性状的遗传研究及近红外检测模型的建立[D].重庆:西南大学硕士学位论文,2010.
[81]Leonardo V,Jose M,Fernandez-Martinez,et al.Inheritance of increased oleic acid concentration in high erucic acid Ethiopian Mustard[J].Crop Science,2003,43:106-109.
[82]官梅,李栒.高油酸油菜品系农艺性状研究[J].中国油料作物学报,2008,30(1):25-28.
[83]张振乾,谭敏,肖钢,等.高油酸油菜近等基因系材料的比较研究[J].生物学杂志,2015(4):20-24.
[84]Antje S,Heiko CB.Influence of oleic acid content on yield in winter oilseed rape[J].Crop Sci,2011,51(5):1973-1979.
[85]Guy CB,Tony RL,Ian AG,et al.Novel insights into seed fatty acid synthesis and modification pathways from genetic diversity and quantitative trait loci analysis of theBrassicaC genome[J].Plant Physiology,2007,144:1827-1842.
[86]Schierholt A,Becker HC.Genetic and environmental variability of high oleic acid content in winter oilseed rape[A].The 10th International Rapeseed Congress[C].Canberra,Australia,1999.
[87]Gurpreet K,Banga SK,Banga SS.Introgression of desaturation suppressor gene(s) fromBrassicanapusL.To enhance oleic acid content inBrassicajunceaL.Coss[A].Proceedings of the 4th International Crops Science Gongress[C].Australia,2004.
[88]Karine V,Maarten DB,Nele H,et al.Ozone effects on yield quality of spring oilseed rape and broccoli[J].Atmospheric Environment,2012,47:76-83.
[89]Baux A,Sergy P,Pellet D.Pilot production of High-oleic low-linolenic(HOLL)winter oilseed rape in Switzerland[A].Proceedings of the 12thInternational Crops Science Congress[C].AGRONOMY:Cultivation 2007.151-154.
[90]谭太龙,徐一兰,张宏军.栽培因子对油菜油酸含量的影响[J].湖南农业科学,2009(6):41-43.
[91] 梁会娟,苗丽娟,曹刚强,等.甘蓝型油菜Δ12-油酸去饱和酶基因RNAi载体的构建[J].河南农业科学,2006(6):36-41,46.
[92] 梁会娟,曹刚强,苗利娟,等.根癌农杆菌介导的fad2RNA干扰体基因转化甘蓝型油菜的研究[J].河南农业科学,2007(1):34-38.
[93] Suresha GS,Rai RD,Santha IM.Molecular cloning,expression analysis and growth temperature dependent regulation of a novel oleate desaturase gene (fad2) homologue fromBrassicajuncea[J].Australian Journal of Crop Science,2012,6(2):296-308.
[94] Peng Q,Hu Y,Du PF,et al.Construction of SSH library with different stages of seeds development inBrassicanapusL.[J].Acta Agronomica Sinica,2009,35(9):1576-1583.
[95] Xiao G,Wu XM,Guan CY.Identification of differentially expressed genes in seeds of twoBrassicanapusmutant lines with different oleic acid content[J].African Journal of Biotechnology,2009,8(20):5155-5162.
[96] Zhang ZQ,Xiao G,Liu RY,et al.Efficient construction of a normalized cDNA library of the high oleic acid rapeseed seed[J].African Journal of Agricultural Research,2011,6(18):4288-4292.
[97] Xiao G,Zhang ZQ,Yin CF,et al.Characterization of the promoter and 5-UTR intron of oleic acid desaturase (FAD2) gene inBrassicanapus[J].Gene,2014,545(1):45-55.
[98] 刘芳,刘睿洋,彭烨,等.甘蓝型油菜BnFAD2-C1基因全长序列的克隆、表达及转录调控元件分析[J].作物学报,2015,41(11):1663-1670.
[99] 陈松,张洁夫,浦惠明,等.转基因高油酸油菜T-DNA插入拷贝数及整合位点分析[J].分子植物育种,2011,9(1):17-24.
[100] 陈松,彭琦,高建芹,等.转基因高油酸油菜株系W-4种子脂肪酸组成[J].中国油料作物学报,2015,37(2):129-133.
[101] Iyer LM,Kumpatla SP,Chandrasekharan MB,et al. Transgene silencing in monocots[J].Plant Mol Biol,2000,43(2-3):323-346.
[102] Vaucheret H,Béclin C,Elmayan T,et al.Transgene-induced gene silencing in plant[J].Plant J,1998,16(6):651-659.
[103] Lee KR,Sohn SI,Jung JH,et al.Functional analysis and tissue-differential expression of fourFAD2 genes in amphidiploidBrassicanapusderived fromBrassicarapaandBrassicaoleracea[J].Gene,2013,531:253-262.
[104] Scheffler JA,Sharpe AG,Schmidt H,et al.Desaturase multigene families ofBrassicanapusarose through genome duplication[J].Theor Appl Genet,1997,94:583-591.
[105] Suresha GS,Santha IM.Molecular cloning and in silico analysis of novel oleate desaturase gene homologues fromBrassicajunceathrough sub-genomic library approach[J].Plant Omics Journal,2013,6(1):55-64.
[106] Guan M,Li X,Guan CY.Microarray analysis of differentially expressed genes betweenBrassicanapusstrains with high- and low-oleic acid contents[J].Plant Cell Rep,2012,31:92.
[107] Zhang ZQ,Xiao G,Liu RY,et al.Proteomic analysis of differentially expressed proteins between Xiangyou 15 variety and the mutant M15[J].Front Biol,2014,9(3):234-243.
[108] 张振乾,肖钢,官春云,等.转录组及iTRAQ技术分析高油酸油菜抗病相关基因[J].华北农学报,2015(5):16-24.
Present Research Situation,Questions and Developmental Advises of High Oleic Acid Rapeseed
ZHANG Zhenqian,HU Qingyi,GUAN Chunyun*
(College of Agronomy,Hunan Agricultural University,Changsha,Hunan 410128,China)
High oleic acid rapeseed oil has very good nutrition and health functions,and its quality can be comparable with the camellia oil,olive oil and other senior edible vegetable oil,which is helpful to increase the edible vegetable oil supply of China and promote the upgrading of the rape industry.The study trend and application situation of Hunan Agricultural University and the other domestic and foreign research institutions were summarized in this paper.At the same time,the genetic characteristics of oleic acid,high oleic acid rapeseed breeding (microspore culture,distant hybridization,induced and transgenic technology),advances of high oleic acid rapeseed breeding by different methods (such as,microspore culture,distant hybridization,mutation and transgenic technology),and the molecular biology research were summarized.In addition,several advices were proposed according to the currently existing questions.
rapeseed;high oleic acid;genetic;breeding
2016-01-20
张振乾(1977-),男,博士,副教授,Email:zzq770204@163.com。*通信作者:官春云,教授,博士生导师,从事油菜育种、栽培研究。
国家自然科学基金(31201240);国家863计划项目(2012AA101107-3);湖南省科技重大专项(2014FJ1006);湖南农业大学作物学开放基金(ZWKF201502)。
S565.403.2
A
1001-5280(2016)04-0462-13
10.16848/j.cnki.issn.1001-5280.2016.04.27
