西瓜不同类型样品的DNA提取研究
2016-09-13王吉明尚建立马双武徐永阳
王吉明,尚建立,李 娜,马双武,徐永阳
(中国农业科学院郑州果树研究所 郑州 450009)
DNA是遗传物质的重要信息载体,DNA提取的数量及质量与PCR扩增、限制性酶切、Southern杂交、测序等分子生物学研究密切相关[1]。在西瓜研究中通常从真叶中提取DNA[2-4],以满足SSR、SRAP等分子标记的需求。西瓜种子是最常见和易获得的样品材料之一,但很少直接用于DNA提取,仅国外有从西瓜种子中提取DNA的报道[5]。在实际研究和工作中为了提高效率,可能需要对现有的特定类型西瓜样品进行DNA提取,如进行种子纯度分子标记检测时,若能从种子样品中提取DNA,而不必播种育苗后从真叶提取DNA,可以缩短鉴定时间1周以上,对于快速实现种子纯度检测具有重要意义。为此笔者以西瓜种子、下胚轴、子叶、种芽(下胚轴+子叶)、新鲜真叶和干燥真叶6种不同类型样品为试验材料,比较不同类型样品的DNA提取数量和质量,并对提取的DNA进行dCAPS扩增和酶切,判断不同类型西瓜样品中提取的DNA在分子生物学研究中的应用价值,为合理利用西瓜样品材料提供研究依据。
1 材料与方法
1.1 材料
试验于2016年3—7月在中国农业科学院郑州果树研究所进行,以来自国家西瓜甜瓜中期库的西瓜种质资源父本‘14CB11’(感枯萎病)、母本‘Sugarlee’(抗枯萎病)及杂交F1为研究材料,种子经过25℃清水浸种24 h后用棉布包裹,于32℃条件下恒温催芽48 h,然后播种于营养钵中育苗,取催芽前备份的单粒种子,以及催芽或育苗后的下胚轴、种芽(下胚轴+子叶)、子叶、新鲜真叶各0.05 g为材料,另取0.05 g新鲜真叶置于国家西瓜甜瓜中期库种质保存冷库中(5℃,40%相对湿度)放置72 h后脱水为干燥真叶,一起用于DNA提取研究。
1.2 DNA提取
采用天根DNA提取试剂盒[由天根生化科技(北京)有限公司生产]进行提取,提取方法参照天根DNA提取试剂盒操作说明书的操作步骤并略加改进,改进地方为将操作步骤第4步的GP2替换为预冷的0.7倍体积异丙醇,以增加DNA析出产量。
1.3 DNA检测
采用 Nano Drop 1000(Thermo Scientific)微量紫外分光光度计对提取的DNA进行检测,对提取DNA的含量、OD260/280值和OD260/230值进行测量和计算,同一类型样品提取DNA的检测结果计算平均值。
1.4 dCAPS扩增
采用2×Taq Master Mix(北京百泰客生物技术有限公司生产)进行PCR反应,反应体系为25μL,包括 2×Taq Master Mix 12.5μL,模板 DNA 2.0μL,10 μmol·μL-1上、下游混合引物 2.0 μL,ddH2O 8.5μL;扩增反应程序为94℃预变性5 min;94℃20 s,55℃ 20 s,72℃ 30 s,34个循环;72℃延伸5 min;4℃保存。
dCAPS引物为国内公开发表的抗枯萎病生理小种1紧密连锁的dCAPS标记502124_fon[6],该标记引物信息如下:
上游引物序列为5′-AACACCACCCACTTTG⁃GAGCTTCG-3′,下游引物序列为 5′-TTTTAGGGT⁃GAAAATGGGTATTGTA-3′,由生工生物工程(上海)股份有限公司合成。
1.5 dCAPS酶切
dCAPS产物采用内切酶Taq I进行酶切,酶切识别位点为 T’CGA,酶切体系为:10×Buffer 1.5 μL,限制内切酶1.0μL;dCAPS扩增产物5.0μL,ddH2O 7.5μL,总体系为15.0μL。酶切程序为:65℃条件下酶切16 h,80℃条件变性20 min,4℃保存,Taq I来自Fermentas公司。
1.6 电泳
扩增/酶切产物采用8.0%非变性聚丙烯酰胺电泳,280 V恒定电压下电泳50 min,银染染色,拍照分析,以判断不同类型样品中提取的DNA的dCAPS扩增和酶切效果。
dCAPS产物酶切后电泳出116 bp条带判定为感病纯合基因型,出现单条带94 bp为抗病纯合基因型,同时出现116 bp和94 bp 2条带为抗病杂合基因型。
2 结果与分析
2.1 不同类型样品DNA提取结果
采用改进的试剂盒提取方法均可以不同类型的西瓜样品中提取出DNA,其中新鲜真叶和干燥真叶提取的DNA质量浓度最大,分别为 1 130.18、1 039.74 ng·μL-1,二者比较接近,表明西瓜真叶经过低温干燥后对DNA的提取量影响不大;子叶、下胚抽、种芽稍低,质量浓度分别为434.33、406.21、428.98 ng·μL-1,而种子中提取的DNA 质量浓度最低,为 55.08 ng·μL-1。

表1 不同类型西瓜样品提取DNA的检测结果
2.2 不同类型样品提取DNA的dCAPS扩增及酶切
全部样品中提取的DNA均可扩增出条带,电泳背景干净,条带清晰,大小在116 bp附近,与该引物开发的信息相符,表明采用改进的DNA试剂盒提取方法从西瓜种子、子叶、下胚轴、种芽、新鲜真叶和干燥真叶提取的DNA可以满足dCAPS扩增的需求,提取的DNA样品中残留的RNA和盐分对dCAPS扩增没有明显的影响(图1)。
酶切结果表明,感病母本的dCAPS扩增产物被酶切成94 bp,抗病父本的dCAPS扩增产物未被酶切,而杂交1代扩增产物出现了94 bp和116 bp的共显性条带,各类型样品提取的DNA扩增产物酶切正常,酶切片段大小一致,表明不同类型样品中提取的DNA可以满足dCAPS酶切的需求。
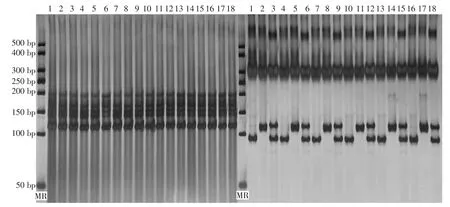
图1 西瓜不同类型样品中提取DNA的d Caps扩增与酶切结果
3 讨论与结论
笔者采用改进的DNA试剂盒提取法对西瓜种子、下胚轴、子叶、种芽、新鲜真叶和干燥真叶共6种样品进行了DNA提取,结果表明从各样品中均可有效提取DNA,但提取的DNA质量浓度相差比较大,如从真叶提取的DNA质量浓度在1 130 ng·μL-1左右,而从种子中提取的DNA质量浓度仅为55 ng·μL-1左右,2者相差20倍左右,出现这种情况是否与样品中DNA含量差异或提取效率有关,有待于进一步研究。
利用种子提取 DNA 已经在棉花[7-10]、大豆[1,11-13]、玉米[14-17]、水稻[18-19]和小麦[20-21]等作物上实现,在同为葫芦科园艺作物的甜瓜上也有从种子中提取DNA的报道[22]。西瓜种子富含氨基酸和脂肪酸[23],可能会对DNA提取有不利影响,笔者曾采用常规的CTAB法和SDS法进行过多次提取,均无法有效提取DNA,而本研究采用改进的DNA试剂盒提取法成功地从西瓜种子中提取出DNA,表明从西瓜种子中提取DNA有较大的改进和提高的空间。
dCAPS扩增涉及错配碱基的扩增,对DNA质量要求较高,笔者在dCAPS操作中曾发现,提取的DNA在4℃冰箱中保存一段时间后虽然能够扩增出条带,但扩增产物却无法被酶切出目的条带,笔者用改进的DNA试剂盒提取法使用了吸附柱,能够通过吸附作用进一步去除杂质,提高DNA的质量,所提取的DNA可以满足dCAPS扩增及酶切的需求,根据本研究结果,按照研究目的和具体的试材条件,可以选择从种子到种芽、育苗和瓜苗生长过程中的任一样品提取DNA用于西瓜分子生物学的研究。
