柽柳液泡膜微囊蛋白的分离
2016-09-13杨桂燕赵玉琳郭宇聪高彩球
杨桂燕 赵玉琳 郭宇聪 赵 震 高彩球
(1.林木遗传育种国家重点实验室(东北林业大学),黑龙江 哈尔滨 150040;2.西北农林科技大学林学院,核桃研究中心,陕西 杨凌 712100)
柽柳液泡膜微囊蛋白的分离
杨桂燕1,2赵玉琳1郭宇聪1赵震1高彩球1
(1.林木遗传育种国家重点实验室(东北林业大学),黑龙江 哈尔滨 150040;2.西北农林科技大学林学院,核桃研究中心,陕西 杨凌 712100)
采用差速离心和不连续蔗糖密度梯度离心法分离和纯化柽柳液泡膜微囊,通过western杂交对获得的微囊蛋白进行检测,获得ThVHAc1蛋白目的条带,表明分离的液泡膜微囊中含有有效的V-ATPase成分,进一步测定液泡膜微囊对NaNO3、Na3VO3、NaN3的敏感性及V-ATPase的水解活性和翻转比例。结果表明:液泡膜微囊主要分布在0~25%蔗糖梯度界面上,且研磨法提取液泡膜微囊具有较高的水解活性和较大的原位比例,表明液氮研磨结合差速离心及不连续蔗糖密度梯度离心法能有效提取柽柳液泡膜微囊。
刚毛柽柳;液泡膜;V-ATPase;翻转比例
植物H+-ATPase对植物离子运输起重要作用,主要包括分布于细胞质膜上的P-ATPase、分布于叶绿体内类囊体膜和线粒体内膜上F-ATPase及分布于液泡膜上的V-ATPase[1]。其中,F-ATPase在其发挥作用过程中主要利用跨膜质子电化学势实现,而P-ATPase和V-ATPase主要利用ATPase水解产生的能量来驱动跨膜质子运动[2]。
V-ATPase是具有复杂结构和多亚基的复合蛋白,最基本的功能是维持细胞质内的酸碱性内平衡状态(pH内稳态)和建立跨膜电化学梯度,为相关的代谢提供能量[3-4]。当植物处于胁迫条件时,V-ATPase在调控过程中的作用具有复杂性和多样性,这不仅体现在V-ATPase本身的结构,也体现在其各个亚基的变化和调控上[5-6]。Yamaguchi等[7]认为,盐胁迫下液泡对Na+的运输是通过液泡中的次级Na+/H+反向转运蛋白(Na+/H+antiporter,NHX)进行的,而Na+/H+反向转运的能量由液泡V-ATPase驱动的质子动力提供。进而,Dietz等[8]认为,植物耐盐的首要条件和特征是V-ATPase基因响应盐胁迫而进行的表达能力,在盐胁迫下V-ATPase通过改变自身结构、状态及在植物体内的数量来适应环境的改变,从而抵抗盐胁迫伤害。因此,对V-ATPase在逆境应答调控中的作用研究,将有助于深入了解植株的抗逆机理。
V-ATPase在植物液泡膜广泛分布,是一类对硝酸盐敏感,而对钒酸盐、叠氮钠不敏感的酶,因此能通过相应的抑制剂来测定V-ATPase的活性[9]。而对V-ATPase进行研究的首要条件是分离获得含有V-ATPase的液泡膜微囊蛋白。早年於丙军等[10]用不连续蔗糖和葡聚糖分别分离大麦(Hordeumvulgare)幼根的细胞质膜和液泡膜微囊,结果使用蔗糖梯度离心获得的液泡膜微囊的翻转比例稍高于葡聚糖。后来Ma等[11]和刘群录等[11-12]将葡萄糖梯度设置在0~25%和25%~50%进行梯度离心分离胡杨(Populuseuphratica)液泡膜微囊,表明液泡膜微囊主要分布在0~25%蔗糖梯度层面上,且分析表明捣碎法较研磨和超声波破碎细胞获得的液泡膜微囊正向比例较高、封闭性好。因此后续大多分离液泡膜微囊的方法都在此基础上进行修改和应用。
柽柳(Tamarixchinensis)是广泛分布于干旱、半干旱地区的一种抗旱耐盐碱植物,是进行抗逆机制研究的理想材料[13]。为了研究柽柳液泡膜V-ATPase在其抗逆调控过程中的作用机理,本研究根据上述方法进行液泡膜微囊分离,以期确定柽柳液泡膜微囊分离的方法,为后续研究奠定基础。
1 材料与方法
1.1植物材料处理
刚毛柽柳(Tamarixhispida):培植于东北林业大学校林场,8年生;2013年4月取其枝条扦插,培养于温度24 ℃、相对湿度65%~75%,光照为天然光照周期的塑料大棚中。5个月后取扦插苗的根和叶用于试验。
1.2液泡膜微囊分离
使用液氮研磨法破碎柽柳根和叶细胞,利用Beckman 32Ti 80 000、100 000、160 000 g梯度离心和质量体积分数0~25%、25%~50%蔗糖梯度离心法进行液泡膜分离[12]。
1.3Western杂交检测提取蛋白
Alyn正在经营摄影讲习班,为想要拍摄星星的摄影爱好者服务,他还应邀撰写一本书。同时,他出售自己制作的Lightroom预设,这些预设设计可以为需要编辑和增强天文摄影效果的摄影师提供结构化的工作流程。这些预设(售价约合人民币180元,网址www. alynwallacephotography.com)提供了独到的降噪算法,使星星从黑暗的夜空中凸显出来,还有锐化、增强色彩层次等更多功能。他下一步尝试为星空摄影师开发滤镜并投入市场(参见12页),他的摄影包里有制造商提供的多个版本,目前正在试用阶段。
使用二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒对膜蛋白浓度进行测定。取40 μg膜蛋白,20 μL loading buffer,加水至40 μL,98 ℃ 5 min,14 000 r/min离心5 min;在浓度为15%的分离胶进行SDS-PAGE电泳80 V 1 h,120 V 1 h[11, 14-15]和western blotting验证[11,16]。转膜前,膜于甲醇中浸泡30 s至1 min,再在转膜缓冲液中泡2 min。一抗为ThVHAc1蛋白抗体,是根据V-ATPase c 亚基蛋白序列在上海艾比马特公司合成(Abmart Inc,Shanghai)。二抗为AHA3(bs-2 247r),购自北京博奥森生物有限公司(Bioss,Beijing)。
1.4水解活性和翻转比例测定
根据Ma、刘群录等的方法,通过测定在ATPase水解活性测定溶液中加或不加体积分数为0.012 5的TrionX-100的水解活性计算翻转比例[11-12,17]。
1.5数据分析
试验数据分析使用SPSS软件。
2 结果与分析
2.1Western 杂交分析获得的膜微囊蛋白
ThVHAc1为柽柳V-ATPase的重要亚基基因,为了鉴定是否成功分离获得液泡膜微囊蛋白,制备ThVHAc1蛋白抗体,利用western blotting测定分离获得的柽柳地上部分和根部的膜微囊蛋白,结果见图1。
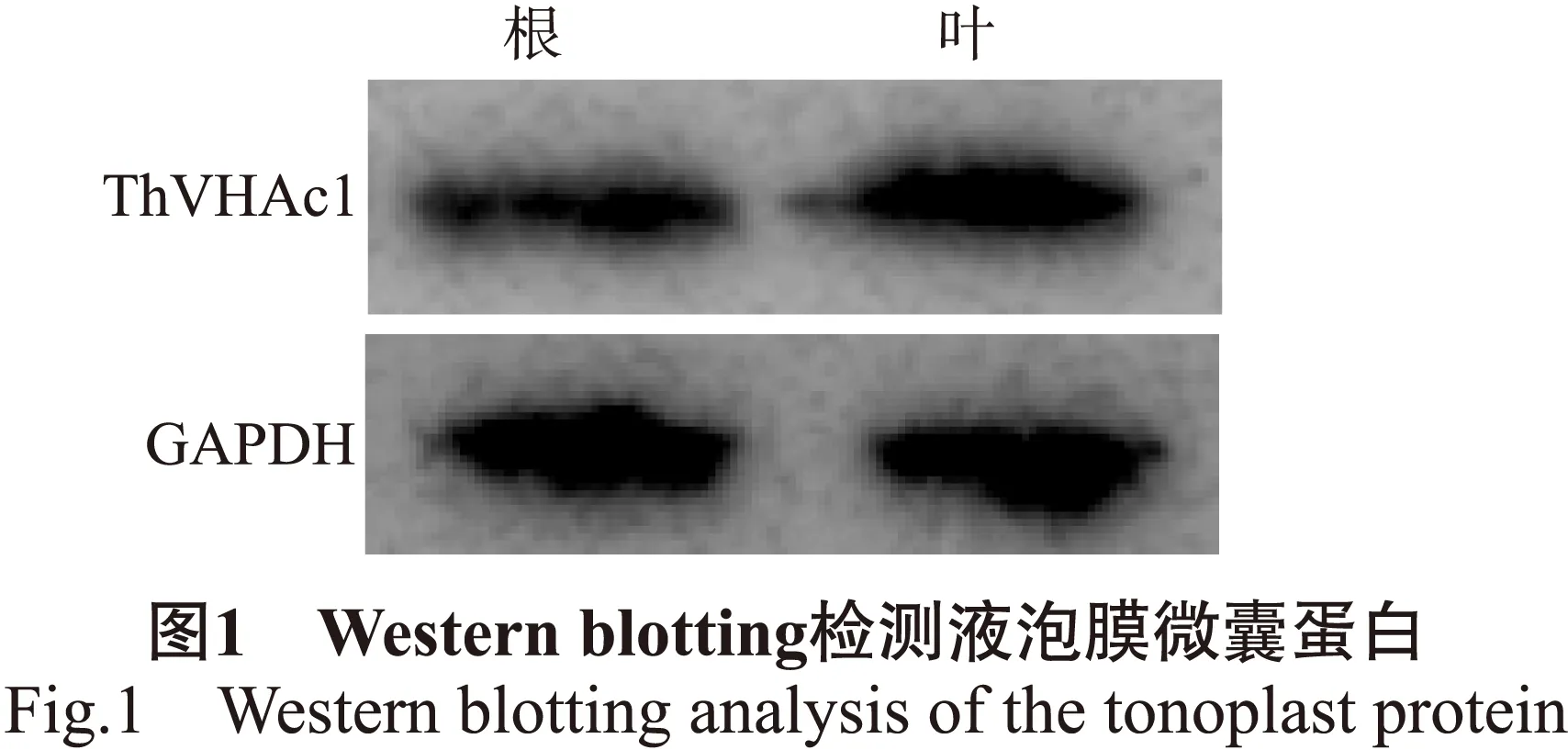
图1结果显示:2种膜微囊蛋白与抗体杂交后均具有明显条带(GAPDH为内参蛋白)。表明分离的柽柳液泡膜微囊蛋白中含有较高成分的V-ATPase,可以用于后续的酶活性相关测定。
2.2抑制剂的选择及水解活性
液泡膜V-ATPase水解活性通过释放的无机磷含量表示。通过向不同蔗糖界面分离的蛋白中加入不同的抑制剂后,测定水解活性可以获得V-ATPase的分布。加TritonX-100的水解活性测定结果见表1,设置不加抑制剂时的水解活性为100。

表1 不同抑制剂处理下的ATPase水解活性
注:V-ATPase、P-ATPase、F-ATPase的抑制剂分别为NaNO3、Na3VO3、NaN3。
表1结果显示,加入3种抑制剂后,无论叶还是根中,ATPase水解活性均有明显变化。在根中,加入抑制剂NaNO3时,0~25%梯度蔗糖界面被抑制后的ATPase水解活性为22.3%~29.5%,显著低于25%~50%蔗糖梯度界面的活性61.5%~65.4%,表明V-ATPase主要存在于0~25%蔗糖层;而加NaN3抑制剂时,在2层蔗糖界面的变化并不大,表明2层中F-ATPase含量可能较少;加Na3VO3时,25%~50%层蔗糖梯度ATPase被抑制后的活性为22.3%~32.3%,显著低于0~25%层蔗糖的44.1%~53.3%,表明P-ATPase主要存在于25%~50%层蔗糖梯度界。
在叶中加入3种抑制剂后,各种ATPase活性的变化趋势与根中相似。即加入NaNO3后,25%~50%的ATPase活性(63.7%~68.2%)显著高于0~25%层(22.3%~29.5%),V-ATPase活性被显著抑制;NaN3抑制效果在两层差别不大;加Na3VO3时0~25%层活性为46.5%~55.5%,显著高于25%~50%的33.7%~44.8%,P-ATPase被显著抑制。同时,叶中3种酶活性均略高于对应根中的ATPase活性,但差异性不显著。表明液氮研磨法及梯度离心法适合提取柽柳叶和根的液泡膜微囊蛋白。
增加2种抑制剂时可以比较准确测定未被抑制的ATPase水解活性。由表1可知,3种ATPase水解活性随着各抑制剂浓度的增加,水解活性被抑制效果增强。但加入75 mmol/L NaNO3时ATPase水解活性(22.3%)与加入50 mmol/L时(23.7%)无明显差异,但NaN3和Na3VO3在0.6 mmol时的效果要明显高于较低浓度,因此测定V-ATPase、P-ATPase、F-ATPase水解活性选择的抑制剂浓度分别为NaN3(0.6 mmol/L)+Na3VO3(0.6 mmol/L)、NaNO3(50 mmol/L)+NaN3(0.6 mmol/L)、NaNO3(50 mmol/L)+Na3VO3(0.6 mmol/L)。结果显示,根0~25%蔗糖层的V-ATPase、P-ATPase、F-ATPase水解活性分别为59.7%、18.3%、16.2%,25%~50%层的V-ATPase、P-ATPase、F-ATPase水解活性分别为17.3%、56.8%、15.3%,对应的叶中活性0~25%层为63.2%、20.7%,18.2%,25%~50%层为18.5%、67.9%、16.8%(表1),表明V-ATPase确实主要存在于0~25%蔗糖层,而P-ATPase主要存在于25%~50%层,F-ATPase含量较少,推测其主要分布在这2层蔗糖离心层的离心管底部分被去除。
2.3膜微囊翻转比例
为了解研磨法和蔗糖梯度离心对柽柳根和叶膜微囊翻转情况的影响,对相同抑制条件下提取的膜微囊蛋白通过测定加和不加TritonX-100 后的ATPase水解活性,分析获得根和叶中的V-ATPase和P-ATPase的翻转比例,见表2。

表2 不同处理下膜微囊的翻转比例
结果显示,在加和不加TritonX-100时V-ATPase的翻转比例在根和叶中分别为15.25%、18.35%,而P-ATPase翻转比例在根和叶中分别为33.02%、32.36%,显著高于V-ATPase。即研磨和蔗糖梯度离心法能使V-ATPase达到81.65%~84.75%的原位比例,显著高于P-ATPase的66.98%~67.64%。表明柽柳液泡膜微囊分离使用研磨和蔗糖梯度离心法较质膜分离合适。同时叶中V-ATPase的翻转比例稍高于根,而叶中P-ATPase的翻转比例稍低于根,但差异均不显著。一定程度说明柽柳根中的液泡膜分离比叶更适合使用液氮研磨法。
3 结论与讨论
本研究使用液氮研磨的方式破碎柽柳叶和根部细胞来提取液泡膜微囊,Western blotting杂交表明,所提取的液泡膜微囊在蔗糖梯度0~25%界面上的蛋白中含有大量V-ATPase。不同浓度抑制剂下的ATPase水解活性测定结果表明,对于柽柳液泡膜微囊V-ATPase、P-ATPase和F-ATPase相关活性测定的适宜抑制剂浓度分别为NaN3(0.6 mmol/L)+Na3VO3(0.6 mmol/L)、NaNO3(50 mmol/L)+NaN3(0.6 mmol/L)、NaNO3(50 mmol/L)+Na3VO3(0.6 mmol/L)。刘群录等人分离胡杨液泡膜微囊测定其水解活性时使用的抑制剂浓度是75 mmol NaNO3,0.4 mmol Na3VO3,0.6 mmol NaN3[12];赵昕等人测定盐芥质膜ATPase活性时使用的是0.4 mmol KNO3作为抑制剂[18],表明不同物种ATPase活性的抑制剂要求的种类和浓度可能不同。
本研究结果还表明在叶和根中可以使用同一种方法进行液泡膜微囊分离。而以往大多数的液泡膜微囊相关活性的分析和研究主要是在根中进行的。如黄瓜(Cucumissativus)在重金属胁迫下的液泡膜质子泵活性测定[19],镉和铜胁迫下的黄瓜根中的质子转运活性测定[20]等;而王欢等人则将发芽3~4 d大豆(Glycinemax)的中间下胚轴用于液泡膜的分离,发现液泡膜微囊主要分布在8%~25%蔗糖界面[21]。柽柳中测定结果表明,0~25%蔗糖梯度分离即可达到较高的纯度。
分离植物液泡膜的一个关键影响因素是细胞的破碎。前期报道表明在分离液泡膜时主要利用研磨、捣碎、超声波破碎3种方法。刘群录等人研究表明,超声波法获得的胡杨膜微囊蛋白产率最高,且随着超声波能量的提高产率增大,而研磨法得到的胡杨蛋白得率最低[12]。而马挺军等人在分离胡杨液泡膜微囊时使用捣碎法也可以获得较高的得率,而使用研磨法时应注意的是保持酶活性[22]。表明这3种方法提取液泡膜微囊在产率上可能有差异,且关键在于保证提取微囊的酶活性。因此本研究在分离柽柳的液泡膜微囊,使用液氮研磨法时保持样品处于液氮环境,待研样结束进行提取时也保证低温。由于细胞破碎方法也可能会影响ATPase的翻转比例,如果翻转比例太高,则测定的酶活差异可能较大。於丙军等人使用研磨法分离大麦根液泡膜和质膜,结果V-ATPase在蔗糖梯度离心下的原位比例为84.01%,P-ATPase为53.89%[10],表明蔗糖梯度离心结合研磨法提取的植物根液泡膜能保持较高的原位比例,是有效分离液泡膜微囊的组合。本研究中,根中V-ATPase和P-ATPase的原位比例分别为84.75%、66.98%,叶中分别为81.65%、67.64%,与大麦根中情况相似,即研磨法和蔗糖梯度离心法提取柽柳液泡膜V-ATPase时能保持较高的原位比例,P-ATPase则较小。进一步表明蔗糖梯度离心适合分离液泡膜微囊,而不适合于质膜的分离。
总之,柽柳根和叶液泡膜微囊的分离可以使用液氮研磨法进行破碎细胞,并使用梯度离心和0~25%蔗糖梯度进行分离,分离获得的微囊原位比例较高,可以比较准确地反应膜微囊V-ATPase相关活性。对于柽柳V-ATPase,硝酸盐抑制剂的较佳浓度为50 mmol。
[1]Parry R, Turner J, Rea P, et al. High purity preparations of higher plant vacuolar H+-ATPase reveal additional subunits [J]. J Biol Chem, 1989, 264(33): 20025-20032.
[2]马挺军, 李卓, 张旭家, 等. 胡杨液泡膜 H+-ATPase 的部分纯化及其耐盐性研究[J]. 西北植物学报, 2004, 24(7): 1246-1249.
[3]Rienmuller F, Dreyer I, Schonknecht G, et al. Luminal and cytosolic pH feedback on proton pump activity and ATP affinity of V-type ATPase from Arabidopsis [J]. J Biol Chem, 2012, 287(12): 8986-8993.
[4]Verweij W, Spelt C, Di Sansebastiano G P, et al. An H+P-ATPase on the tonoplast determines vacuolar pH and flower colour [J]. Nat Cell Biol, 2008, 10(12):1456-1462.[5]Eyenbach K W, Wieczorek H. The V-type H+- ATPase: molecular structure and function, physiological roles and regulation [J]. J Exp Biol, 2006, 209(4):577-589.
[6]Whyteside G, Gibson L, Scott M, et al. Assembly of the yeast vacuolar H+-ATPase and ATP hydrolysis occurs in the absence of subunit c ″[J]. FEBS Lett, 2005, 579(14):2981-2985.[7]Yamaguchi T, Apse M P, Shi H, et al. Topological analysis of a plant vacuolar Na+/H+antiporter reveals a luminal C terminus that regulates antiporter cation selectivity [J]. P Nat Acad Sci , 2003, 100(21):12510-12515.[8]Dietz K J, Tavakoli N, Kluge C, et al. Significance of the V-type ATPase for the adaptation to stressful growth conditions and its regulation on the molecular and biochemical level [J]. J Exp Bota, 2001, 52(363):1969-1980.
[9]Zhou S, Zhang Z, Tang Q, et al., Enhanced V-ATPase activity contributes to the improved salt tolerance of transgenic tobacco plants overexpressing vacuolar Na+/H+antiporter AtNHX1 [J]. Bio Lett, 2011, 33(2):375-380.
[10]於丙军, 龚红梅, 李名旺, 等. 葡聚糖与蔗糖密度梯度离心制备膜微囊方法的比较[J]. 南京农业大学学报, 1997, 20(4):14-18.
[11]Ma T, Liu Q, Li Z. et al. Tonoplast H+-ATPase in response to salt stress inPopuluseuphraticacell suspensions [J]. P Sci, 2002, 163(3):499-505.
[12]刘群录, 张旭家, 李义, 等.胡杨液泡膜微囊的纯化及其质子转运活性[J]. 中国生物化学与分子生物学报, 2000, 16(3):372-376.
[13]尹林克. 中亚荒漠生态系统中的关键种:柽柳 (Tamarixspp.) [J]. 干旱区研究, 1995, 12(3):43-47.
[14]Singh N, Shepherd K, Cornish G. A simplified SDS-PAGE procedure for separating LMW subunits of glutenin [J]. J Cereal Sci, 1991, 14(3):203-208.
[15]Schägger H. Tricine-SDS-PAGE [J]. Nat Protoc, 2006, 1(1):16-22.
[16]Burnette W N. ‘Western blotting’: electrophoretic transfer of proteins from sodium dodecyl sulfate-polyacrylamide gels to unmodified nitrocellulose and radiographic detection with antibody and radioiodinated protein A [J]. Anal Biochem, 1981, 112(2):195-203.
[17]Wang Y , Sze H. Similarities and differences between the tonoplast-type and the mitochondrial H+-ATPases of oat roots[J]. J Biol Chem,1985, 260(19):10434-10443.
[18]赵昕, 谭会娟,丁楠. NaCl 胁迫对盐芥质膜和液泡膜ATPase活性的影响[J]. 西北植物学报, 2009, 29(4):717-723.
[19]Kabala K, Janicka-Russak M, Kobus G. Different responses of tonoplast proton pumps in cucumber roots to cadmium and copper [J]. J Plant Physiol, 2010, 167(16):1328-1335.
[20]Kabala K, Janicka-Russak M, Anklewicz A. Mechanism of Cd and Cu action on the tonoplast proton pumps in cucumber roots [J]. Physiol Plantarum, 2013, 147(2):207-217.
[21]王欢, 祝雄伟,王延枝. 液泡膜 H+-ATPaSe 质子泵活性的荧光测定[J]. 生物化学与生物物理进展, 1999. 26(2):183-187.
[22]马挺军, 白根本, 向远寅, 等. 胡杨悬浮细胞的生长及液泡膜微囊的制备[J]. 新疆农业大学学报, 2004, 26(3):55-59.
(责任编辑张坤)
The Isolation of the Tonoplast Protein of Tamarix hispida
Yang Guiyan1,2,Zhao Yulin1,Guo Yucong1,Zhao Zhen1,Gao Caiqiu1
(1.State Key Laboratory of Tree Genetics and Breeding (Northeast Forestry University), Harbin Heilongjiang 150040, China;2.College of Forestry, Laboratory of Walnut Research Center,Northwest Agriculture and Forestry University, Yangling Shaanxi 712100, China)
To further understand the mechanism ofTamarixhispidaV-ATPase under stresses, in the current study, differential centrifugation and discontinuous sucrose density gradient centrifugation were used to isolate and purify theT.hispidatonoplast. The results of Western blotting showed that the ThVHAc1 protein was screened, indicating that the isolated tonoplast contained V-ATPase. Furthermore, the sensitivity of tonoplast ATPase was determined by added with inhibitors NaNO3, Na3VO3, NaN3, and V-ATPase hydrolytic activity and overturn percentage were also determined. The results showed the tonoplast was mainly distributed on the 0-25% sucrose interface, and grinding for insolating the tonoplast showed high V-ATPase hydrolytic and percentage of overturn, indicating liquid nitrogen grinding combined with differential centrifugation and discontinuous density gradient centrifugation methods was effective to isolateT.hispidatonoplast.
Tamarixhispida; tonoplast;V-ATPase;overturn percentage

2015-05-12
国家自然科学基金项目(31000312)资助。
高彩球(1980—),女,教授。研究方向:林木遗传育种。Email:gaocaiqiu@nefu.edu.cn。
10.11929/j.issn.2095-1914.2016.01.005
S718.46
A
2095-1914(2016)01-0028-05
第1作者:杨桂燕(1986—),女,博士,讲师。研究方向:林木抗逆分子遗传育种。Email:yangguiyan@nwsuaf.edu.cn。
