响应面法优化鲍鱼内脏中牛磺酸提取工艺的研究
2016-09-10张凌晶李钰金雷桂英曹敏杰
崔 璨,章 骞,张凌晶,,翁 凌,,李钰金,雷桂英,曹敏杰,,*
(1.集美大学食品与生物工程学院,福建厦门 361021;2.水产品深加工技术国家地方联合工程研究中心,福建厦门 361021;3.泰祥集团山东省海洋食品营养研究院,山东荣成 264309)
响应面法优化鲍鱼内脏中牛磺酸提取工艺的研究
崔璨1,章骞2,张凌晶1,2,翁凌1,2,李钰金3,雷桂英1,曹敏杰1,2,*
(1.集美大学食品与生物工程学院,福建厦门 361021;2.水产品深加工技术国家地方联合工程研究中心,福建厦门 361021;3.泰祥集团山东省海洋食品营养研究院,山东荣成 264309)
以鲍鱼内脏为原料,采用单因素及响应面分析法(RSM)研究提取温度、提取时间、液固比、提取次数4个因素及其交互作用对牛磺酸提取量的影响,并利用高效液相色谱法以及扫描电子显微镜(SEM)对纯化的牛磺酸进行分析。建立各因素与牛磺酸提取量关系的数学回归模型,确定最佳水提条件为:提取温度94 ℃、提取时间140 min、固液比1∶4、提取次数4次。在此条件下,鲍鱼内脏中牛磺酸提取量为(12.82±0.23)mg·g-1,与数学回归模型的预测值13.00 mg·g-1基本一致,回归模型能很好地预测鲍鱼内脏中牛磺酸的提取量。采用最优水提条件对鲍鱼内脏中牛磺酸进行水提,并经乙醇抽提、蒸发浓缩、沉淀、活性炭处理、结晶等步骤制备得到牛磺酸晶体,经高效液相色谱法检测其纯度为96.5%。通过扫描电子显微镜(SEM)观测,天然牛磺酸晶体呈细针状,表面较为粗糙。
牛磺酸,提取工艺,鲍鱼内脏,响应面法,扫描电子显微镜
鲍鱼,以其独特的风味、质地及丰富的营养价值热销国内外。我国是世界鲍鱼养殖大国,2010年中国鲍鱼养殖产量达5.65万吨,占世界总产量的85%左右[1]。2014年全国鲍鱼产量已超过11万吨[2]。目前鲍鱼主要以鲜销和罐头制品为主,随着鲍鱼产量的逐年增加和鲍鱼加工业的发展,鲍鱼的深加工显得尤为重要。在鲍鱼加工过程中,产生的大量汤汁和内脏等副产物往往被丢弃,不仅造成资源浪费还带来环境污染。另一方面,随着经济的发展及人们对健康意识的提高,天然保健食品的需求量也越来越大。研究表明:鲍鱼内脏中含有丰富的牛磺酸[3],其不仅对人体具有增加细胞抗氧化[4]、抗自由基损伤、抗病毒侵害[5]、增强视力[6]、促进大脑发育[7]、解除疲劳、降低胆固醇等[8]功效,还对畜禽的生长发育[9]、增长繁殖[10]及免疫力[11]有促进、改善作用。据报道[12],目前市场上天然牛磺酸的价格是合成牛磺酸的约100倍。因此,以鲍鱼加工副产物内脏为原料来制备天然牛磺酸,不仅具有良好的经济前景,而且能减少环境污染。
在前期的研究中,报道了利用鲍鱼内脏提取天然牛磺酸的方法,但未对该方法的提取工艺作优化[13]。响应面分析法(Response Surface Methodology,RSM)是一种以多元二次回归方程来拟合因素与响应值之间函数关系的一种统计方法[14]。通过此方法可以清晰的观察到各拟合因素之间的交互作用对响应面值的影响,该优化方式具有数据准确性高、实验数量少[15]等优点。因此,本文拟以响应面法优化鲍鱼内脏中牛磺酸的提取工艺,旨为大规模天然牛磺酸生产提供理论基础,并在减少环境污染的同时获得最大经济效益。
1 材料与方法
1.1材料与仪器
新鲜皱纹盘鲍内脏由福州日兴水产食品有限公司提供;牛磺酸标准品美国Sigma公司;Milli-Q超纯水美国Millipore公司;HPLC级甲醇美国 Fisher Scientific公司;邻苯二甲醛等化学试剂国药集团化学试剂有限公司。
台式扫描电镜Phenom ProX荷兰Phenom-worldB.V公司;高压液相色谱仪美国Agilent Technologies 公司;色谱柱Discovery C18Supelco,美国;旋转蒸发上海泉杰仪器有限公司;恒温水浴锅德国Memmert公司;组织捣碎机Kinematica,瑞士;pH计Sartorius,德国;电子天平上海精科天平,中国。
1.2实验方法
1.2.1鲍鱼内脏中牛磺酸水提工艺准确称取鲍鱼内脏60.0 g置于300 mL三角瓶中,加入一定质量比的蒸馏水将其捣碎,于恒温水浴锅中一定温度下进行水提,提取一定时间后将其冷却过滤,得到鲍鱼内脏牛磺酸提取液[13]。
1.2.2牛磺酸提取量的测定
1.2.2.1色谱条件色谱柱:Discovery C18(250 mm×4.6 mm,5 μL);流动相:甲醇-0.05 mol/L 乙酸钠缓冲液(pH5.3)(v/v,50∶50);进样量:20 μL,流速:1 mL/min;检测波长:330 nm;柱温:室温[13]。
1.2.2.2标准曲线的绘制使用牛磺酸标准品分别配制成2、5、10、20、50、100 μg·mL-1的牛磺酸标准溶液,经0.22 μm滤膜过滤后置于自动进样瓶,经OPA柱前衍生反应后注入Agilent 1260 高压液相色谱仪测定。实验平行测定3次。以牛磺酸标准浓度为横坐标(X),峰面积为纵坐标(Y),制作标准曲线。
1.2.2.3牛磺酸提取量的测定取一定体积的鲍鱼内脏牛磺酸提取液,稀释100倍后,利用HPLC法[12]测定提取液中牛磺酸的峰面积,并将峰面积值带入标准曲线的线性回归方程,计算得到提取液中牛磺酸质量浓度X(μg·mL-1)。按下式计算鲍鱼内脏中牛磺酸提取量(mg·g-1)。
式中,Z:牛磺酸的提取量(mg·g-1);X:由标准曲线计算得到的牛磺酸质量浓度(μg·mL-1);A:所得鲍鱼内脏牛磺酸提取液体积(mL);60:鲍鱼内脏的质量(g)。
1.2.3鲍鱼内脏中牛磺酸水提工艺单因素实验
1.2.3.1固液比 精确称取60 g鲍鱼内脏6份,在提取温度90 ℃下,分别按照固液比1∶1、1∶2、1∶3、1∶4、1∶5的比例水提2 h,经过纱布过滤,收集滤液,记录体积,采用HPLC进行含量测定。实验平行3次。
1.2.3.2提取温度 精确称取60 g鲍鱼内脏7份,按固液比1∶3分别在提取温度为40、50、60、70、80、90、100 ℃下水提2 h,经过纱布过滤,收集滤液,记录体积,采用HPLC进行含量测定。实验平行3次。
1.2.3.3提取时间 精确称取60 g鲍鱼内脏6份,在提取温度90 ℃、固液比1∶3下,分别水提30、60、90、120、150、180 min,经过纱布过滤,收集滤液,记录体积,采用HPLC进行含量测定。实验平行3次。
1.2.3.4提取次数 精确称取60 g鲍鱼内脏6份,在提取温度90 ℃、提取时间120 min、固液比1∶3下,分别水提1、2、3、4、5、6次,对滤渣重复提取后合并提取液,经过纱布过滤,收集滤液,记录体积,采用HPLC进行含量测定。实验平行3次。
1.2.4响应面优化分析鲍鱼内脏中牛磺酸的水提工艺采用Design-Expert.V.8.0.6.1软件进行Box-Behnken实验。根据1.2.3节单因素实验结果,选取固液比、提取温度、提取时间、提取次数4个因素为自变量,以牛磺酸提取量为响应值,考察4个因素对牛磺酸提取量的影响,设计了一个四因素三水平的实验。实验因素及水平见表1。

表1 响应面法实验因素及水平
1.2.5牛磺酸的制备参考章骞等[13]鲍鱼内脏中牛磺酸的制备方法,精确称取鲍鱼内脏1.0 kg,采用1.2.4得到的最优水提条件对鲍鱼内脏中牛磺酸进行水提,并经乙醇抽提、蒸发浓缩、沉淀、活性炭处理、结晶、重结晶等步骤制备牛磺酸。
1.2.6牛磺酸的纯度测定分别称取按照1.2.5方法制备的牛磺酸样品和牛磺酸标准品各1.0 g,配制成50.00 μg·mL-1的溶液,经0.22 μm滤膜过滤后置于自动进样器的样品瓶中,柱前衍生反应后注入Agilent 1260高压液相色谱仪进行测定。记录峰面积,根据所制得的标准曲线,采用峰面积归一化方法计算牛磺酸样品的纯度[13]。
1.2.7牛磺酸晶体的扫描电子显微镜分析称取按照1.2.5方法制备的牛磺酸晶体0.5 g,经干燥后将其用导电胶粘在样品台上,喷金后观察并照相记录。
1.3数据处理
运用Excel 2007统计软件和Design Expert.V 8.0.6.1响应面分析软件处理实验数据。
2 结果与分析
2.1牛磺酸标准曲线的绘制
由图1 可知,牛磺酸在质量浓度0~100 μg·mL-1的范围内,与其峰面积呈良好的线性关系,且在此范围内的线性回归方程为Y=127.43X+75.287,R2=0.9996。
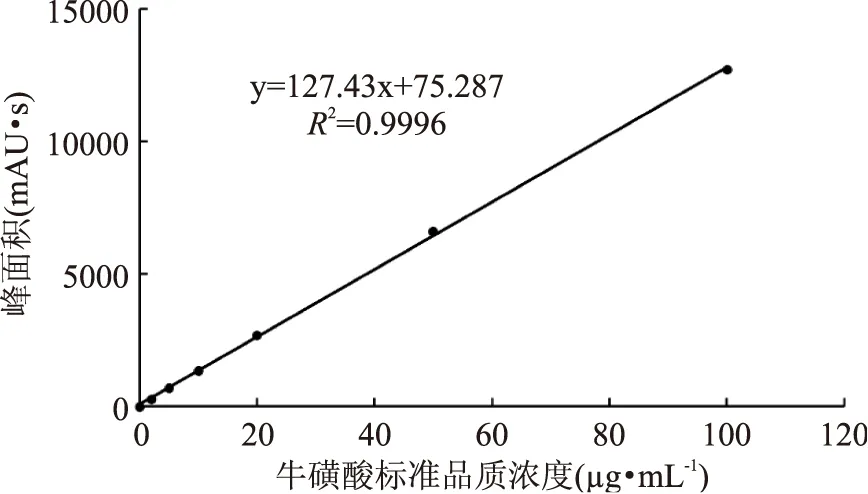
图1 牛磺酸标准曲线Fig.1 Scandard curve of taurine
2.2单因素实验
2.2.1固液比对鲍鱼内脏中牛磺酸提取量的影响如图2所示,在不同固液比条件下,牛磺酸含量随着固液比的增大呈现先增大后减小的趋势,在固液比为1∶3时出现牛磺酸提取量的最大值。这说明水溶性的牛磺酸在加水比例达到一定值时,提取量已经达到了饱和值,若再增加固液比,产量也不会有所增加,反而因为固液比的增加导致后续浓缩成本增大。因此,本实验的最佳固液比为1∶3。
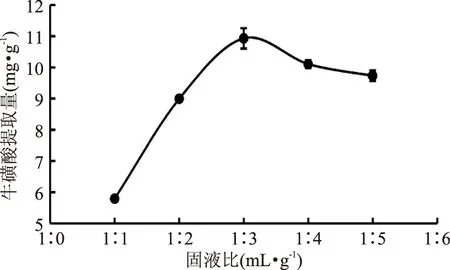
图2 固液比对牛磺酸提取量的影响Fig.2 Effects of solid-to-liquid ratio on taurine yield
2.2.2提取温度对鲍鱼内脏中牛磺酸提取量的影响如图3所示,牛磺酸提取量在提取温度从40 ℃升高至50 ℃的过程中呈现快速增加的趋势,从50 ℃升高到90 ℃的过程中呈现缓慢增加的趋势,但是当提取温度为100 ℃时,牛磺酸提取量反而有所下降,这可能是因为温度过高使得蛋白质凝固时与牛磺酸共沉淀,导致在后续的过滤过程中牛磺酸的损失增大。因此,本实验选取提取温度90 ℃。
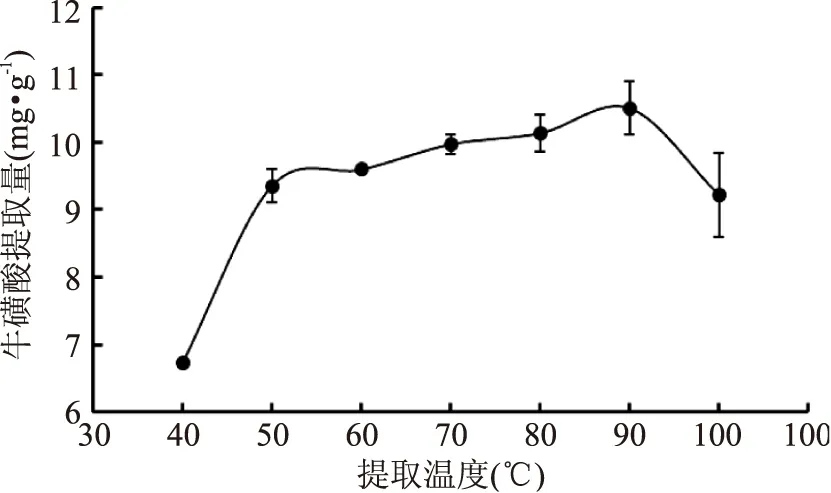
图3 提取温度对牛磺酸提取量的影响Fig.3 Effect of extraction temperature on taurine yield
2.2.3提取时间对鲍鱼内脏中牛磺酸提取量的影响如图4所示,在120 min之前,牛磺酸提取量随着时间的延长而增加,120 min后随着时间的延长提取量反而降低。可能原因是提取时间过长使得内脏中其他大分子杂质大量溶出,包裹住了牛磺酸,在过滤过程中使牛磺酸的损失反而增多。因此,本实验采用提取时间120 min。

图4 提取时间对牛磺酸提取量的影响Fig.4 Effects of extraction time on taurine yield
2.2.4提取次数对鲍鱼内脏中牛磺酸提取量的影响如图5所示,牛磺酸提取量随着提取次数的增多而增加,但是在提取次数为3次之后,牛磺酸提取量的增加趋势减缓,考虑到能耗等成本因素,本实验选用提取次数为3次。

图5 提取次数对牛磺酸提取量的影响Fig.5 Effect of extraction times on taurine yield
2.3响应面分析法优化实验
2.3.1模型的建立及方差分析在单因素实验的基础上,根据1.2.4节设计方案,采用Box-Behnken设计方法,对鲍鱼内脏中牛磺酸的水提工艺进行优化,结果见表2。

表2 响应曲面法优化实验设计及结果
利用Design-Expert.V.8.0.6.1软件对表2中的实验数据进行分析,得拟合二次多项式方程:牛磺酸提取量=11.62+0.82A+0.33B+0.55C+0.45D-0.21AB-0.16AC+0.090AD-0.054BC+0.27BD+0.23CD-1.00A2-0.40B2-0.59C2+0.33D2
对二次响应面回归模型进行方差分析结果见表3。可以看出,回归模型p值<0.01,模型极显著。失拟项=0.2221>0.05,失拟项不显著,说明模型对本实验拟合程度良好,即可用该数学模型推测实验结果。分析模型中各项系数的p值,A、B、C、D、AB、AC、BD、CD、A2、B2、C2、D2项的影响极显著,而AD、BC影响不显著,说明提取温度与提取次数、提取时间与固液比之间不存在交互作用。剔除不显著项,将拟合方程修正为:牛磺酸提取量=11.62+0.82A+0.33B+0.55C+0.45D-0.21AB-0.16AC+0.27BD+0.23CD-1.00A2-0.40B2-0.59C2+0.33D2。由于F值可反映各因素对响应值的影响程度,且F值越大,表面该因素对响应值的影响越大。因此,由F值可知,各因素对牛磺酸提取量的影响次序为:提取温度>固液比>提取次数>提取时间。
2.3.2响应面交互作用分析为了能够直观反映出两个因素间交互作用的显著程度,通过Design-Expert.V.8.0.6.1软件绘制了提取温度、提取时间、固液比以及提取次数在牛磺酸提取量上两两相互影响程度的响应面。结果如图6~图9所示。
图6为提取温度与提取时间对牛磺酸提取量的影响。从图6中可以看出,提取时间与提取温度之间的交互作用存在最优值(曲面顶点),并且当提取时间一定时,牛磺酸提取量随着提取温度的升高而升高,在93 ℃左右出现最高值后牛磺酸提取量开始有一定程度的下降;同样,当提取温度一定时,牛磺酸提取量随着提取时间的延长呈现先上升后下降的趋势。因此,可以清晰的看出提取时间与提取温度交互作用极显著。

图6 提取温度和提取时间对牛磺酸提取量的响应面图Fig.6 Response surface methodology of temperature and time to the extraction of taurine
图7为提取温度与固液比对牛磺酸提取量的影响。如图所示,当提取温度不变时,随着固液比从1∶2到1∶3.5时,牛磺酸提取量缓慢增加,之后牛磺酸提取量基本保持稳定;当固液比一定时,牛磺酸提取量在80~95 ℃的提取时间范围内迅速增加,之后的牛磺酸提取量逐渐降低。所以,提取温度与固液比交互作用极显著。

表3 二次响应面回归模型的方差分析

图7 提取温度和液固比对牛磺酸提取量的响应面图Fig.7 Response surface methodology of temperature and liquid-to-solid ratio to the extraction of taurine
注:**表示极显著,p<0.01;*表示显著,p<0.05。
图8为提取时间与提取次数对牛磺酸提取量的影响。当提取时间不变时(以提取时间为150 min为例),随着提取次数的增多,牛磺酸提取量存在上升的趋势;当提取次数不变时(以4次提取次数为例),提取时间在90~120 min之间,牛磺酸提取量迅速增加,从120~150 min时,牛磺酸提取量较为稳定。说明提取次数与提取时间对牛磺酸提取量的影响显著。

图8 提取时间和提取次数对牛磺酸提取量的响应面图Fig.8 Response surface methodology of extraction time and duration to the extraction of taurine
图9为固液比与提取次数对牛磺酸提取量的影响。由图9可知,当提取次数不变时,牛磺酸提取量随着固液比的增大逐渐增加,在固液比为1∶3.5时出现最大值;当固液比不变时(以1∶4的固液比为例),随着提取次数的增多,牛磺酸提取量呈现不断增加的趋势。说明固液比与提取次数对牛磺酸提取量的影响明显。
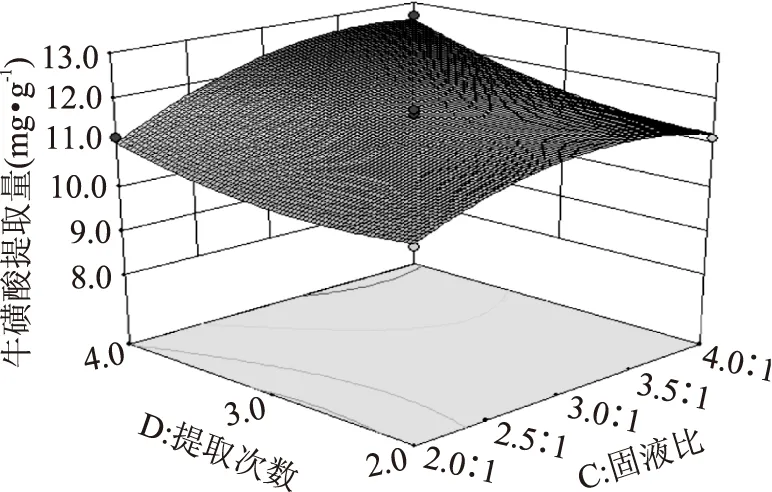
图9 固液比和提取次数对牛磺酸提取量的响应面图Fig.9 Response surface methodology of solid-to-liquid ratio and duration to the extraction of taurine
由表3中的F值可知,影响鲍鱼内脏中牛磺酸提取量的因素大小顺序为提取温度>固液比>提取次数>提取时间。
2.3.3最优条件的验证实验通过软件分析计算得出理论最佳提取工艺:提取温度93.4 ℃、提取时间138.8 min、固液比1∶3.6、提取次数4次。在实际应用上,将最佳工艺修正为:提取温度94 ℃、提取时间140 min、固液比1∶4、提取次数4次。在此条件下,重复3次实验,得到牛磺酸提取量为(12.82±0.23) mg·g-1,与理论值12.96 mg·g-1基本相吻合,说明该方程与实际情况的拟合性良好,通过响应面分析法得到的鲍鱼内脏中牛磺酸的水提工艺参数真实可靠,具有一定的实用价值。
2.4牛磺酸的制备及纯度测定
采用1.2.5方法从1 kg鲍鱼内脏中获得牛磺酸晶体3.02 g。图10(a)表示标准牛磺酸的色谱图,图10(b)表示从鲍鱼内脏中提取的天然牛磺酸的色谱图。由图10可知,标准牛磺酸的出峰时间为6.717 min,从鲍鱼内脏中提取的牛磺酸保留时间为6.956 min,两者基本一致。经过峰面积归一化方法计算得知,鲍鱼内脏中牛磺酸样品纯度达到96.5%,说明此工艺可制备得到高纯度的天然牛磺酸。

图10 牛磺酸溶液色谱图Fig.10 HPLC chromatogram of taurine solutionextracted from abalone visceral
2.5天然牛磺酸晶体的扫描电子显微镜分析
对天然牛磺酸进行显微镜观察分析,可以发现其晶体形态为细针状结晶性粉末。图11中的(a)、(b)分别表示放大倍数为500倍与3000倍的天然牛磺酸晶体。从图11(a)可以明显看出天然牛磺酸晶体粒度较小,形态以细长针状为主,直径为48 μm左右;并从图11(b)中可清晰观察到其表面较为粗糙,棒状颗粒表面有类似于晶粒的结构。

图11 天然牛磺酸的扫描电镜图Fig.11 SEM pictures of native taurine
3 结论
建立了以提取温度、提取时间、固液比、提取次数为自变量,牛磺酸提取量为响应值的数学回归模型,分析得出鲍鱼内脏中牛磺酸的最佳水提工艺为:提取温度94 ℃、提取时间140 min、固液比1∶4、提取次数4次。在此条件下可得到鲍鱼内脏中牛磺酸提取量为(12.82±0.23)mg·g-1,与回归模型的预测值
12.96 mg·g-1基本一致。依据最优水提工艺参数,可从鲍鱼内脏中进一步纯化得到纯度高达96.5%的天然牛磺酸。扫描电子显微镜的结果显示,天然牛磺酸晶体呈细针状,且表面粗糙。
[1]柯才焕.我国鲍鱼养殖产业现状与展望[J].中国水产,2013(1):27-30.
[2]刘增胜,李书民,徐晖,等.中国渔业年鉴[M].北京:中国农业出版社,2014.
[3]章骞,沈建东,赵雪冰,等.杂色蛤中牛磺酸含量与季节变化的关系[J].集美大学学报:自然科学版,2015(3):167-172.
[4]SIRDAH,Mahmoud M. Protective and therapeutic effectiveness of taurine in Diabetes Mellitus:A rationale for antioxidant supplementation[J]. Diabetes and Metabolic Syndrome Clinical Research and Reviews,2015,9(1):55-64.
[5]CHANG Chun-Yu,SHEN Chao-Yu,KANG Chao-Kai,et al. Taurine protects HK-2 cells from oxidized LDL-induced cytotoxicity via the ROS-mediated mitochondrial and P53-related apoptotic pathways[J]. Toxicology and Applied Pharmacology,2014,279(3):351-363.
[6]HUANG Mei-Hong,SONG Jia-Qi,LU Bing-Zheng,et al. Synthesis of taurine-fluorescein conjugate and evaluation of its retina-targeted efficiencyinvitro[J]. Acta Pharmaceutica Sinica B,2014,4:447-453.
[7]GU Yi,ZHAO Yan,QIAN Kun,et al. Taurine attenuates hippocampal and corpus callosum damage,and enhances neurological recovery after closed head injury in rats[J]. Neuroscience,2015,291:331-340.
[8]YUN Biao,AI Qing-Hui,MAI Kang-Sen,et al. Synergistic effects of dietary cholesterol and taurine on growth performance and cholesterol metabolism in juvenile turbot(ScophthalmusMaximusL.)fed high plant protein diets[J]. Aquaculture,2012,324(1):85-91.
[9]TUFFT Linda S,JENSEN Lasse S. Influence of dietary taurine on performance and fat retention in broilers and turkey poults fed varying levels of fat[J]. Poultry Science,1992,71(5):880-885.
[10]SALZE Guillaume P,DAVIS D Allen. Taurine:a critical nutrient for future fish feeds[J]. Aquaculture,2015,437:215-229.
[11]SCHULLER-Levis Georgia B,PARK Eunkyue. Taurine and its chloramines:modulators of immunity[J]. Neuro-Chemical Research,2004,29(1):117-126.
[12]莫建光,卢安根,陈秋虹,等.一种鉴别天然牛磺酸和合成牛磺酸的检测方法:CN,CN102213714A[P].2011.
[13]章骞,郑福来,翁凌,等.鲍鱼内脏中天然牛磺酸的提取与检测[J].食品安全质量检测学报,2014,5(1):70-76.
[14]WU Jun-Kai,YU Dan,SUN Hui-Feng,et al. Optimizing the extraction of anti-tumor alkaloids from the stem of Berberis Amurensis by response surface methodology[J]. Industrial Crops and Products,2015,69:68-75.
Optimized extraction technology of taurine fromHaliotisdiscushannaivisceral by response surface methodology
CUI Can1,ZHANG Qian2,ZHANG Ling-jing1,2,WENG Ling1,2,LI Yue-jin3,LEI Gui-ying1,CAO Min-jie1,2,*
(1.College of Food and Biological Engineering,Jimei University of Fujian Province,Xiamen 361021,China;2.National and Local Joint Engineering Research Center of Processing Technology for Aquatic Products,Xiamen 361021,China;3.Taixiang Group Company,Marine Food Nutrition Research Institute,Rongcheng 264309,China)
Using abalone viscera as raw materials,analysis of single factor and response surface method(RSM)combining 4 factors of extraction temperature,extraction time,liquid to solid ratio,extraction times and their interaction effects on the extraction of taurine were investigated,followed by HPLC and scanning electron microscopy(SEM)to identify purification of taurine. A mathematical regression model was established based on the effect of each factor and taurine extraction. Optimal extraction conditions were determined as following:temperature at 94 ℃,duration for 140 min,solid-to-liquid ratio of 1∶4,extraction of 4 times. Under these conditions,the extraction rate of taurine from abalone viscera was(12.82±0.23)mg·g-1,which agreed well with the predicted value of 13.00 mg·g-1from the regression model. This result indicated that the regression model could well predict the amount of extraction of taurine from abalone viscera. Using optimum extraction conditions,followed by ethanol extraction,evaporation,precipitation,carbon treatment,and crystallization,taurine was effectively extracted from abalone viscera and its crystal was obtained. The purity of acquired taurine was 96.5% as detected by HPLC. Scanning electron microscopy(SEM)assay showed that taurine mainly forms fine-needle-shaped crystals with rough surface.
taurine;extraction technology;abalone viscera;response surface methodology;scanning electron microscopy(SEM)
2015-11-09
崔璨(1992-),女,硕士研究生,研究方向:水产品深加工,E-mail:rainbowcuican@163.com。
曹敏杰(1964-),男,博士,教授,研究方向:水产品深加工与蛋白质化学,E-mail:mjcao@jmu.edu.cn。
国家自然科学基金资助项目(31471640);海洋公益性行业科研专项经费项目(201305015);福建省海洋高新产业发展专项项目([2013]22号)。
TS254.1
B
1002-0306(2016)12-0272-06
10.13386/j.issn1002-0306.2016.12.043
