雷公藤多苷干预舒尼替尼引起的小鼠肾足细胞凋亡及相关蛋白表达的机制研究
2016-09-08陈映霞秦叔逵杨爱珍马兴群曹梦苒
江 超,陈映霞,秦叔逵,杨爱珍,马兴群,成 远,曹梦苒,闻 妹
雷公藤多苷干预舒尼替尼引起的小鼠肾足细胞凋亡及相关蛋白表达的机制研究
江超1,陈映霞1,秦叔逵1,杨爱珍2,马兴群1,成远1,曹梦苒1,闻妹1
目的 观察舒尼替尼对体外培养小鼠肾足细胞的影响,并探讨雷公藤多苷(TWP)对舒尼替尼所致小鼠肾足细胞损伤的保护作用及其机制。方法 体外培养小鼠肾足细胞,不同分组给药处理后,采用MTT法、流式细胞术、Western blot法检测小鼠肾足细胞的增殖抑制率、凋亡率及相关蛋白(Nephrin、CD2AP)的表达情况。结果 小鼠肾足细胞增殖抑制率随着舒尼替尼浓度及作用时间的增加而增加(P<0.01);48 h凋亡率随舒尼替尼浓度增加而增加(P<0.01)。TWP可降低48 h舒尼替尼引起的小鼠肾足细胞增殖抑制率和凋亡率(P<0.05),同时可抑制舒尼替尼引起的Nephrin、CD2AP表达量降低(P<0.05)。结论 舒尼替尼可损伤小鼠肾足细胞;而TWP通过上调Nephrin、CD2AP蛋白表达减轻舒尼替尼导致的足细胞损伤。
舒尼替尼;抗血管生成;雷公藤多苷;小鼠肾足细胞;蛋白尿
网络出版时间:2016-5-9 15:43:10 网络出版地址:http://www.cnki.net/kcms/detail/34.1065.R.20160509.1543.018.html
舒尼替尼是一种口服的小分子多靶点酪氨酸激酶抑制剂,能抑制多个在肿瘤血管生成和肿瘤细胞增殖中起到了关键作用的酪氨酸激酶[1],因此具有抗血管生成和抗肿瘤作用。然而,研究[2]显示服用道舒尼替尼的患者蛋白尿的发生率为21%~63%,在晚期肾癌患者中发生严重蛋白尿的比例达6.5%。雷公藤多苷(Tripteryium wilfordii polyglycosidium,TWP)是从雷公藤植物根中提取的总苷,包括雷公藤甲素、雷公藤乙素、雷公藤红素等,具有抗炎、免疫抑制等作用[3]。临床上TWP可用于治疗多种原发性及继发性肾小球疾病。动物实验[4]显示TWP通过改善肾小球裂孔膜(slit diaphragm,SD)相关蛋白的表达,保护足细胞,减少蛋白尿。该研究通过观察舒尼替尼对体外培养的小鼠肾足细胞生物学活性的影响,探索抗血管生成药物引起蛋白尿形成的可能机制;并探讨TWP是否具有保护舒尼替尼导致足细胞损伤的作用。
1 材料与方法
1.1细胞株与试剂 小鼠肾足细胞购自北京协和细胞中心。主要试剂:舒尼替尼购自美国辉瑞公司;雷公藤多苷购自浙江得恩德制药有限公司;DMEM(高糖)培养基、胎牛血清、双抗、0.25%胰酶(含EDTA)购自美国Thermo公司;重组小鼠γ-干扰素(interferon,IFN-γ)购自美国PEPROTECH公司;MTT购自美国Sigma公司;Annexin-V APC/7-AAD双染凋亡试剂盒、RIPA裂解液(含1 mmol/L PMSF)购自南京凯基生物科技公司;兔抗小鼠Nephrin一抗、兔抗小鼠CD2AP一抗购自美国Abcam公司;羊抗兔IgG-HRP、GAPDH一抗购自南京凯基生物科技公司。
1.2方法
1.2.1细胞培养 小鼠肾足细胞复苏,未分化细胞用含10%胎牛血清(FPS)、10 U/ml重组小鼠IFN-γ、100 U/ml青霉素、100 μg/ml链霉素DMEM(高糖)培养基在33℃、5%CO2的培养箱中培养。传代后将细胞在37℃、不含重组小鼠IFN-γ的其他条件相同的环境下诱导分化2周,待细胞呈对数生长期时待用。
1.2.2MTT比色法检测 取生长良好的对数期小鼠肾足细胞,0.25%胰酶(含EDTA)消化,用含血清的培养基配成细胞悬液,计数。将细胞以4×104个/ml接种于96孔板内,每孔100 μl,24 h后弃掉上清液,分别加入含药且无血清培养基,根据药物浓度分组为:空白对照组、舒尼替尼(1、2、3、4、5 μmol/ L)组、TWP 40 ng/ml组及TWP(40 ng/ml)+舒尼替尼(3 μmol/L)组,每组设4个平行孔。TWP浓度根据参考文献及预实验确定,舒尼替尼3 μmol/L接近于该药作用于足细胞48 h的半数抑制浓度(half maximal inhibitory concentration,IC50)值。培养24、48、72 h后,每孔加入5 mg/ml的MTT 20 μl,继续培养4 h,弃上清液,每孔加200 μl DMSO,避光振荡10 min,用全自动酶联免疫检测仪测定在570 nm下各孔的吸光度(absorbance,A)值,并计算各组细胞的增殖抑制率。采用药物相互作用指数(coefficient of drug interaction,CDI)反映舒尼替尼和雷公藤多苷两药相互作用性质。CDI值计算如下:CDI=AB/(A× B);AB为两药联用组与空白对照组A值的比值,A或B是各药物单独使用组与空白对照组A值的比值。如CDI<0.9,表示两药作用性质为协同;CDI 0.9~1.1,表示两药性质为相加;CDI>1.1,表示两药作用性质为拮抗(本文中A药代表舒尼替尼,B药代表雷公藤多苷)。
1.2.3流式细胞术检测 取生长良好的对数期小鼠肾足细胞,消化、计数(同前),后以1×106个每孔接种于6孔板中,24 h后弃上清液,分别加入含药的无血清培养基,分组为空白对照组、不同浓度舒尼替尼(1、3 μmol/L)组、TWP 40 ng/ml组、TWP(40 ng/ ml)+舒尼替尼(3 μmol/L)组;继续培养48 h后收集上清液,PBS洗3次,收集非贴壁细胞。用0.25%胰酶(不含EDTA)消化收集贴壁细胞,将每孔的非贴壁细胞和贴壁细胞混合,2 000 r/min离心5 min后用PBS洗涤重悬细胞再次离心,共洗涤2次。收集5×105个细胞,加入500 μl的Binding Buffer悬浮细胞,加入5 μl Annexin V-APC混匀后,加入5 μl 7-AAD,混匀,室温、避光、反应10 min,用流式细胞仪检测各组细胞的凋亡情况。
1.2.4Western blot法检测 将生长良好对数期小鼠足细胞接种于6孔板内(同流式细胞术)。细胞分组为空白对照组、舒尼替尼3 μmol/L组、TWP 40 ng/ml组、TWP(40 ng/ml)+舒尼替尼(3 μmol/L)组,加药后培养48 h。收集每孔内所有细胞(包括上清液中及贴壁细胞),用预冷PBS洗涤后离心(2 000 r/min、5 min)2次,每孔加入含1 mmol/L PMSF的RIPA细胞裂解液150 μl裂解提取细胞总蛋白,4℃、12 000 r/min离心5 min后取上清液;用BCA蛋白定量试剂盒检测每孔蛋白浓度;取等量40 μg总蛋白质经8%SDS-PAGE凝胶电泳分离蛋白,湿转移至PVDF膜上,5%BSA室温封闭2 h,分别用兔抗小鼠Nephrin、兔抗小鼠CD2AP一抗(按照1∶400稀释),GAPDH一抗(按照1∶1 000稀释)4℃孵育过夜,TBST洗涤3次,每次10 min,再用按照1∶200稀释的辣根过氧化物酶(HRP)标记的羊抗兔IgG二抗室温孵育2 h,TBST洗涤3次,每次10 min;ECL试剂发光、显影。使用Tanon MP-FLI Capturer软件成像,Tanon Gel Image System软件对结果进行灰度值分析。结果以目标蛋白灰度值/内参GAPDH灰度值表示。
1.3统计学处理 采用SPSS 21.0软件进行分析,数据±s表示。不同药物分组之间增殖抑制率、凋亡率及相关蛋白表达量的比较采用单因素方差分析,组间两两比较采用LSD检验。
2 结果
2.1不同组小鼠肾足细胞的增殖抑制率 不同浓度舒尼替尼作用24、48、72 h后,小鼠肾足细胞增殖抑制率随着药物浓度及作用时间的增加而增高(F =133.824,P<0.01),呈现浓度依赖性和时间依赖性;TWP具有微弱细胞增殖抑制作用,但随时间增加差异无统计学意义;TWP(40 ng/ml)+舒尼替尼(3 μmol/L)组与相同浓度舒尼替尼单药组比较,48 h抑制率降低(F=45.209,P<0.01),而24、72 h差异无统计学意义。48 h组CDI>1.1,说明在48 h组舒尼替尼与TWP作用性质为拮抗,见表1。
2.2不同组小鼠肾足细胞调亡率 采用流式细胞术检测不同分组给药48 h后,舒尼替尼1、3 μmol/L组凋亡率分别为(8.98±0.135)%、(47.04±2.180)%,高于空白对照组(5.92±0.125)%;且舒尼替尼3 μmol/L组高于舒尼替尼1 μmol/L组(P<0.01)。TWP 40 ng/ml组凋亡率为(4.46±0.32)%,与空白对照组比较差异无统计学意义。TWP(40 ng/ml)+舒尼替尼(3 μmol/L)组凋亡率低于同等剂量舒尼替尼组(P<0.01),见图1。
表1 不同药物分组小鼠肾足细胞的增殖抑制率(%,n=4,±s)
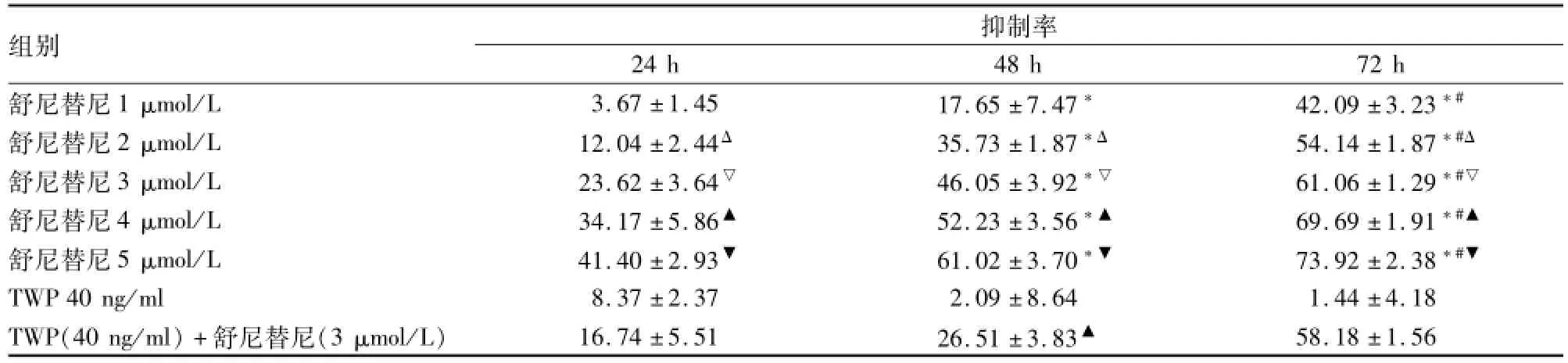
表1 不同药物分组小鼠肾足细胞的增殖抑制率(%,n=4,±s)
与24 h比较:*P<0.01;与48 h比较:#P<0.01;与相同时间舒尼替尼1 μmol/L组比较:ΔP<0.01;与相同时间舒尼替尼2 μmol/L组比较:▽P<0.05;与相同时间舒尼替尼3 μmol/L组比较:▲P<0.05;与相同时间舒尼替尼4 μmol/L组比较:▼P<0.05
组别抑制率24 h48 h72 h舒尼替尼1 μmol/L3.67±1.4517.65±7.47*42.09±3.23*#58.18±1.56舒尼替尼2 μmol/L12.04±2.44Δ35.73±1.87*Δ54.14±1.87*#Δ舒尼替尼3 μmol/L23.62±3.64▽46.05±3.92*▽61.06±1.29*#▽舒尼替尼4 μmol/L34.17±5.86▲52.23±3.56*▲69.69±1.91*#▲舒尼替尼5 μmol/L41.40±2.93▼61.02±3.70*▼73.92±2.38*#▼TWP 40 ng/ml8.37±2.372.09±8.641.44±4.18 TWP(40 ng/ml)+舒尼替尼(3 μmol/L)16.74±5.5126.51±3.83▲
2.3不同分组给药对小鼠肾足细胞蛋白Nephrin、CD2AP表达水平的影响 给药48 h后,舒尼替尼(3 μmol/L)组小鼠肾足细胞蛋白Nephrin、CD2AP表达较对空白对照组降低(FNephrin=47.035、FCD2AP=20.856,P<0.01);TWP 40 ng/ml组Nephrin、CD2AP蛋白与空白对照组比较差异无统计学意义;而TWP(40 ng/ml)+舒尼替尼(3 μmol/L)组较舒尼替尼3 μmol/L组增高(FNephrin=16.910、FCD2AP= 12.493,P<0.05)。见图2、表2。
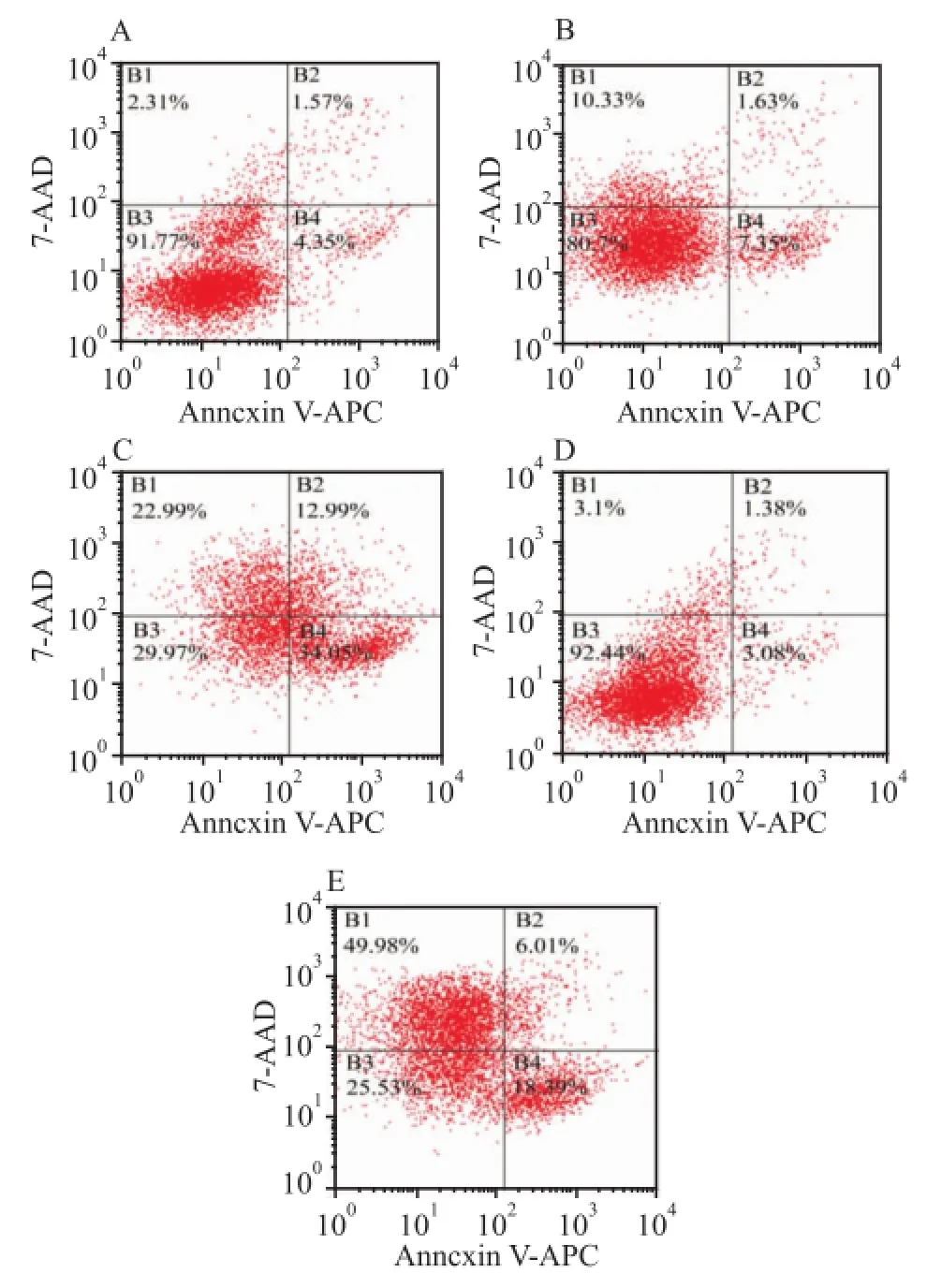
图1 不同分组给药48 h后小鼠肾足细胞凋亡情况A:空白对照组;B:舒尼替尼1 μmol/L组;C:舒尼替尼3 μmol/L组;D:TWP 40 ng/ml组;E:TWP(40 ng/ml)+舒尼替尼(3 μmol/L)组
3 讨论
蛋白尿是抗血管生成药物常见毒副作用,多为无症状性[2],肾活检病理无显著改变。少部分患者在服药期间会出现大量蛋白尿,并伴有不可逆性肾功能损伤[5]。在服用舒尼替尼期间,当24 h尿蛋白大于3.0 g时需要中断治疗,直至低于该标准后,方可继续治疗,而达到肾性蛋白尿时,则推荐永久性停药[6],这将导致有效治疗中断。抗血管生成药物所致蛋白尿的发生可能涉及多个机制[7],包括干扰足细胞源性血管内皮生长因子(vascular endothelial growth factor,VEGF)信号通路、下调足细胞连接蛋白、改变肾小球血流动力学、引起亚急性肾小球血栓性微血管病变等。如伴糖尿病等基础疾病或合并使用肾毒性药物蛋白尿发生率较高。
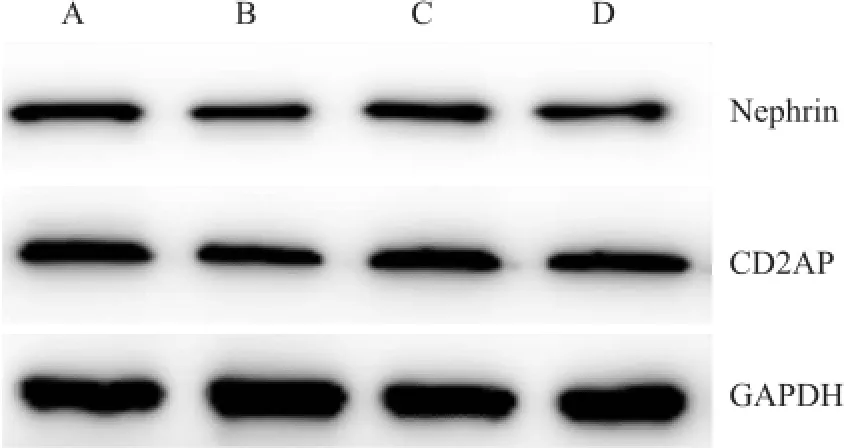
图2 不同分组给药48 h后各组Nephrin、CD2AP蛋白的表达情况A:空白对照组;B:舒尼替尼3 μmol/L组;D:TWP 40 ng/ml组;E:TWP(40 ng/ml)+舒尼替尼(3 μmol/L)组
表2 不同分组给药48 h后,各组Nephrin、CD2AP蛋白相对表达量(±s)
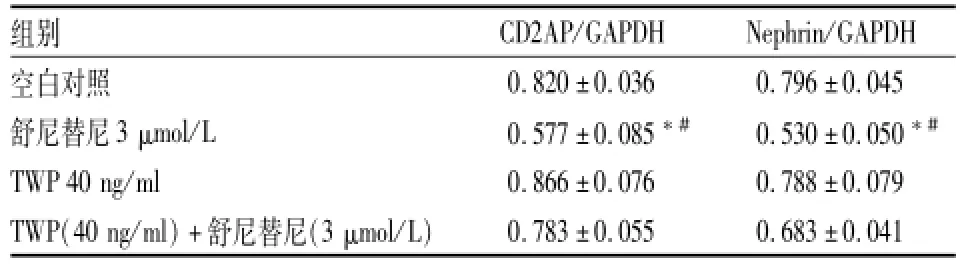
表2 不同分组给药48 h后,各组Nephrin、CD2AP蛋白相对表达量(±s)
与空白对照组比较:*P<0.01;与TWP(40 ng/ml)+舒尼替尼(3 μmol/L)组比较:#P<0.05
组别CD2AP/GAPDHNephrin/GAPDH空白对照0.820±0.0360.796±0.045舒尼替尼3 μmol/L0.577±0.085*#0.530±0.050*#TWP 40 ng/ml0.866±0.0760.788±0.079 TWP(40 ng/ml)+舒尼替尼(3 μmol/L)0.783±0.0550.683±0.041
足细胞和足突相互交错构成的SD作为肾小球滤过膜的关键部分,参与了肾小球滤过膜机械和电荷屏障的建立。足细胞是一种终末分化细胞,再生能力有限[8],一旦受损必将导致肾小球滤过膜的破坏,血液中大分子蛋白滤过,形成蛋白尿。本实验结果显示,舒尼替尼在体外可抑制小鼠肾足细胞增殖,呈现剂量依赖性和时间依赖性;且舒尼替尼能诱导小鼠肾足细胞凋亡。提示抗血管生成剂相关蛋白尿发生的机制与小鼠肾足细胞受损相关。
Nephrin是第1个被发现的由足细胞产生特异性表达于SD上的跨膜蛋白,是引起先天性肾病综合症(芬兰型)的致病基因的产物[9],是一种信号受体分子,其胞内区的酪氨酸磷酸化而起到信号传导作用。同时还维持着SD的完整性和足细胞的正常形态及功能。CD2AP在肾脏主要由足细胞产生,是一种胞质蛋白,具有信号传导和介导蛋白相互作用的功能。CD2AP在足细胞中与其他的SD分子Nephrin、Podocin形成复合体,维持足细胞裂孔膜的结构和正常功能[10]。因此Nephrin、CD2AP在维持足细胞生理功能、肾小球滤过屏障的完整和蛋白尿的产生中起到重要作用。研究[11]显示,拮抗VEGF或VEGFR均可导致肾小管内皮细胞增生、肥大,细胞连接松散,其原因与足细胞上Nephrin蛋白表达下调有关。本实验结果显示,舒尼替尼可降低小鼠肾足细胞SD关键蛋白Nephrin、CD2AP的表达,这将导致肾小球SD结构和功能的完整性被破坏。这可能是舒尼替尼等抗血管生成药物导致蛋白尿发生的重要机制。
研究[4,12]显示,TWP对一些大鼠肾病模型中足细胞具有保护作用,并可上调Nephrin、Podocin、CD2AP等足细胞SD蛋白的表达,从而改善足细胞病变减少尿蛋白。本研究显示,TWP对舒尼替尼导致的小鼠足细胞的增殖抑制及细胞凋亡有改善作用。采用TWP干预时,可上调SD关键蛋白Nephrin、CD2AP的表达。提示TWP可能对抗血管生成剂所致蛋白尿具有一定的预防和治疗价值。
研究[13]显示,雷公藤中二萜类化合物具有广谱抗癌活性,且其中的有效成分如雷公藤内酯醇可通过抑制Toll样受体4和核因子-κB(TLR4/NF-κB)信号通路、下调基质金属蛋白酶-9(MMP-9)表达抑制肿瘤细胞的侵袭和转移。研究[14]显示,TWP中有效成分雷公藤红素可抑制肿瘤血管生成。因此TWP与舒尼替尼等抗血管生成药物联合使用,除了可改善其导致的肾足细胞的损伤外,是否具有一定的协同抗肿瘤、抗血管形成效应,值得进一步研究。雷公藤制剂早先被认为是一种免疫抑制剂,近年研究[15]显示其具有双相免疫调节作用,另外还具有肝肾、生殖系统等毒性。在与抗肿瘤药物、抗血管形成药物联合应用时,其如何影响免疫功能,其他毒性是否会叠加,均需要进行深入细致的研究。
综上所述,舒尼替尼在体外可损伤小鼠肾足细胞,下调其SD关键蛋白Nephrin、CD2AP的表达。TWP通过上调Nephrin、CD2AP蛋白的表达同时改善舒尼替尼导致的足细胞损伤。下一步将进行动物实验验证本研究结果,为进一步临床应用提供依据。
[1] Oudard S,Beuselinck B,Decoene J,et al.Sunitinib for the treatment of metastatic renal cell carcinoma[J].Cancer Treat Rev,2011,37(3):178-84.
[2] Izzedine H,Massard C,Spano J P,et al.VEGF signalling inhibition-induced proteinuria:Mechanisms,significance and management[J].Eur J Cancer,2010,46(2):439-48.
[3] 管 立.雷公藤多苷治疗糖尿病肾病的研究进展[J].中成药,2012,34(10):1986-9.
[4] 王军建,胡 锐,毛云英,等.雷公藤多苷对阿霉素肾病大鼠足细胞病变的影响[J].陕西医学杂志,2011,40(9):1119-22.
[5] Takahashi D,Nagahama K,Tsuura Y,et al.Sunitinib-induced nephrotic syndrome and irreversible renal dysfunction[J].Clin Exp Nephrol,2012,16(2):310-5.
[6] Zhou A.Management of sunitinib adverse events in renal cell carcinoma patients:the Asian experience[J].Asia Pac J Clin Oncol,2012,8(2):132-44.
[7] 马兴群,成 远,陈映霞.VEGF信号通路抑制剂相关蛋白尿的研究进展[J].临床肿瘤学杂志,2015,20(4):357-62.
[8] Marshall C B,Shankland S J.Cell cycle regulatory proteins in podocyte health and disease[J].Nephron Exp Nephrol,2007,106(2):e51-9.
[9] Kandasamy Y,Smith R,Lumbers E R,et al.Nephrin-a biomarker of early glomerular injury[J].Biomark Res,2014,2:21.
[10]Huang L,You Y S,Wu W.Role of CD2 associated protein in podocyte apoptosis and proteinuria induced by angiotensin II[J]. Ren Fail,2014,36(8):1328-32.
[11]Sugimoto H,Hamano Y,Charytan D,et al.Neutralization of circulating vascular endothelial growth factor(VEGF)by anti-VEGF antibodies and soluble VEGF receptor 1(sFlt-1)induces proteinuria[J].J Biol Chem,2003,278(15):12605-8.
[12]郑 云,郝 丽,潘梦舒,等.雷公藤多苷对糖尿病肾病大鼠足细胞的保护作用[J].安徽医科大学学报,2011,46(9):857-60.
[13]马建霞,孙运良,王一倩,等.雷公藤内酯醇对胰腺癌PANC 1细胞Toll样受体4/核因子-κB信号通路的影响[J].中华胰腺病杂志,2013,13(2):114-7.
[14]Huang S,Tang Y,Cai X,et al.Celastrol inhibits vasculogenesis by suppressing the VEGF-induced functional activity of bone marrow-derived endothelial progenitor cells[J].Biochem Biophys Res Commun,2012,423(3):467-72.
[15]刘玉凤,潘 丽,南丽红,等.雷公藤药理作用研究进展[J],亚太传统医药,2014,10(9):37-9.
Research on the mice podocyte apoptosis and expression of the associated protein caused by TWP intervene sunitinib
Jiang Chao,Chen Yingxia,Qin Shukui,et al
(Dept of Medical Oncology,81st Clinical Medical College of Anhui Medical University,Nanjing 210002)
Objective To observe the effect of sunitinib culturing mice podocyte in vitro,moreover,probe into the protective effect of Tripterbium wilfordii polyglycosidium(TWP)to the cell trauma which caused by sunitinib and its mechanisms.Methods Cultured mice podocyte in vitro,after given medicine to different groups,detected the proliferation inhibiting rate,apoptosis rate and the expression status of the mice podocyte related protein(Nephrin,CD2AP)by MTT,FCM and Western blot methods.Results The proliferation inhibition rate of the mice podocyte was increased with the increasing of sunitinib dose and treated time(P<0.01).The apoptosis rate of mice podocyte increased with the increasing of the dose of sunitinib at 48 h(P<0.01).TWP could decrease the proliferation inhibition and apoptosis of the mice podocyte which caused by sunitinib at 48 h(P<0.05),at the same time it could inhibit the decrease of the mice podocyte related protein(Nephrin,CD2AP)expression which caused by sunitinib(P<0.05).Conclusion Sunitinib can damnify mice podocyte,but TWP can induce the mice podocyte cell trauma caused by sunitinib through up-regulating Nephrin and CD2AP expression.
sunitinib;anti-angiogenesis;Tripterygium wilfordii polyglycosidium;mice podocyte;proteinuria
R 73-34
A
1000-1492(2016)06-0800-05
2016-03-04接收
南京军区重点课题基金项目(编号:14ZD21)
安徽医科大学解放军八一临床学院1肿瘤内科、2中心实验室,南京 210002
江 超,男,硕士研究生;陈映霞,女,主任医师,硕士生导师,责任作者,E-mail:chenyingxiacsco@163.com
