海拔对全缘叶绿绒蒿植株性状和花特征的表型选择分析
2016-09-02张霓雯刘光立
吴 云, 张霓雯, 彭 瀚, 刘光立*
海拔对全缘叶绿绒蒿植株性状和花特征的表型选择分析
吴云1,2,3, 张霓雯4, 彭瀚1, 刘光立1*
(1 四川农业大学 风景园林学院,成都 611130;2 中国科学院西双版纳热带植物园 热带森林生态学重点实验室,云南勐腊 666303;3 中国科学院大学,北京 100039; 4 四川航天职业技术学院 四川广汉 618300)
为了研究海拔差异对植株性状、花特征表型选择的影响,以青藏高原高寒草甸的全缘叶绿绒蒿(Meconopsisintegrifolia)为研究材料,于盛花期内,测定不同海拔(4 452、4 081和3 681 m)种群中个体植株性状、花特征、单果结实数并进行统计分析,采用线性回归模型估计不同海拔种群间植株性状、花特征所受的表型选择(选择差与选择梯度)。结果表明:(1)随着海拔升高,全缘叶绿绒蒿植株性状、花特征及单果结实数显著降低,海拔越高的种群中株高越矮、叶面积越小、花数越少、花越小、单果结实数越低。(2)不同海拔种群中各性状的表型选择存在差异,较低海拔(3 681 m)种群中花数、花大小具有显著的选择差和选择梯度,表现为花越多、花越大的个体雌性适合度越高;海拔较高(4 081 m)的种群中株高、叶面积及花数更容易受到选择,表现为植株越高、叶面积越大、花越多的个体雌性适合度越高;海拔最高(4 452 m)的种群中叶面积与花数的选择梯度接近显著。(3)植物性状分化伴随着海拔的变化而呈现出差异,较低海拔种群中花特征容易受到选择,而较高海拔种群中可能由于传粉者稀少、资源限制等因素使得株高、叶面积更容易受到选择。
株高;叶面积;花特征;雌性适合度;表型选择;海拔
自然界中,植物的固着生长模式决定了其必须依赖一定的传粉媒介(动物、水、风等)才能实现有性生殖,而这其中传粉昆虫作为最主要、最多样的传粉媒介,往往对植物的花部性状及进化具有重要的作用,并最终影响植物的雌雄适合度[1]。种群内或种群间,不同传粉者的访花偏好往往造成花部性状的适应性分化,并最终导致个体适合度的改变[2-3]。如对毛茛状金莲花(Trolliusranunculoides)的研究表明,蜜蜂和蝇类偏好较大的花,在蝇类为主导传粉者的种群中,个体具有更多的单花花瓣但更小的花,继而造成毛茛状金莲花种群间结实率存在差异[4]。在一些高度特化的传粉系统中,传粉者与植物往往是一对一的关系。如,在南美厄瓜多尔安第斯山脉,作为加长钟形花(Centropogonnigricans)的唯一的传粉者,长舌蝙蝠(Anourafistulata)的舌头长度几乎与加长钟形花花冠的长度一致(8~9 cm),造成加长钟形花具有更长的雌性与雄性持续时间[5]。对分布于尼泊尔的象牙参(Roscoeapurpurea)的研究发现,一种虻(Philolichelongirostris)的喙长与此种植物的花冠管长相吻合,作为此种象牙参最有效的传粉者对植物有性繁殖的成功具有重要的作用[6]。
具有专化传粉系统的传粉者-宿主植物间的关系相对稳定,但自然界中更多的是泛化传粉系统,且这种由泛化传粉者介导对植株性状、花特征的选择往往存在时间和空间上的变异。如对多年生草本植物春苦豆(Lathyrusvernus)[7]和毛茛状金莲花(T.ranunculoides)[8]传粉者介导的表型选择研究表明,不同花期,访花昆虫的变化可能对植物花特征(花数量、花瓣及花萼大小)的分化起到了至关重要的作用,继而影响了不同花期植株的适合度。对牛皮杜鹃(Rhododendronaureum)的深入研究表明,早花期与末花期传粉者介导表型选择的差异不但造成植株适合度的差异,而且对种子遗传多样性亦产生影响[9]。
值得注意的是,传粉者介导的选择作用更多表现为空间上的差异。如,对蓝花耧斗菜(Aquilegiacoerulea)[10]、兰科植物Gymnadeniaodoratissima[11]以及挪威Dovrefjell 国家公园中的植物[12]研究均表明,不同海拔间传粉者种类的差异导致植物个体的花色存在差异。除对个体花色具有选择作用外,传粉者的差异亦对个体的花大小、雌雄蕊位置关系等具有各异的选择作用。如,对毛茛(Ranunculusacris)的研究表明,低海拔种群中传粉者偏好更大的花,高海拔种群中传粉者无此偏好[13]。对兰科植物Gymnadeniaodoratissima的研究亦有相似的结论[11]。有趣的是[14-15],由于高海拔种群中传粉者的缺乏,植物雌雄蕊位置更为接近,有自交的倾向。随着海拔的变化,传粉者的种类、数量、组成、活动能力、访花频率均会出现变化,这种变化所带来的表型选择作用于不同海拔种群可能不同,而目前大多数的研究均是集中于不同海拔种群间个体的形态指标,对于传粉者差异所带来的对特定性状的选择差、选择梯度,继而影响个体适合度的认识较为缺乏。
本研究以传粉昆虫泛化的全缘叶绿绒蒿(Meconopsisintegrifolia)为研究对象,通过对不同海拔种群个体的植株性状、花特征、雌性适合度及相关的表型选择进行分析,主要探讨以下问题:(1)在不同海拔种群中,全缘叶绿绒蒿的植株性状、花特征及雌性适合度是否存在差异?(2)通过相对雌性适合度在不同海拔种群估计的表型选择是否有差异?
1 材料和方法
1.1研究材料及研究地点
全缘叶绿绒蒿为罂粟科绿绒蒿属一年生或多年生草本,主要分布于海拔2 500 m的林缘到海拔5 000 m的雪线区间,生境多为高山草甸。植株高15~150 cm,花黄色,通常3~5朵生于茎上部叶腋内;雄蕊多数;心皮3~6,子房卵形;蒴果。花期5~8月,果期9~10月。
研究于2014年6月中旬(盛花期)在四川省阿坝藏族羌族自治州汶川县卧龙自然保护区巴郎山(102.90°~102.95°E, 30.88°~30.91°N,海拔4 484 m)进行。巴郎山年均温8.6 ℃(1月均温-1.7 ℃,7月均温17.0 ℃),年降水量700~900 mm,雨季5~9月。在充分踏查的基础上,共选择了3个全缘叶绿绒蒿研究种群[种群1(4 452 m)、种群2(4 081 m)、种群3(3 681 m)]。
1.2研究方法
1.2.1性状指标2014年6月中旬(盛花期)于各种群随机标记30株全缘叶绿绒蒿成熟植株,测量并统计株高、叶片数、叶片长宽(每株随机测量3个叶片)、花数、花瓣数(每株随机标记3朵花)、花瓣长宽(随机测量标记的3朵花的花瓣,每朵花测量3个花瓣)。其中,株高的测量标准为贴近地面部分到最高点的高度,叶片长宽与花瓣长宽的测量方法见图1。待果实成熟尚未开裂前,每株随机收集3个成熟果实,统计种子数。
1.2.2替代指标及替代方法为减小相似指标对分析结果的干扰,分别以叶面积和花大小作为替代指标加以分析。具体替代如下:1)叶面积= 叶片数×叶片长×叶片宽;2)花大小= 花瓣数×花瓣长×花瓣宽。分别计算每株叶面积的平均值、花大小的平均值、单果结实数的平均值,并以平均值作为该株相应指标的指标值。
1.2.3回归模型表型选择分析中,参照Lande等[16]的模型进行分析。
选择差:选择差表示每个性状所受选择压力的
总和,包括直接选择和间接选择。以相对雌性适合度(个体种子数/种群平均种子数)作为因变量,标准化的性状指标(平均值=0,方差=1)为自变量。通过相对雌性适合度与每个标准化的性状指标作一元线性回归,所得的回归系数“β”为选择差。
选择梯度:选择梯度表示每个性状所受的直接选择压力。以相对雌性适合度(个体种子数/种群平均种子数)为因变量,标准化的性状指标(平均值=0,方差=1)为自变量,采用多元线性回归,所得到的每个标准化性状的偏回归系数“βi”,即为线性选择梯度[17-18]。
1.3数据分析
采用单因素方差分析(one-way ANOVA)检验不同海拔种群间全缘叶绿绒蒿株高、叶面积、花数、花大小、单果结实数的差异并计算变异系数(CV)。采用Spearman相关性分析检验株高、叶面积、花数、花大小间的相关性,相关分析数据采用3个种群的数据。
以相对雌性适合度为因变量,标准化的性状为自变量分别进行一元与多元线性回归,分别求出选择差与选择梯度。以显著的选择差对应的标准化性状与相对雌性适合度为变量作图。以上分析均在SPSS 19.0中进行,图在Excel 2007中完成。
2 结果与分析
2.1不同海拔种群全缘叶绿绒蒿植株性状、花特征及其相关性
表1显示,全缘叶绿绒蒿株高、叶面积、花数、花大小及种子产量在不同海拔种群间均存在显著差异(P<0.001)。海拔越高的种群,个体的株高越低,叶面积越小,花数越少,花越小,种子产量越低。
各海拔种群中个体株高、叶面积、花数、花大小及种子产量均存在不同程度的差异。其中,种群中个体的叶面积、花数、花大小的变异较大,变异系数较高(表2)。随着海拔升高,性状的差异逐渐增大,海拔最高的种群1中个体的株高、叶面积、花大小和种子产量变异最大。
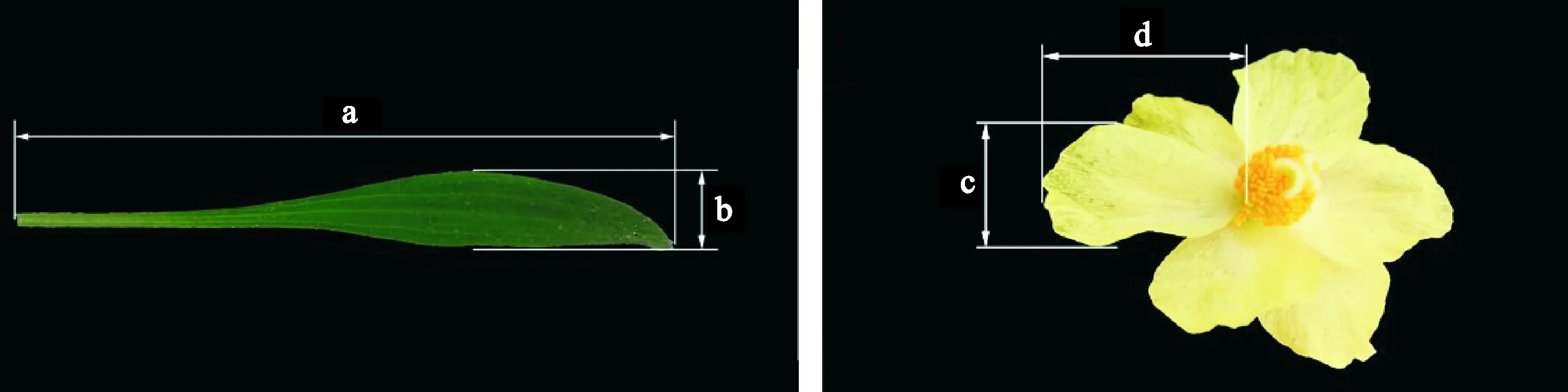
a.叶片长;b.叶片宽;c.花瓣宽;d.花瓣长图1 全缘叶绿绒蒿叶片长宽和花瓣长宽测量示意图a. Leaf length; b. Leaf width; c. Petal width; d. Petal lengthFig. 1 Measurements on leaf length, leaf width, petal length and petal width of Meconopsis integrifolia
Spearman相关性分析表明(表3),株高、叶面积、花数及花大小间均存在极显著正相关性(P<0.01)。植株越高,叶面积越大,花越多,花越大。
2.2不同海拔全缘叶绿绒蒿的表型选择分析
通过相对雌性适合度与各标准化的性状指标间线性回归分析结果发现,种群1中个体的各性状没有显著的选择差和选择梯度。由表4表5可以看出,种群2中个体的株高(β=0.135,P<0.001)、叶面积(β=0.108,P<0.01)和花数(β=0.079,P=0.014)存在显著的选择差,且种群2中个体的株高(βi=0.115,P<0.001)与花数(βi=0.056,P=0.013)亦存在显著的选择梯度。种群3中个体的花数与花大小存在显著的选择差(β=0.066,P=0.023;β=0.086,P=0.011)和选择梯度(βi=0.103,P=0.02;βi=0.09,P=0.015)。图2表明,种群2中株高、叶面积、花数与适合度间存在显著的正定向选择,表现为植株越高、叶面积越大、花越多,个体的适合度越大。图3表明,种群3中花数、花大小与适合度间存在显著的正定向选择,表现为花越多、花越大,个体适合度越大。

表3 全缘叶绿绒蒿各性状间的相关性
注:**表示显著水平P<0.01
Notes: ** indicated significant levelP<0.01
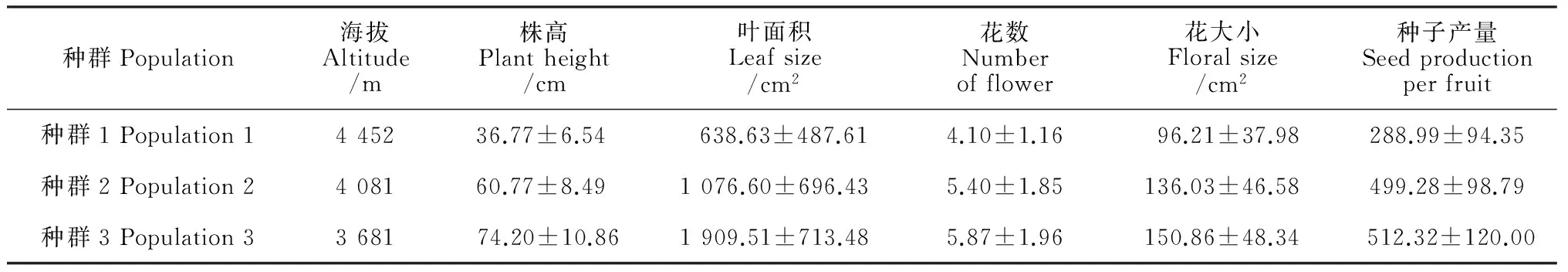
表1 不同海拔种群全缘叶绿绒蒿植株性状、花特征及种子产量
注:表中数据为平均值±标准差。
Notes: data= mean±S.D.
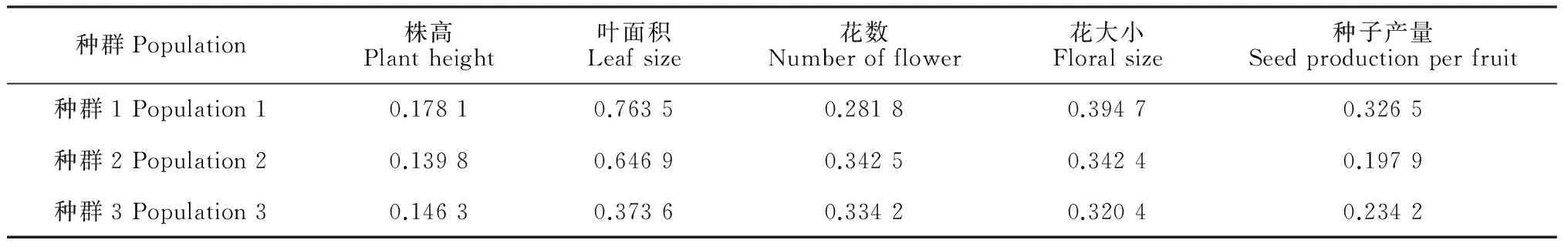
表2 不同海拔种群全缘叶绿绒蒿性状变异系数
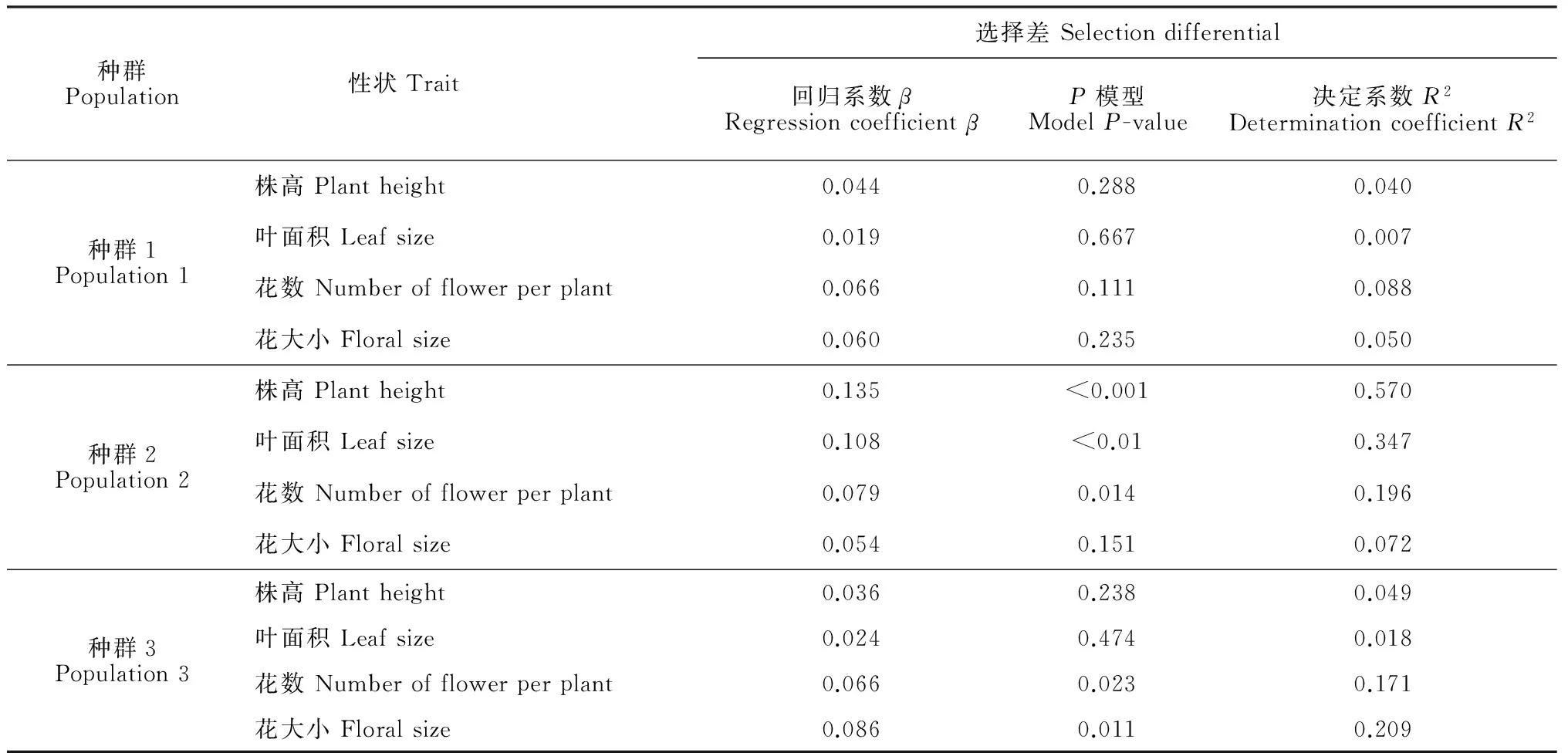
表4 全缘叶绿绒蒿各性状在不同海拔种群间受到的选择差
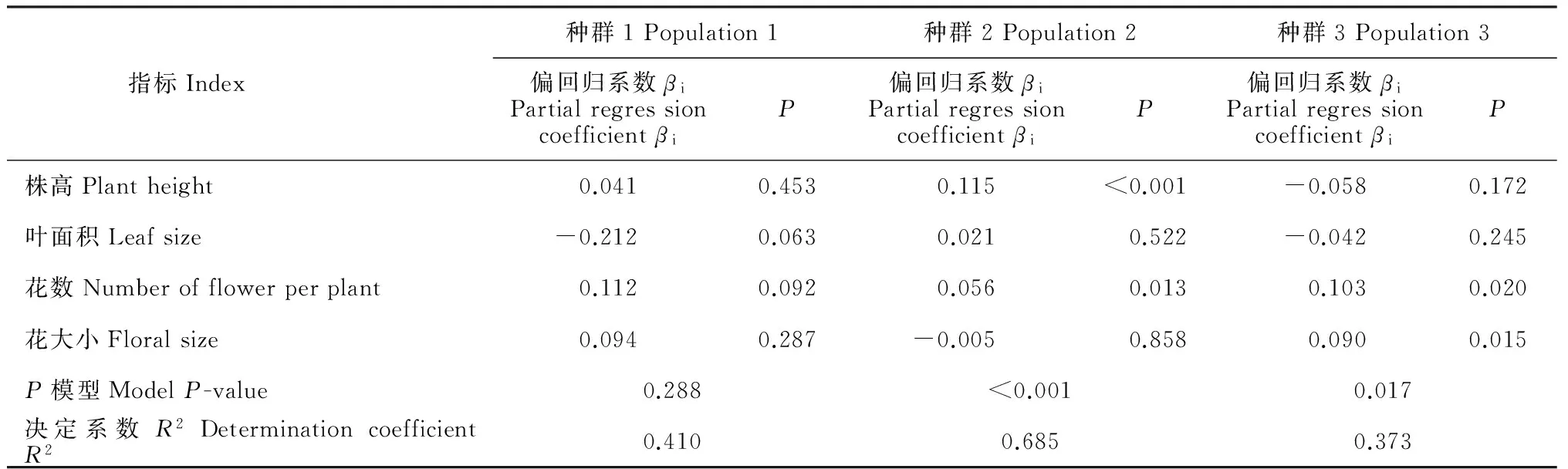
表5 全缘叶绿绒蒿各性状在不同海拔种群间的选择梯度
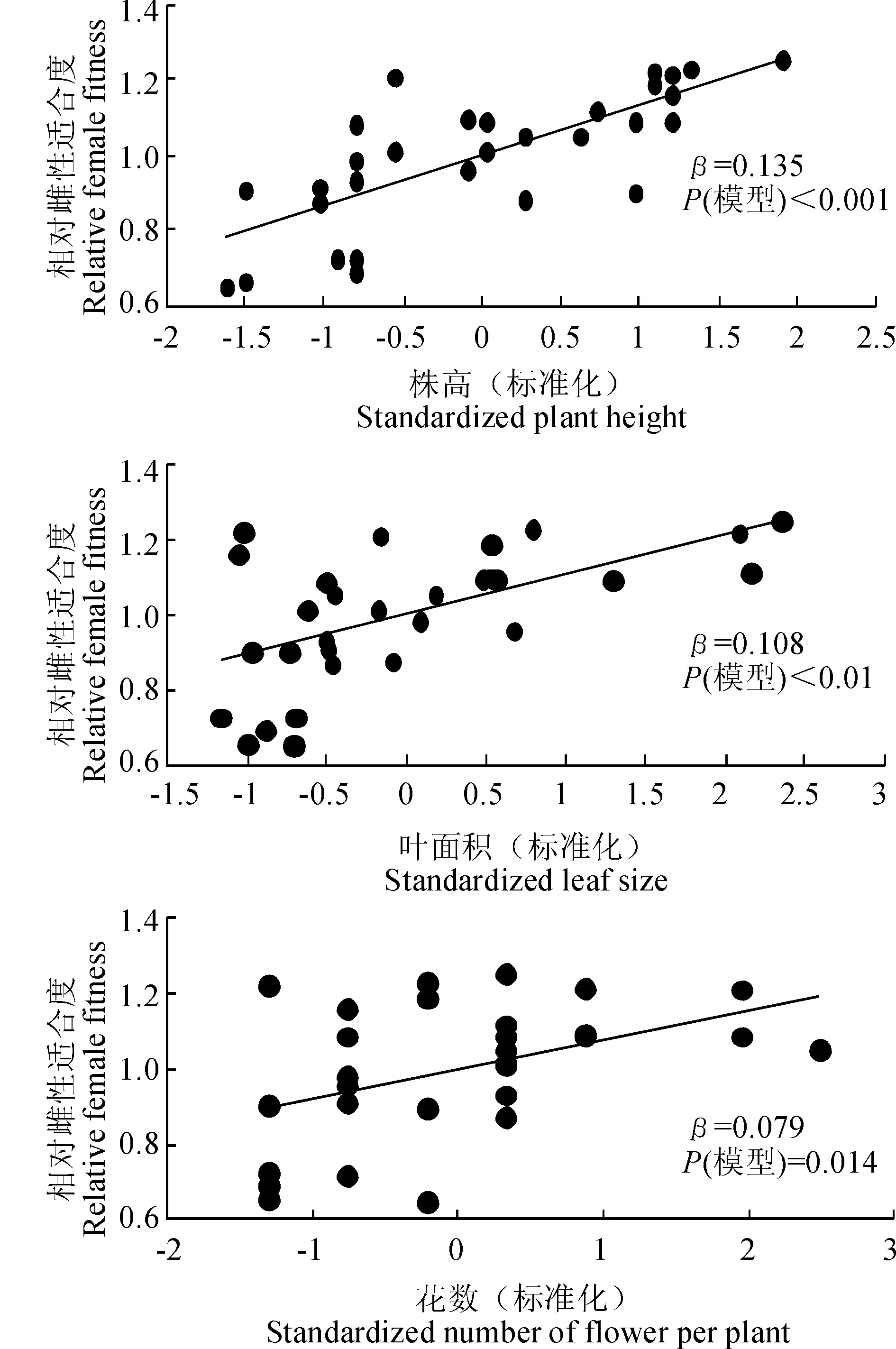
图2 种群2全缘叶绿绒蒿相对雌性适合度与具有显著选择差的性状的关系Fig. 2 Relationships between relative female fitness and traits with significant selection differential in population 2 of M. integrifolia
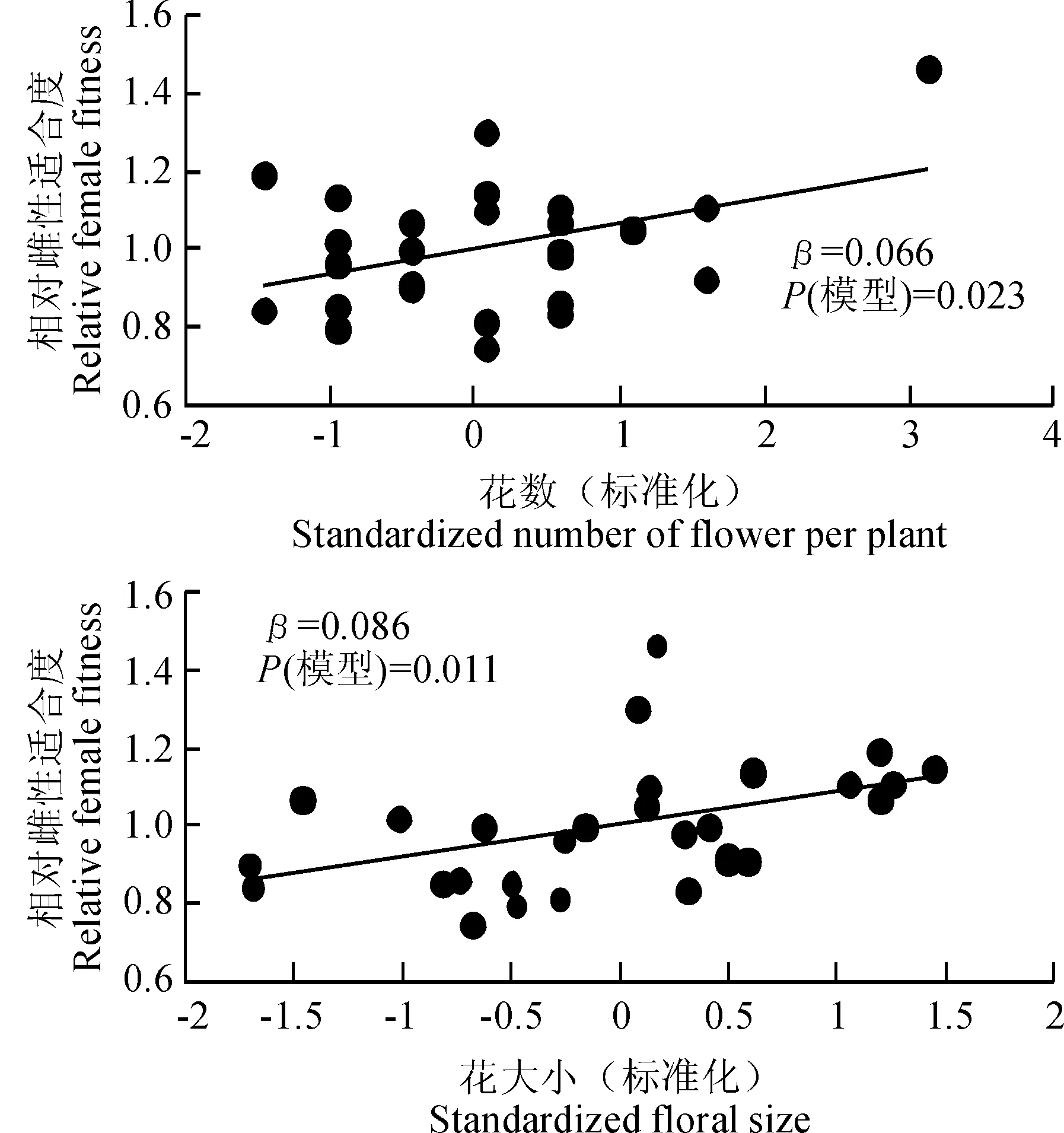
图3 种群3全缘叶绿绒蒿相对雌性适合度与具有显著选择差的性状的关系Fig. 3 Relationships between relative female fitness and traits with significant selection differential in population 3 of M. integrifolia.
3 讨 论
3.1不同海拔植株性状、花特征的变化
全缘叶绿绒蒿的株高、叶面积、花数、花大小及单果结实数在不同海拔种群间均存在显著差异。海拔越高的种群中株高越矮、叶面积越小、花数越少、花越小、单果结实数越低。高山植物中,营养器官的生物量和资源投入会随着海拔的升高而呈现出逐渐降低的趋势,使得株高、叶面积等性状呈现下降[19-21]。由于资源限制的存在,随着海拔的升高,大多数高山植物会选择减少对营养器官、繁殖器官绝对资源量的投入,但会增加对繁殖器官相对资源量的投入,即随着海拔升高,繁殖器官生物量的比重会增加。在很多植物中,花特征如花数、花色、花大小、气味、花蜜、雌雄蕊位置关系、开花物候等受到传粉者的选择作用[11,18,22-23]。如,对花荵科植物胶粘花荵(Polemoniumviscosum)的研究表明,该植物花序高度、花大小随着海拔的变化可能是由传粉者介导的选择作用造成的[24]。对挪威Dovrefjell国家公园的高山植物的研究发现,随着海拔升高,传粉者由以蜂类为主转变为以蝇类为主,植物的花色也由低海拔的bee-blue和UV-blue转变为高海拔的bee-blue-green和green[12]。而对耧斗菜属植物Aquilegiacoerulea连续4年的研究发现,海拔越高,植物花色越蓝;相对于仅有大戟天蛾(Hyleslineata)传粉的种群,在另一种天蛾传粉者Sphinxvashti为主导的种群中个体具有更长的距[10]。不同海拔种群中全缘叶绿绒蒿传粉者的数量、传粉效率存在差异,随着海拔升高,传粉者数量、传粉效率大致呈现降低的趋势[25],加之可能存在的资源限制,造成不同海拔种群间株高、叶面积及花特征的分化。作为一种“温室植物”,全缘叶绿绒蒿更多的采用花内温度的升高以吸引传粉者,作为泛化传粉系统的物种,高海拔种群中的低温可能使得此物种增加对升温机制的选择。因此,对于全缘叶绿绒蒿而言,不同海拔种群间的温度、传粉者的数量、传粉效率以及资源限制可能共同造成其植株性状、花特征在空间上的分化。
3.2不同海拔表型选择的差异
通过相对雌性适合度估计发现,不同海拔种群中全缘叶绿绒蒿植株性状及花特征受到的表型选择存在差异。海拔较低的种群3中,花数和花大小受到显著的正定向选择差和选择梯度;海拔更高的种群2中,株高和花数受到显著的正定向选择差和选择梯度,且叶面积亦受到显著的正定向选择差;海拔最高的种群1中,各性状未受到显著的正定向选择差,但叶面积和花数受到的正定向选择梯度接近显著。传粉者选择具有更多的、更大的花的个体,可能是因为更多的花、更大的花意味着更强的吸引力和更多的访花报酬[26-27],较低海拔种群中,全缘叶绿绒蒿不是优势种且往往与其他草本植物同时开放,在传粉者介导的选择作用下,此类植物采取提高花展示的方式以吸引传粉者,继而维持一定的适合度利益。随着海拔的升高,全缘叶绿绒蒿逐渐成为群落中的优势种,花展示较为突出,此时吸引传粉者成为次要目标,由于资源限制和各器官间资源分配权衡效应的存在[20-21],保障种子的发育成为主要目标,因此传粉者介导的表型选择更多的对株高、叶面积这类获取资源的性状具有选择作用。
植物的株高、叶面积及花特征不仅在空间上存在分化,亦在时间上存在分化。同时,导致植物花特征的因素众多,既包括非生物因素中的温度、光照、水分、资源有限性及分配模式等,又包括生物因素中的传粉者、盗蜜者、植食者、传粉限制等。在以后的研究中,应该弄清传粉者介导花特征的选择是否受到花粉限制的影响,不同传粉者对某一特定花特征的选择强度如何,以及不同年际间、同一生长季内不同花期间传粉者介导花特征的选择作用如何,并更加全面地考虑各花特征及引起花特征分化的各类因素。
[1]STEBBINS G L. Adaptive radiation of reproductive characteristics in angiosperms. I. Pollination mechanism [J].AnnualReviewofEcologyandSystematics, 1970, 1: 307-326.
[2]SCHIESTL F P, PEAKALL R, MANT J G,etal. The chemistry of sexual deception in an orchid-wasp pollination system[J].Science, 2003, 302: 437-438.
[3]PARRA-TABLA V, VARGAS C F. Flowering synchrony and floral display size affect pollination success in a deceit-pollinated tropical orchid[J].ActaOecologica, 2007, 32: 26-35.
[4]ZHAO Z G, HUANG S Q. Differentiation of floral traits associated with pollinator preference in a generalist-pollinated herb,Trolliusranunculoides(Ranunculaceae)[J].InternationalJournalofPlantSciences, 2013, 174(4): 637-646.
[5]MUCHHALA N, THOMSON J D. Going to great length: selection for long corolla tubes in an extremely specialized bat-flower mutualism[J].ProceedingoftheRoyalSocietyB:BiologicalSciences, 2009, 276: 2 147-2 152.
[6]BABU R P, SHRESTHA M, DYER A G,etal. Out of Africa: evidence of the obligate mutualism between long corolla tubed plant and long-tongued fly in the Himalayas[J].EcologyandEvolution, 2015, 22(5): 5 240-5 251.
[7]EHRLÉN J, MÜNZBERGOVZ. Timing of flowering: opposed selection on different fitness components and trait covariation[J].TheAmericanNaturalist, 2009, 173(6): 819-830.
[8]刘乐乐, 刘左军, 杜国祯, 等. 毛茛状金莲花不同花期的花特征和访花昆虫的变化及表型选择[J]. 生物多样性, 2012, 20(3): 317-323.
LIU L L, LIU Z J, DU G Z,etal. Floral traits, pollinator assemblages, and phenotypic selection at different flowering time forTrolliusranunculoides[J].BiodiversityScience, 2012, 20(3): 317-323.
[9]HIRAO A S, KAMEYAMA Y, OHARA M,etal. Seasonal changes in pollinator activity influence pollen dispersal and seed production of the alpine shrubRhododendronaureum(Ericaceae)[J].MolecularEcology, 2006, 15: 1 165-1 173.
[10]BRUNET J. Pollinators of the Rocky Mountain columbine: temporal variation, functional groups and associations with floral trait [J].AnnalsofBotany, 2009, 103: 1 567-1 578.
[11]SUN M, GROSS K, SCHIESTL F P. Floral adaptation to local pollinator guilds in a terrestrial orchid[J].AnnalsofBotany, 2014, 113: 289-300.
[12]ARNOLD S E J, SAVOLAINEN V, CHITTKA L. Flower colours along an alpine gradients, seen through the eyes of fly and bee pollinators[J].Arthropod-PlantInteraction, 2009, 3: 27-43.
[13]TOTLANDØ. Environment-dependent pollen limitation and selection on floral traits in an alpine species[J].Ecology, 2001, 82(8): 2 233-2 244.
[14]TOTLANDØ. Breeding system, insect flower visitation and floral traits of two alpine Cerastium species in Norway[J].Arctic,Antarctic,andAlpineResearch, 2003, 35(2): 242-247.
[15]JACQUEMYN H, MICHENEAU C, ROBERTS D L,etal. Elevational gradients of species diversity, breeding system and floral traits of orchid on Réunion island[J].JournalofBiogeography, 2005, 32: 1 751-1 761.
[16]LANDE R, ARNOLD S J. The measurement of selection on correlated characters[J].Evolution, 1983, 54: 112-123.
[17]STINCHCOMBE J R, AGRAWAL A F, HOHENLOHE P A,etal. Estimating nonlinear selection gradients using quadratic regression coefficients: double or nothing[J].Evolution, 2008, 62(9): 2 435-2 440.
[18]CHAPURLAT E, ÅGREN J, SLETVOLD N. Spatial variation in pollinator-mediated selection on phenology, floral display and spur length in the orchidGymnadeniaconopsea[J].NewPhytologist, 2015, 208: 1 264-1 275.
[19]FABBRO T, KÖRNER C. Altitudinal differences in flower traits and reproductive allocation[J].Flora, 2004, 199: 70-81.
[20]ZHAO Z G, DU G Z, ZHOU X H,etal. Variations with altitude in reproductive traits and resource allocation of three Tibetan species of Ranunculaceae[J].AustralianJournalofBotany, 2006, 54: 691-700.
[21]MILLA R, REICH P B. Multi-trait interactions, not phylogeny, fine-tune leaf size reduction with increasing altitude[J].AnnalsofBotany, 2011, 107: 455-465.
[23]HOPKINS R, RAUSHER M D. Pollinator-mediated selection on flower color allele drives reinforcement[J].Science, 2012, 335: 1 090-1 092.
[24]GALEN C. Measuring pollinator-mediated selection on morphometric floral traits: bumblebees and the alpine sky pilot,Polemoniumviscosum[J].Evolution, 1989, 43: 882-890.
[25]吴 云, 刘玉蓉, 彭 瀚, 等. 高山植物全缘叶绿绒蒿在不同海拔地区的传粉生态学研究[J]. 植物生态学报, 2015, 39(1): 1-13.
WU Y, LIU Y R, PENG H,etal. Pollination ecology of alpine herbMeconopsisintegrifoliaat different altitudes[J].ChineseJournalofPlantEcology, 2015, 39(1): 1-13.
[26]BLARER A, KEASAR T, SHMIDA A. Possible mechanisms for the formation of flowering size preferences by foraging bumblebees[J].Ethology, 2002, 108: 341-351.
[27]HAEDER L D, JOHNSON S D. Darwin’s beautiful contrivances: evolutionary and functional evidence for floral adaptation[J].NewPhytologist, 2009, 183: 530-545.
(编辑:潘新社)
Phenotypic Selection on Plant Traits and Floral Traits at Different Altitudes forMeconopsisintegrifolia
WU Yun1,2,3, ZHANG Niwen4, PENG Han1, LIU Guangli1*
(1 College of Landscape Architecture, Sichuan Agriculture University, Chengdu 611130, China; 2 Key Laboratory of Tropical Forest Ecology, Xishuangbanna Tropical Botanical Garden, Chinese Academy of Sciences, Mengla, Yunnan 666303, China; 3 University of Chinese Academy of Sciences, Beijing 100039, China; 4 Sichuan Aerospace Vocational College, Guanghan Sichuan 618300, China)
We measured plant traits and floral traits ofMeconopsisintegrifoliaat different altitude populations (4 452 m, 4 081 m, 3 681 m), collected ripe fruits in the end of flowering and counted seed production per fruit to estimate the overall phenotypic selection differential and selection gradient. We used one-way ANOVA analysis to estimate variations of plant traits, floral traits and seed production per fruit at different altitude populations. We evaluated phenotypic selection (selection differential and selection gradient) on plant traits (plant height and leaf size), floral traits at different altitudes populations using multi linear regression model. The results showed that: (1) there were significant reducing of plant traits, floral traits and seed production with the increasing altitude. The higher altitude, the lower plant height, the smaller leaf size, the lower number of flower per plant, the smaller floral size and the lower seed production per fruit were in population. (2) We found significant differences on phenotypic selection of plant traits and floral traits at different altitude populations. In particularly, there were significant selection differential and selection gradient on number of flower per plant and floral size in population 3 (3 681 m); however, plant height, leaf size and number of flower per plant were more likely to be chosen in population 2 (4 081 m); interestingly, selection differential and selection gradient on leaf size and number of flower per plant were marginal significant in population 1 (4 452 m). (3) Our results indicated that divergent altitudes might lead to different phenotypes, floral traits were more likely to be chosen at lower altitude. By contrast, plant height and leaf size were more likely to be chosen because of rare pollinators and resources limitation at higher altitude.
plant height; leaf size; floral traits; female fitness; phenotypic selection; altitude
1000-4025(2016)07-1443-07
10.7606/j.issn.1000-4025.2016.07.1443
2016-03-16;修改稿收到日期:2016-05-21
国家自然科学基金(31370436)
吴 云(1989-),男,在读博士研究生,主要从事高山植物繁殖生态、进化生态学研究。E-mail: wuyun15902858767@163.com
刘光立,副教授,硕士生导师,主要从事园林植物栽培与应用研究。E-mail: liugl_1@163.com
Q948.114
A
