小麦β-胡萝卜素异构酶基因定位克隆及表达分析
2016-09-02单丽伟范三红
张 朋,贾 笑,邓 帅,单丽伟,范三红*
(1 西北农林科技大学 生命科学学院,陕西杨陵 712100;2 西北农林科技大学 理学院,陕西杨陵 712100)
小麦β-胡萝卜素异构酶基因定位克隆及表达分析
张朋1,贾笑1,邓帅1,单丽伟2,范三红1*
(1 西北农林科技大学 生命科学学院,陕西杨陵 712100;2 西北农林科技大学 理学院,陕西杨陵 712100)
β-胡萝卜素异构酶(D27)是独脚金内酯(SLs)合成通路的第一个酶。该研究以普通小麦‘中国春’为材料,通过RT-PCR克隆了小麦β-胡萝卜素异构酶对应cDNA(TaD27),并对其在不同组织和低磷胁迫下的表达进行分析。结果显示:(1)克隆获得2个高度同源cDNA片段,分别定位于7A、7D 染色体的长臂,命名为TaD27-7AL和TaD27-7DL;序列分析发现,7B染色体长臂上还存在另一个同源基因TaD27-7BL。(2)3个TaD27基因均包含7个外显子,编码区长度分别为828 bp(7AL)、840 bp(7BL) 和843 bp(7DL) ,编码蛋白的N-端均含有叶绿体转运肽;进化分析表明,植物D27蛋白主要聚集在3个进化枝中,小麦、水稻和玉米等单子叶植物的D27高度同源,聚集在同一进化分枝。(3)组织表达分析表明,TaD27基因在叶、叶鞘和茎中的表达量较高,在幼穗中的表达量相对较低,在根中的表达量最低;低磷胁迫下,TaD27在根中的表达量先下降后升高,胁迫至6~12 h时,表达量达到最低,96 h时基本恢复至初始状态,而在叶中表达量则是先升高后下降,6 h达到峰值,12 h基本恢复到初始水平,随后表达量继续下降。
小麦;D27;染色体定位;基因结构;表达模式
独脚金内酯(SLs)最初在棉花中发现,被认为是一种促进根寄生杂草种子萌发的诱导物[1]。此后的研究发现,SLs还可以促进植物与丛枝菌根真菌形成共生关系[2-3]。2008年,Gomez-Roldan等发现,豌豆多分枝突变体rms1表现出SLs合成缺陷的性状,而外部施加独脚金内酯类似物GR24后,其可恢复至野生型状态,证明了独脚金内酯可以调控植物分枝[4]。植物的分枝是一种重要的形态学性状,因此SLs调控植物分枝的功能受到广泛关注。
SLs是一些萜类内酯的总称,它们源于类胡萝卜素。近年来有关SLs生物合成通路的研究取得了重要进展,目前为止已有4种参与该通路的酶被确认,分别是β-胡萝卜素异构酶(D27)、类胡萝卜素裂解双加氧酶7(CCD7)、类胡萝卜素裂解双加氧酶8(CCD8)和细胞色素P450家族成员MAX1。2012年,Alder等[5]确定了该通路的前三步反应,即D27可催化全反式β-胡萝卜素转化为9-顺-β-胡萝卜素,再由CCD7和CCD8分别进行裂解和分子重排,生成类胡萝卜素内酯(carlactone,CL)。2014年Satoko Abe等[6]利用酵母表达系统获得重组拟南芥AtMAX1,该酶可将 CL转化为类胡萝卜素内酯酸(carlactonoic acid,CLA),其甲酯后的化合物(MeCLA)在体外可与SLs受体蛋白AtD14互作。
D27是SLs合成通路的第一个关键酶,其编码基因(OsD27)最初在水稻矮化突变体dwarf27中发现,这种突变体植株表现出多分枝、株型矮小和SLs合成缺陷的特征,并且在施加外源SLs类似物后,其表型可以恢复至野生型,这表明其与SLs的合成相关。OsD27位于11号染色体上,包含7个外显子,编码一个含有非血红素铁离子的蛋白,定位于叶绿体[7]。Waters等[8]研究发现,拟南芥D27基因(AtD27)在不同组织中的表达模式与MAX3(CCD7)和MAX4(CCD8)不同,其在地上部分的表达量要远远高于根中的表达量,并且AtD27表达量会受到SLs合成匮乏、生长素处理、去除植株顶芽等信号的刺激而上调,但是变化量并不大。低磷胁迫条件下,通常SLs合成量会增加,植株表现出分枝减少、株型矮小、侧根增多等表型[9-11],但是目前关于低磷胁迫下SLs合成相关基因表达量的动态变化研究尚未见报道。Umehara等[9]对水稻SLs合成相关基因OsD10(CCD8)、OsD17(CCD7)和OsD27等在低磷胁迫2周后恢复正常磷营养后的表达量进行了研究,发现其均呈现下降的趋势,并且根部SLs的合成量也会下降,侧芽的生长得到恢复。
目前,关于小麦SLs合成和调控信号通路的研究尚未见报道。本研究以OsD27基因为参考,以EST拼接结果为依据,通过反转录PCR同源克隆到小麦D27(TaD27)基因cDNA,分析了其基因结构、染色体定位和进化关系,并且通过荧光定量PCR的方法分析了其在不同组织和低磷胁迫条件下的表达模式。
1 材料与方法
1.1植物材料
用于组织表达模式研究的部分小麦组织材料来自西北农林科技大学生命科学学院实验田拔节期的‘中国春’(TriticumaestivumL.)。在植株拔节期,分别剥取其叶鞘、幼穗以及紧邻幼穗的茎,用液氮速冻后于-80 ℃保存备用。
用于低磷胁迫下表达模式研究的小麦材料为本实验室保存的‘中国春’种子。小麦幼苗的培养和低磷胁迫方法参考Kaori Yoneyama的方法[12], 将挑选的籽粒饱满的小麦‘中国春’种子用70%酒精消毒2 min,1% NaClO溶液灭菌5 min,腹线朝下置于1个铺有灭菌滤纸的无菌培养皿中,用灭菌水润湿后于4 ℃黑暗条件下放置2 d,然后置于25 ℃黑暗条件下萌发2 d。萌发后的幼苗先用自来水培养5 d,然后用1/2 TT培养基正常培养5 d,之后用去掉磷酸盐的1/2 TT培养基进行低磷胁迫下的培养并开始取样。取样时分别剪下植株的根和叶,用液氮速冻后于-80 ℃保存备用。
1.2方法
1.2.1RNA提取及反转录材料总RNA的提取使用TaKaRa公司的RNAiso Plus,按照说明书提供的方法进行,用琼脂糖凝胶电泳检测RNA完整性,并使用Thermo NanoDrop 1 000核酸蛋白检测仪检测RNA浓度。用于克隆的cDNA第一链的合成使用TaKaRa公司的PrimeScriptTMⅡ 1st Strand cDNA Synthesis Kit,按照说明书方法进行;用于表达模式分析的cDNA的合成使用TaKaRa公司的PrimeScriptTMRT reagent Kit with gDNA Eraser (Perfect Real Time),按照说明书所提供方法进行。
1.2.2小麦TaD27基因克隆以OsD27基因序列为参考,在NCBI上使用Blast工具搜索小麦EST数据库,将得到的高度同源序列进行甄别和拼接。以拼接后序列为模板设计PCR特异引物TaD27-f(5′-AGGCCATAAACATGGAGGCCACCGCA-3′)和TaD27-r(5′-GCTAGCAATTCACACCAT AGTCCTGCTTCGCG-3′)。以合成的cDNA第一链为模板,使用TaKaRa公司的高保真酶PrimeSTAR®HS DNA Polymerase with GC Buffer进行扩增,PCR产物回收后连接至pMD19-T载体,转化至大肠杆菌Top10菌株。挑取阳性克隆送至上海立菲生物技术有限公司(北京)进行测序。
1.2.3TaD27表达分析采用实时荧光定量RT-PCR的方法探究TaD27在不同组织及不同时间低磷胁迫条件下的表达模式。根据TaD27测序后的序列,使用Beacon Designer 8设计RT-PCR引物TaD27-qf(5′- GGCTACCAAGGATTAATAGA-3′)和TaD27-qr(5′-ATCATCACCTTTATCATTGTG-3′)。以小麦β-actin基因为内参,其引物为TaActin-qf(5′-GACCTCACGGATAATCTAATG-3′)和TaActin-qr(5′-ACCATCAGGCATCTCATAG-3′)。RT-PCR反应使用TaKaRa公司的SYBR®Premix ExTaqTMⅡ (Tli RNaseH Plus)试剂盒,按照说明书所提供方法在Bio-Rad CFX96实时定量PCR仪上进行。
1.2.4TaD27基因染色体定位及其蛋白序列比对和进化关系分析利用克隆获得的TaD27基因序列搜素小麦单条染色体survey sequence(http://
www.wheatgenome.org/),获得其同源序列以及各同源序列在染色体上的定位信息。下载同源序列,使用spidey软件比对基因组和cDNA序列,获得基因结构信息。多序列比对和进化树的构建利用MEGA 6完成。进化树构建使用Neibor-joining算法,并使用Bootstrap方法进行检验。
2 结果与分析
2.1小麦TaD27基因克隆及序列分析
提取小麦根组织总RNA,反转录后使用特异引物扩增,获得TaD27 cDNA片段,大小约为800 bp,与预期大小相符(图1)。目标片段连接至克隆载体进行测序,结果显示,该基因包含2个高度相似的同源序列( GeneBank编号为KX168420和KX168421)。用两者分别搜索小麦每一个染色体臂的筛查序列,结果显示,两者分别定位于7AL和7DL上的重叠群chr7AL_4558620和 chr7DL_3370387。另外发现,7BL重叠群chr7BL_6654524上存在另一个D27同源基因。将上述3个同源基因分别命名为TaD27-7AL、TaD27-7BL和TaD27-7DL。基因结构分析显示,3个TaD27基因序列及结构高度一致,均包含7个外显子,编码区长度分别为828 bp(7AL)、840 bp(7BL)和843 bp(7DL)。三者基因结构与二穗短柄草、水稻等单子叶植物高度一致(表1)。
3种小麦D27蛋白序列比对结果如图2所示,三者的序列极度一致,尤其是TaD27-7BL和TaD27-7DL,它们之间仅有2个氨基酸残基的差异。
M. NEB 100 bp DNA ladder;1.TaD27 cDNA图1 TaD27 cDNA琼脂糖凝胶电泳Fig. 1 Agarose gel electrophoresis of TaD27 cDNA
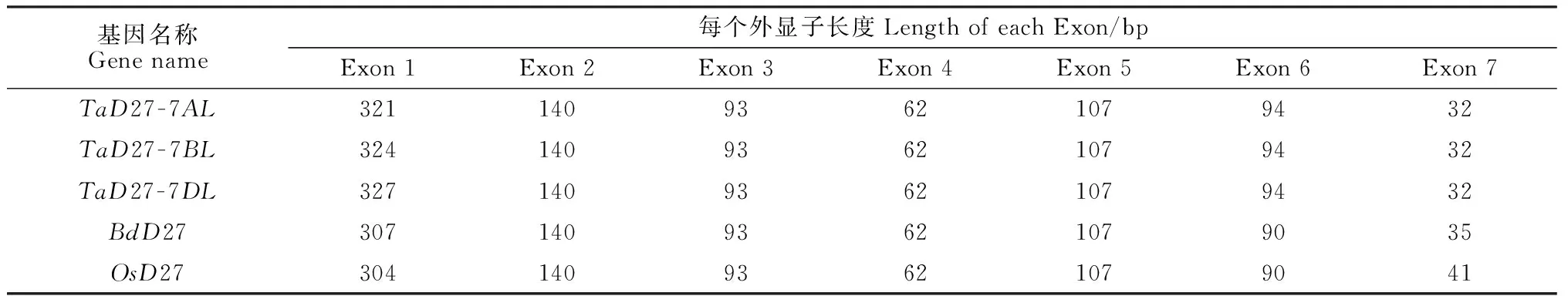
基因名称Genename每个外显子长度LengthofeachExon/bpExon1Exon2Exon3Exon4Exon5Exon6Exon7TaD27-7AL32114093621079432TaD27-7BL32414093621079432TaD27-7DL32714093621079432BdD2730714093621079035OsD2730414093621079041
三者N-末端均包含一段叶绿体转运肽,该部分保守性稍低。结构域分析显示,TaD27中包含一个功能未知的DUF4033结构域,该结构域位于TaD27-7AL序列的175~256之间。
2.2小麦TaD27系统发育分析
用MEGA6软件对来自不同植物的D27蛋白进行比对后构建进化树。结果显示(图3),D27蛋白主要分布于3个相对独立进化枝中,小麦、二穗短柄草、水稻、玉米等单子叶植物处于同一相对独立进化分枝中;苜蓿、苹果、番茄、葡萄等双子叶植物处于同一相对独立的进化枝中;藻类则处于单独的一个进化枝中。小麦的TaD27与粗山羊草、乌拉尔图小麦、大麦的亲缘关系最近,其中TaD27-7AL与乌拉尔图小麦和大麦亲缘最近,TaD27-7BL、TaD27-7DL与粗山羊草亲缘相近,这符合小麦异源六倍体的进化历史,即A基因组来源于乌拉尔图小麦,D基因组来源于粗山羊草,B基因组来源于拟斯卑尔脱山羊草的近亲。

图2 小麦TaD27同源蛋白的比对Fig. 2 Alignment of wheat TaD27 homologous proteins

图中分支点的数字表示基于500次重复该节点的自展支持率;标尺代表遗传距离图3 小麦TaD27基因的系统发育分析The figures at the nodes show the bootstrap values based on 500 replications, and the scale represents the genetic distanceFig. 3 Phylogenetic analysis of wheat TaD27
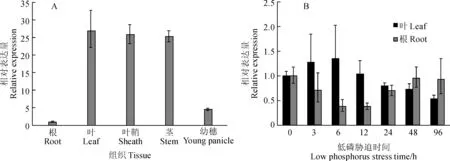
图4 小麦TaD27基因在不同组织(A)和低磷胁迫(B)下的表达模式Fig. 4 Expression pattern of wheat TaD27 in different tissues (A) and under low phosphate stress (B)
2.3小麦TaD27基因在不同组织和低磷胁迫下的表达
使用荧光定量PCR法检测TaD27基因在不同组织中的表达水平以及低磷胁迫对其表达量的影响。结果显示,TaD27基因在叶、叶鞘和茎等地上营养组织中表达量最高,在幼穗中的表达量较低,在根中的表达量最低,只有叶中表达量的约1/27(图4,A)。当植株受到低磷胁迫时,TaD27在根中的表达量会先下降,在胁迫3~6 h时表达量降到未受胁迫时的1/3左右,随后,其表达量又会逐渐恢复,在96 h时基本恢复到未受胁迫时的表达量(图4,B)。与根的情况不同的是,叶中TaD27在低磷胁迫条件下的表达量会先轻微上调,在6 h时达到峰值,然后表达量又会下降,胁迫至96 h时,表达量只有初始的一半左右(图4,B)。
3 讨 论
本研究以水稻OsD27基因为参考,同源克隆了小麦TaD27基因。染色体定位表明在小麦7A、7B、7D染色体长臂上各有1个TaD27基因座位。基因的结构分析表明,3种小麦编码区均由7个外显子组成,除了第一个外显子外,其余几个长度完全一致,这种基因结构与二穗短柄草、水稻等单子叶植物也非常一致,说明它们是从共同祖先进化而来。TaD27基因编码的氨基酸序列前端包含1个45个氨基酸残基左右的叶绿体转运肽,这与模式植物水稻和拟南芥D27的研究事实相符。所有植物D27蛋白后端均包含一个DUF4033结构域,该结构域应该与其催化类胡萝卜素异构的功能直接相关,但该结构域如何实现功能,需要更深入的研究。
以前的观点认为SLs应该主要是在根中合成,然后运输到其他部位发挥作用,然而笔者发现,TaD27在植株地上部分(叶、叶鞘和茎)的表达量要远远高于其在根中的表达量。前人分别对水稻D27和拟南芥D27在不同组织中的表达量做过研究,均发现D27在根中的相对表达量并不高[7-8]。近些年,2种新的调控D27基因表达的GRAS型转录因子NSP1和NSP2的发现表明,可能存在一种通过控制D27基因的表达量来调控SLs合成量的信号途径[13],这种信号途径可能无需SLs的跨组织运输即可完成对外部环境刺激的应答。还有研究发现,根对外部矿物营养的响应策略取决于其是否依赖外部的丛生菌根真菌(AM)提供的矿物营养,这导致有根瘤固氮的红三叶草(TrifoliumrepensLinn)[14]、无根瘤固氮但依赖AM共生的高粱[12]和不依赖AM共生的白羽扇豆(Lupinusalbus)[15]受到低磷胁迫时采取了不同的SL合成策略。由此,笔者推测,根受到外部营养匮乏信号刺激时SLs的大量合成主要用于分泌并诱导共生的AM的分枝来获得更多的矿物营养,而不是向上运输,抑制分枝的SLs可能来自于地上组织,这也与植株根部D27基因的表达量相对于地上部分更低的事实相符。
在本研究中,TaD27在低磷胁迫下的表达在根中和叶中呈现不同的模式,在根中的表达量先下调后上调,而叶中却是先上调后下调,笔者推断,这可能与这两种组织营养储备状况相关。当受到低磷胁迫时,根和叶都要做出提高SLs合成量的响应,但根中相对较小的营养物质储存量造成TaD27表达会短时下调,当营养状况通过跨组织运输得到改善后,其表达量又开始上升;而叶由于营养储备丰富,因此可以短时内增加TaD27表达量,当SLs积累后,通过负反馈作用抑制自身的继续合成,因此TaD27表达量又开始下调。本研究中所取的低磷胁迫的时间范围内,TaD27的表达量变化不大,未来的研究中应该增加胁迫时间,以期看到其表达量随低磷胁迫时间变化的全貌。同时,关于根部的“低磷信号”是如何传导至地上部分并调控其SLs合成途径的问题尚待解决。
[1]COOK C E, WHICHARD L P, TURNER B,etal. Germination of witchweed (StrigaluteaLour.): isolation and properties of a potent stimulant[J].Science, 1966, 154(3 753):1 189-1 190.
[2]AKIYAMA K, MATSUZAKI K, HAYASHI H. Plant sesquiterpenes induce hyphal branching in arbuscular mycorrhizal fungi[J].Nature, 2005, 435(7 043):824-827.
[3]DOR E, JOEL D M, KAPULNIK Y,etal. The synthetic strigolactone GR24 influences the growth pattern of phytopathogenic fungi[J].Planta, 2011, 234(2):419-427.
[4]GOMEZ-ROLDAN V, FERMAS S, BREWER P B,etal. Strigolactone inhibition of shoot branching[J].Nature, 2008, 455(7 210):189-194.
[5]ALDER A, JAMIL M, MARZORATI M,etal. The path from β-carotene to carlactone, a strigolactone-like plant hormone[J].Science, 2012, 335(6 074):1 348-1 351.
[6]ABE S, SADO A, TANAKA K,etal. Carlactone is converted to carlactonoic acid by MAX1 inArabidopsisand its methyl ester can directly interact with AtD14invitro[J].Proc.Natl.Acad.Sci. U S A, 2014, 111(50):18 084-18 089.
[7]LIN H, WANG R, QIAN Q,etal. DWARF27, an iron-containing protein required for the biosynthesis of strigolactones, regulates rice tiller bud outgrowth[J].ThePlantCell, 2009, 21(5):1 512-1 525.
[8]WATERS M T, BREWER P B, BUSSELL J D,etal. TheArabidopsisortholog of rice DWARF27 acts upstream of MAX1 in the control of plant development by strigolactones[J].PlantPhysiology, 2012, 159(3):1 073-1 085.
[9]UMEHARA M, HANADA A, MAGOME H,etal. Contribution of strigolactones to the inhibition of tiller bud outgrowth under phosphate deficiency in rice[J].Plant&CellPhysiology, 2010, 51(7):1 118-1 126.
[10]KAPULNIK Y, DELAUX P M, RESNICK N,etal. Strigolactones affect lateral root formation and root-hair elongation inArabidopsis[J].Planta, 2011, 233(1):209-216.
[11]KOHLEN W, CHARNIKHOVA T, LIU Q,etal. Strigolactones are transported through the xylem and play a key role in shoot architectural response to phosphate deficiency in nonarbuscular mycorrhizal hostArabidopsis[J].PlantPhysiology, 2011, 155(2):974-987.
[12]YONEYAMA K, XIE X, KUSUMOTO D,etal. Nitrogen deficiency as well as phosphorus deficiency in sorghum promotes the production and exudation of 5-deoxystrigol, the host recognition signal for arbuscular mycorrhizal fungi and root parasites[J].Planta, 2007, 227(1):125-132.
[13]LIU W, KOHLEN W, LILLO A,etal. Strigolactone biosynthesis inMedicagotruncatulaand rice requires the symbiotic GRAS-type transcription factors NSP1 and NSP2[J].ThePlantCell, 2011, 23(10):3 853-3 865.
[14]YONEYAMA K, YONEYAMA K, TAKEUCHI Y,etal. Phosphorus deficiency in red clover promotes exudation of orobanchol, the signal for mycorrhizal symbionts and germination stimulant for root parasites[J].Planta, 2007, 225(4):1 031-1 038.
[15]YONEYAMA K, XIE X, SEKIMOTO H,etal. Strigolactones, host recognition signals for root parasitic plants and arbuscular mycorrhizal fungi, from Fabaceae plants[J].TheNewPhytologist, 2008, 179(2):484-494.
(编辑:宋亚珍)
Cloning, Mapping and Expression Analysis of β-carotene Isomerase Encoding Genes in Wheat (TriticumaestivumL.)
ZHANG Peng1, JIA Xiao1, DENG Shuai1, SHAN Liwei2, FAN Sanhong1*
(1 College of Life Science, Northwest A&F University, Yangling, Shaanxi 712100, China; 2 College of Science, Northwest A&F University, Yangling, Shaanxi 712100, China)
β-carotene isomerase (D27) is the first enzyme involved in strigolactones biosynthesis. In this study, the cDNAs encoding β-carotene isomerase (TaD27) were cloned from wheat cultivar Chinese Spring by RT-PCR. Further, their expression in different tissues and under low phosphate stress were analysed by Real-time Quantitative PCR. The result showed that: (1) TwoTaD27 cDNAs were cloned, which was maped on the long arms of 7A and 7D chromosome, respectively (namedTaD27-7ALandTaD27-7DL). In addition, we found another locus located on chromosome 7BL encoding the third homolog (TaD27-7BL) by sequence analysis. (2) Each of the threeTaD27s contains 7 exons composing an ORF of 828 bp (7AL), 840 bp(7BL) or 843 bp (7DL), respectively and encodes a protein containing a chloroplast transit peptide at N-terminal. Phylogenetic analyses indicated that D27s in plants clustered into three independent clades. TaD27s share a high level of identity with orthologs in other monocots such asOryzasativaandZeamays, as a result, they are clustered in the same clade. (3) The expression level ofTaD27 is relatively high in leaves, sheaths and stems, lower in young panicles, and lowest in roots. Under low phosphate stress the expression ofTaD27 in roots is down regulated to the bottom in 6-12 h firstly, and then it rises to the normal level after 96 h. On the contrary, the expression ofTaD27 in leaves is up regulated in early stage and the peak is at 6h, then it continuously drops to a relatively low point at 96 h.
wheat;D27; chromosomal localization; gene structure; expression pattern
1000-4025(2016)07-1315-06
10.7606/j.issn.1000-4025.2016.07.1315
2016-04-29;修改稿收到日期:2016-05-26
中央高校基本科研业务费专项(2014YB032)
张朋(1988-),男,在读硕士研究生,主要从事植物分子生物学研究。E-mail: 1010178322@qq.com
范三红,博士,副教授,主要从事分子生物学及生物信息学研究。E-mail: shfan@nwsuaf.edu.cn
Q785;Q786
A
