香蕉叶片发育过程中不同甲酯化程度果胶的变化
2016-09-02李小泉陈厚彬徐春香
马 娟, 范 韦, 李小泉, 陈厚彬, 谢 玲, 刘 静,吴 茜, 袁 梦, 徐春香*
(1 华南农业大学 园艺学院,广州 510642;2 广西农业科学院生物技术研究所,南宁 530007)
香蕉叶片发育过程中不同甲酯化程度果胶的变化
马娟1, 范韦1, 李小泉2, 陈厚彬1, 谢玲1, 刘静1,吴茜1, 袁梦1, 徐春香1*
(1 华南农业大学 园艺学院,广州 510642;2 广西农业科学院生物技术研究所,南宁 530007)
采用免疫荧光标记技术,利用5种识别不同甲酯化程度聚半乳糖醛酸(HGs)果胶及香蕉果胶甲酯酶(PME)的单克隆抗体,对不同株龄香蕉叶片中PME及不同甲酯化程度的HGs定位、相对含量以及PME活性的变化进行分析,为探讨HGs和PME在香蕉生长发育及抵抗逆境过程中的功能和生理机制奠定基础。结果显示:(1)PME主要在组培苗的叶肉和保卫细胞中表达,其表达量及其酶的活性均随着香蕉株龄的增长而呈现下降趋势。(2)叶肉细胞也是各类不同甲酯化程度HGs的主要分布区域,其含量随着香蕉株龄的增长有不同程度的下降,但不同HGs在叶肉细胞中的含量以及在表皮、保卫细胞及叶脉中的分布模式不尽相同,保卫细胞中HGs的甲酯化程度较高。研究表明,香蕉的叶肉细胞是PME及这5种不同甲酯化程度HGs的主要分布场所,且这些HGs在香蕉发育过程中的含量变化趋势与PME相似。
香蕉;聚半乳糖醛酸(HG);免疫定位;叶片;果胶甲酯酶(PME)
植物细胞壁中的果胶多糖是植物初生细胞壁的主要成份,除了在植物的生长发育过程中起结构支持、物质运输等作用外,还具有抵御逆境的作用:植物在遭受低温、病虫害等各种逆境胁迫后,包括果胶在内的细胞壁成份的含量与结构均会发生改变,从而改变细胞壁的机械特性以适应新的环境[1-11]。聚半乳糖醛酸(homogalacturonan, HG)是植物细胞壁中最丰富的果胶多糖。HG是由线形的α-1,4糖苷键相连而成的多聚半乳糖醛酸,能被果胶甲基转移酶在高尔基体中甲酯化并以高度(70%~80%)甲酯化的形式沉积在细胞壁中[3, 12]。细胞壁中高度甲酯化的HG能被果胶甲酯酶(pectin methylesterase, PME)脱酯[4],从而形成甲酯化程度不同果胶,进而影响植物细胞壁的坚韧程度及其抗性。可见,PME是影响细胞壁果胶甲酯化程度的关键酶,在植物的生长发育[13-20]以及对逆境的抵抗过程中起着调控作用[9, 19-20]。PME是目前植物生物学研究中的一个热点问题,然而迄今为止,对其结构、生理功能及其作用机制都还不很清楚[13]。对PME及HGs在植物细胞中的定位、含量及其组成与结构等进行研究具有重要的意义。
植物细胞壁多糖结构复杂,分子量大且呈动态变化,致使至今直接对这些多功能的成份进行纯化与分析的技术还不成熟[21]。利用特异抗体的免疫定位技术能够对细胞壁中抗原成份的时空分布进行精准的研究,从而研究它们的功能,是研究结构与功能极其复杂且呈动态变化的植物细胞壁果胶的理想选择[22]。前人利用该技术探讨了果胶在植物根系[9, 23]、茎尖[24]、花器官[25-26]、胚胎[27]等组织器官中的定位分布情况。叶片是植物最重要的器官之一,然而各种不同果胶成份在植物叶片中的含量与分布情况尚不明了。有关PME在植物组织器官中的分布定位情况仅见对其在亚麻(LinumusitatissimumL.)下胚轴中的报道[28]。
香蕉(Musaspp.)是一种巨型草本植物,叶片侧脉发达以支撑巨大叶身。香蕉不同株龄植株其叶片在叶面积上相差巨大因而在侧脉发达程度上也差距明显。本研究以不同株龄香蕉叶片为研究对象,采用免疫荧光标记技术,利用识别不同甲酯化程度HGs及香蕉PME的单克隆抗体,对PME及其影响下的各种不同甲酯化程度HGs的组织细胞定位和相对含量及PME酶活性变化进行了探讨,以期为进一步研究其在香蕉生长发育及抵抗逆境过程中的生物学功能提供参考。
1 材料和方法
1.1植物材料
供试材料选用中国主栽香蕉品种‘巴西蕉’(Musaspp. AAA cv. ‘Baxijiao’)。供试香蕉株龄分别为在生根培养基上培养4 周的香蕉组培苗,在基质中培养2个月的袋苗(移载前)及抽蕾期的香蕉植株。取叶部位均为第一片完全展开叶基部三分之一处,由主脉起沿侧脉取样。
1.2固定包埋
样品用含3.7%(v/v)甲醛的MSTB固定缓冲液[50 mmol·L-1PIPES (piperazine-N, N’-bis (2-ethanesulfonic acid), sodium salt), 5 mmol·L-1MgSO4·7H2O, 5 mmol·L-1EGTA (ethylene glycol-bis(2-aminoethylether)-N, N, N’, N’-tetraacetic acid, pH 6.9]进行固定。经梯度脱水后用Steedman’s蜡[29]包埋。切片厚度为8 μm。
1.3PME活性测定
参照Marcus和Sehejter[30]的方法进行。
1.4免疫荧光标记
所用抗体相关信息见表1,包括PME及分别识别不同甲酯化程度的HG抗体。其中,JIM5、JIM7、LM19和LM20抗体的免疫荧光标记步骤参照文献[31]的方法进行,而2F4抗体则参照文献[32]的方法进行。
2 结果与分析
2.1PME在香蕉叶片中的分布
PME是植物生长发育过程中影响果胶甲酯化程度的关键酶,能脱去沉积在细胞壁中高度(70%~80%)甲酯化的HG上的酯从而形成甲酯化程度不同的果胶。从图1中可以看出:在香蕉组培苗的叶片中,叶肉和保卫细胞中PME的表达量非常高,叶脉其次(其中的韧皮细胞较高),叶片上、下表皮最低(图1,A)。袋苗叶片PME的表达模式与组培苗的相近,此时叶脉维管组织更加发达,韧皮细胞中PME的表达量高于周围叶脉维管组织的维管束鞘(bundle sheath, BS)细胞(图1,B)。但抽蕾期叶片的叶肉细胞和维管束鞘中PME表达量明显降低,叶脉韧皮部的信号仍较强,而叶表皮细胞的信号甚至有所增强,叶表皮与叶肉间的细胞层中的PME信号与表皮的相当,靠近上表皮的厚壁组织(screnchyma, Sc)中有较强的PME信号,但靠近下表皮的则没有(图1,C~E)。此外,在叶脉间木质部中也观察到了很强的荧光信号(图1,F)。
表1 本试验所用的单克隆体及其二抗
注:除PME外,其余一抗均购自英国 PlantProbes (http://www.plantprobes.net/index.php),二抗购自Sigma。
Note:All antibodies used in the present study except PME were from PlantProbes (http://www.plantprobes.net/index.php), UK. All the second antibodies were from Sigma
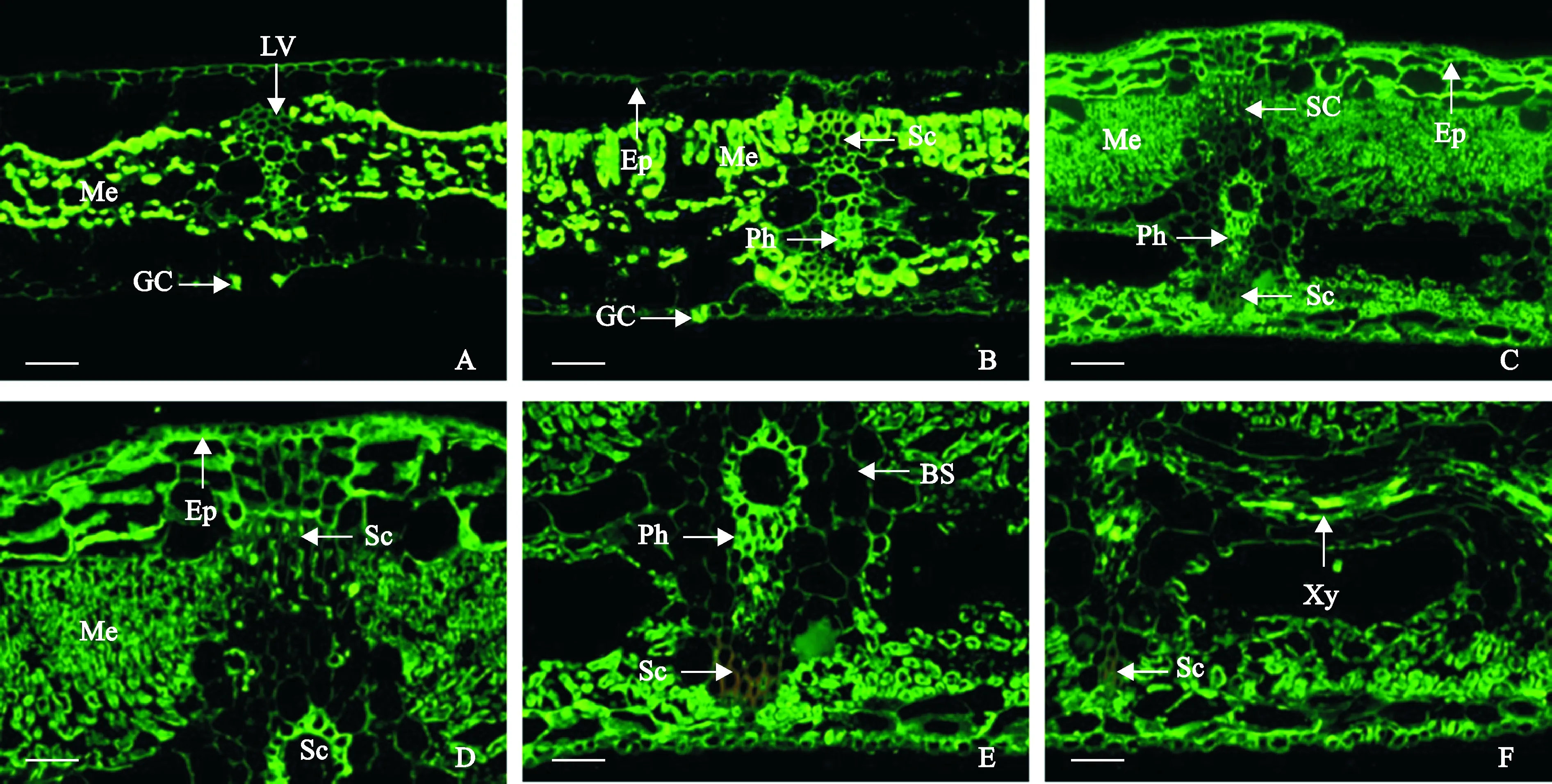
A. 组培苗;B.袋苗;C. 抽蕾期植株;D、E. C的放大;F. 抽蕾期植株叶脉间的木质部。A, B, D, E和F 标尺=50 μm,C标尺=100 μm。Ep. 表皮;GC. 保卫细胞;LV. 叶脉;Me. 叶肉;Ph. 韧皮部;Sc. 厚壁组织;Xy. 木质部图1 果胶甲酯酶在不同株龄香蕉叶片中的免疫定位A. Tissue-cultured seedlings;B, Bag seedlings;C. Inflorescence emerging plants;D and E. Detail observations of C;F. The xylem of inflorescence emerging plants. A,B,D,E and F Bar=50 μm, C Bars=100 μm. Ep. Epidermis; GC. Guard cell; LV. Leaf vein; Me. Mesophyll; Ph. Phloem; Sc. Sclerenchyma; Xy. XylemFig. 1 Immunolocalization of pectin methylesterase in banana leaves at different developmental stages

图中数据为3 次重复的平均值。图上不同字母表示经差异显著性分析(邓肯氏)在0.01 水平存在显著差异;T. 组培苗;B. 袋苗;I. 抽蕾期植株图2 不同株龄香蕉叶片中果胶甲酯酶活性Data in the figure were the average of 3 repetitions. The different letter on the top of the column indicated significant difference at 0. 01 level using Duncan’s Multiple Range Test. T. Tissue-cultured seedlings; B. Bag seedlings; I. Inflorescence emerging plantsFig. 2 The enzyme activity of PMEs in banana leaves at different developmental stages
2.2不同株龄香蕉叶片的PME活性
为了更好地验证香蕉叶片发育过程中PME表达量的变化趋势,对不同株龄叶片中PME的活性进行了分析。结果(图2)显示,随着香蕉株龄的增长,其叶片中PME活性呈下降趋势,尤其是袋苗和抽蕾期植株之间的差异达到极显著水平。
2.3不同甲酯化程度HGs在香蕉叶片中的分布
2.3.1高甲酯化程度HG在香蕉叶片中的分布LM20抗体所识别的抗原为高度甲酯化的HG。从图版Ⅰ中可以看出:随着香蕉植株年龄的增长,这种高度甲酯化的HG在香蕉叶片中的含量呈下降趋势(图版Ⅰ, A~C)。组培苗阶段,叶肉及保卫细胞的含量最高,其次为表皮细胞,而叶脉维管组织中则几乎观察不到LM20的信号(图版Ⅰ, A);袋苗阶段,LM20抗原在香蕉叶片中的分布模式与组培苗阶段相同,但含量水平有所下降(图版Ⅰ, B);抽蕾阶段,叶肉细胞中LM20抗原降至很低,其中保卫细胞以及叶表皮与叶肉间的细胞层中的含量稍高(图版Ⅰ, C)。
JIM7抗体识别部分甲酯化的HG,其甲酯化程度最高可以达到80%。组培苗阶段,叶片保卫细胞和叶肉细胞的JIM7信号非常强,叶脉维管组织和叶表皮的信号也较强,但略弱于保卫细胞和叶肉细胞的(图版Ⅰ, D)。袋苗阶段的叶片中JIM7信号的分布模式未发生明显变化,但信号强度略有下降(图版Ⅰ, E)。抽蕾期的叶片,在靠近上表皮的厚壁组织与表皮间的细胞信号最强,其次是叶肉和保卫细胞。此时维管组织已非常发达,叶脉维管组织的分结维管束鞘信号相对较弱,而韧皮细胞的信号基本与叶肉细胞的接近。此外,叶脉间的木质细胞及靠近上表皮的厚壁细胞中也可以观察到稍弱于叶肉细胞但强于分结维管束鞘的信号,但靠近下表皮的厚壁组织几乎没有信号(图版Ⅰ, F)。
2.3.2低甲酯化程度HG在香蕉叶片中的分布JIM5抗体所识别部分甲酯化的HG,抗原甲酯化程度最高为40%。JIM5抗体的抗原在香蕉叶片中含量不如JIM7的丰富。组培苗与袋苗阶段,JIM5抗原主要富集在叶肉细胞中,表皮细胞次之,叶脉组织含量最低(其中韧皮部细胞含量相对较高)。偶尔可以在保卫细胞中观察到稍强于其他表皮细胞的JIM5信号(图版Ⅰ, G~H)。抽蕾期,叶肉细胞中的抗原水平明显下降而其表皮细胞及叶脉维管组织中的信号强度变化不明显。靠近上表皮的厚壁组织中有弱的JIM5信号,而靠近下表皮的则没有(图版Ⅰ, I)。
LM19抗体识别甲酯化程度很低的HG。从图中可以看出:LM19抗体的抗原在香蕉叶片中的含量与LM20的接近,但其在叶片中的含量没有明显随着香蕉植株年龄的增长而下降(图版Ⅰ, J~L)。其中,组培苗和袋苗阶段,LM19抗原也是主要富集在叶肉细胞中,其次是叶脉和上、下表皮,保卫细胞中并没有明显较其他表皮细胞更强的信号,叶脉组织中韧皮部的信号稍强于分结维管束鞘的(图版Ⅰ, J~K);抽蕾期,叶肉细胞和叶脉组织分结维管束鞘中的信号减弱,相比较而言,海棉组织的信号强于栅栏组织的,表皮细胞的信号与海棉组织的相近(图版Ⅰ, L)。
2.3.3脱酯HG在香蕉叶片中的分布2F4抗体识别钙联未甲酯化的HG。总体而言2F4在香蕉叶片中的含量非常低。在组培苗和袋苗叶片中,叶肉细胞中有中弱信号,表皮细胞信号更弱,其他细胞基本没有信号(图版Ⅰ, M~N)。抽蕾时叶肉细胞信号减弱,但在木质细胞及表皮与叶肉细胞间的细胞中可以观察到中等强度的信号(图版Ⅰ, O)。
2.4叶表皮中PME及不同HGs的免疫定位比较
以香蕉组培苗叶片为代表,对PME及5种识别不同类型HGs的抗体在其中的分布与含量情况进行比较。结果表明:PME在保卫细胞中高丰度表达,但其他叶表皮细胞的表达量很低,其中两个细胞交界处(箭头所示)相对较高(图版Ⅱ, A)。LM20抗体识别高度甲酯化HG,这些HG在保卫细胞中的含量明显高于其他表皮细胞中的,其中保卫细胞的内侧信号强度又明显低于外侧的(图版Ⅱ, B)。JIM7抗原在组培苗的保卫细胞信号非常强,其他表皮细胞的信号稍弱于保卫细胞的,保卫细胞的信号在内、外侧细胞壁中的分布较为均匀(图版Ⅱ, C)。JIM5抗体识别低甲酯化的酸性果胶,其在香蕉组培苗叶表皮中的信号强弱与LM20抗体的接近,但只能在极少数的保卫细胞中偶尔观察到强于其他表皮细胞的信号(图版Ⅱ, D)。LM19抗体所识别的HG,其甲酯化程度低于JIM5抗体的,这些HG在叶表皮中的含量比JIM5抗体的略高,保卫细胞的信号只比其他表皮细胞的稍微强一点(图版Ⅱ, E)。2F4抗体所识别的未甲酯化、钙联HG在香蕉表皮中的含量相比其他几种HG成份要低得多,相对稍强的信号主要出现在每两个表皮细胞的外侧交界处(箭头所示)(图版Ⅱ, F)。
2.5叶脉与叶肉中PME及不同HGs的免疫定位比较
图版Ⅱ, G~L是PME及5种甲酯化程度不同HGs在香蕉组培苗叶片中的定位。PME在叶肉中的表达量非常之高并呈坨状,在叶脉中的表达量较低,其中叶脉韧皮细胞中的表达量相对较高(图版Ⅱ, G)。LM20抗体在香蕉叶脉与叶肉中的分布模式与PME的类似,信号强度整体较PME的弱,叶脉维管组织的分结维管束鞘中几乎观察不到LM20的信号(图版Ⅱ, H)。与LM20抗体不同的是,除叶肉细胞外,JIM7抗体在叶脉组织中的信号也很强(图版Ⅱ, I)。JIM5抗体所识别的酸性果胶在叶肉细胞中含量非常之高,韧皮细胞次之,分结维管束鞘中则几乎检测不到抗原的存在(图版Ⅱ, J)。LM19抗原在叶肉与叶脉中的分布模式与JIM7的较为相似,但整体信号强度低很多,且韧皮细胞的相对信号强度较高,与叶肉细胞的差距没有JIM7抗体的大(图版Ⅱ, K)。未甲酯化、钙联HG在香蕉叶肉与叶脉中的分布模式则与LM20抗体的最为接近,但整体信号微弱,相对较强的信号出现在三细胞交联处(图版Ⅱ, L)。
3 讨 论
高等植物初生细胞壁含有纤维素、半纤维素、包括HG在内的果胶多糖以及结构蛋白。其中果胶无论从结构上还是从功能上,均是最复杂的细胞壁成份,并对细胞壁的理化性状有重要影响[8]。前人曾对果胶在植物根系[9, 23]、茎尖[24]、花器官[25-26]、胚胎[27]等组织器官中的定位分布情况进行了研究,但未见有叶片中果胶分布与含量情况的报道。本研究以不同株龄香蕉叶片为研究对象,采用免疫荧光标记技术探讨了各种不同甲酯化程度HGs的组织细胞定位及相对含量变化情况,发现不同甲酯化程度的HGs均主要分布在香蕉的叶肉细胞中,随着香蕉株龄的增长各种HGs的含量均表现不同程度的下降。这些果胶的降解是在PME及多聚半乳糖醛酸酶和果胶裂解酶等共同作用下完成,最后导致细胞壁结构松弛,使细胞生长加快[36],从而使香蕉叶片不断伸展、叶面积迅速增大。Bédouet等[5]抽提出冬油亚麻(LinumusitatissimumL.)茎和叶中的果酯化果胶成份并进行分析,发现茎中果胶含量随着发育而一直表现下降,然而叶片中的果胶却基本保持稳定。看起来似乎与我们的结果相矛盾,但有一个共同的地方即是香蕉的叶片随着年龄增长其纤维化程度逐渐提高,而亚麻随着年龄的增长纤维化程度提高的部位主要是茎。有研究表明果胶含量的增长会干扰纤维素的合成[37-38],而在香蕉和亚麻中随着年龄的增长果胶含量的下降可能恰巧顺应了纤维素合成增长的需求。
PME是一种普遍存在的酶,广泛存在于所有高等植物中,包括根、茎、叶、花、果等器官[17]。PME催化从HG骨架上转移甲基的反应使HG脱酯,从而影响HG的甲酯化程度[4]。由此可见,PME可通过影响果胶的甲酯化程度从而进一步影响植物的生长发育及对逆境的响应。PME是一个大的基因家族,尽管分子生物学技术的发展使有关PME的研究取得了长足的进展,但迄今为止对其结构、生理功能及其作用机制都还不很清楚[13]。研究PME在植物细胞中的定位有助于对其功能等进行探讨,然而鲜见相关报道。本研究发现香蕉PME主要富集在香蕉的叶肉和保卫细胞中,在从组培苗发育至抽蕾期的过程中,PME的表达量呈下降趋势,尤其是袋苗和抽蕾期植株间的差异达到极显著水平。香蕉叶片发育过程中,PME活性的变化趋势与其表达量结果基本一致。在陆地棉(GossypiumhirsutumLinn.)的纤维发育过程中,GhPME1和GhPME2的表达峰值分别在开花后9 d和4 d出现,然后依次降低,PME在棉花纤维形成与发育过程中起着重要作用[15]。香蕉是一种巨型草本植物,叶片侧脉发达以支撑巨大叶身,而果胶与纤维素等其他细胞壁成份与植物的机械支撑作用密切相关。因此推测香蕉PME也可能在香蕉叶片纤维的形成与发育过程中起着重要作用。此外,本研究在香蕉的叶脉韧皮部及叶脉间的木质部中也观察到高丰度的PME。类似地,Quentin等[28]也发现PME在亚麻下胚轴中的分布是不均匀的,其中表皮、皮层薄壁细胞的连接处以及木质部中PME的表达量较高。他们认为PME常和JIM5识别的酸性果胶可能存在共同表达的现象[39]。本研究中叶肉细胞中同时含有丰富的PME及不同甲酯化程度的HGs,在香蕉的叶肉细胞中是否也存在PME与酸性果胶共同表达的情况有待于进一步验证。
据报道,保卫细胞由放射状排列的纤维素微纤维和果胶组成,并覆有1层角质层[40]。Majewska-Sawka等[41]采用免疫组化方法分析了甜菜(BetavulgarisL.)叶保卫细胞的组成成份,发现JIM7抗原均一地分布在保卫细胞的细胞壁中,但未检测到JIM5所识别的酸性果胶,后者在表皮细胞中含量则比较丰富。这与我们的结果类似:在香蕉叶片的保卫细胞中只富含高度甲酯化的HG,而只能偶尔检测到JIM5所识别的HG,不能检测到未甲酯化、钙联的HG。保卫细胞是运动细胞,通过开闭运动控制进入叶子的气体的量,而它的这种运动能力由果胶所赋予,低的果胶甲酯化程度往往使植物失去弹性[42-43],因此本实验中所获得的结果与上述结论相一致。
总之,植物细胞壁是植物与外界接触的第一道物理屏障,植物细胞壁果胶除了与植物的生长发育密切相关外,还参与植物抵抗生物与非生物胁迫过程。PME是影响细胞壁果胶甲酯化程度的关键酶。本研究探讨了香蕉不同甲酯化程度HGs及PME在香蕉不同株龄叶片中的组织与细胞定位情况及相对含量的变化,可为进一步研究PME及其调控下的HGs对植物生长发育的影响及逆境胁迫的响应机制提供参考依据。
[1]姚敦义,王静之. 细胞壁[J].植物学通报,1988,5(1):18-21.
YAO D Y, WANG J Z. Plant cell wall[J].ChineseBull.Bot., 1988, 5(1): 18-21.
[2]刘家友,喻敏,刘丽屏,等. 铝胁迫下豌豆根边缘细胞和根细胞壁多糖组分含量的变化[J]. 中国农业科学,2009,42(6):1 963-1 971.
LIU J Y, YU M, LIU L P,etal. Differences of cell wall polysaccharides in border cells and root apices of pea (Pisumsativum) under aluminum stress [J].ScientiaAgri.Sinica, 2009, 42(6): 1 963-1 971.
[3]RIDLEY B L, O’NEILLl M A, MOHNEN D. Pectins: structure, biosynthesis and oligogalacturonide-related signaling [J].Phytochem., 2001, 57(6): 929-967.
[4]WILLATS W G T, ORFILA C, LIMBERG G,etal. Modulation of the degree and pattern of methyl-esterification of pectic homogalacturonan in plant cell walls - Implications for pectin methyl esterase action, matrix properties and cell adhesion [J].J.Biol.Chem., 2001, 276(22): 19 404-19 413.
[5]BÉDOUET L, DENYS E, COURTOIS B,etal. Changes in esterified pectins during development in the flax stems and leaves [J].Carbohydr.Polym., 2006, 65(2): 165-173.
[6]MOHNEN D. Pectin structure and biosynthesis [J].CurrOpinPlantBiol., 2008, 11(3): 266-277.
[7]XIE D S, MA L,AMAJ J,etal. Immunohistochemical analysis of cell wall hydroxyproline-rich glycoproteins in the roots of resistant and susceptible wax gourd cultivars in response toFusariumoxysporumf. sp.benincasaeinfection and fusaric acid treatment [J].PlantCellRep., 2011, 30: 1 555-1 569.
[8]WOLF S, GREINER S. Growth control by cell wall pectins [J].Protoplasma, 2012, 249(2): 169-175.
[9]MA L, JIANG S, LIN G M,etal. Wound-induced pectin methylesterases enhance banana (Musaspp. AAA) susceptibility toFusariumoxysporumf. sp.cubense[J].J.Exp.Bot., 2013, 64(8): 2 219-2 229.
[10]KOHORN B D. Cell wall-associated kinases and pectin perception [J].J.Exp.Bot., 2016, 67(2): 489-494.
[11]LI X W, LI Y L, QU M,etal. Cell wall pectin and its methyl-esterification in transition zone determine Al resistance in cultivars of pea (Pisumsativum)[J].FrontPlantSci., 2016, 7: 39.
[12]WOLF S, MOUILLE G, PELLOUX J. Homogalacturonan methyl-esterification and plant development [J].Mol.Plant, 2009, 2(5): 851-860.
[13]刘乐承,曹家树. 植物果胶甲酯酶及其花粉特异基因的分离[J]. 细胞生物学杂志,2007,29:530-534.
LIU L C, CAO J S. Pectin methylesterase and isolation of its pollen-specific genes [J].ChineseJ.Cell.Biol., 2007, 29: 530-534.
[14]刘志勇,李承彧,叶雪凌,等. 大白菜果胶甲酯酶基因BrPME1的克隆及特征分析[J]. 中国农业科学,2011,44(2):325-334.
LIU Z Y, LI C Y, YE X L,etal. Cloning and characterization of a pectin methylesterase geneBrPME1 in Chinese cabbage [J].ScientiaAgri.Sinica, 2011, 44(2): 325-334.
[15]陈婷婷,李旭凯,王如意,等. 棉花GhME1和GhME2基因的克隆及表达分析[J]. 中国农业大学学报,2012,17(5):7-14.
CHEN T T, LI X K, WANG R Y,etal. Cloning and expression analysis ofGhPME1 andGhPME2 in cotton [J].JChinaAgri.Univ., 2012, 17(5): 7-14.
[16]张莉,薛金爱,于浩泉,等. 调控拟南芥花瓣脱落的果胶甲酯酶基因表达和功能分析[J]. 植物生理学报,2012,48(4):350-358.
ZHANG L, XUE J A, YU H Q,etal. The expression and function study of pectin methylesterase genes which regulate and control the petal falling inArabidopsis[J].J.PlantPhysiol., 2012, 48(4): 350-358.
[17]PELLOUX J, RUSÉRUCCI C, MELLEROWICZ E J. New insight into pectin methyl esterase structure and function [J].TrendsPlantSci., 2007, 12(6): 267-277.
[18]SCHELER C, WEITBRECHT K, PEARCE S P,etal. Promotion of testa rupture during garden cress germination involves seed compartment-specific expression and activity of pectin methylesterases [J].PlantPhysiol., 2015, 167(1): 200-215.
[19]唐剑锋,罗湖旭,林咸永,等. 铝胁迫下小麦根细胞壁果胶甲酯酶活性的变化及其与耐铝性的关系[J]. 浙江大学学报(农业与生命科学版) ,2006,32(2):145-151.
TANG J F, LUO H X, LIN X Y,etal. Aluminum-induced changes in cell-wall pectin methylesterase activity of wheat seedlings in relation to their aluminum tolerance [J].JournalofZhejiangUniversity(Agric & Life Sci), 2006, 32(2): 145-151.
[20]BUBICI G, CARLUCCIO A V, CILLO F,etal. Virus-induced gene silencing of pectin methylesterase protectsNicotianabenthamianafrom lethal symptoms caused by tobacco mosaic virus [J].Eur.J.Plant.Pathol., 2015, 141(2): 339-347.
[21]VORWERK S, SOMERVILLE S, SOMERVILLE C. The role of plant cell wall polysaccharide composition in disease resistance [J].TrendsPlantSci., 2004, 9(4): 203-209.
[22]KNOX J P. Revealing the structural and functional diversity of plant cell walls [J].Curr.Opin.PlantBiol., 2008, 11(3): 308-313.
[23]YANG J L, ZHU X F, ZHENG C,etal. Genotypic differences in Al resistance and the role of cell-wall pectin in Al exclusion from the root apex inFagopyrumtataricum[J].AnnBot., 2011, 107(3): 371-378.
[24]SOBRY S, HAVELANGE A, CUTSEM P V. Immunocytochemistry of pectins in shoot apical meristems: consequences for intercellular adhesion [J].Protoplasma, 2005, 225(1/2): 15-22.
[25]O’DONOGHUE E M, SUTHERLAND P W. Cell wall polysaccharide distribution inSandersoniaaurantiacaflowers using immuno-detection [J].Protoplasma, 2012, 249(3): 843-849.
[27]PAN X, YANG X, LIN G M,etal. Ultrastructural changes and the distribution of arabinogalactan proteins during somatic embryogenesis of banana (Musaspp. AAA cv. ‘Yueyoukang 1’) [J].Physiol.Plantarum, 2011, 142(4): 372-389.
[28]QUENTIN M, JAUNEAU A, MORVAN O,etal. Immunolocalization of pectin methyl-esterases in the hypocotyl tissues of flax [J].PlantPhysiol.Biochem., 1997, 35(6): 475-482.
[29]VITHA S, BALUKA F, BRAUN M,etal. Comparison of cryofixation and aldehyde fixation for plant actin immunocytochemistry: aldehydes do not destroy F-actin [J].Histochem.J, 2000, 32(8): 457-466.
[30]MARCUS L, SCHEJTER A. Single step chromatographic purification and characterization of the endopolygalacturonases and pectinesterases of the fungus,BotrytiscinereaPers [J].Physiol.PlantPathol., 1983, 23 (1): 1-13.
[31]XU C X, TAKT, BURBACH C,etal. Developmental localization and the role of hydroxyproline rich glycoproteins during somatic embryogenesis of banana (Musaspp. AAA) [J].BMCPlantBiol., 2011, 11: 38.
[32]XU C X, ZHAO L, PAN X,etal. Developmental localization and methylesterification of pectin epitopes during somatic embryogenesis of banana (Musaspp. AAA)[J].PLoSONE, 2011, 6(8): e22992.
[33]LINERS F, LETESSON J J, DIDEMBOURG C,etal. Monoclonal antibodies against pectin: recognition of a conformation induced by calcium [J].PlantPhysiol., 1989, 91(4): 1 419-1 424.
[34]VERHERTBRUGGEN Y, MARCUS S E, HAEGER A,etal. An extended set of monoclonal antibodies to pectic homogalacturonan [J].Carbohydr.Res., 2009, 344(14): 1 858-1 862.
[35]KNOX J P, LINSTEAD P J, KING J,etal. Pectin esterification is spatially regulated both within cell walls and between developing tissues of root apices [J].Planta, 1990, 181(4): 512-521.
[36]REN C, KERMODE A R. An increase in pectin methyl esterase activity accompanies dormancy breakage and germination of yellow cedar seeds [J].PlantPhysiol., 2000, 124: 231-242.
[37]BURTON R A, GIBEAUT D M, BACIC A,etal. Virus-induced silencing of a plant cellulose synthase gene [J].PlantCell, 2000, 12(5): 691-705.
[38]MANFIELD I W, ORFILA C, MCCARTNEY L,etal. Novel cell wall architecture of isoxaben-habituatedArabidopsissuspension-cultured cells: global transcript profiling and cellular analysis [J].PlantJ., 2004, 40(2): 260-275.
[39]MORVAN O, QUENTIN M, JAUNEAU A,etal. Immunogold localization of pectin methylesterases in the cortical tissues of flax hypocotyl [J].Protoplasma, 1998, 202(3): 175-184.
[40]BECRAFT P W. Development of the leaf epidermis [J].Curr.Top.Dev.Biol., 1999, 45: 1-40.
[41]MAJEWSKA-SAWKA A, MUNSTER A, RODRIGUEZ-GARCIA M I. Guard cell wall: immuncytochemical detection of polysaccharide components[J].J.Exp.Bot., 2002, 53(371): 1 067-1 079.
[42]JONES L, MILNE J L, ASHFORD D,etal. Cell wall arabinan is essential for guard cell function [J].PNAS, 2003, 100(20): 11 783-11 788.
[43]JONES L, MILNE J L, ASHFORD D,etal. A conserved functional role of pectic polymers in stomatal guard cells from a range of plant species [J].Planta, 2005, 221(2): 255-264.
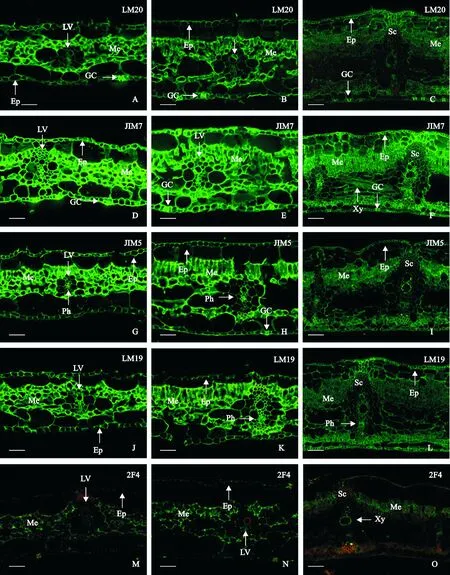
A、D、G、J和M. 组培苗;B、E、H、K和N. 袋苗;C、F、I、L和O. 抽蕾期植株。A、B、D、E、G、H、J、K、M和N Bar=50 μm,C、F、I、L和O Bar=100 μm。Ep. 表皮;GC. 保卫细胞;LV. 叶脉;Me. 叶肉;Ph. 韧皮部;Sc. 厚壁组织;Xy. 木质部图版Ⅰ 不同甲酯化程度聚半乳糖醛酸在不同株龄香蕉叶片中的免疫定位Fig. A, D, G, J and M . Tissue-cultured seedlings; Fig. B, E, H, K and N. Bag seedlings; Fig. C, F, I, L and O. Inflorescence emerging plants. Fig. A, B, D, E, G, H, J, K, M and N. Bars=50 m; Fig. C, F, I, L and O. Bars=100 m. Ep. Epidermis; GC. Guard cell; LV. Leaf vein; Me. Mesophyll; Ph. Phloem; Sc. Sclerenchyma; Xy. XylemPlate Ⅰ Immunolocalization of homogalacturonans at different methyle-esterification degrees in banana leaves at different developmental stages
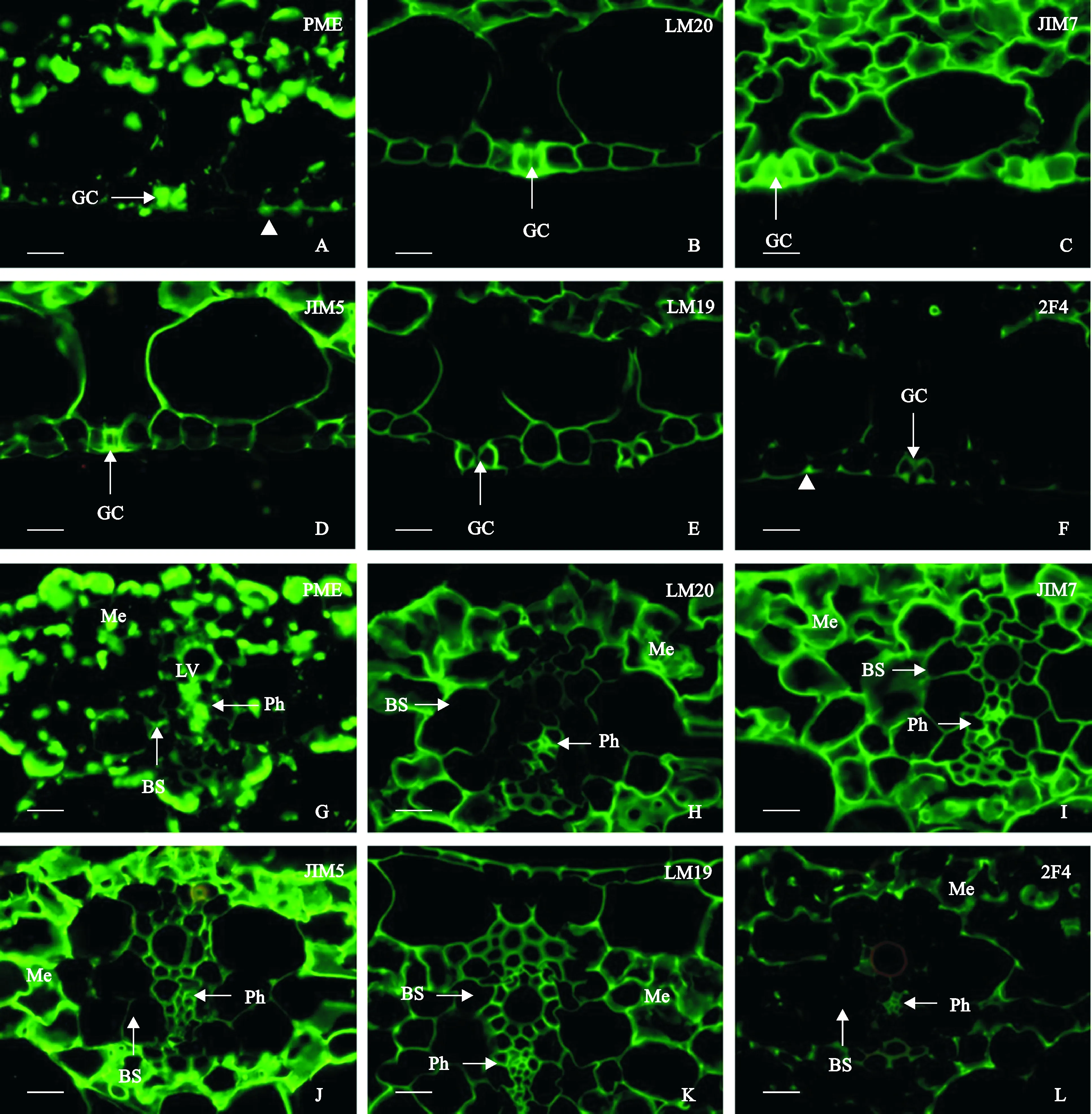
BS. 维管束鞘;GC. 保卫细胞; Me. 叶肉;Ph. 韧皮部。Bar=20 μm图版 Ⅱ 果胶甲酯酶及不同聚半乳糖醛酸在香蕉组培苗叶表皮(A~F)、叶脉及叶肉(G~L)中的免疫定位BS. Bundle sheath; GC. Guard cell; Me. Mesophyll; Ph. Phloem; Bar=20 μmPlate Ⅱ Immunolocalization of Pectin methylesterase. (PME) and different homogalacturonans in the epidermis (A-F), the vein and mesophyll (G-L) of tissue-cultured banana leaves
(编辑:潘新社)
Changes in Homogalacturonans at Different Esterification Degrees during the Development of Banana (Musaspp. AAA) Leaves MA Juan1, FAN Wei1, LI Xiaoquan2, CHEN Houbin1, XIE Ling1, LIU Jing1,
WU Xi1, YUAN Meng1, XU Chunxiang1*
(1 College of Horticulture, South China Agricultural University, Guangzhou 510642, China; 2 Institute of Biotechnology, Guangxi Academy of Agricultural Sciences, Nanning 530007, China)
For better understanding the functions and mechanism of PMEs and HGs in the growth and development of banana and in the defense of banana to the stresses, we traced the spatial and temporal abundance and distribution of banana pectin methylesterases (PMEs) and five homogalacturonans (HGs) at different methyl-esterification degrees (MDs) in banana leaves at different developmental stages using immuno-fluorescence labeling techniques. In addition, enzyme activity of PMEs was also tested. The results indicated that: (1) PMEs located mainly in the mesophyll and guard cells in tissue-cultured banana seedlings. Both the level and activity of PMEs decreased with the development of the plant. (2) HGs at different MDs also mainly appeared in mesophyll cells in tissue-cultured plants and their contents reduced gradually with the development of plants, though the speed varied with each other. However, the distribution of these HGs in the epidermis, the guard cells and the vein of banana leaves showed differential patterns. The MDs of HGs present in the guard cells was relatively high. These results indicated that PMEs and five tested HGs were mainly present in the mesophyll. During the development of banana leaves, the levels of these HGs showed similar trend to that of PMEs.
banana (Musaspp.); homogalacturonan; immuno-localization; leaves; pectin methylesterase
1000-4025(2016)07-1357-09
10.7606/j.issn.1000-4025.2016.07.1357
2016-03-31;修改稿收到日期:2016-07-04
国家自然科学基金(31272117);广东省自然科学基金(2015A030313421);广东省科技攻关(2014A020208111)
马娟 (1988-),女,硕士,从事果树生理研究。E-mail:775338157@qq.com
徐春香,教授,博士生导师,从事果树生理研究。E-mail:chxxu@scau.edu.cn
Q945.6+4
A
