miR-101增强多柔比星对乳腺癌细胞株MDA-MB-435的杀伤活性
2016-08-19张根花张桢浙江省立同德医院浙江杭州310012
张根花,张桢(浙江省立同德医院,浙江杭州310012)
实验研究
miR-101增强多柔比星对乳腺癌细胞株MDA-MB-435的杀伤活性
张根花,张桢
(浙江省立同德医院,浙江杭州310012)
目的探讨microRNA-101(miR-101)增强多柔比星对乳腺癌细胞的杀伤活性及机制。方法用荧光定量PCR方法检测人正常乳腺上皮细胞系MCF-10A及乳腺癌细胞系MCF-7、MDA-MB-231和MDA-MB-435 miR-101的表达水平。MTT法检测miR-101对多柔比星体外杀伤MDA-MB-435能力的影响。利用生物信息学及Western blot方法验证miR-101是否调节MDA-MB-435细胞Mcl-1的表达。构建Mcl-1真核表达载体,MTT法检测Mcl-1表达载体转染对miR-101联合多柔比星杀伤MDA-MB-435细胞疗效的影响。结果(1)多柔比星对转染了miR-101的乳腺癌细胞MDA-MB-435的细胞活力抑制率明显升高(P<0.05或P<0.01);(2)pcDNA3.1-Mcl-1的共转染显著抑制了miR-101联合多柔比星对MDA-MB-435细胞的杀伤活性。结论miR-101通过下调Mcl-1的表达增强多柔比星对乳腺癌细胞的杀伤活性。
miR-101;Mcl-1;乳腺癌;MDA-MB-435;多柔比星
microRNA是一种内源性非编码单链RNA,长度约为19~25个核苷酸,通过与靶基因mRNA的3′非编码区(3′UTR)配对结合发挥生物学功能,下调靶基因的表达[1]。miR-101(microRNA-101)被报道在多种肿瘤类型如膀胱癌、肝癌细胞中表达失衡,与肿瘤的发生、发展和侵袭转移有关[2-3],本研究探讨miR-101在乳腺癌细胞中的表达情况,并研究其对多柔比星杀伤乳腺癌细胞的作用
1 材料与方法
1.1实验材料
1.1.1细胞培养人乳腺癌细胞系MDA-MB-435、MCF-7、MDA-MB-231及人正常乳腺细胞系MCF-10A购于美国ATCC。乳腺癌细胞系及人正常乳腺细胞系MCF-10A均培养在含10%胎牛血清的DMEM培养基中(DMEM培养基、胎牛血清购于美国Gibco),并加入10μg/mL胰岛素,100ng/mL霍乱毒素,20ng/mL人表皮生长因子。所有细胞在37℃恒温培养箱中培养,通入5%CO2。
1.1.2试剂多柔比星、噻唑蓝(MTT)、二甲亚砜(DMSO)、表皮生长因子(EGF)、霍乱毒素、胰岛素购于美国Sigma-Aldrich。兔抗人Mcl-1和兔抗人β-actin购于美国Cell Signaling。PVDF膜购于美国Millipore。ECL试剂盒购于美国Pierce。miR-101模拟物和阴性对照寡核苷酸(NCO)购于上海吉玛生物,miR-101模拟物序列为:5′-UACAGUACUGUGAUAACUGAA-3′;NCO序列为:5′-GUACUAACCUAUGUGAAAU AG-3′。Trizol试剂、逆转录试剂盒、pcDNA3.1、Lipofectamine 2000购于美国Invitrogen。各PCR引物由上海生物工程有限公司合成。
1.2实验方法
1.2.1miR-101的表达采用荧光定量PCR法检测,简要步骤如下:将正常培养条件下的MCF-10A、MDA-MB-435、MDA-MB-231和MCF-7细胞总RNA用Trizol试剂提取。之后采用茎环RT-qPCR法(逆转录-定量PCR)对miR-101进行逆转录和扩增[4],并以U6作为内参,采用2-△△CT法计算miR-101的相对表达水平[5]。miR-101逆转录引物序列:5′-CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGAGCGGGAC-3′。U6定量PCR上游引物:5′-CTCGCTTCGGCAGCACA-3′,下游引物:5′-AACGCTTCACGAATTTGCGT-3′。
1.2.2质粒构建及转染将Mcl-1基因cDNA全长序列(Gene ID:NM_001197320)以分子克隆的方法与pcDNA3.1连接后构建成pcDNA3.1-Mcl-1重组真核表达质粒[6]。使用Lipofectamine 2000按照试剂操作说明书步骤将miR-101或NCO(50pmol/ mL),pcDNA3.1-Mcl(2滋g/mL)转染入MDA-MB-435细胞中,培养24小时。
1.2.3Western blot试验将50pmol/mL miR-101 用Lipofectamine 2000试剂转染入MDA-MB-435细胞中培养24小时,收集细胞并裂解,裂解后的蛋白提取液用12.5%的丙烯酰胺进行SDS-PAGE,之后将凝胶取下将蛋白转膜到PVDF膜上。将膜在Mcl-1或β-actin一抗稀释液中孵育过夜,之后在带辣根过氧化物酶活性的二抗稀释液中孵育2小时,ECL试剂显色曝光。
1.2.4对肿瘤细胞的杀伤活性采用MTT法,将MDA-MB-435细胞按5×103/孔接种在96孔板上。将50pmol/mL miR-101或阴性对照RNA(NCO)转染到细胞中,孵育24小时,然后再加低浓度(0.2滋g/mL)或高浓度(1滋g/mL)多柔比星培养48小时。之后加5mg/mL MTT 20滋L,继续培养4小时。弃上清液,在570nm波长下用酶标仪检测OD值,细胞活力抑制率用以下公式计算:抑制率=(OD对照组-OD治疗组)/OD对照组×100%。
1.3统计学处理实验数据使用SPSS 12.0统计分析软件进行处理,采用非配对双边t检验以及单因素方差分析。
2 结果
2.1miR-101在乳腺各细胞系中的表达通过荧光定量PCR方法发现三种乳腺癌细胞系MDAMB-435、MDA-MB-231和MCF-7的miR-101表达水平均显著低于正常乳腺上皮细胞系MCF-10A(均P<0.01),详见表1。
2.2转染miR-101后多柔比星对MDA-MB-435细胞的杀伤活性多柔比星对转染了miR-101的乳腺癌细胞MDA-MB-435的细胞活力抑制率明显升高(P<0.05或P<0.01),提示miR-101可显著增强多柔比星对乳腺癌的治疗效果。
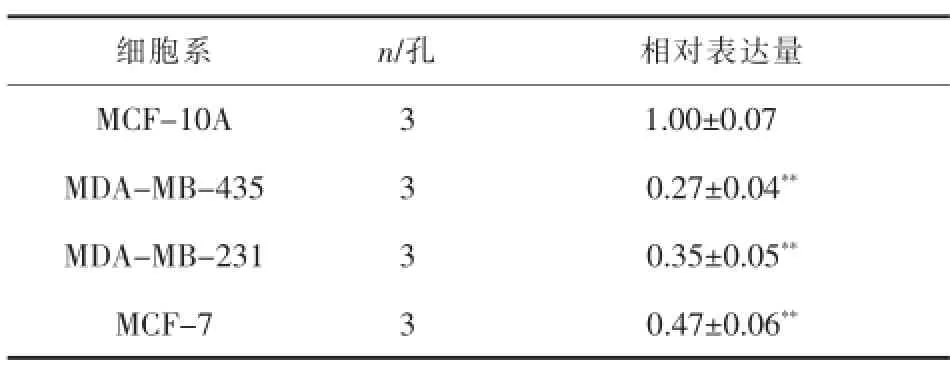
表1 乳腺各细胞系miR-101的表达(x±s)
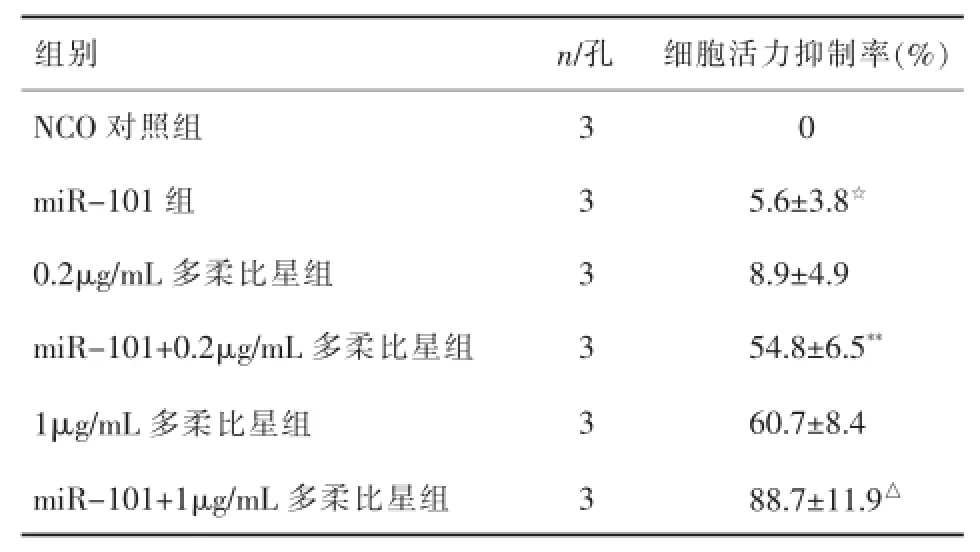
表2 多柔比星联合miR-101对MDA-MB-435细胞的抑制作用(x±s)
2.3miR-101的靶点生物信息学(http://www. targetscan.org/)结果表明Mcl-1是miR-101的潜在靶点(图1)。MDA-MB-435转染miR-101(50pmol/ mL)后,Mcl-1的表达量显著低于未转染miR-101组(图2)。MTT试验结果发现,pcDNA3.1-Mcl-1的共转染显著抑制了 miR-101联合多柔比星对MDA-MB-435细胞的杀伤活性(表3),提示miR-101增强多柔比星对MDA-MB-435细胞的杀伤活性的机制可能是通过下调Mcl-1的表达水平。

图1 Mcl-1基因是miR-101的潜在靶点

图2 转染miR-101下调MDA-MB-435细胞Mcl-1的表达水平
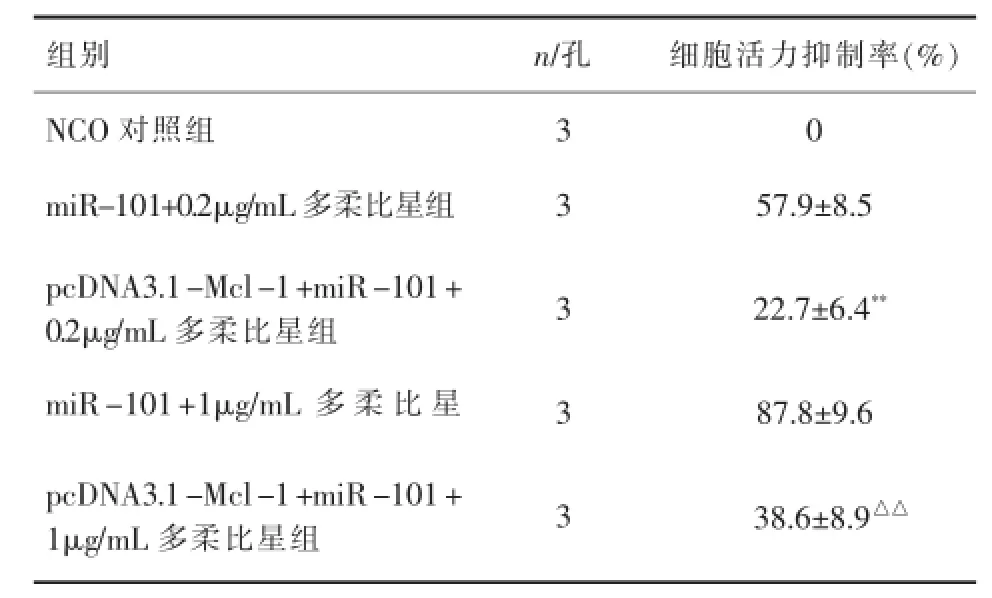
表3 pcDNA3.1-Mcl-1抑制miR-101对多柔比星的协同作用(x±s)
3 讨论
尽管乳腺癌细胞很容易发生耐药,化疗仍是目前治疗乳腺癌的主要手段。多柔比星是一种蒽环类抗生素,是目前最主要的抗肿瘤药物之一,广泛用于乳腺癌的治疗[7]。虽然多柔比星有十分良好的抗肿瘤活性,但是高剂量的多柔比星也能引起严重的心脏毒性反应,而且肿瘤的药物抵抗也大大限制了多柔比星的临床应用[8]。因此联合其他药物降低多柔比星的毒副反应和耐药性显得十分重要。
本研究中,作者发现相比于正常乳腺上皮细胞系,乳腺癌细胞系的miR-101表达水平显著下调,表明miR-101在乳腺癌细胞中可能发挥肿瘤抑制作用,提示了miR-101可能是一个抑癌基因。然而,研究发现miR-101单独治疗乳腺癌的效果并不十分显著,对细胞活力抑制率平均(5.6±3.8)%,但是它却能显著增强多柔比星对乳腺癌的杀伤作用,联合了miR-101的低浓度或者高浓度的多柔比星,其肿瘤细胞活力抑制率均明显升高(P<0.05或P<0.01)。
为了研究miR-101增强多柔比星对乳腺癌细胞杀伤活性的机制,作者通过生物信息学方法寻找miR-101的潜在靶点。在miR-101的众多调控基因中,作者发现Mcl-1这一凋亡相关蛋白可能决定多柔比星对肿瘤细胞的凋亡诱导活性。Mcl-1是Bcl-2蛋白家族中一个重要的抗凋亡蛋白成员,它的高表达和肿瘤细胞的不良预后和多药耐药密切相关[9]。有报道表明,肿瘤细胞中Mcl-1的高表达会显著增强多种肿瘤的存活能力和对细胞毒性化疗药物的抵抗力[10]。因此,作者推测miR-101可能通过下调乳腺癌细胞中Mcl-1的表达,提高多柔比星对肿瘤细胞的凋亡诱导活性。为了验证这个假设,本研究构建了Mcl-1真核表达载体,如表2提示,当MDA-MB-435细胞中转染pcDNA3.1-Mcl-1重组质粒,使细胞中Mcl-1发生过表达后,miR-101对多柔比星的协同抗乳腺癌作用受到显著抑制,证实了miR-101增强化疗药物抗肿瘤活性的机制是靶向于Mcl-1蛋白。
综上所述,miR-101/Mcl-1途径与多柔比星的抗乳腺癌活性密切相关,它可能成为肿瘤化疗的一个新的靶点。
[1] In ui M,M artello G,Piccolo S.MicroRNA control of signal transduction.Nat Rev Mol Cell Biol,2010,11:252
[2]Hu Z,Lin Y,Xie L,et al.MicroRNA-101 suppresses motility of bladder cancer cells by targeting c-Met.Biochem Biophys Res Commun,2013,435(1):82
[3] Zhang Y,Guo X,Lin N,et al.MicroRNA-101 suppresses SOX9-dependenttumorigenicityand promotesfavorable prognosis of human hepatocellular carcinoma.FEBS Lett,2012,586(24):4362
[4]Chen C,Ridzon DA,Lee DH,et al.Real-time quantification of microRNAs by stem-loop RT-PCR.Nucleic Acids Res,2005,33(20):e179
[5]K.J.Livak,T.D.Schmittgen.Analysisofrelativegene expression data using real-time quantitative PCR and the 2 (-Delta Delta C(T))Method.Methods,2001,25(4):402
[6]Sun JG,Xiang J,Liu FY,et al.Clitocine induces apoptosisand enhances the lethality of ABT-737 in human colon cancer cells by disrupting the interaction of Mcl-1 and Bak. Cancer Lett,2014,355(2):253
[7] Xu F,Wang F,Chen Y,et al.Differential drug resistance acquisition to doxorubicin and paclitaxel in breast cancer cells.Cancer Cell Int,2014,14(1):538
[8]Shuhendler AJ,Prasad P,Wu XY,et al.Synergistic nanoparticulat e drug combination overcomes multidrug resistance, increasesefficacy,andreducescardiotoxicityina nonimmunocompromised breast tumor model.Mol Pharm,2014,11(8):2659
[9] Kelly PN,Strasser A.The role of Bcl-2 and its pro-survival relatives in tumourigenesis and cancer therapy.Cell Death Differ,2011,18(9):1414
[10]Zhang T,Zhao C,Xu F,et al.The expression of Mcl-1 in human cervical cancer and its clinical significance.Med Oncol,2012,29(3):1985
