小球藻抽脂残留物培养产气肠杆菌的制氢研究
2016-08-15MUHAMMADJawed闫云君
MUHAMMAD Jawed,王 俊,徐 莉,闫云君
华中科技大学生命科学与技术学院,湖北 武汉 430074
小球藻抽脂残留物培养产气肠杆菌的制氢研究
MUHAMMAD Jawed†,王俊†,徐莉*,闫云君*
华中科技大学生命科学与技术学院,湖北 武汉 430074
为使高效产氢产气肠杆菌能够运用到实际生产中,探索并且优化以小球藻抽脂残留物的水解产物为底物的厌氧批次产氢发酵实验参数.采用中心组合设计,通过三次平行实验取得的数值,拟合得到反映温度、接种量和pH值与产氢量之间关系的多元二次回归模型,以产氢率为响应值,进行响应面分析.方差分析结果显示,该模型的显著性和可靠性较高,拟合效果良好.该模型预测出最佳产氢结果为54.22 mL/g小球藻抽脂残留物,产氢条件为温度37.55℃,接种量12.25%,pH值5.95.进行了厌氧批次发酵产氢验证实验,实际结果为小球藻抽脂残留物的产氢量为54.61 mL/g,与预测值十分接近,说明该模型能较好反应三因素对产氢量的影响.优化了高效产氢菌利用廉价底物发酵产氢的运行条件,为实现生产氢气的过程与有机废弃物无害化处理相耦合提供了新思路.
产气肠杆菌;生物制氢;小球藻提脂残留物;响应面法
1 引言
随着能源危机的加剧,人们环保意识越发增强,氢气作为可再生的清洁能源载体受到越来越多的重视[1-3].其中,厌氧发酵产氢技术反应条件温和、能耗低、效率高,能同时解决化石燃料能源消耗所带来的资源匮乏、环境污染等问题,因此成为目前制氢方法的研究热点[4-8].
但是,微生物厌氧发酵制氢成本高制约着微生物发酵制氢的大规模产业化.利用富含碳水化合物的废弃物代替葡萄糖、蔗糖这类昂贵的原料作为底物,实现生产氢气的过程与有机废弃物无害化处理相耦合是生物制氢最有应用前景的方向之一,吸引了政府和科研人员的大力关注[9-11].作为制备新能源的重要原料微藻具有光合效率高和资源丰富等特点,其油脂抽提后剩余的废弃物藻渣(lipid extracted microalgal biomass residues,LMBRs)是一种营养丰富的有机质,若处理不当排放到环境当中将造成环境的污染和资源浪费[12].厌氧发酵产氢菌对底物适应性较广,如果利用来源丰富的藻渣作为产氢微生物的发酵底物来制备氢气,变废为宝,在降解有机废弃物解决环境问题的同时,可以降低氢气生产成本.该方法将为最终实现原位处理类似有机废弃物低成本获得氢气提供新的思路.
发酵培养条件及其工艺优化可以得到最佳的产氢效率.产氢发酵的培养条件主要包括培养基成分、培养温度、反应器转速、pH值的大小和初始接种量等因素.在这些因素中,有一些因素微小的变化会导致目的产物产量发生大幅度改变,一般认为这样的因素对于目的变量具有显著性影响.通过单因素实验结合最陡爬坡试验(plackett-burman,PB试验)可以确定一个因素是否具有显著性和该因素最优值的范围.为了确定培养参数之间的关系和最优值,各种统计学方法和工具被开发和应用[13].其中“响应面优化法”(response surface methodology,RSM)因其方便准确拟合度好而运用广泛[14-15].
在此背景下,本研究针对厌氧发酵制氢成本较高的问题,拟开展利用油脂抽提后剩余的小球藻藻渣LMBRs水解产物作为发酵底物,利用响应面优化法研究利用该底物发酵产氢量与培养温度、培养基pH值大小以及接种量之间的关系,预测这三个因素在进行产氢发酵时的最优数值,并进行验证实验.以此模拟工业化生产生物柴油的微藻藻渣原位水解产氢的过程,探索类似有机废弃物工业应用的潜在价值.
2 实验部分
2.1材料
2.1.1菌株产氢发酵菌株使用产气肠杆菌工程菌 Enterobacter aerogenes AB91102-OP/N(Δppc,Δldh,nadE),该菌为本实验利用基因敲除的方法构建获得的产气肠杆菌工程菌,该菌具有能够利用五碳糖和六碳糖生长并产氢的特点,能够较好地利用成分复杂的小球藻提脂残留物水解产物[16]. 2.1.2培养基发酵培养基小球藻提脂残留物LMBRs的水解产物水解液调节pH至中性后干燥.成分为31.8%(质量分数)的还原糖和6.1%(质量分数)的总氮.每升培养基中加入30.0 g小球藻提脂残留物LMBRs的水解产物.
2.1.3仪器和试剂常规生化试剂均购自国药公司.pH-stat计(德国 Schott),电转化仪(美国Bio-RAD),电热恒温培养箱(上海苏进),紫外检测仪(上海金达生化仪器),恒流泵(上海金达生化仪器),台式离心机(德国Eppendorf),恒温摇床(上海智城),紫外可见分光光度计(上海美谱达),3 L自控发酵罐(上海保兴).
2.2方法
2.2.1小球藻提脂残留物的水解策略取10 L发酵罐发酵的毕赤酵母细胞培养液,4 000 r/min离心20 min取沉淀,无菌水重悬细胞,离心取沉淀重悬制备成质量浓度为10%的悬浊液,调节pH值至5.2;再向该溶液中加入NaCl和无水乙醇使其终质量浓度均为5%,混匀.50℃,150 r/min震荡孵育24 h.4 000 r/min离心20 min取上清获得酵母自溶物.取该新鲜酵母自溶物100 mL与5 g干燥后的小球藻抽脂残余物LMBRs分别在37、43℃和50℃下,150 r/min震荡孵育.再分别在80、100℃和121℃,用NaOH溶液碱解孵育上述预处理的小球藻提脂残留物8 h.处理后将降解液冷却,12 000 r/min离心5 min,分离上清液和固体物质,上清液检测其还原糖和氨基酸含量,固体不溶物质检测总氮含量.
2.2.2厌氧批次发酵实验将装有培养基的生物反应器在灭菌锅中灭菌后,立即放在磁力搅拌座上,迅速接入通过滤膜Midisart 2000过滤后的99.9%(体积分数)的高压氮气30 min使培养环境处于无氧状态,将排气管连接到气体收集瓶中.将pH电极与控制器连接,通过无菌操作将装有质量分数为28%氨水和1 mol/L稀盐酸的补料瓶连接到发酵罐,开启搅拌至450 r/min,在控制器上设定pH值为预定值,打开自动调节.
种子培养基使用LB培养基,按照实验设计的不同接种量确定体积,每次发酵接种两瓶,一瓶作为检测OD值变化样品,一瓶作为接种液.37°C下摇床震荡培养,待检测瓶的OD值达到0.6时,迅速将另一瓶菌液接种到反应器中.发酵培养12 h,测定收集气体中氢气的含量. 2.2.3优化实验设计采用三因素三水平中心组合设计(central composite design,CCD),利用统计分析软件“Design Expert”将获得的厌氧批次发酵优化实验数据进行分析,研究产氢量与有效独立变量:初始接种量、pH和温度之间的关系.将每克小球藻抽脂残余物LMBRs能够产生的氢气的量作为响应参数,各优化参数采用的考察水平如表1所示:
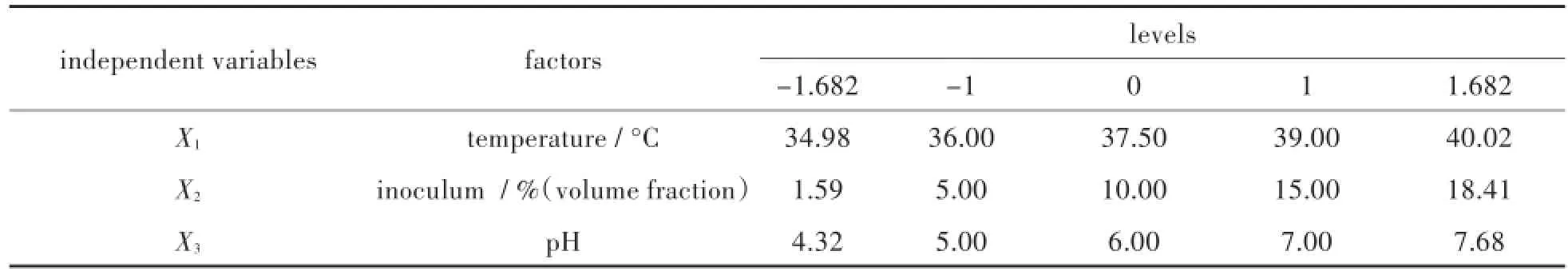
表1 优化小球藻提脂残留物产氢的因素及其水平Tab.1 Levels and factors used for optimization of hydrogen production from LMBRs
由于需要优化的因素数量为3个,根据析因部分实验的次数F=2k(k为因素的数量)得出,析因实验的次数为 F=2k=23=8次.极值α=F1/4=81/4≈1.682,星点数为2k=2×3=6,为保证实验的精密性,中心点实验重复6次.所以需要进行的优化实验次数总共为20次.
实验得到的数据参数变量和相应值之间的关系可以用如公式(1)所示的二次模型表示:

其中,Y表示相应结果的预测值,xi表示输入变量的值,i=1-k,j=1-k,A0表示线性系数,Aii表示二次项系数,Aij表示相互作用系数.
通过方差分析对该二次模型进行统计学分析.通过该模型构建的等高线图和三维曲面图可以进一步预测最大产氢量及产生该产氢量时初始接种量、pH和温度的大小.
2.2.4氢气浓度的测定氢气的浓度使用气象色谱仪进行测定,采用的是FULI GC-9750型气相色谱,装配有一个填充柱(2.0 mmL.D.200 mmL,carboxen-1004,80~100 mesh),和一个TCD热导检测器.检测器和柱子的工作温度分别为60℃和110℃.
3 结果与讨论
3.1模型的建立及拟合检验
如表2所示,按照中心组合设计CCD设计的各参数变量的值进行一组20次的优化实验,每组进行三次平行实验,得到在所设计的初始接种量、pH和温度下的产氢效率.该产氢效率设定为每克小球藻抽脂残余物LMBRs为底物被菌株AB91102-OP/N利用产生的氢气的量.
通过表2中的实验数据,建立统计学模型,获得多元回归方程如公式(2)所示.
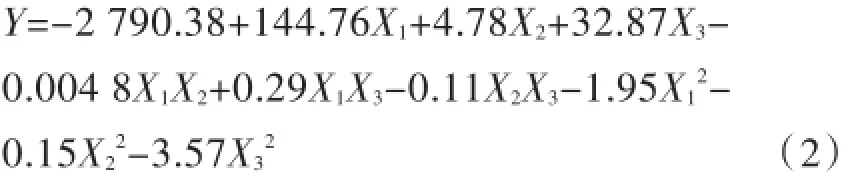
其中,Y表示产氢量,X1、X2和X3分别表示如表1中所示变量.对该回归方程进行方差分析结果依次如表3中所示.
3.2产氢条件的优化
通过对二次模型的拟合检验,证明该模型具有较高的显著性和可靠性,能够较好的拟合产氢效率与初始接种量、培养温度和pH值之间的关系,通过统计学软件“Design Expert”将该模型生成能够反应接种量、温度和pH与产氢量之间关系的3D响应面图,以及这三个参数两两之间相互作用的等高线图,如图1所示.
3.3最优发酵条件的预测
对二次回归模型进行响应面分析,结合响应面3D立体图中的极值点,预测得出产氢气效率最大值为54.22 mL/g小球藻抽脂残余物LMBRs,在条件为温度37.55℃,接种量12.25%,pH值为5.95时产生.
3.4验证实验
为检验模型的实际预测效果,在上述预测的最优发酵条件下进行厌氧批次发酵验证实验,结果显示该理想条件下利用小球藻抽脂残余物LMBRs产氢效率为 54.61 mL/g,与预测结果54.22 mL/g小球藻抽脂残余物LMBRs十分相近,证明该模型能够很好地体现三个因素与产氢量之间的关系,具有良好的预测能力.
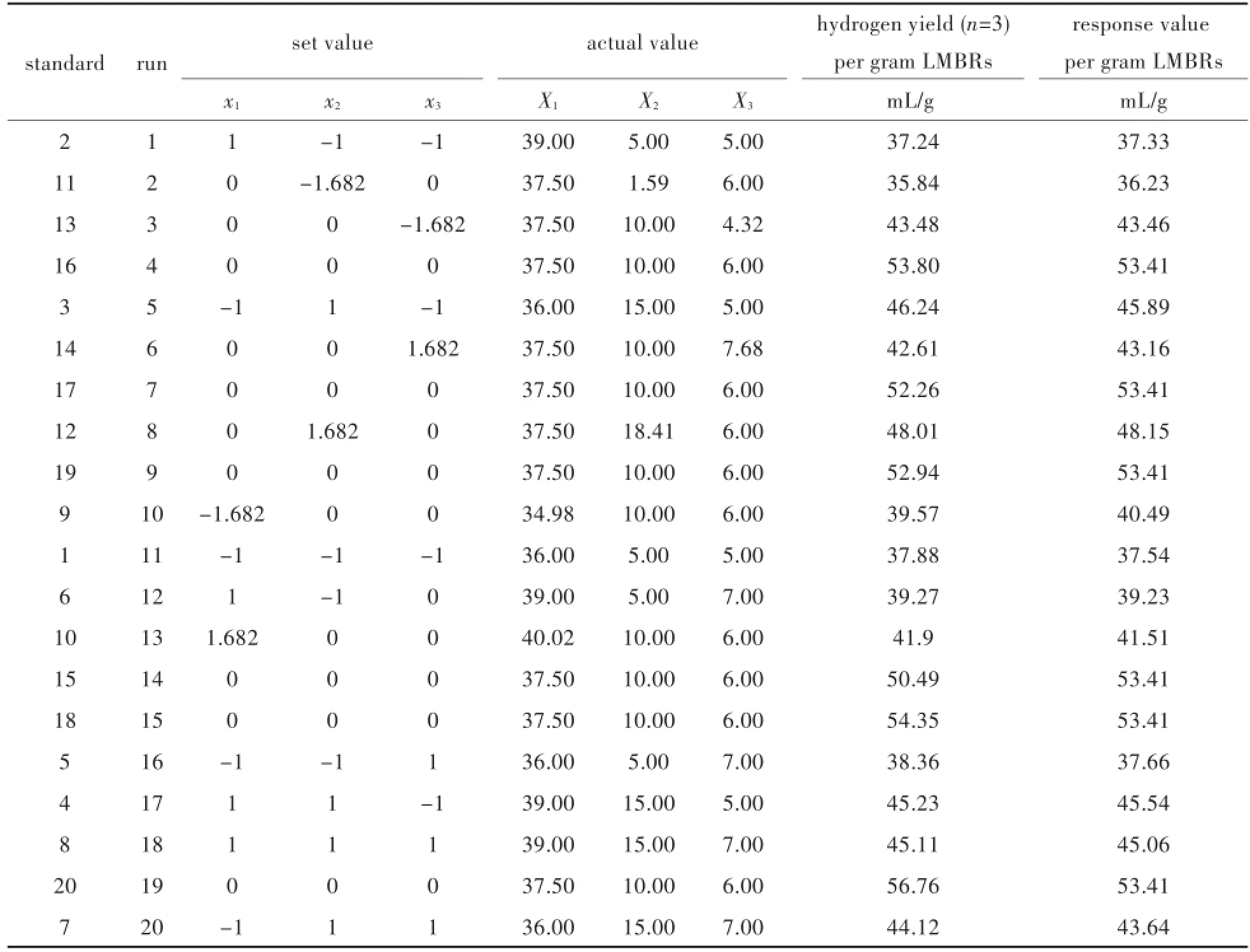
表2 利用小球藻提脂残留物在不同温度、接种量、pH值下氢气的产量Tab.2 Hydrogen production from LMBRs at different temperatures,ratios of inoculum and pH values
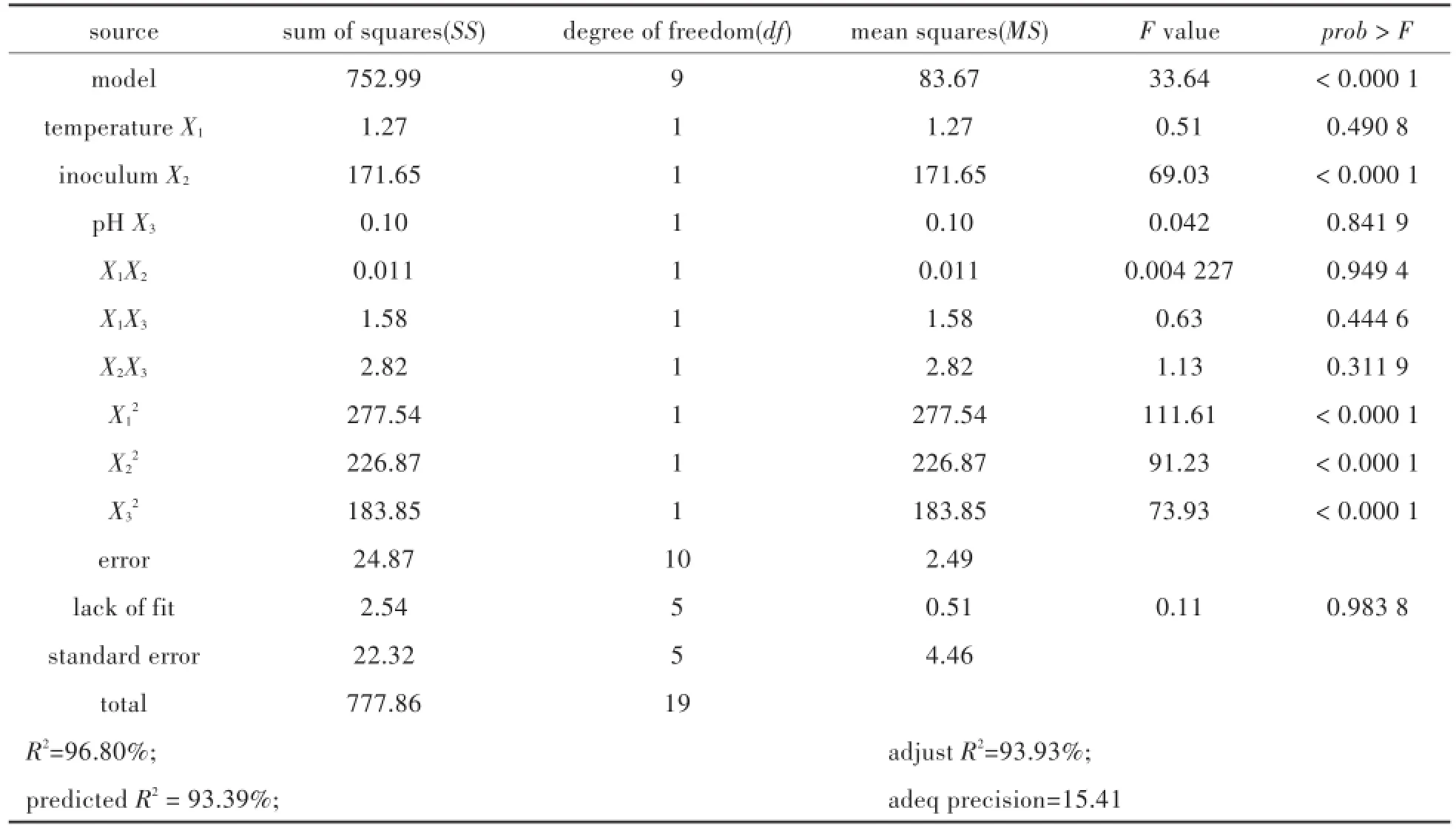
表3 响应面二次模型的方差分析Tab.3 ANOVA for response surface quadratic model

图1 温度、pH值和接种量影响产氢量的响应面和等高线图(a)温度和接种量对产氢量的影响;(b)温度和pH值对产氢量的影响;(c)接种量和pH值对产氢量的影响Fig.1 Response surface plot and the corresponding contour lines showing the effects of temperature,pH and ratios of inoculum on hydrogen yield (a)Effects of temperature and ratios of inoculum on hydrogen yield;(b)Effects of temperature and pH on hydrogen yield;(c)Effects of ratios of inoculum and pH on hydrogen yield
3.5讨论
响应面法是常用的优化产氢发酵重要参数的方法,在很多研究中被证明能够有效地提高产氢量[14-19].Chong等运用响应面法优化酪酸梭菌利用棕榈油流出物生产氢气的条件,使产氢速率提高到了849.5 mL/h,培养条件的变化使收集气体中氢气的浓度从60%提高到了75%[14].Hay等运用响应面法优化厌氧活性污泥生物反应器的运行条件,建成了预测产氢准确的模型[18].
本研究为考察已构建的高效产氢肠杆菌工程菌AB91102-OP/N的实际应用能力,通过响应面法优化可再生废弃物小球藻抽脂残余物为底物的厌氧批次产氢发酵参数.该厌氧发酵产氢采用纯培养,发酵底物采用同一批次获得的小球藻抽脂残余物水解产物;接种使用的培养物均控制相同的OD值;反应器中接入溶氧电极,确保每次实验均在严格厌氧的条件下进行等系列措施,最大限度降低发酵过程的不确定因素,保证本拟合二次模型的各种拟合参数较高.研究结果表明,在通过响应面法优化的条件下,每克LMBRs产氢量将可达到54.61mL/g,相对未经优化的条件下45.33 mL/g的产氢量提升20.47%(P-value=0.016 2),效果显著.该研究为进一步利用类似有机废弃物作为发酵底物制备氢气,实现氢气的制备与有机废弃物无害化处理相耦合,一并解决环境问题和能源危机问题,最终实现原位处理有机废弃物,获得低成本的绿色能源氢气提供了新的思路.
4 结 语
系统优化了本实验室构建的产气肠杆菌工程菌以小球藻抽脂残余物水解产物为培养基的厌氧发酵产氢条件.采用三因素三水平中心组合设计,通过统计学软件“Design Expert”设计了一组数量为20次的优化实验,并通过3次平行实验取得的数值,拟合得到反应温度、接种量和pH值与产氢量之间关系的多元二次回归模型,以产氢率为响应值,进行响应面分析.方差分析结果显示,该模型显著性和可靠性较高,拟合效果良好.按照该模型预测出的最佳结果54.22 mL/g小球藻抽脂残余物LMBRs产生的条件为温度 37.55℃,接种量12.25%,pH值5.95.进行了厌氧批次发酵产氢验证实验,最终结果表明实际产氢量54.61 mL/g小球藻抽脂残余物LMBRs与预测值十分相近,证明该模型能较好地反应三个因素对产氢量的影响.通过响应面法优化了高效产氢菌利用廉价底物发酵产氢的运行条件,对高效产氢菌的实际应用进行探索,为开发有效降低厌氧发酵产氢成本提供了新的策略.
[1] SODE K,WATANABE M,MAKIMOTO H,et al.Biohydrogen[M].United States:Springer,2014.
[2]ARGUN H,KARGI F.Bio-hydrogen production by different operational modes of dark and photo-fermentation:an overview[J].International journal of hydrogen energy,2011,36(13):7443-7459.
[3]LEE H,VERMAAS W F J,RITTMANN B E.Biological hydrogen production:prospects and challenges[J]. Trends in biotechnology,2010,28(5):262-271.
[4]TURNER J A.Sustainable hydrogen production[J].Science,2004,305(5686):972-974
[5] KOTHARI R,SINGH D P,TYAGI V V,et al.Fermentative hydrogen production-an alternative clean energy source[J].Renewable and sustainable energy reviews,2012,16(4):2337-2346.
[6]ZHANG C,LU F,XING X.Bioengineering of the enterobacter aerogenes strain for biohydrogen production[J]. Bioresource technology,2011,102(18):8344-8349
[7]王姝玉,王俊,徐莉,等.同源过表达fnr、pncB和fdhF对克雷伯菌产氢代谢的影响[J].生物工程学报,2013,29(9):1278-1289. WANG S Y,WANG J,XU L,et al.Enhanced biohydrogen productio by homologous over-expression of fnr,pncB,fdhF in Klebsiella sp.HQ-3[J].Chinese journal of biotechnology,2013,29(9):1278-1289.
[8]LEE D,CHIU L.Development of a biohydrogen economy in the United States,China,Japan,and India:with discussion of a chicken-and-egg debate[J].International journal of hydrogen energy,2012,37(20):15736-15745。
[9]SINHA P,PANDEY A.An evaluative report and challenges for fermentative biohydrogen production[J]. International journal of hydrogen energy,2011,36 (13):7460-7478.
[10]LIN C,LAY C,SEN B,et al.Fermentative hydrogen production from wastewaters:a review and prognosis [J].International journal of hydrogen energy,2012,37(20):15632-15642
[11]KAPDAN I K,KARGI F.Bio-hydrogen production from waste materials[J].Enzyme and microbial technology,2006,38(5):569-582.
[12]WAHLEN B D,WILLIS R M,SEEFELDT L C. Biodiesel production by simultaneous extraction and conversion of total lipids from microalgae,cyanobacteria,and wild mixed-cultures[J].Bioresource technology,2011,102(3):2724-2730
[13] JAMIL Z,MOHAMAD ANNUAR M S,IBRAHIM S,et al.Optimization of phototrophic hydrogen production by Rhodopseudomonas palustris PBUM001 via statistical experimental design[J].International journal of hydrogen energy,2009,34(17):7502-7512.
[14] CHONG M,ABDUL R N A,RAHIM R A,et al.Optimization of biohydrogen production by Clostridium butyricum EB6 from palm oil mill effluent using response surface methodology[J].International journal of hydrogen energy,2009,34(17):7475-7482.
[15]LIU Q,ZHANG X,ZHOU Y,et al.Optimization of fermentative biohydrogen production by response surface methodology using fresh leachate as nutrient supplement[J].Bioresourcetechnology,2011,102 (18):8661-8668.
[16]WANG J,YU W Y,XU L,et al.Effects of increasing the NAD(H)pool on hydrogen production and metabolic flux distribution in Enterobacter aerogenes mutants[J].International journal of hydrogen energy,2013,38(30):13204-13215.
[17]GUO W Q,REN N Q,WANG X J,et al.Optimization of culture conditions for hydrogen production by EthanoligenensharbinenseB49 usingresponsesurface methodology[J].Bioresource technology,2009,100 (3):1192-1196.
[18]HAY J X W,WU T Y,TEH C Y,et al.Optimized growthofRhodobactersphaeroidesO.U.001using response surface methodology(RSM)[J].Journal of scientific and industrial research,2012,71(2):149-154.
[19]NGUYEN T A D,KIM J P,MI S K,et al.Optimization ofhydrogen production by hyperthermophilic eubacteria,Thermotoga maritima and Thermotoga neapolitana in batch fermentation[J].International journal of hydrogen energy,2008,33(5):1483-1488.
本文编辑:张瑞
Cultivation of Enterobacter Aerogenes for Hydrogen Production with Lipid Extracted Microalgal Biomass Residues
MUHAMMAD Jawed†,WANG Jun†,XU Li*,YAN Yunjun*
School of Life Science and Technology,Huazhong University of Science and Technology,Wuhan 430074,China
To examine the feasibility of cultivating Enterobacter aerogenes for hydrogen production with lipid extracted microalgal biomass residues,the anaerobic batch fermentations from microalgal hydrolysate were conducted and their key parameters were optimized using response surface methodology.The central composite designs were performed,and a quadratic regression model based on temperature,pH,inoculum and hydrogen yield was obtained from the triplicate experimental data.The analysis of variances indicates that the model has good fitting degree.The predicted maximum hydrogen yield of 54.22 mL/g of lipid extracted microalgal biomass residues was obtained when the temperature,pH and inoculum were respectively at 37.55℃,5.95 and 12.25%.The confirmatory experiments showed that the mutant evolved hydrogen yield of 54.61 mL/g of lipid extracted microalgal biomass residues in the optimal conditions.The coincident result verified the practicability of the model.This study indicates that a strategy of cultivating Enterobacter aerogenes for hydrogen production with lipid extracted microalgal biomass residues has great potential for the large scale of production.
Enterobacter aerogenes;biohydrogen;lipid extracted microalgal biomass residues;response surface methodology
闫云君,博士,教授,博士研究性导师.E-mail:yanyunjun@hust.edu.cn
Q93-335
A
10.3969/j.issn.1674-2869.2016.04.001
1674-2869(2016)04-0313-06
2016-03-03
中央高校基本科研业务费专项资金(2010MS029)
王俊,博士研究生,为并列第一作者.E-mail:651113197@qq.com
徐莉,博士,副教授.E-mail:xuli@hust.edu.cn
