金蝉花多糖的抗氧化活性及结构分析
2016-08-10贡小辉韦德群刘英坤于小凤OPEYEMIJoshuaOlatunji焦心怡欧阳臻江苏大学药学院江苏镇江03江苏大学京江学院江苏镇江03
封 燕,贡小辉,韦德群,刘英坤,赵 明,于小凤,OPEYEMI Joshua Olatunji,焦心怡,欧阳臻,*(.江苏大学药学院,江苏 镇江 03;.江苏大学京江学院,江苏 镇江 03)
金蝉花多糖的抗氧化活性及结构分析
封 燕1,贡小辉2,韦德群1,刘英坤1,赵 明1,于小凤1,OPEYEMI Joshua Olatunji1,焦心怡1,欧阳臻1,*
(1.江苏大学药学院,江苏 镇江 212013;2.江苏大学京江学院,江苏 镇江 212013)
摘 要:本实验研究金蝉花多糖的抗氧化活性,并对其纯化组分进行结构分析。采用热水浸提、不同浓度乙醇分级沉淀的方法从金蝉花中提取多糖,分别获得50%醇沉金蝉花多糖(50% polysaccharides from Cordyceps cicadas,CP50)和80%醇沉金蝉花多糖(CP80),并检测两者的体外抗氧化活性。结果表明:CP50较CP80表现出较强的清除自由基的能力,且具有一定的还原能力和总抗氧化能力。CP50进一步经二乙氨乙基(diethylaminoethyl,DEAE)纤维素-52和Sephadex G-100凝胶柱分离纯化,得到活性多糖CPA-1和CPB-1。经紫外扫描光谱法和高效凝胶过滤色谱法鉴定CPA-1和CPB-1为均一多糖;单糖组成分析显示两个组分中均含有葡萄糖、甘露糖和半乳糖,其物质的量比分别为:1∶0.48∶0.52和1∶0.14∶0.114。红外光谱(infrared spectroscopy,IR)及刚果红实验发现,CPA-1和CPB-1具有典型的多糖红外吸收,且含有三股螺旋分子结构。
关键词:金蝉花多糖;抗氧化活性;分离纯化;结构分析
引文格式:
封燕, 贡小辉, 韦德群, 等.金蝉花多糖的抗氧化活性及结构分析[J].食品科学, 2016, 37(13): 19-24.DOI:10.7506/ spkx1002-6630-201613004. http://www.spkx.net.cn
FENG Yan, GONG Xiaohui, WEI Dequn, et al.Antioxidant activity and preliminary structure analysis of polysaccharides from Cordyceps cicadas[J].Food Science, 2016, 37(13): 19-24.(in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201613004. http://www.spkx.net.cn
金蝉花(Cordyceps cicadae)是麦角菌科真菌寄生于一些蝉若虫后形成的干燥复合体,性寒味甘,具有疏风散热之功效,是一种药食两用真菌,亦是我国传统名贵中药材之一。早在宋代《证类本草》中就有蝉花治疗小儿惊癫、夜啼心悸的记载。近代许多学者对蝉花的药理活性进行过广泛研究。如陈以平教授等[1]率先使用蝉花代替冬虫夏草进行临床实验,发现其在保护肾功能、延缓慢性肾功能衰竭方面功效显著,有望成为冬虫夏草的代用品。宋捷民等[2]发现蝉花可显著提高血清溶血素水平和巨噬细胞的吞噬活性,表明其具有促进免疫功能的作用。另外,国内外研究还发现蝉花具有抗肿瘤[3]、调节脂质代谢[4]、抗疲劳抗应激[5]等生物活性。其活性成分主要包括多糖、核苷、甘露醇、麦角甾醇等[6],现代药理研究表明,多糖作为其主要有效成分之一,具有明显的免疫调节[7]、改善肾功能[8]等作用,因此成为近年来研究和开发的热点。但目前关于金蝉花多糖抗氧化活性及结构分析方面报道甚少。本研究主要以金蝉花为原料,通过本课题组前期已优化的提取条件[9],提取得到不同体积分数乙醇分级沉淀的金蝉花多糖,筛选出抗氧化活性较高的多糖成分,利用二乙氨乙基(diethylaminoethyl,DEAE)纤维素-52和Sephadex G-100等现代分离手段获得高纯度的金蝉花多糖组分,并对其结构进行初步解析,为金蝉花多糖用于保健食品和医药产品的开发提供理论依据。
1 材料与方法
1.1 材料与试剂
野生金蝉花,采自江苏省句容市天王镇磨盘山,由江苏大学药学院欧阳臻教授鉴定。
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、抗坏血酸(vitamin C,VC),单糖标准品(葡萄糖、鼠李糖、阿拉伯糖、木糖、甘露糖、半乳糖) 美国Sigma公司;透析袋(截留分子质量3 500 D) 瑞典Pharmacia公司;其他试剂均为分析纯。
1.2 仪器与设备
UV-2102 PCS 型紫外分光光度计 尤尼柯(上海)仪器有限公司;HH-S数显恒温水浴锅 江苏金坛市医疗仪器厂;MP502B电子天平 上海精密科学仪器有限公司;R-200旋转蒸发仪 德国Büchi公司;Agilent4890D气相色谱仪 美国惠普公司;Nicolet 470傅里叶红外光谱仪 美国Nicolet公司。
1.3 方法
1.3.1 金蝉花多糖的提取
称取干燥金蝉花粉末80 g,按照1∶10(m/V)的料液比加入蒸馏水,于88 ℃提取2 次,合并提取液,减压浓缩至200 mL,采用Sevag法去除蛋白;活性炭脱色得金蝉花多糖水溶液,加入乙醇,使最终乙醇体积分数分别为50%和80%,静置过夜,离心,冷冻干燥,分别得白色金蝉花多糖CP50(50% polysaccharides from Cordyceps cicadas)和CP80。
1.3.2 体外抗氧化活性检测
1.3.2.1 供试品溶液的制备
分别称取CP50和CP80各25 mg,用蒸馏水定容至25 mL,得1 mg/mL的供试品溶液,备用。称取VC 25 mg,用蒸馏水定容至25 mL,得1 mg/mL的阳性对照溶液,备用。
1.3.2.2 DPPH自由基清除能力的测定
用无水乙醇将DPPH试剂配制成1×10-4mol/L的溶液。准确吸取不同质量浓度(100、200、400、600、700、800 μg/mL)金蝉花待测液、DPPH溶液各1 mL,混匀后暗处放置30 min,于517 nm波长处测定吸光度[10]。以无水乙醇做空白对照、VC作阳性对照,按下式计算DPPH自由基清除率。
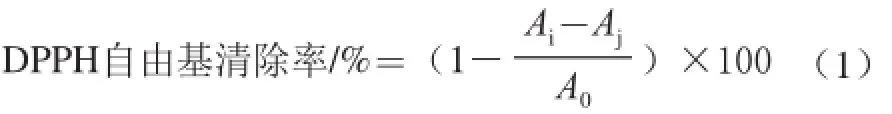
式中:Ai为1 mL样品溶液+1 mL DPPH试剂混合液的吸光度;Aj为1 mL样品溶液+1 mL空白溶剂(无水乙醇)混合液的吸光度;A0为1 mL DPPH溶液+1 mL空白溶剂混合液的吸光度。
1.3.2.3 ·OH清除能力的测定
利用Fenton体系法测定多糖对·OH的清除能力[11-13]。往10 mL离心管中依次加入1 mL不同质量浓度多糖溶液,1 mL 6 mmol/L的FeSO4溶液,1 mL 6 mmol/L的水杨酸-乙醇溶液和1 mL 6 mmol/L 的H2O2溶液,于37 ℃水浴1 h,然后在510 nm波长处测定吸光度(Ai)。按下式计算·OH清除率。

式中:Aj为蒸馏水代替多糖溶液作阴性对照的吸光度;A0为蒸馏水代替H2O2溶液作本底对照的吸光度。
1.3.2.4 还原力的测定
参照Kumaran等[14]的方法进行:将1 mL不同质量浓度的多糖溶液分别与2.5 mL pH 6.6的磷酸盐缓冲液及2.5 mL 1 g/100 mL的铁氰化钾混合,混合物于50 ℃水浴20 min,然后加入2.5 mL 10 g/100 mL的三氯乙酸(trichloroacetic acid,TCA)终止反应,离心10 min,取上清液2.5 mL,依次加入2.5 mL无水乙醇和0.5 mL 0.1 g/100 mL的FeCl3溶液,混匀后于700 nm波长处测定吸光度,蒸馏水作空白对照,VC作阳性对照。
1.3.2.5 总抗氧化能力的测定
取不同质量浓度的多糖溶液,依次加入3 mL混合液(精确称取磷酸三钠1.065 g、钼酸铵0.494 g,用少量蒸馏水溶解后加浓硫酸3.28 mL,定容至100 mL容量瓶中),于95 ℃水浴90 min,695 nm波长处测定吸光度[15],蒸馏水作空白对照,VC作阳性对照。
1.3.3 金蝉花多糖(CP50)的分离纯化
1.3.3.1 DEAE-52纤维素层析柱纯化
称取CP500.15 g,溶解于5 mL蒸馏水,离心,上清液经DEAE-52纤维素柱层析,分别用去离子水、不同浓度的NaCl溶液进行梯度洗脱,流速1 mL/min,分别收集洗脱液(每管10 mL)。隔管用苯酚-硫酸法跟踪检测,在490 nm波长处测定吸光度,以试管数为横坐标,吸光度为纵坐标,绘制洗脱曲线。合并各尖峰管洗脱液,减压浓缩,蒸馏水透析2 d,冷冻干燥,得到多糖CP50的DEAE柱分离组分,分别为CPA、CPB。
1.3.3.2 Sephadex G-100凝胶柱纯化
与热带西北太平洋与东南印度洋对流活动异常正相关时不同,负相关时(图5c、5d),850 hPa上的苏门答腊岛西南附近海域为显著风场辐合区,高层辐散,菲律宾群岛以东海域850 hPa上存在辐散风场,对流层上层则相反,构成了一个东北—西南向的局地垂直环流圈。而热带西北太平洋处于下沉区,对流弱,热带东南印度洋则相反,对流强。从流场分布也可看出,850 hPa上热带西北太平洋存在反气旋性环流,而热带东南印度洋则存在气旋性环流。这与图3b中海温异常相对应,且与Gill型响应理论结果一致(Gill,1980)也与图2中的降水异常相对应。
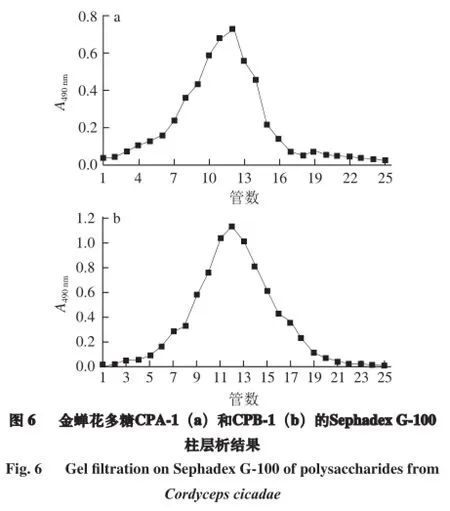
将DEAE-52柱层析收集到的CPA和CPB用Sephadex G-100柱层析进一步纯化。上样量为60 mg,上样体积为5 mL,流速为1 mL/min,以去离子水和不同浓度的NaCl 溶液为洗脱剂洗脱,分别收集洗脱液,苯酚-硫酸法测定多糖含量。合并各尖峰管洗脱液,减压浓缩,用蒸馏水透析2 d,冷冻干燥,分别得到其纯化组分CPA-1、CPB-1。
1.3.4 CPA-1、CPB-1纯度的鉴定
紫外光谱分析:将CPA-1和CPB-1分别配成1 mg/mL的水溶液,用紫外分光光度计在波长190~400 nm范围内进行扫描。
HPLC检测:CPA-1和CPB-1分别用0.003 mol/L醋酸钠配成5 mg/mL溶液,0.45 μm滤膜过滤后进样。色谱条件:采用TSKgel G4000PW色谱柱,流动相为0.003 mol/L醋酸钠,流速为0.5 mL/min。
1.3.5 单糖组成成分分析
分别称取10 mg CPA-1和CPB-1于安瓿瓶中,加5 mL 2 mol/L的硫酸溶液,酒精灯封口。100 ℃水解8 h,碳酸钡中和,离心,取上清液,减压蒸干。往多糖水解物、各单糖标准品中加入10 mg盐酸羟胺和1 mL吡啶,90 ℃水浴反应30 min,冷却至室温。加入1 mL乙酸酐,90 ℃水浴反应30 min,冷却至室温,制备成糖腈乙酰酯衍生物,进行气相色谱(gas chromatography,GC)分析[16]。色谱条件:HP-1弹性石英毛细管色谱柱(21 000 mm× 0.2 mm);柱温:起始温度130 ℃,保留5 min,程序升温4 ℃/min,终止温度240 ℃,保持10 min;汽化室温度250 ℃;氢火焰离子化检测器温度250 ℃。
1.3.6 CPA-1和CPB-1红外光谱分析
1.3.7 刚果红实验
配制质量浓度为1 mg/mL的多糖溶液,80 μmol/L的刚果红溶液。取1 mL样品溶液加入1 mL刚果红溶液,逐渐加入1 mol/L的NaOH,使溶液中NaOH终浓度由0 mol/L逐渐升高到0.5 mol/L,混匀,室温下静置15 min,进行紫外光谱扫描,记录刚果红在不同浓度NaOH溶液中的最大吸收波长。
2 结果与分析
2.1 金蝉花多糖的体外抗氧化活性
2.1.1 DPPH自由基的清除能力
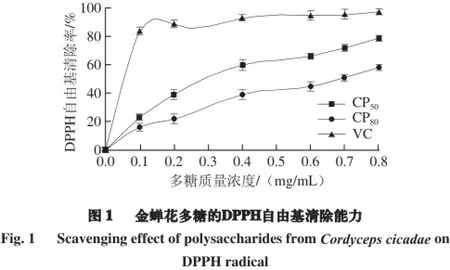
如图1所示,金蝉花多糖CP50和CP80均具有显著的清除DPPH自由基的能力,且表现出良好的剂量依赖关系。在质量浓度为0.1 mg/mL时,金蝉花多糖对DPPH自由基的清除能力虽然低于VC,但随着质量浓度的升高其清除能力增强,当质量浓度达到0.8 mg/mL时,CP50和CP80的清除率分别达到79.16%、58.73%。金蝉花多糖对DPPH自由基的清除能力可能是多糖中的羟基具有供氢质体能力的结果。可见金蝉花多糖具有明显清除DPPH自由基的能力,且CP50相对于CP80清除DPPH自由基的能力较强。
2.1.2 ·OH的清除能力
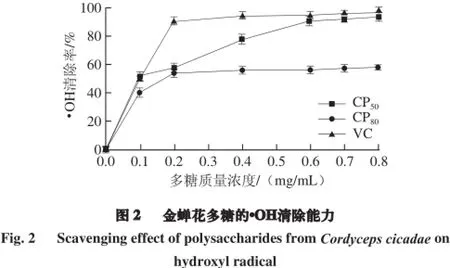
由图2可知,金蝉花多糖CP50和CP80清除·OH的能力随着质量浓度的增加而增强,表现出良好的剂量效应关系。在相同质量浓度下CP50对·OH的清除率高于CP80,在0.8 mg/mL时,CP50清除率为94.12%,而CP80的·OH清除率为57.9%。与VC相比,当多糖质量浓度在0.1~0.6 mg/mL之间时,CP50和CP80清除· OH的能力显著低于VC,当质量浓度大于0.6 mg/mL时,CP50对· OH的清除率趋于平缓,清除效果与VC相当。表明金蝉花多糖对·OH 有很好的清除能力,且CP50相对于CP80清除·OH能力较强。
2.1.3 总还原能力
在一定吸光度范围内,金蝉花多糖的总还原能力与其吸光度成正相关,吸光度越高,表示还原能力越强。由图3可知,在实验质量浓度范围内,金蝉花多糖和VC都具有显著的还原能力,并且随着质量浓度的增加而增强,CP50的还原力明显低于VC,但是略高于CP80,说明金蝉花多糖有一定的还原能力,且CP50的还原能力略高于CP80。

2.1.4 总抗氧化能力
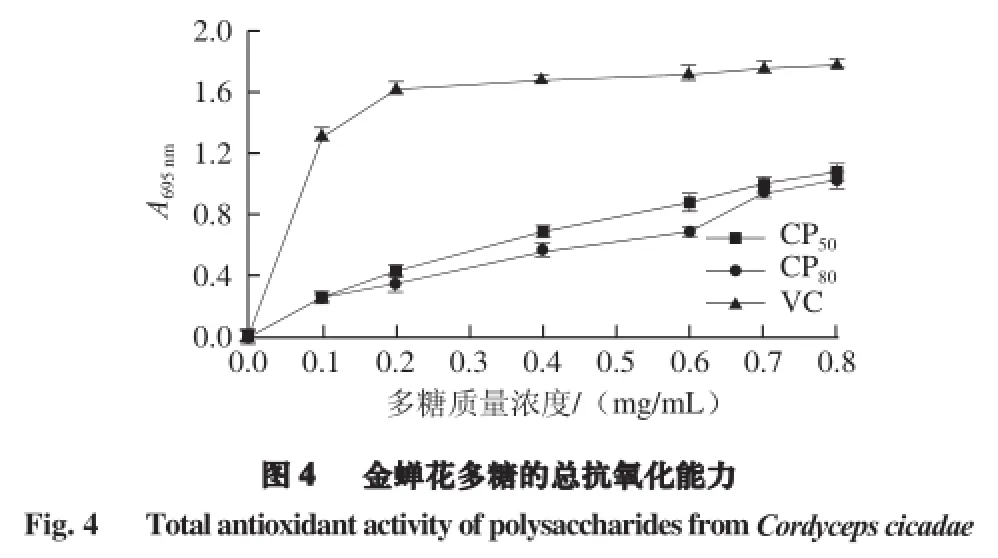
由图4可知,在测定质量浓度范围内,与VC相比,随着金蝉花多糖的质量浓度提高,总抗氧化能力明显增强。在相同质量浓度下,CP50较CP80的总抗氧化性能略强。
综合以上4 种体外抗氧化指标可知,金蝉花多糖有较好的清除DPPH自由基、·OH的能力和一定的还原能力以及总抗氧化能力,说明金蝉花多糖有良好的抗氧化活性,可以作为一种天然的抗氧化剂,值得开发和利用。
通过测定CP50和CP80的抗氧化活性,表明CP50相对CP80的抗氧化活性较高,具有广阔的潜在利用价值,故本实验将对CP50进一步分离纯化,为金蝉花多糖的进一步研究应用提供重要的理论依据和指导。
2.2 金蝉花多糖CP50的纯化结果
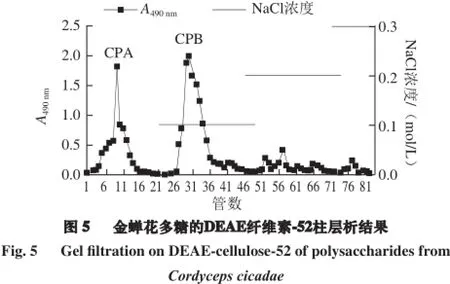
由图5可知,金蝉花多糖CP50经DEAE纤维素-52离子交换层析分离,以苯酚-硫酸法跟踪检测,主要得到2 个组分,分别为水洗脱部位(CPA)和0.1 mol/L NaCl洗脱部位(CPB)。再进一步经Sephadex G-100柱层析纯化,结果如图6所示。
2.3 CPA-1、CPB-1纯度的鉴定
CPA-1和CPB-1的紫外扫描结果显示,在核酸(260 nm)和蛋白质(280 nm)的特征吸收峰处没有紫外吸收,说明样品中均不含有蛋白质和核酸;经高效液相色谱法(high performance liquid chromatography,HPLC)检测为单一对称峰,表明样品为均一组分。
2.4 单糖组成成分分析
金蝉花多糖各组分的单糖组成结果如图7所示,CPA-1主要含有甘露糖、葡萄糖、半乳糖,各单糖的物质的量比为0.48∶1∶0.52。CPB-1主要由葡萄糖以及少量的甘露糖和半乳糖组成,其物质的量比为1∶0.14∶0.114。

2.5 CPA-1、CPB-1红外光谱分析
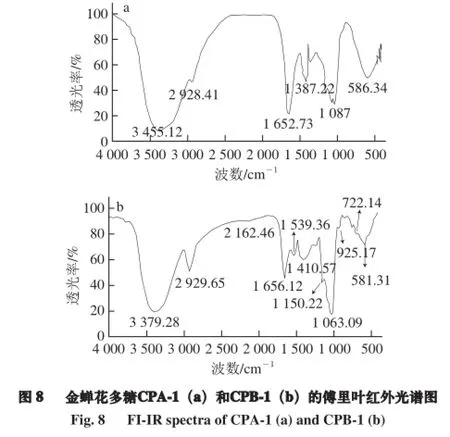
由图8可知,在3 400 cm-1附近的强吸收峰是糖分子中O—H的伸缩振动[17];2 930 cm-1处的峰是糖类C—H伸缩振动;1 600 cm-1附近的吸收峰可能是COO—中的C=O键的不对称伸缩振动;1 400~1 200 cm-1之间的吸收峰是糖类C—H的变角振动,以上几组吸收峰可以判断该物质属于糖类化合物[18];1 300~1 000 cm-1处的吸收属于吡喃环的伸缩振动,因此可以推测CPA-1和CPB-1是吡喃环结构[19]。此外,CPB-1在1 000~800 cm-1区域内有许多弱小吸收峰,说明CPB-1是以β-型糖苷键连接[20]。
2.6 刚果红实验结果分析
刚果红是一种酸性染料,能与具有三股螺旋构象的多糖形成络合物,使刚果红的最大吸收波长(λmax)发生红移,而一定浓度的NaOH溶液可破坏三股螺旋结构的氢键,表现为最大吸收波长的特征变化[21]。由图9可知,CPA-1和CPB-1与刚果红发生络合作用,NaOH浓度在0~0.1 mol/L时,溶液的最大吸收波长有上升趋势,但随着NaOH浓度的增高,这2 种溶液的最大吸收波长又逐渐减小,因此可以推测CPA-1和CPB-1具有三股螺旋构象。

3 结 论
抗氧化能力是衡量营养健康食品和植物生物活性成分的重要指标。目前常用的合成抗氧化剂如丁基羟基茴香醚和2,6-二叔丁基对甲酚等,虽然清除自由基的效果很好,但长期服用有致毒或致癌的风险[21-22]。因此,从天然产物中寻找安全有效的抗氧化剂显得越来越重要。本实验采用水提醇沉法从金蝉花中提取不同浓度乙醇分级沉淀的多糖(CP50和CP80),并分别检测其抗氧化活性。研究表明,CP50和CP80均具有较强的清除自由基的活性,且具有一定的还原能力和总抗氧化能力,说明金蝉花多糖具有良好的抗氧化活性,可以作为一种天然抗氧化剂。CP50表现出比CP80更加显著的清除自由基的活性,且存在明显的量效关系,当质量浓度达到0.8 mg/mL时,对DPPH自由基和·OH的清除率分别达到了79.16%、94.12%,显著高于CP80,表明CP50的抗氧化能力强于CP80,更适合开发为抗氧化剂。许多研究表明[23-25],多糖的生物活性与结构存在着密切关系,因此合理准确地分析活性多糖的结构具有重要意义。本研究对抗氧化活性较高的金蝉花多糖CP50进一步分离纯化,得到2 个组分CPA-1和CPB-1,并对其结构进行初步分析。经紫外光谱法和高效凝胶色谱法鉴定得知两者都是纯度较高的多糖组分。单糖组成分析表明CPA-1和CPB-1均含有葡萄糖、甘露糖和半乳糖,其物质的量比分别为:1∶0.48∶0.52、1∶0.14∶0.114;红外光谱扫描结果显示2 个组分具有多糖的典型特征吸收峰,并且都是吡喃环结构;刚果红实验研究表明,CPA-1和CPB-1具有三股螺旋结构。本研究可为进一步探讨金蝉花多糖活性与结构的关系奠定基础,同时也为金蝉花多糖功能产品的开发提供初步理论依据。
参考文献:
[1] 王海颖, 陈以平.陈以平教授巧用蝉花经验[J].中国中医药信息杂志, 2000, 7(10): 71.
[2] 宋捷民, 陈玲, 陈玮, 等.蝉花对免疫功能影响的实验研究[J].中国中医药杂志, 2007, 14(1): 37-38.
[3] ZHU Zhenyuan, LIU Nian, SI Chuanling, et al.Structure and antitumor activity of a high-molecular-weight polysaccharide from cultured mycelium of Cordyceps gunnii[J].Carbohydrate Polymers,2012, 88(3): 1072-1076.DOI:10.1016/j.carbpol.2012.01.068.
[4] 金丽琴, 吕建新, 袁谦, 等.蝉拟青霉对大鼠免疫功能和血液生化指标的影响[J].温州医学院学报, 2001, 31(6): 344-346.DOI:10.3969/ j.issn.1672-6472.2007.01.012.
[5] 王砚, 赵小京, 唐法娣.蝉花药理作用的初步探讨[J].浙江中医杂志, 2001, 36(5): 219.DOI:10.3969/j.issn.0411-8421.2001.05.027.
[6] 葛飞, 夏成润, 李春如, 等.蝉拟青霉菌丝体与天然蝉花中化学成分的比较分析[J].菌物学报, 2007, 26(1): 68-75.DOI:10.3969/ j.issn.1672-6472.2007.01.012.
[7] 金丽琴, 吕建新, 杨介钻, 等.蝉拟青霉总多糖对免疫抑制大鼠巨噬细胞激活作用的实验研究[J].中草药, 2007, 38(8): 1217-1220.DOI:10.3321/j.issn:0253-2670.2007.08.035.
[8] 金周慧, 陈以平, 邓跃毅.蝉花菌丝延缓肾小球硬化的作用机制研究[J].中国中西医结合肾病杂志, 2005, 6(3): 132-136.DOI:10.3969/ j.issn.1009-587X.2005.03.003.
[9] 王吉标, 欧阳臻, 赵明, 等.响应面分析法优化金蝉花多糖的提取工艺[J].天然产物研究与开发, 2014, 26(3): 438-443.
[10] 江岩, 郑力, 克热木江·吐尔逊江.药桑椹花青素的体外抗氧化作用[J].食品科学, 2011, 32(13): 45-48.
[11] TIAN Lingmin, ZHAO Yan, GUO Chao, et al.A comparative study on the antioxidant activities of an acidic polysaccharide and various solvent extracts derived from herbal Houttuynia cordata[J].Carbohydrate Polymers, 2011, 83(2): 537-544.DOI:10.1016/ j.carbpol.2010.08.023.
[12] 吕喜茹, 郭亮, 常明昌, 等.姬松茸粗多糖抗氧化作用[J].食用菌学报, 2010, 17(1): 69-71.DOI:10.3969/j.issn.1005-9873.2010.01.013.
[13] SONG Houfang, ZHANG Quanbin, ZHANG Zhongshan, et al.In vitro antioxidant activity of polysaccharides extracted from Bryopsis plumosa[J].Carbohydrate Polymers, 2010, 80(4): 1057-1061.DOI:10.1016/j.carbpol.2010.01.024.
[14] KUMARAN A, JOEL KARUNAKRAN R.Antioxidant and free radical scavenging activity of an aqueous extract of Coleus aromaticus[J].Food Chemistry, 2006, 97(1): 109-114.DOI:10.1016/ j.foodchem.2005.03.032.
[15] SMIRNOFF N, CUMBES Q J.Hydroxyl radical scavenging activity of compatible solutes[J].Phytochemistry, 1989, 28(4): 1057-1060.DOI:10.1016/0031-9422(89)80182-7.
[16] 欧阳臻, 陈钧, 李永辉.桑叶多糖的分离纯化及组成研究[J].食品科学, 2005, 26(3): 181-183.DOI:10.3321/j.issn:1002-6630.2005.03.043.
[17] 黄静涵, 艾斯, 卡尔, 等.灵芝多糖的分离纯化及结构鉴定[J].食品科学, 2011, 32(12): 301-304.
[18] XU Wentao, ZHANG Fangfang, LUO Yunbo, et al.Antioxidant activity of a water-soluble polysaccharide purified from Pteridium aquilinum[J].Carbohydrate Research, 2009, 344 (2): 217-222.DOI:10.1016/j.carres.2008.10.021.
[19] CAI Weirong, GU Xiaohong, TANG Jian.Extraction, purification,and characterization of the polysaccharides from Opuntia milpa alta[J].Carbohydrate Polymers, 2008, 71(3): 403-410.DOI:10.1016/ j.carbpol.2007.06.008.
[20] XIE Jianhua, XIE Mingyong, NIE Shaoping, et al.Isolation,chemical composition and antioxidant activities of a water-soluble polysaccharide from Cyclocarya paliurus (Batal.) lljinskaja[J].Food Chemistry, 2010, 119(4): 1626-1632.DOI:10.1016/ j.foodchem.2009.09.055.
[21] 刘微微, 刘旭, 曹学丽, 等.白背三七多糖的结构表征及α-葡萄糖苷酶的抑制活性[J].食品科学, 2013, 34(7): 115-120.
[22] BOTTERWECK A A, VERHAGEN H, GOLDBOHM R A, et al.Intake of butylated hydroxyanisole and butylated hydroxytoluene andstomach cancer risk: results from analyses in the Netherlands cohort study[J].Food and Chemical Toxicology, 2000, 38(7): 599-605.DOI:10.1016/S0278-6915(00)00042-9.
[23] SAITO M, SAKAGAMI H, FUJISAWA S.Cytotoxicity and apoptosis induction by butylated hydroxyanisol (BHA) and butylated hydroxytoluene (BHT)[J].Anticancer Research, 2003, 23(6C): 4693-4701.
[24] COSTA L S, FIDELIS G P, CORDEIRO S L, et al.Biological activities of sulfated polysaccharides from tropical seaweeds[J].Biomedicine & Pharmacotherapy, 2010, 64(1): 21-28.DOI:10.1016/ j.biopha.2009.03.005.
[25] JIAO Guangling, YU Guangli, ZHANG Junzeng, et al.Chemical structures and bioactivities of sulfated polysaccharides from marine algae[J].Marine Drugs, 2011, 9(2): 196-223.DOI:10.3390/ md9020196.
[26] HROMÁDKOVÁ Z, PAULSEN B S, POLOVKA M, et al.Structural features of two heteroxylan polysaccharide fractions from wheat bran with anti-complementary and antioxidant activities[J].Carbohydrate Polymers, 2013, 93(1): 22-30.DOI:10.1016/j.carbpol.2012.05.021.
DOI:10.7506/spkx1002-6630-201613004
中图分类号:R284.1
文献标志码:A
文章编号:1002-6630(2016)13-0019-06
收稿日期;2015-08-24
基金项目:国家自然科学基金面上项目(81072985;81373480;81573529);江苏省大学生实践创新训练计划立项项目(201513986001Y);江苏大学第13批大学生科研立项一般项目(13A154);江苏大学第14批大学生科研立项一般项目(14A134)
作者简介:封燕(1991—),女,硕士研究生,研究方向为中药活性成分。E-mail:fengyanxy@163.com
*通信作者:欧阳臻(1964—),女,教授,博士,研究方向为中药资源活性成分及新药开发。E-mail:zhenouyang@ujs.edu.cn
Antioxidant Activity and Preliminary Structure Analysis of Polysaccharides from Cordyceps cicadas
FENG Yan1, GONG Xiaohui2, WEI Dequn1, LIU Yingkun1, ZHAO Ming1, YU Xiaofeng1, OPEYEMI Joshua Olatunji1, JIAO Xinyi1, OUYANG Zhen1,*
(1.School of Pharmacy, Jiangsu University, Zhenjiang 212013, China;2.Jingjiang College, Jiangsu University, Zhenjiang 212013, China)
Abstract:In this study, the antioxidant activities and structural characteristics of polysaccharides from Cordyceps cicadae were determined.Two crude polysaccharide fractions (CP50and CP80) were extracted from Cordyceps cicadae with hot water and isolated by precipitation with different concentrations of ethanol.Their antioxidant activities were also analyzed.The results indicated that both CP50and CP80were effective in antioxidant activity.The radical scavenging activity of CP50was higher than that of CP80.CP50also showed higher reducing capacity and total antioxidant activity.CP50was then further purified by gel filtration on diethylaminoethyl (DEAE)-cellulose-52 and Sephadex G-100 columns, and two purified fractions were obtained, namely CPA-1 and CPB-1.Ultraviolet spectroscopy and high-performance liquid chromatography (HPLC) analysis revealed that CPA-1 and CPB-1 were homogeneous.Monosaccharide analysis revealed that both CPA-1 and CPB-1 were composed of Glc, Gal and Man with a molar ratio of 1:0.48:0.52 and 1:0.14:0.114, respectively.Moreover,both polysaccharide fractions had three helix structures.
Key words:Cordyceps cicadaes polysaccharides; antioxidant activity; separation and purification; structural analysis
