极端高温对西花蓟马存活、繁殖特性及体内海藻糖、山梨醇含量的影响
2016-07-18李洪刚万方浩郑长英
姜 姗,李 帅,张 彬,李洪刚,2,万方浩,3,郑长英
(1青岛农业大学农学与植物保护学院山东省重点昆虫生态学实验室,山东青岛 266109;2山东省植物保护总站,济南 250100;3中国农业科学院植物保护研究所植物病虫害生物学国家重点实验室,北京 100193)
极端高温对西花蓟马存活、繁殖特性及体内海藻糖、山梨醇含量的影响
姜姗1,李帅1,张彬1,李洪刚1,2,万方浩1,3,郑长英1
(1青岛农业大学农学与植物保护学院山东省重点昆虫生态学实验室,山东青岛 266109;2山东省植物保护总站,济南 250100;3中国农业科学院植物保护研究所植物病虫害生物学国家重点实验室,北京 100193)
摘要:【目的】西花蓟马(Frankliniella occidentalis)是中国的重要外来入侵和检疫性害虫, 对各地的蔬菜和花卉造成了巨大的经济损失。明确极端高温(45℃)对西花蓟马存活率、繁殖力以及体内海藻糖、山梨醇含量的影响,为西花蓟马的防治提供理论依据。【方法】设置45℃条件下高温热激西花蓟马当代成虫、2龄若虫2 h,经过24 h变温模式22℃(4 h)-25℃(8 h)-28℃(4 h)-25℃(8 h)培养后再进行一次45℃ 2 h的热激处理。研究热激处理后其亲代、F1代和F2代的种群参数(亲代各虫态存活率、雌成虫寿命,F1和F2代种群数量、存活率、性比)以及2龄若虫和成虫体内海藻糖和山梨醇含量的变化。【结果】45℃ 2 h高温热激两次后,西花蓟马各个虫态的存活率均小于50%,且预蛹和蛹的存活率为0,成虫的存活率最高为41.38%,显著高于其他虫态(1龄若虫存活率为5%,2龄若虫存活率为21.36%)(P<0.05);西花蓟马2龄若虫和成虫在45℃高温条件下热激2 h两次后,其亲代雌成虫寿命和繁殖力均明显降低,且F1代也受到较大影响, F1代种群数量、存活率、性比(♀∶♂)显著降低,但F2代种群有所恢复,另外热激处理西花蓟马成虫的雌成虫寿命及繁殖力在亲代、F1代中都明显高于热激处理2龄若虫(P<0.05);西花蓟马亲代成虫和2龄若虫在45℃热激2 h两次后其体内的海藻糖含量明显降低,并且影响到F1和F2代种群体内的海藻糖含量,另外热激处理亲代成虫其体内海藻糖含量低于热激处理亲代2龄若虫的海藻糖含量, 且F1和F2代与亲代趋势相同(P<0.05);西花蓟马亲代成虫和2龄若虫在45℃热激2 h两次后其体内的山梨醇含量明显升高,热激亲代成虫的山梨醇含量高于热激2龄若虫体内的山梨醇含量,且这种热激处理能够影响到后代种群体内山梨醇的含量,F1和F2代体内山梨醇含量的变化趋势与亲代相同(P <0.05)。【结论】45℃极端高温处理不仅对西花蓟马亲代的生长发育、繁殖和生理生化产生了明显的影响,而且这种影响延续到了子代(F1、F2代)的不同发育阶段。同时,西花蓟马对极端高温的应对与其体内的海藻糖、山梨醇的含量具有一定的相关性。
关键词:极端高温;西花蓟马;繁殖力;海藻糖;山梨醇
联系方式:姜姗,E-mail:906342335@qq.com。通信作者郑长英,E-mail:zhengcy67@qau.edu.cn
0 引言
【研究意义】温度是影响昆虫分布、存活、种群动态、行为特征以及适合度的一个重要的非生物因子[1],昆虫的正常生长发育需要在特定的温度范围才能进行,温度过高或过低都会对昆虫的生长发育产生不利影响,在田间或温室中,昆虫会经常遭受高温胁迫,有时甚至超过其生理上限造成死亡[2],因此高温闷棚方法已用于控制一些温室害虫[3-4];然而在低于致死高温的一定温度范围内,高温会造成昆虫器官的热损伤,从而影响到存活率及健康状况,尤其是导致其生殖适应性降低,从而影响到下一代的种群规模[5]。研究亚致死高温对昆虫存活、繁殖以及生理上的影响,对研究昆虫的种群适合度和种群动态具有一定的指导意义。【前人研究进展】昆虫对高温敏感主要是由于其弱小的体型和变温生理特性造成的[6]。在生物学方面,高温对昆虫的影响主要包括降低存活率、繁殖力、致使昆虫发育延迟或体型畸形等;而在生理上可致蛋白质变性、改变细胞膜通透性、酶的结构以及水分丧失等[7]。海藻糖是生物体内一种重要的双糖。作为昆虫体内重要血糖,海藻糖存在于昆虫几乎所有的组织和器官中。研究发现海藻糖可在高温、高寒、高渗透压及干燥失水等恶劣环境条件下在细胞表面形成独特的保护膜,有效地保护蛋白质分子使之不变性失活,从而维持生命体的生命过程和生物特征[8-9]。在高温条件下,海藻糖的表现尤为明显,并且可能与耐热性存在某种联系[10]。另外,生物体内多羟基化合物的积累对其抵抗极端温度的胁迫也十分重要。例如,研究发现山梨醇在蚜虫和粉虱耐高温方面起了非常重要的作用[11-12];高温刺激了蚜虫和粉虱取食量的明显增加,可以使食物中获取的糖分转变成山梨醇来提高耐热性[13]。【本研究切入点】西花蓟马(Frankliniella occidentalis)是世界范围分布的危险性入侵害虫[14]。具有个体小、善于隐藏、繁殖能力强、适生区广泛以及抗药性不断增强等特点,防治困难[15]。高温闷棚是防治西花蓟马的一种安全、有效,且对环境无污染的物理防治措施,已用于温室中防治害虫[16],但其机制还不明确。探讨西花蓟马对高温响应的生理机制有利于对其进行科学防治,前期研究发现在45℃热激处理一次西花蓟马亲代2 h,其亲代和F1代的繁殖参数变化不明显。因此,本试验探究两次热激对西花蓟马种群亲代和 F1代的影响以及这种热激是否会对F2代产生影响。【拟解决的关键问题】45℃高温处理西花蓟马不同虫态,探究高温连续热激两次对其存活率、繁殖力以及海藻糖、山梨醇含量的影响,了解高温对昆虫产生的生理损伤,以及这些损伤与昆虫的生长发育、存活、繁殖等的关系,从生理学、生态学角度为阐明西花蓟马对环境胁迫的适应机制提供依据。
1 材料与方法
试验于2014—2015年在青岛农业大学完成。
1.1 供试材料与仪器
供试西花蓟马采自青岛农业大学校园内三叶草(Trifolium repens)上,采回后在室内变温模式下用紫甘蓝(Brassica oleracea)饲养多代后备用。
MGC-250BP-2型光照培养箱(上海恒科学仪器有限公司,温差:±0.5℃)、酶标仪、超低温冰箱、Eppendorf冷冻离心机、恒温磁力搅拌器、Thermo超低温冰箱。
1.2 试验方法
依据温室通常情况下的平均温度,温度设为变温模式22℃(4 h)-25℃(8 h)-28℃(4 h)-25℃(8 h),相对湿度55%—60%,光周期L∶D=16 h∶8 h。极端温度设定为45℃,热激时间为2 h,次数为48 h内两次。
1.2.1 西花蓟马各虫态存活率 用毛笔分别挑取西花蓟马的1龄若虫、2龄若虫、预蛹、蛹、成虫各60头分别放于内置新鲜甘蓝叶片养虫瓶中,然后于45℃的培养箱内热激2 h(培养箱缓慢升温,到45℃开始计时2 h),之后移到预先设定好的变温条件下培养,24 h后,再次放于45℃的培养箱内热处理2 h。记录各虫态的存活情况。每处理设5个重复。若虫和蛹可发育到下一虫态,记为存活,否则记为死亡。成虫则用软毛刷轻触虫体,无活动或四肢无抖动判定为死亡。
对照设置:将西花蓟马1龄若虫、2龄若虫、预蛹、蛹、成虫各60头放置预先设定好的变温模式22℃(4 h)-25℃(8 h)-28℃(4 h)-25℃(8 h)下培养。

虫态存活率=1-校正死亡率(图中此百分率需转化为小数)
1.2.2 西花蓟马亲代 2龄若虫、成虫孤雌生殖下亲代、F1代的繁殖参数 经过预试验45℃两次热处理1龄若虫死亡率达到95%,预蛹和蛹死亡率达到100%,故选取成虫和2龄若虫法进行下一步试验。
热激处理及对照设置:收集西花蓟马2龄若虫、成虫于内置新鲜甘蓝叶片养虫瓶中,然后于45℃的培养箱内分别热激2 h两次,方法同1.2.1。西花蓟马2龄若虫或成虫在预先设定好的变温模式22℃(4 h)-25℃(8 h)-28℃(4 h)-25℃(8 h)培养后,不经热激处理,作为对照。
亲代成虫处理:试验开始时将若干刚羽化西花蓟马成虫(雌雄均有)置于有甘蓝叶片的养虫瓶中,放于45℃的培养箱内热处理2 h,之后移到预先设定好的变温条件下培养,24 h后,再次放于45℃的培养箱内热处理2 h,待其恢复2 h后,用吸虫器吸取20头幸存雌成虫置于放有紫甘蓝叶片的100 mL离心管中,离心管放置于预先设定好的变温培养箱中培养。每隔24 h更换新鲜的甘蓝叶片,并将前一天的甘蓝叶片取出,放入相应的9 cm培养皿中,培养皿放置在变温箱中培养,每天调查1次培养皿中刚孵化出的F1代1龄若虫数量作为亲代产卵量(卵产于叶肉中用肉眼难以观察),直至离心管中亲代雌性蓟马全部死亡。将F1代1龄若虫全部移走,放入养虫瓶中,大约7 d后成虫羽化开始记录F1代成虫数,每天记录1次,直至若虫全部羽化为成虫。试验每个处理重复 3次,共 60头。统计亲代的雌虫寿命、计数F1代若虫和成虫总数量、计算F1代存活率(F1代均为雄虫,无性比)。
由于西花蓟马孤雌产雄,因此在F1代的雄成虫刚羽化之时,取20头雄虫,另取20头未经高温处理的雌成虫与之配对。每个处理重复3次,共120头。统计 F1代的雌虫寿命、计数 F2代若虫和成虫总数量、计算F2代存活率以及F2代性比。
亲代2龄若虫处理:45℃热激处理西花蓟马亲代2龄若虫两次,待长成成虫后孤雌生殖下产卵,处理方法同1.2.1。
后代存活率=(成虫数量/ 1龄若虫数量)×100%(此百分率在下文表中无需转换)
F2代性比:F1代所产生的20头雄虫与未处理的20头雌虫交配,计数后代雌雄数量,雌虫与雄虫的比值即为F2性比(3次重复的平均值)。
为方便表达,下文中所有“F1代孤雌生殖”是指亲代孤雌产雄生殖得到的F1代,“F2代孤雌生殖”是指未处理的雌虫与 F1代雄虫进行有性生殖得到的 F2代。
1.2.3 西花蓟马亲代 2龄若虫、成虫两性生殖下亲代、F1代的繁殖参数 热激处理方法同1.2.2,区别为高温热激后存活2龄若虫待其培养到成虫后,从中选取20头雌性蓟马和20头雄性蓟马放入每个离心管中进行两性生殖,共3组,120头;高温热激后存活的成虫,从中选取20头雌性蓟马和20头雄性蓟马放入每个离心管中进行两性生殖,共3组,120头。
取F1代的20头雄成虫与20头雌成虫配对。每个处理重复3次,共120头。统计亲代F1代的雌虫寿命、计数F1代和F2代若虫和成虫总数量、计算F1代和F2代存活率以及性比。
后代性比:亲代处理过的20头雌虫与20头雄虫交配,F1代雌虫与雄虫的比值即为F1代性比(3次重复的平均值);F1代种群内20头雌虫与20头雄虫交配,F2代雌虫与雄虫的比值即为F2代性比(3次重复的平均值)。
1.2.4 西花蓟马体内海藻糖和山梨醇的含量变化海藻糖的测定:将若干西花蓟马成虫和2龄若虫置于有甘蓝叶片的养虫瓶中,分别进行上述1.2.1的高温处理。处理后用吸虫器吸取活虫300头,每个处理5个重复。另外,重新高温处理西花蓟马成虫和2龄若虫,取存活的成虫和2龄若虫西花蓟马置于预先设定好的变温培养箱中培养,亲代产卵后分别取 F1代成虫和F1代2龄若虫个体,测定其体内海藻糖含量变化。同样地,培养到F2代个体,测定其体内海藻糖含量变化,从而与亲代、F1代进行比较。将亲代、F1代、F2代的成虫和2龄若虫蓟马(每次重复约300头)分别放入1.5 mL离心管内,用液氮浇在离心管外部,使蓟马迅速死亡,固定体内成分,置于-80℃超低温冰箱内,保持其体内物质的稳定性,待测。
参考杜尧[17]的测定方法,制作葡萄糖标准曲线,得出标准曲线的回归方程,相关系数R2,求出0—l 000 µg·mL-1之间葡萄糖与DNS吸光值的线性关系。
用分析天平称量出西花蓟马的质量。测定待测液中原有葡萄糖含量Cl值,再测定出酶分解后所含有葡萄糖含量 C2值。依据公式:海藻糖含量=(C2-Cl)×1.05×4/蓟马质量,来计算出样品海藻糖含量。
山梨醇的测定:将若干西花蓟马成虫和2龄若虫置于有甘蓝叶片的养虫瓶中,然后分别进行上述1.2.1的高温处理。处理方法同上。
首先制作山梨醇含量标准曲线,得出标准曲线的回归方程,相关系数R2,进而求出0—2 mg·mL-1之间山梨醇含量与吸光度的线性关系。然后制备酶液,加500 µL蒸馏水,5 000 r/min离心10 min,取上清液;用500 µL蒸馏水再离心提取,合并上清液。记下测试液体积V。在655 nm下进行比色,用空白试管溶液调零,记录吸光度。对比标准曲线,求得标准曲线查得的山梨醇含量C0(ng·mg-1)。
最后求得山梨醇含量:C =(C0×V)/(蓟马质量×l 000)
1.3 数据分析
采用Excel将所得数据绘制表格,通过SPSS19.0进行统计分析,采用LSD检测法比较不同处理之间的差异显著性。显著性水平取P<0.05。
2 结果
2.1 对西花蓟马不同龄期存活率的影响
45℃连续两次热激处理西花蓟马不同虫态2 h后,各个虫态的存活率都小于50%,且预蛹和蛹的存活率为 0,显著低于成虫和 2龄若虫(F4,20=985.28,P<0.05)。1龄、2龄以及成虫的存活率分别为5%、21.36% 和 41.38%,存在显著差异(F4,20=985.28,P<0.05)(图1)。
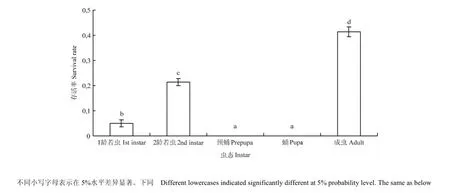
图1 西花蓟马不同龄期的存活率Fig. 1 The survival rate of different instars of F. occidentalis
2.2 对西花蓟马繁殖力的影响
2.2.1 不同生殖方式下亲代、F1代雌虫的寿命 45℃连续两次热激2 h后,对于亲代孤雌生殖,45℃热激当代成虫其当代雌虫寿命(34.33 d)显著高于热激2龄若虫(25.33 d),显著低于对照的(40.67 d)(F2,6=267.17,P<0.05)。亲代两性生殖与亲代孤雌生殖有相似的趋势(F2,6=46.33,P<0.05)。F1代种群有恢复的趋势。但对于两性生殖F1代的雌虫寿命,处理和对照之间仍存在显著差异(F2,6=22.79,P<0.05)(表1)。
2.2.2 不同生殖方式下F1、F2代的若虫数 无论是孤雌生殖还是两性生殖,西花蓟马亲代经短时高温热激对其后代若虫数量都有很大的影响,且对照和两个处理之间在0.05水平差异显著。对于F1代孤雌生殖,热激当代成虫(雌虫20头)其后代若虫数(1 428.33)显著高于热激2龄若虫(1 261.00),显著低于对照(2 582.33)(F2,6=9 317.13,P<0.05)。对于F1代两性生殖(雌虫20头,雄虫20头)与孤雌生殖有相似的趋势。孤雌生殖F2代若虫数量显著高于F1代,但仍低于对照;有性生殖F2代若虫数量有恢复的趋势,但与对照间仍存在显著差异(孤雌:F2,6=166.64,P<0.05;两性:F2,6=122.73,P<0.05)(表2)。

表1 对孤雌生殖和两性生殖下亲代、F1代雌虫寿命的影响Table 1 Effect of EHT on adult females longevity of parental generation and F1under parthenogenesis and sexual reproduction conditions
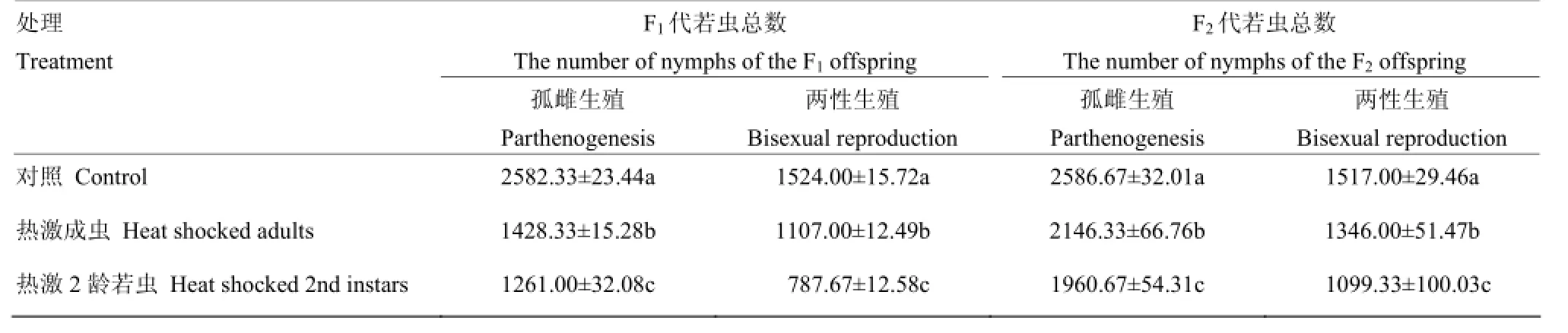
表2 对孤雌生殖和两性生殖下F1、F2代若虫数的影响Table 2 Effect of EHT on the numbers of F1, F2nymphs under parthenogenesis and sexual reproduction conditions
2.2.3 不同生殖方式下F1、F2代的成虫数 西花蓟马亲代经历短时高温热激后,对其成虫的数量也有很大的影响。对于孤雌生殖来说,热激当代成虫F1代成虫数(853.33)显著高于热激2龄若虫(699.67),显著低于对照(1 905.33)(F2,6=2 571.37,P<0.05)。 两性生殖和孤雌生殖有相似的趋势(F2,6=2 186.00,P<0.05)。孤雌生殖F2代成虫数量显著高于F1代,但仍低于对照;有性生殖F2代成虫数量有恢复的趋势,但与对照间仍存在显著差异(孤雌:F2,6=110.35,P<0.05;两性:F2,6=29.34,P<0.05)(表3)。
2.2.4 不同生殖方式下F1、F2代的总存活率 西花蓟马亲代经历短时高温热激后,对其后代的总存活率也有很大的影响。对于孤雌生殖来说,热激当代成虫和 2龄若虫其 F1代存活率分别为 59.75%、55.50%,与对照(73.78%)存在显著差异(F2,6=582.14,P<0.05)。而两性生殖,热激当代成虫和2龄若虫后其 F1代存活率分别为 60.74%、59.40%,与对照存在显著差异(F2,6=114.01,P<0.05)。对于 F2代总存活率,无论是孤雌还是两性生殖,种群整体有恢复趋势,热激当代成虫其F2代和热激2龄若虫其F2代存活率分别与对照种群存在显著差异,而热激成虫和热激 2龄若虫之间差异不显著(孤雌:F2,6=19.63,P>0.05;两性:F2,6=24.44,P>0.05)(表4)。

表3 对孤雌生殖和两性生殖下F1、F2代成虫数的影响Table 3 Effect of EHT on the numbers of F1, F2adult under parthenogenesis and sexual reproduction conditions

表4 对孤雌生殖和两性生殖下F1、F2代总存活率的影响Table 4 Effect of EHT on the survival rates from nymph to adult of F1and F2under parthenogenesis and sexual reproduction conditions
2.2.5 不同生殖方式下 F1、F2代的性比 短时高温热激对西花蓟马性比(♀∶♂)的影响较大。对于两性生殖下F1代,热激当代成虫其F1代性比(2.53∶1)高于热激2龄若虫(2.42∶1),低于对照(2.66∶1)。对于两性生殖下F2代,热激成虫其F2代的性比(2.43∶1)低于对照种群(2.77∶1),但是热激成虫和热激2龄若虫其F2代的性比差异不明显。对于孤雌生殖来说,F1代全部为雄性,无性比。F2代中对照的性比(2.65∶1)高于其他两个处理(热激成虫:2.43∶1;热激2龄若虫2.41∶1)(表5)。

表5 对孤雌生殖和两性生殖下F1、F2代性比的影响Table 5 Effect of EHT on the sex ratio (female∶male) of F1and F2under parthenogenesis and sexual reproduction conditions
2.3 对西花蓟马体内海藻糖含量的影响
2.3.1 成虫体内海藻糖含量的变化 西花蓟马经过45℃高温2 h连续两次处理后,其成虫体内的海藻糖含量变化较大。对照西花蓟马成虫体内的海藻糖含量为17.23 mg·g-1,而 45℃处理西花蓟马当代成虫后,其体内的海藻糖含量降低为8.43 mg·g-1,显著低于对照种群(F5,24=130.11,P<0.05)。热激当代成虫和若虫后,其F1代成虫体内的海藻糖含量(热激成虫:12.86 mg·g-1;热激若虫11.73 mg·g-1)显著低于对照成虫体内的海藻糖含量(F5,24=130.11,P<0.05)。F2代成虫体内的海藻糖含量与 F1代相比有所上升,但与对照仍然差异显著(F5,24=130.11,P<0.05)。热激当代成虫其F1代成虫体内的海藻糖含量(12.86 mg·g-1)显著高于热激当代若虫其F1代的成虫体内含量(11.73 mg·g-1),且F2代与F1代趋势相同(F5,24=130.11,P<0.05)(图2)。
2.3.2 若虫体内海藻糖含量的变化 西花蓟马经过45℃高温2 h连续两次处理后,其若虫体内的海藻糖含量变化明显。对照西花蓟马的若虫体内海藻糖含量为27.12 mg·g-1,而45℃处理西花蓟马当代若虫后,其体内的海藻糖含量降低为12.04 mg·g-1,显著低于对照种群(F5,24=384.27,P<0.05)。热激当代成虫和若虫后,其F1代若虫体内的海藻糖含量(热激成虫:16.48 mg·g-1;热激若虫14.20 mg·g-1)显著低于对照若虫体内的海藻糖含量(F5,24=384.27,P<0.05)。F2代若虫体内的海藻糖含量与F1代相比有所上升,但与对照差异显著(F5,24=384.27,P<0.05)。热激当代成虫其F1代若虫体内的海藻糖含量(16.48 mg·g-1)显著高于热激当代若虫其 F1代若虫体内的含量(14.20 mg·g-1),且F2代与F1代趋势相同(F5,24=384.27,P <0.05)(图3)。
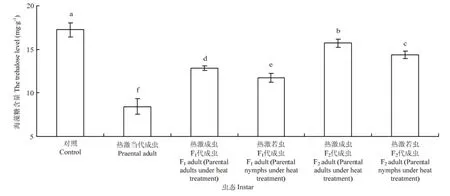
图2 对亲代、F1代、F2代成虫体内海藻糖含量的影响Fig. 2 Effect of EHT on the trehalose level in adult of parent generation, F1and F2
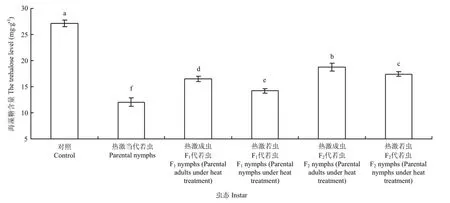
图3 对亲代、F1代、F2代若虫体内海藻糖含量的影响Fig. 3 Effect of EHT on the trehalose level in nymphs of parent generation, F1and F2
2.4 对西花蓟马体内山梨醇含量的影响
2.4.1 成虫体内山梨醇含量的变化 西花蓟马经过45℃高温2 h连续两次处理后,其成虫体内的山梨醇含量变化较大。对照西花蓟马的成虫体内山梨醇含量为0.95 ng·mg-1,而 45℃处理西花蓟马当代成虫后,其体内的山梨醇含量上升为 2.73 ng·mg-1,显著高于对照种群(F5,24=554.57,P<0.05)。热激当代成虫和若虫后,其F1代成虫体内的山梨醇含量(热激成虫:1.45 ng·mg-1;热激若虫:1.38 ng·mg-1)显著高于对照成虫体内的山梨醇含量(0.95 ng·mg-1)(F5,24=318.30,P<0.05)。而F2代成虫体内的山梨醇含量与F1代相比有所降低,分别为1.22、1.15 ng·mg-1,但与对照仍然存在差异显著性(F5,24=318.30,P<0.05)。热激当代成虫其F1代成虫体内的山梨醇含量(1.45 ng·mg-1)与热激当代若虫其F1代成虫体内的含量(1.38 ng·mg-1)无明显差异,F2代也无明显差异(F5,24=384.27,P>0.05)(图4)。
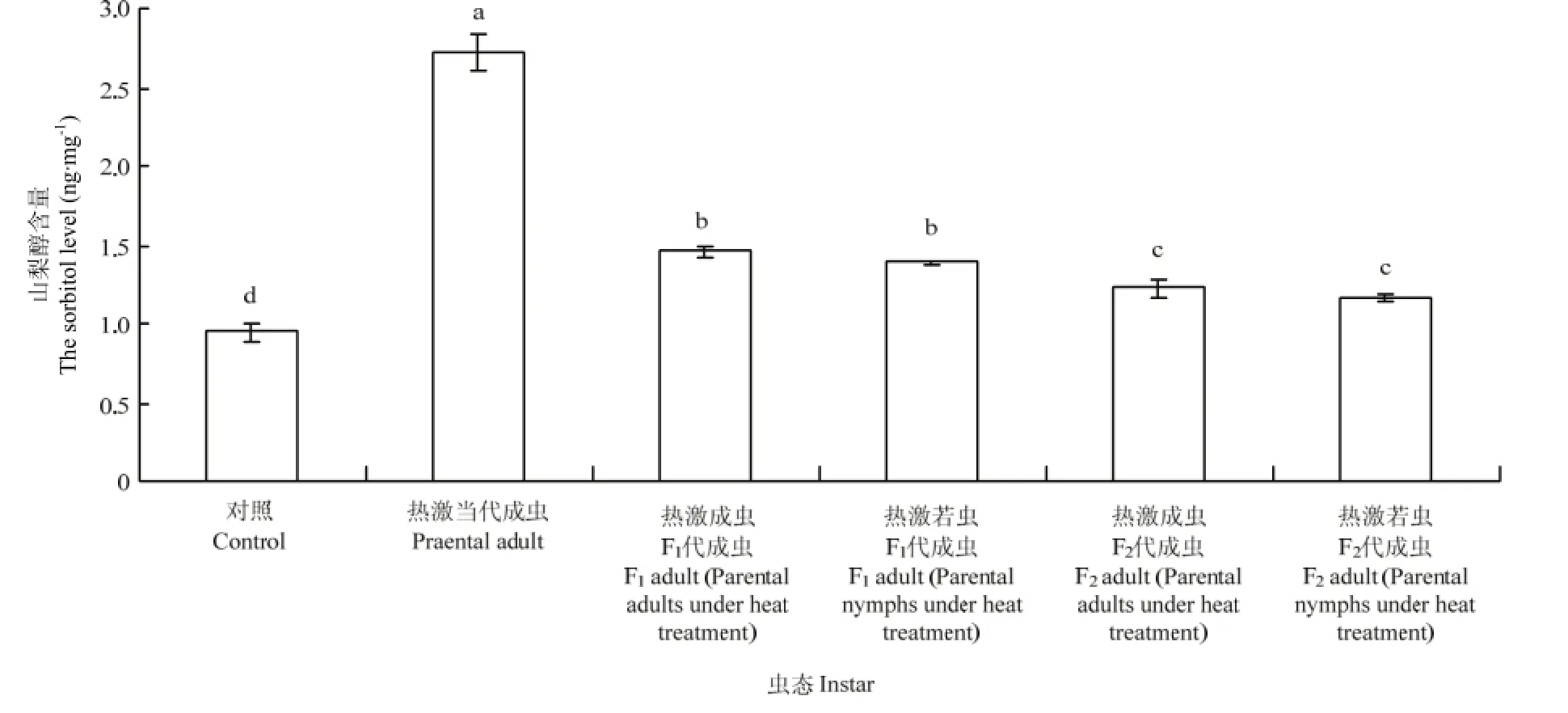
图4 对亲代、F1代、F2代成虫体内山梨醇含量的影响Fig. 4 Effect of EHT on the sorbitol level in adult of parent generation, F1and F2
2.4.2 若虫体内山梨醇含量的变换 西花蓟马经过45℃高温2 h连续两次处理后,其若虫体内的山梨醇含量的变化明显。对照条件下,西花蓟马的若虫体内山梨醇含量为0.70 ng·mg-1,而45℃处理西花蓟马当代若虫后,其体内的山梨醇含量上升为2.13 ng·mg-1,显著高于对照种群(F5,24=318.30,P<0.05)。热激当代成虫和若虫后,其F1代若虫体内的山梨醇含量(热激成虫:1.63 ng·mg-1;热激若虫1.61 ng·mg-1)显著高于对照若虫体内的山梨醇含量(0.70 ng·mg-1)(F5,24=318.30,P<0.05)。F2代若虫体内的山梨醇含量与F1代相比有所降低,热激成虫后F2代若虫(0.84 ng·mg-1)仍与对照有差异显著性(F5,24=318.30,P<0.05),而热激若虫后F2代若虫(0.70 ng·mg-1)与对照无差异显著性。热激当代成虫其F1代若虫体内的山梨醇含量(1.63 ng·mg-1)与热激当代若虫其F1代若虫体内的含量(1.61 ng·mg-1),但热激当代成虫其 F2代若虫体内的山梨醇含量(0.84 ng·mg-1)显著高于热激当代若虫其 F2代若虫体内的含量(0.70 ng·mg-1)(F5,24=384.27,P<0.05)(图5)。
3 讨论
3.1 高温对西花蓟马存活率的影响
高温可导致昆虫体内水分的散失[18]、膜结构的破坏和蛋白的降解,从而限制了相关酶催化的反应[19]。同时,高温对昆虫神经系统的伤害常导致许多功能的丧失[20-21],而这些伤害主要反映在昆虫存活率上。前期结果显示,西花蓟马成虫在45℃热激一次2 h后,其存活率在80%左右,本研究在此结果的基础上进行连续两次热激,结果表明西花蓟马各个虫态的存活率极低,并且不同虫态表现出的耐热性不同,预蛹和蛹的存活率为0,1龄若虫的存活率为5%。相比较而言,成虫的耐热性是最高的,其次是2龄若虫。这表明,45℃的极端高温对西花蓟马的存活极其不利,这可能是由于如此的高温超出了西花蓟马所能承受的生理极限。西花蓟马成虫的耐热性是最高的,推测原因可能是由于若虫的体表较柔软,角质层较薄;而成虫的体表相对坚硬,角质层较厚,降低了体内水分损失,保持体内的正常生命活动的进行。西花蓟马蛹期的耐热性最低,可能是由于蛹期时西花蓟马几乎处于不食不动的状态,无法迅速躲避外界高温。
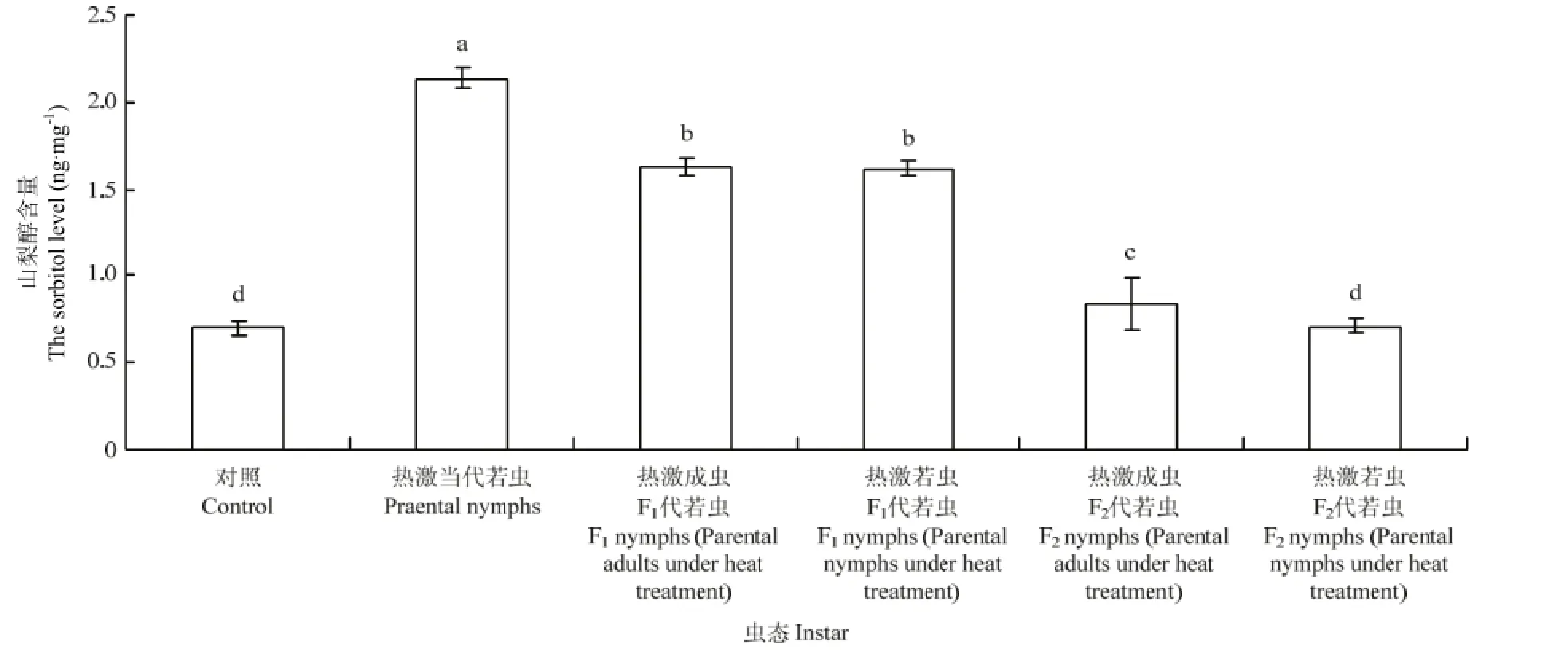
图5 对亲代、F1代、F2代若虫体内山梨醇含量的影响Fig. 5 Effect of EHT on the sorbitol level in nymphs of parent generation, F1and F2
3.2 高温对西花蓟马生殖的影响
一般而言,大多数昆虫存活及发育的上限温度范围为 40—50℃。超出此范围后,昆虫将面临两个结局:存活或死亡[7]。此外,即使一部分昆虫在遭遇高温后能存活下来,但其适合度必定会受到影响[22]。研究发现,烟粉虱雌虫的寿命从20℃时的44.36 d下降到35℃时的10.43 d[23]。小菜蛾雌虫的寿命也随着温度升高而明显缩短,15℃下46.4 d,35℃下平均寿命仅为3.6 d[24]。前期试验结果显示,西花蓟马种群在45℃的高温2 h热激一次后,雌成虫寿命从34.65 d缩短到27.91 d[25]。本研究显示,45℃的高温2 h热激两次后,无论是孤雌生殖还是两性生殖,雌性成虫的寿命都明显缩短,甚至影响到F2代雌虫寿命。这可能是西花蓟马在抵抗高温胁迫时消耗了部分能量或者体内生理物质发生改变,影响了以后的生存。
温度对昆虫繁殖起着至关重要的作用。许多研究表明,在高温作用下,昆虫的生殖受到明显地抑制。研究人员发现,将棉铃虫暴露在 42—46℃的高温范围一段时间后,其产卵量受到严重影响。当在 40、42.5、45℃下暴露360、120、15 min后,棉铃虫在整个生活史时期内均不产卵[26]。在相关的研究中发现,将红尾肉蝇(Sarcophaga crassipalpis)暴露于45℃ 1 h后,其产卵量仅为对照的10%。更为重要的是,这些卵全部不可育[22]。Q型烟粉虱(Bemisia tabaci)成虫在44℃下暴露1 h后单头雌虫的产卵量为77. 2粒,低于常温 26℃下的产卵量 100.1粒[27];温室白粉虱(Trialeurodes vaporariorum)成虫在37—43℃暴露2 h后单雌产卵量由62.4粒下降到1.5粒,45℃暴露2 h后甚至停止了产卵[28]。另外麦无网长管蚜(Metopolophium dirhodum)经过高于29℃的高温处理后,产卵量和寿命明显降低,且高温对成虫期的伤害要大于若虫期[29]。与上述研究不同的是,本试验的结果是热激对若虫的伤害大于成虫,F1代有性生殖结果显示,热激亲代成虫和若虫后产卵量从对照的1 524.00粒分别下降至1 107.00粒和787.67粒。无论是两性生殖还是孤雌生殖,F1代种群数量都明显减少,两个处理间和对照都有显著性差异。对于孤雌生殖F2代,由于与F1代雄成虫交配的雌成虫是未经处理,所以产卵量高于孤雌生殖F1代,但低于对照,这说明高温对F1代雄性有一定影响。对于有性生殖 F2代,种群有明显的恢复,但是与对照仍然存在显著性差异。分析其原因,在多数昆虫中,高温能破坏雌雄两性的生殖系统功能[30-31]。已有的研究表明,高温能够影响雌虫卵巢和卵子的发育,从而导致产卵量的降低。此外,高温也能对雄虫的输精管及精子造成伤害,导致其不育[22,32],从而导致F1代种群降低。
热激对西花蓟马后代性比和存活率也有很大的影响。关于高温对昆虫后代存活率和性比的影响,在不同昆虫上有不同表现:赵鑫等[33]研究表明,莲草直胸跳甲(Agasicles hygrophila)经短时高温暴露后,后代存活率下降;另有研究表明,温度对烟粉虱的性比变化有影响[34]。B型烟粉虱成虫在比较温和的高温下(39 和41℃)热激l h,其后代中雌虫的比例上升;经过43℃及以上高温暴露后其后代性比产生逆转,雄虫所占的比例上升。在本试验中,孤雌生殖情况下,热激西花蓟马成虫、若虫2 h后,F1代总存活率和对照都有显著差异,且热激当代成虫的存活率高于热激2龄若虫;F2代两个处理与对照有显著差异,但两个处理间差异不大。F2代的总存活率总体来说高于F1代,仍与对照存在显著差异。热激处理后F1代两性生殖的性比和对照相比明显降低,两个处理间也有所差异。F2代处理与对照仍有差异,但是处理间差异不大。造成这一现象的原因可能是西花蓟马孤雌生殖产生雄虫,两性生殖产雌虫和雄虫,西花蓟马亲代在45℃高温处理后可能出现雄性不育的现象,导致两性生殖产雌率降低,后代雌雄比例降低。而F2代种群整体有所恢复,因此会有更多的雌性蓟马选择两性生殖,F2代就会产生更多的雌性个体,雌雄性比在 F2代相对增加,F2代以后的种群数量就会趋于稳定。
综上所述,亲代进行短时高温暴露后,存活率降低,F1代繁殖速度相应变慢,这些都是西花蓟马在短时高温下的不利反应。而F1代可以通过自身的种群调节,保证相应龄期的存活率和产生较多的雌性后代来保证后代种群的延续,降低了高温暴露对后代不利影响的累积效应。
3.3 高温对西花蓟马小分子物质变化的影响
3.3.1 高温对西花蓟马海藻糖变化的影响 昆虫属于变温动物,保持和调节体内温度的能力不强。因此,昆虫的代谢速率十分依赖于环境温度的变化。一旦温度出现急剧变化,将引发其体内一系列代谢反应。海藻糖是昆虫体内的主要糖分,主要用于满足昆虫的各种需能活动,细胞内高含量的海藻糖能保护生物分子抵御伤害,增强生存能力。海藻糖能在海藻糖酶的水解作用下转化成葡萄糖,而葡萄糖在昆虫体内糖类代谢过程中可与糖原互相转化,参与能量代谢[10]。西花蓟马成虫和2龄若虫受到45℃高温处理后其体内的海藻糖含量明显降低,这说明在热激处理后,其体内的海藻糖已被海藻糖酶分解为葡萄糖,大部分用于抵抗高温胁迫,因此不足以为其正常的生命活动提供足够的能量,从而影响其健康性甚至存活,这方面可以用于解释高温能够降低西花蓟马的存活率。另外,除了能量代谢,海藻糖在昆虫生殖腺和生殖细胞发育等方面也起着重要的作用。其含量的显著改变,将破坏昆虫正常生理功能,使之生理状态紊乱,生长发育受阻。这一点也可以解释西花蓟马不同虫态经过高温处理后,其F1代若虫总数、成虫总数和后代总存活率都下降。结果结果还显示,西花蓟马亲代经过45℃热激处理后,亲代成虫体内的海藻糖含量明显低于2龄若虫的,这说明亲代成虫大部分的海藻糖被分解用于抵抗高温胁迫,再次证明了西花蓟马成虫的耐热性高于 2龄若虫的,对其后代影响较小,这与高温热激成虫后其F1、F2代若虫数和成虫数较高相吻合。相似的结果也表现在恒温条件下培养的西花蓟马种群(数据未发表)。
3.3.2 高温对西花蓟马山梨醇变化的影响 在高温胁迫下,昆虫可能通过合成小分子物质来抵御高温的伤害。例如,在高温胁迫下蚜虫和粉虱体内的山梨醇含量显著增加,由此推测,蚜虫和粉虱将从食物中获得果糖作为底物,在NADPH酮糖还原酶的作用下将果糖转变成甘露醇或山梨醇[15]。同时也有研究发现,甘露醇和山梨醇在昆虫体内的含量随气温变化而有所差异。在温度较高的中午,2种物质的含量要显著高于早晨[15]。因此,甘露醇和山梨醇在昆虫抵御高温过程中可能具有重要作用[14,35]。本研究表明,西花蓟马亲代成虫和2龄若虫经过45℃热激处理后,其体内的山梨醇含量明显升高,且在F1、F2代种群中仍然存在较高的含量,这说明高温热激后,西花蓟马取食量增加,从而将食物中的果糖转变成山梨醇。另外西花蓟马亲代不同虫态经热激处理后,成虫体内的山梨醇含量明显高于若虫,说明在高温胁迫下成虫的取食量大于2龄若虫,与高温影响西花蓟马繁殖力的生态数据相吻合(热激处理西花蓟马亲代2龄若虫,其成虫寿命低于热激处理成虫,F1、F2代若虫数和成虫数低于热激处理成虫)。因此,在西花蓟马若虫遭受高温胁迫时,其适合度和体内小分子物质的积累受到的影响大于成虫期,在进行生物化学防治时可以着重考虑若虫期的闷棚和施药。
4 结论
极端高温处理对西花蓟马生殖适应性有很大的影响,从生态角度上来看,45℃高温2 h连续2 d处理会导致西花蓟马的各个指标明显下降,各虫态的存活率降低、雌成虫寿命缩短、后代种群数量波动以及性比的降低,整个种群的生长发育受到影响,甚至F2代种群的规模也受到影响;另外高温胁迫也会影响西花蓟马体内海藻糖和山梨醇含量,若虫阶段的高温处理对西花蓟马生态和生理的影响比成虫阶段明显。而且,热激亲代虫态之后对其后代有持续性的影响,并随代数的增加影响逐渐减小。
西花蓟马具有个体小、隐蔽性危害、繁殖快等特点,农药防治易产生抗药性,而且会对环境造成污染;而高温闷棚技术无污染、低成本、易操作,45—46℃闷棚2 h两次对寄主植物并无太大影响,且能在短时间内在一定程度上控制种群快速增长,是生产实践中温室防治该害虫的一项值得推广应用的技术措施。
References
[1] HALLMAN G J, DENLINGER D L. Introduction: temperature sensitivity and integrated pest management//HALLMAN G J,DENLINGER D L. Temperature Sensitivity in Insects and Application in Integrated Pest Management. Boulder, CO: Westview Press, 1998:1-5.
[2] BALE J S, HAYWARD S A L. Insect overwintering in a changing climate. The Journal of Experimental Biology, 2010, 213: 980-994.
[3] FIELDS P G. The control of stored-product insects and mites with extreme temperatures. Journal of Stored Products Research, 1992,28(2): 89-118.
[4] MOURIER H, POULSEN K P. Control of insects and mites in grain using a high temperature/short time (HTST) technique. Journal of Stored Products Research, 2000, 36: 309-318.
[5] DENLINGER D L, YOCUM G D. Physiology of heat sensitivity// HALLMAN G J, DENLINGER D L. Temperature Sensitivity in Insects and Application in Integrated Pest Management. Boulder, CO:Westview Press, 1998: 11-18.
[6] RINEHART J R, YOCUM G D, DENLINGER D L. Thermotolerance and rapid cold hardening ameliorate the negative effects of brief exposures to high or low temperatures on fecundity in the flesh fly,Sarcophaga crassipalpis. Physiological Entomology, 2000, 25:330-336.
[7] GULLAN P J, CRANSTON P S. The Insects: An Outline of Entomology. 3rd ed. Davis, USA: Blackwell Publishing Ltd., 2005.
[8] 戴秀玉, 程苹, 周坚, 江慧修. 海藻糖的生理功能、分子生物学研究及应用前景. 微生物学通报, 1995, 22(2): 102-103. DAI X Y, CHENG P, ZHOU J, JIANG H X. Physiological function,molecular biology and applications of trehalose. Microbiology Bulletin, 1995, 22(2): 102-103. (in Chinese)
[9] 聂凌鸿, 宁正祥. 海藻糖的生物保护作用. 生命的化学, 2001,21(3): 206-209. NIE L H, NING Z X. Biological protective function of the trehalose. Chemistry of Life, 2001, 21(3): 206-209. (in Chinese)
[10] CROWE J, CROWE L, CHAPMAN D. Preservation of membranes in anhydrobiotic organisms: The role of trehalose. Science, 1984,223(4637): 701-703.
[11] SALVUCCI M E, HENDRIX D L, WOLFE G R. Effect of high temperature on the metabolic processes affecting sorbitol synthesis in the silverleaf whitefly, Bemisia argentifolii. Journal of Insect Physiology, 1999, 45(1): 21-27.
[12] SALVUCCI M E, STECHER D S, HENNEBERRY T J. Heat shock proteins in whiteflies, an insect that accumulates sorbitol in response to heat stress. Journal of Thermal Biology, 2000, 25: 363-371.
[13] HENDRIX D L, SALVUCCI M E. Polyol metabolism in homopterans at high temperatures: accumulation of mannitol in aphids (Aphididae:Homoptera) and sorbitol in whiteflies (Aleyrodidae: Homoptera). Comparative Biochemistry and Physiology, A, 1998, 120(3): 487-494.
[14] KIRK W D J, TERRY L I. The spread of the western flower thrips Frankliniella occidentalis (Pergande). Agricultural and Forest Entomology, 2003, 5: 301-310.
[15] CHILDERS C C, ACHORS D S. Thrips feeding and oviposition injuries to economic plants, subsequent damage and host response to infestation//PARKER B L, SKINNER M, LEWIS T. Thrips Biology and Management. New York and London: Plenum Press, 1995: 31-50.
[16] 周永丰, 唐峻岭. 高温对南美斑潜蝇的致死作用. 昆虫知识, 2003,40(4): 372-373. ZHOU Y F, TANG J L. Lethal effect of high temperature on the leafminer fly, Liriomyza huidobrensis in a greenhouse. Entomological Knowledge, 2003, 40(4): 372-373. (in Chinese)
[17] 杜尧. 高温模式对麦蚜实验种群影响的生态机制研究[D]. 北京:中国农业科学院, 2007. DU Y. Ecological mechanism of effects of high temperature patterns on laboratory population of cereal aphid[D]. Beijing: Chinese Academy of Agricultural Sciences, 2007. (in Chinese)
[18] YODER J A, CHAMBERS M J, TANK J L, KEENEY G D. High temperature effects on water loss and survival examining the hardiness of female adults of the spider beetles, Mezium affine and Gibbium aequinoetiale. Journal of Insect Science, 2009, 9: Article 68.
[19] CHOWN S L, NICHOLSON S W. Insect Physiological Ecology:Mechanisms and Patterns. New York: Oxford Press, 2004.
[20] ROBERTSON R M. Modulation of neural circuit operation by prior environmental stress. Integrative and Comparative Biology, 2004,44(1): 21-27.
[21] CHOWN S L, TERBLANCHE J S. Physiological diversity in insects:Ecological and evolutionary contexts. Advances in Insect Physiology,2006, 33: 50-152.
[22] RINEHART J R, YOCUM G D, DENLINGER D L. Thermotolerance and rapid cold hardening ameliorate the negative effects of brief exposures to high or low temperatures on fecundity in the flesh fly,Sarcophaga crassipalpis. Physiological Entomology, 2000, 25:330-336.
[23] DROST Y C, VAN LENTEREN J C, VAN ROERMUND H J W. Life-history parameters of Bemisia tabaci (Hemiptera: Aleyrodidae) in relation to temperature and host plant: a selective review. Bulletin of Entomological Research, 1998, 88(3): 219-229.
[24] 刘芸, 阮传清, 刘波, 朱育菁. 温度对小菜蛾成虫繁殖和寿命的影响. 中国农学通报, 2013, 29(12): 190-193. LIU Y, RUAN C Q, LIU B, ZHU Y J. Effects of temperature on oviposition and longevity of adult diamondback moth (Plutella xylostella L.). Chinese Agricultural Science Bulletin, 2013, 29(12):190-193. (in Chinese)
[25] WANG J C, ZHANG B, WANG J P, LI H G, WANG S F, SUN L J,ZHENG C Y. Effects of heat stress on survival of Frankliniella occidentalis (Thysanptera: Thripidae) and Thrips tabaci (Thysanoptera:Thripidae). Journal of Economic Entomology, 2014, 107(4): 1426-1433.
[26] MIRONIDIS G K, SAVOPOULOU-SOULTANI M. Effects of heat shock on survival and reproduction of Helicoverpa armigera (Lepidoptera: Noctuidae) adults. Journal of Thermal Biology, 2010,35: 59-69.
[27] 朱绍光, 李照会, 万方浩. 短时高温暴露对Q型烟粉虱存活和生殖适应性的影响. 昆虫知识, 2010, 47(6): 1141-1144. ZHU S G, LI Z H, WAN F H. Effects of brief exposure to high temperature on survival and reproductive adaptation of Bemisia tabaci Q-biotype. Chinese Bulletin of Entomology, 2010, 47(6): 1141-1144. (in Chinese)
[28] 崔旭红, 谢明, 万方浩. 短时高温暴露对B型烟粉虱和温室白粉虱存活以及生殖适应性的影响. 中国农业科学, 2008, 41(2): 424-430. CUI X H, XIE M, WAN F H. Effects of brief exposure to high temperature on survival and fecundity of two whitefly species: Bemisia tabaci B-biotype and Trialeurodes vaporariorum (Homoptera:Aleyrodidae). Scientia Agricultura Sinica, 2008, 41(2): 424-430. (in Chinese)
[29] MA C S, HAU B, POEHLING B H. Effects of pattern and timing of high temperature exposure on reproduction of the rose grain aphid,Metopolophium dirhodum. Entomologia Experimentalis et Applicata,2004, 110: 65-71.
[30] MAHROOF R, ZHU K Y, SUBRAMANYAM B. Changes in expression of heat shock proteins in Tribolium castaneum (Coleoptera:Tenebrionidae) in relation to developmental stage, exposure time, and temperature. Annals of the Entomological Society of America, 2005,98(1): 100-107.
[31] CUI X, WAN F H, XIE M, LIU T X. Effects of heat shock on survival and reproduction of two whitefly species, Trialeurodes vaporariorum and Bemisia tabaci biotype B. Journal of Insect Science , 2008, 8(24):Article 24.
[32] SCOTT M, BERRIGAN D, HOFFMANN A A. Costs and benefits of acclimation to elevated temperature in Trichogramma carverae. Entomologia Experimentalis et Applicata, 1997, 85: 211-219.
[33] 赵鑫, 傅建炜, 万方浩, 郭建英, 王进军. 短时高温暴露对莲草直胸跳甲生殖特性的影响. 昆虫学报, 2009, 52(10): 1110-1114. ZHAO X, FU J W, WAN F H, GUO J Y, WANG J J. Effect of brief high temperature exposure on reproduction characteristics of Agasicles hygrophila (Coleoptera: Chrysomelidae). Acta Entomologica Sinica,2009, 52(10): 1110-1114. (in Chinese)
[34] ENKEGAARD A. Encarsia formosa parasitizing the Poinsettia-strain of the cotton whitefly, Bemisia tabaci, on Poinsettia: bionomics in relation to temperature. Entomologia Experimentalis et Applicata,1993, 69(3): 251-261.
[35] CHOWN S L, SORENSEN J G, TERBLANCHE J S. Water loss in insects: An environmental change perspective. Journal of Insect Physiology, 2011, 57(8): 1070-1084.
(责任编辑 岳梅)
Effects of Extreme High Temperature on Survival Rate,Reproduction, Trehalose and Sorbitol of Frankliniella occidentalis
JIANG Shan1, LI Shuai1, ZHANG Bin1, LI Hong-gang1,2, WAN Fang-hao1,3, ZHENG Chang-ying1
(1Key Laboratory for Insect Ecology of Shandong Province, College of Agronomy and Plant Protection, Qingdao Agricultural University, Qingdao 266109, Shandong;2Plant Protection Station of Shandong Province, Jinan 250100;3Key Laboratory for Biology of Plant Diseases and Insect Pests, Institute of Plant Protection,Chinese Academy of Agricultural Sciences, Beijing 100193)
Abstract:【Objective】The western flower thrips (Frankliniella occidentalis) is an important invasive and quarantine pest in China which created massive economic losses in vegetables and flowers. The objective of this study is to explore the influence of extreme high temperature (EHT) on survival rate, fecundity and content of trehalose and sorbital of F. occidentalis, and to provide a basis for the control of F. occidentalis. 【Method】After 2nd nymphs and adults exposed to 45℃ for 2 h twice (24 h interval under variable temperatures 22℃ (4 h)-25℃ (8 h)-28℃ (4 h)-25℃ (8 h) between two heat treatments), the survival rate, female adult longevity, offspring population dynamics, sex ratio and content of trehalose and sorbital were detected and analyzed. 【Result】In comparison with the control, the survival rate of each stage was less than 50% (0 for 3rd and 4th nymph, 41.38% for female adults,5% for 1st nymphs and 21.36% for 2nd nymphs), parental and offspring female adult longevity and fecundity significantly reduced (P<0.05), the content of trehalose in 2nd nymphs and adults significantly declined (P<0.05), and the content of sorbital in 2nd nymphs and female adults significantly increased after heat-shocked on parental 2nd nymphs and female adults (P<0.05). Meanwhile, higher female adult longevity and fecundity, lower content of trehalose, higher content of sorbital in F. occidentalis sufferred from twice 45℃ for 2 h heat shock on parental adults was expressed more than those in F. occidentalis sufferred from heat-shock on parental 2nd nymphs. Interestingly, the influence of twice 45℃ for 2 h heat shock not only occurred on parental generation but subsequent generations (F1and F2generations), and the trend of F1and F2generations was the same as the parental generation.【Conclusion】Twice 45℃ for 2 h exposes on parental F. occidentalis significantly affected the development, reproduction and physiology of present and offspring generations. The changes of trehalose and sorbital content had a correlation with the population dynamics of F. occidentalis.
Key words:extreme high temperature; Frankliniella occidentalis; fecundity; trehalose; sorbitol
收稿日期:2016-01-22;接受日期:2016-04-07
基金项目:国家自然科学基金(31372033)、山东省现代农业产业技术体系(SDAIT-02-021-11)、“泰山学者”建设工程专项
