渗透压、pH、葡萄糖及离子溶液对夏牙鲆精子激活及运动特征的影响
2016-07-11王学颖徐世宏刘清华
王学颖,徐世宏,刘清华,李 军
渗透压、pH、葡萄糖及离子溶液对夏牙鲆精子激活及运动特征的影响
王学颖1,2,徐世宏1,刘清华1,李军1
(1.中国科学院 海洋研究所 实验海洋生物学重点实验室,山东 青岛 266071; 2.中国科学院大学,北京100049)
摘要:作者通过渗透压计分别测定各溶液的渗透压值,通过CASA精子分析系统,测定精子运动参数,分析、比较了渗透压、pH、葡萄糖及离子溶液对夏牙鲆(Paralichthys dentatus)精子激活及运动特征的影响。结果表明: 夏牙鲆精子激活的渗透压范围为581~1260 mosm/kg; 在特定的渗透压范围内(单位为mosm/kg),A组(581~650),B组(762~877),C组(931~1060),D组(1117~1260)中,与NaCl和KCl溶液相比较,葡萄糖溶液可以显著提高夏牙鲆精子激活后的运动率; 在相对高渗条件下(1091~1180),经CaCl2400、EGTA400和无Ca2+人工海水激活的夏牙鲆精子运动率存在显著差异; 且夏牙鲆精子最适的激活pH范围是7~7.5。综上,激活剂的渗透压决定了夏牙鲆精子能否激活并显著影响了激活后精子的运动率,同时葡萄糖、外源Ca2+及pH均在一定程度上影响了精子的运动率。
关键词:夏牙鲆(Paralichthys dentatus); 精子; 渗透压; pH; 运动率
[Foundation: National Natural Science Foundation(No.31572602,No.31472264); Modern Agro-industry Technology Research System(No.nycytx-50); Marine Economy Innovative Development Project(No.12PYY001SF08); The Innovation Key Program of the Chinese Academy of Sciences(No.KSCX2-EW-B-3); Chinese Academy of Science and Technology Service Network Planning(No.KFJ-EW-STS-060); National Infrastructure of Fishery Germplasm Resource ]
夏牙鲆(Paralichthys dentatus)隶属于硬骨鱼纲(Osteichthys)、鲽形目(Peuronetiformes)、鲽亚目(Plenronectoides)、鲆科(Bothidae)、牙鲆亚科(Paralichthyinae)、牙鲆属(Paralichthys),学名大西洋牙鲆,犬齿牙鲆。主要分布于北美洲大西洋沿岸,因其肉质细嫩,营养丰富,生长快,且耐高温,所以具有较高的经济价值[1]。
鱼类精子的活力不仅与自身质量有关,而且与渗透压、pH及离子等环境因子密切相关[2-6]。体外受精的鱼类,精子在精浆中(等压等渗条件)是静止不动的。在淡水鱼类中,淡水(相对低渗)可使精子激活,如斑马鱼(Danio rerio)[2]和玛瑙石脂鲤(Brycon opalinus)[3]等,而在海水鱼类中,海水(相对高渗)才能使精子激活。鲷科(Sparidae)鱼类中的研究表明,水通道蛋白在渗透压启动精子激活过程中起到了重要作用[4]。此外,在鲑科(Salmonidae)鱼类及鲟科(Acipenseridae)鱼类中[5-6],K+在精子激活过程中起到了关键作用,精浆中高浓度的 K+抑制精子的运动,环境中 K+浓度的降低使 K+通过特定的膜通道外流,引起细胞膜超极化,从而使精子激活。有关鲱鱼(Clupeidae)的研究则发现,其精子的激活呈现趋化性,需要卵释放一种精子激活多肽(HSAPS)[7]。有关精子激活的研究,在人、鼠等哺乳动物中相对较多,且较成熟,继通过膜片钳技术发现精子激活时内部的钙电流直观表现之后,又发现了Catsper这一特有的精子钙通道[8],且在近两年相继证明了该通道在介导孕酮信号受精时的巨大作用[9-10]。在欧洲鳗鲡(Anguilla anguilla)上的最新研究表明[11],精子激活后,细胞内的Ca2+和K+浓度升高,而细胞内pH逐渐降低。但是关于海水鲆鲽鱼类的精子激活相关研究却鲜有报道。
本试验拟通过研究渗透压、pH、葡萄糖及离子溶液等环境因子对夏牙鲆精子活力的影响,初步阐明影响鲆鲽鱼类精子激活的决定因素,以期为海水鱼类精子的激活机制提供参考,有助于优化种质保存及育苗生产,同时也将有益于鱼类精子生物学和繁殖生物学特性的深入研究。
1 材料与方法
1.1实验材料
实验所用夏牙鲆精液取自山东东方海洋科技股份有限公司繁殖季节的亲鱼(2012年4月)。采用腹部挤压法获得若干亲鱼的精液,分别进行镜检,将活力>于 80%的个体精液选出,预混,进行后续试验。
1.2不同离子及非离子溶液的配置
配置 3种单一组分溶液: NaCl、KCl和葡萄糖,浓度分别为 50、100、150、300、400、500、600、800、1 000 mmol/L,共计 9个梯度(表1)。
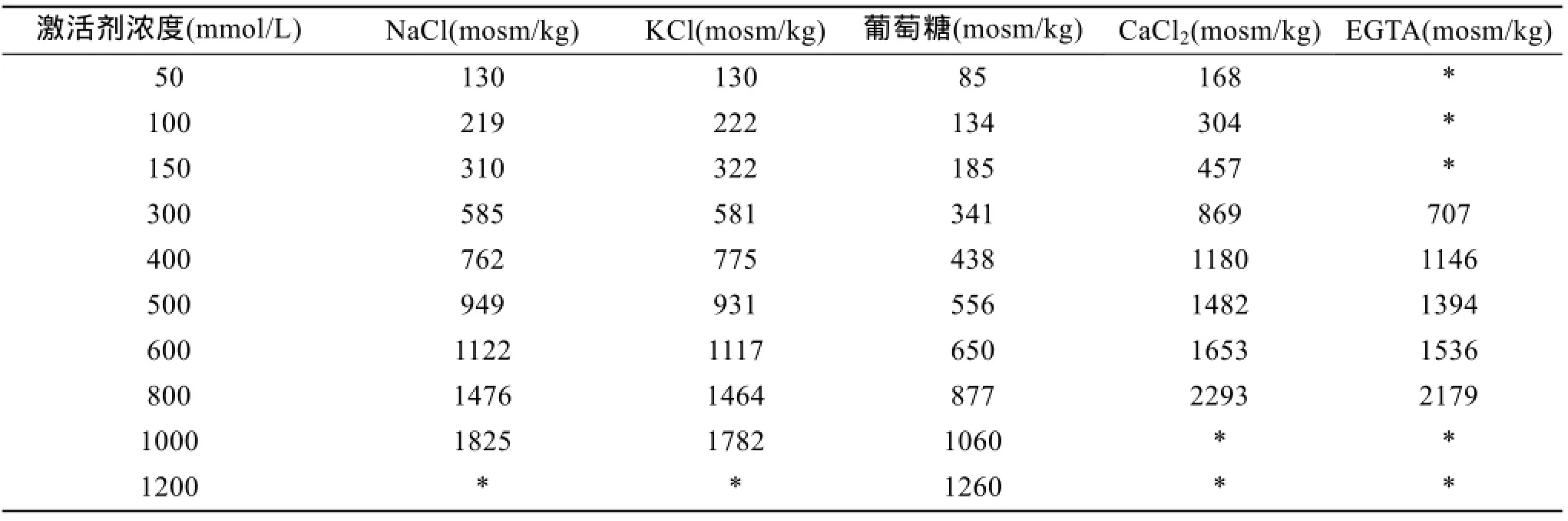
表1 不同溶液的渗透压(mosm/kg)Tab.1 The osmolality of the solutions of different concentrations
同时设无Ca2+/K+/Mg2+/HCO3-的4种单一离子缺陷型人工海水(人工海水配方参考张莲蕾[12])、天然海水等溶液组。所用药品均为国药分析纯、超纯水配制。
不同pH组天然海水的pH值分别为6.0、6.5、7.0、7.5、8.0、8.5、9.0(分别用0.01 mol/L HCl溶液或0.01 mol/L NaOH溶液进行pH调整)。
1.3CASA活力检测
分别用1.2中的溶液作用于夏牙鲆精子,初步筛选出精子可以激活的溶液浓度和渗透压范围,然后再精细测定在可激活渗透压范围下的精子运动参数。通过计算机辅助精子分析系统(computer-assisted sperm analysis,CASA),0~300 s内,每隔30 s测定采集一次精子运动参数。每次测量5~6个重复,每个重复检测 3个视野。分析、比较不同溶液对夏牙鲆精子激活及运动特征的影响。
1.4渗透压测定
通过渗透压计对所配置的不同溶液进行渗透压测定(表 2)。渗透压计型号: Osmolality—mosm/kg,The Fiske Micro—Osmometer Model 210。
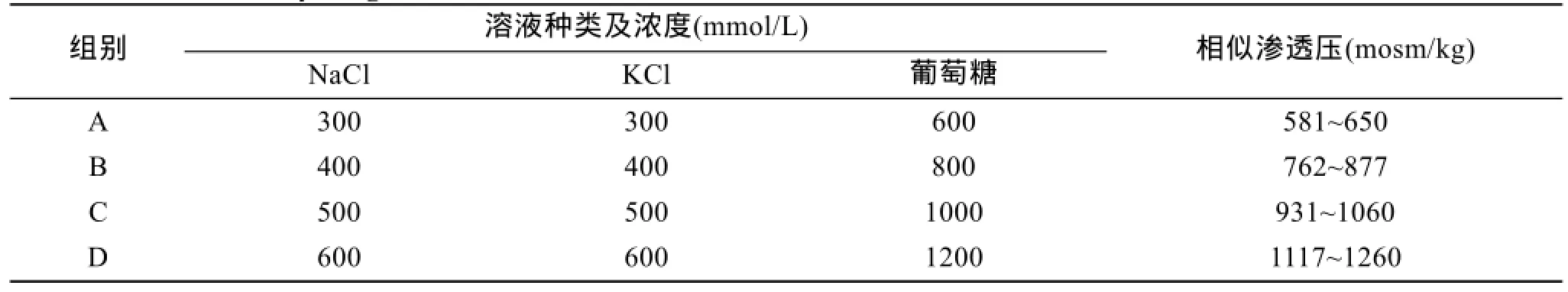
表2 12种不同浓度溶液的渗透压范围Tab.2 The osmolality range of the solutions of different concentrations
当单一组分溶液: NaCl和 KCl溶液的浓度是300 mmol/L,葡萄糖溶液的浓度为600 mmol/L时(3种溶液渗透压相似),简写为 NaCl300-KCl300-葡萄糖600,并列标记为A组,其他依次类推。
激活剂浓度为 NaCl300-KCl300-葡萄糖 600、NaCl400-KCl400-葡萄糖800、NaCl500-KCl500-葡萄糖1000-和NaCl600-KCl600-葡萄糖1200分别标记为A/B/C/D 4组,单位为mmol/L。 各组中每种溶液(单一组分)的渗透压值相似。
CaCl2溶液浓度为400 mmol/L时简写为CaCl2400(1180 mosm/kg),EGTA的溶液浓度为400 mmol/L时简写为EGTA400(1146 mosm/kg)与无Ca2+人工海水渗透压(1091 mosm/kg)相似。比较在相似渗透压下,外源Ca2+对夏牙鲆精子激活的影响。
此外,天然海水渗透压为939,人工海水为1131,人工海水无K+为954,人工海水无Mg2+为1029,人工海水无HCO3-为1114,单位为mosm/kg。
1.5数据结果统计分析
精子活力通过精子分析系统(CASA)采集。利用SPSS 18对数据结果进行显著性检验,P<0.05 表示具有显著性差异。描述性统计量用平均值±标准差表示。
2 结果与分析
2.1渗透压对夏牙鲆精子激活和运动特征的影响
2.1.1夏牙鲆精子激活 1 s时,不同渗透压下的运动率
当NaCl和KCl离子溶液浓度在300~600 mmol/L,葡萄糖溶液的浓度在600~1 200 mmol/L时,均可将夏牙鲆精子激活,也就是渗透压<581或者>1 260 mosm/kg的不同离子溶液或者葡萄糖溶液,均不能将夏牙鲆精子激活(运动率为0)。夏牙鲆精子激活的渗透压范围为581~1 260 mosm/kg,运动率可达35.27%±11.61 %~85.25%±9.16%。在激活启动,即激活1 s时,激活范围内的相似渗透压下,A组(581~650),B组(762~877),C组(931~1 060),D组(1 117~1 260)4组,每组3种溶液,共12种溶液(表1),通过比较发现,NaCl和葡萄糖对于夏牙鲆精子的激活明显优于 KCl,且随着渗透压增大,显著性增强(图1)。
2.1.2夏牙鲆精子激活30 s时,不同渗透压下的运动率情况
通过 CASA精子辅助分析系统对精子的运动率进行检测,由于瞬间激活时即激活 1 s时运动过快,捕捉不够精确,作者认为取激活后30 s时更能代表激活的一个稳定状态,所采集到的数据更加具有说服力。
研究结果表明: 在30 s时,在相似的渗透压下,A,B,C,D 组,NaCl、KCl、葡萄糖三者比较,葡萄糖对夏牙鲆激活及运动特征的影响优势非常显著(图2)。A组,在相对低渗条件下,葡萄糖作用下的精子运动
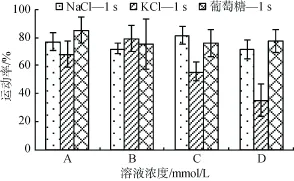
图1 不同渗透压下NaCl,KCl及葡萄糖处理组的精子运动率(激活1s)Fig.1 Sperm motility in NaCl,KCl and glucose solutions under different osmolality(1 s after activationed)
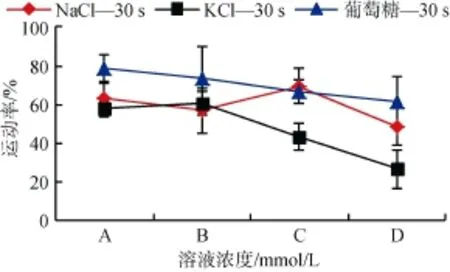
图2 不同渗透压下NaCl、KCl及葡萄糖处理组的精子运动率(激活30 s)Fig.2 Sperm motility in NaCl,KCl and glucose solutions under different osmolality(30 s after activationed)
率可以达到78.86%±6.70%,NaCl作用下为62.64%± 8.61%,KCl作用下仅为57.62%±4.04%。D组,在相对高渗条件下,葡萄糖作用下的运动率可以达到
78.86%±6.70%,NaCl 作用下为 48.58%±9.44%,而
KCl作用下仅为26.35%±10.04%,差异显著。
2.1.3夏牙鲆精子激活 300s 时,不同渗透压下的运动率
在激活300 s以后,葡萄糖溶液激活后的精子运动率显著高于NaCl、KCl,优势非常明显,且随着渗透压的增加,优势愈加显著。A组中,NaCl300-KCl300-葡萄糖600 mmol/L,渗透压为581~650 mosm/kg,运动率为 6.85%±1.61%~29.91%±5.53%; D组中,NaCl600-KCl600-葡萄糖 1 200 mmol/L,渗透压为 1 117~1 260 mosm/kg,运动率为4.16%±0.75%~18.31%± 0.22%(图3)。
2.2pH 对夏牙鲆精子激活和运动特征的影响
pH6~9范围内,在激活30 s时,pH7.5的天然海水作用下,精子运动率最高,为 69.65%±6.52%,pH8.5的天然海水作用下,运动率最低,为 41.43%± 2.99%。激活后30、60、90 s时,在pH为7及7.5天然海水作用下,运动率显著高于其他pH的作用。在180~300 s内,不同pH的天然海水对运动率的影响差异不显著。夏牙鲆精子的最适激活pH为7~7.5,且对pH的变化较敏感(图4)。
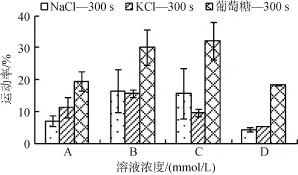
图3 不同渗透压下NaCl,KCl及葡萄糖处理组的精子运动率(激活300 s)Fig.3 Sperm motility in NaCl,KCl,and glucose solutions under different osmolality(300 s after activationed)
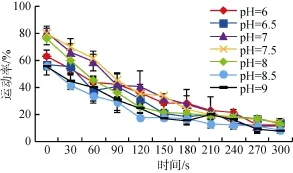
图4 pH对精子活力的影响(激活0~300 s)Fig.4 Effects of pH on sperm motility(0-300 s after activationed)
2.3离子对夏牙鲆精子激活和运动特征的影响
2.3.1天然海水、人工海水、无Ca2+/K+/Mg2+/HCO3-的人工海水激活作用下,运动率在 0~300 s内的变化
激活后的1、90、180 s时,在天然海水作用下,夏牙鲆精子激活后运动率均显著高于其他单一离子缺陷型人工海水及全人工海水。在激活后0~300 s内,人工海水无 Ca2+作用下,夏牙鲆精子的运动率均显著低于天然海水,但与其他溶液的作用相比较(无Mg2+人工海水除外),运动率均无显著性差异。由此说明,相对于天然海水,人工海水中的 Ca2+,K+,HCO3-在精子激活中很重要,而 Mg2+对运动率的影响不显著(图5)。
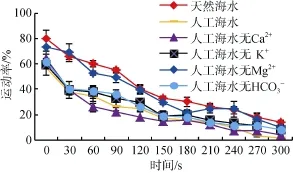
图5 天然海水、人工海水及无Ca2+/K+/Mg2+/HCO3−人工海水对精子活力的影响(激活0~300 s)Fig.5 Effects of natural seawater,artificial seawater and artificial seawater without Ca2+/K+/Mg2+/HCO3−- on sperm motility(0-300 s after activationed)
2.3.2相似渗透压下,CaCl2400/ EGTA400/无Ca2+人工海水作用下精子的运动率变化
相似渗透压(1091~1180 mosm/kg)下,EGTA400,CaCl2400,无 Ca2+人工海水对夏牙鲆精子激活和运动特征的差异显著,在相对高渗条件下,外源 Ca2+在激活和运动过程中不但没有使运动率提高,反而降低。在CaCl2400作用 120 s后,精子运动率仅为5%左右(图6)。
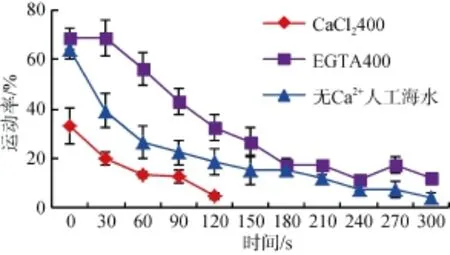
图6 CaCl2400、EGTA400和无Ca2+人工海水对精子活力的影响(激活0~300 s)Fig.6 Effects of CaCl2400,EGTA400 and artificial seawater without Ca2+on sperm motility(0-300 s after activationed)
3 讨论
3.1相似渗透压下,不同浓度的NaCl、KCl和葡萄糖溶液对精子活力的影响
大部分硬骨鱼类的精子在精巢的等渗环境下是静止不动的。精子的激活发生在排放到外界环境以后,淡水鱼的精子是排放到低渗的溶液中,而海水鱼的精子是排放到高渗的溶液中启动激活的。然而,不同的离子溶液及葡萄糖溶液对于鱼类精子激活及运动特征的影响具有种的特异性。本研究表明,在相似渗透压下,与NaCl和KCl相比,葡萄糖可以显著提高激活后的运动率; 且随着渗透压增大,葡萄糖的优势愈加明显。葡萄糖在淡水鱼类如中华鲟(Acipenser sinensis)[13],和凹目白鲑(Coregonus autumnalis)[14],精子激活和运动的作用显著,可以显著延长运动时间和寿命。Gardiner[15]认为,体外受精鱼类的精子具有三羧酸循环代谢的能力,能够通过氧化作用对细胞外源性葡萄糖加以利用,以此来补偿自身运动过程中所消耗的部分能量。然而,Bondarenko[16]的研究表明,渗透压相似,在葡萄糖溶液作用下,美洲红点鲑鱼(Salvelinus fontinalis)精子运动率显著低于Na+溶液,细胞内外的Na+交换对于精子激活起着非常重要的调控作用。不同离子或者葡萄糖溶液对鱼类精子激活的作用具有显著差异,具体的激活机制也可能存在种的差异性,还有待进一步研究。此外,Mannowetz[17]对小鼠的研究表明,葡萄糖对精子激活早期是pH依赖性的,并对精子震动频率具有重要的影响。
3.2不同pH对精子活力的影响
大多数鱼类精浆pH偏碱性,精子在中性或中性偏碱性的溶液中活力较高。在本实验中,研究结果表明pH在6~9范围内,30、60、90 s时,pH为7~7.5时,夏牙鲆精子激活和运动特征最佳。淡水鱼类翘嘴红鲌(Erythroculter ilishaeformis)最适合的精子运动的pH在8.5[18]; 人工精浆中培养金鳟(Oncorhynchus mykiss)伪雄鱼精子,在提高 pH后其活力显著提高,寿命亦延长[19]; 长鳍篮子鱼(Siganus canaliculatus)和点篮子鱼(Siganus guttatus)最适pH为8[20],圆斑星鲽(Verasper variegatus)的最适pH范围为7~8[21],过酸性或过碱性的溶液都降低了精子活力。夏牙鲆精子激活的pH范围为中性偏碱性,与其他鱼种已有研究结果一致,且对 pH的变化较敏感。pH敏感性的变化对于鱼类精子最后的成熟与排放以及冷冻保存过程的抗冻性可能具有一定的影响。
3.3外源Ca2+对精子活力的影响
EGTA400、CaCl2400溶液、无Ca2+人工海水对于夏牙鲆精子激活和运动特征的影响差异显著。适当浓度的EGTA溶液及无Ca2+人工海水同样可以将夏牙鲆精子激活,且在0~300 s内,EGTA400溶液、无Ca2+人工海水比CaCl2400溶液作用下,精子运动率高,说明相似渗透压(可激活渗透压范围内相对较高时)下,外源Ca2+在夏牙鲆精子激活和运动过程中,不能使其运动率提高,但是可能对运动轨迹、直线运动速率、路径运动速率、曲线运动速率等运动参数具有一定的影响。鲤鱼是在不需要Ca2+的低渗环境中激活的,当激活时有 Ca2+存在,其精子运动轨迹是环形的,且很快停止运动,处于静息状态; 而Ca2+对虾虎和鲶鱼精子激活及运动过程与鲤鱼相比差别很大[22]。所以,外源Ca2+在不同的鱼种精子激活时所起的作用可能不同。在欧洲鳗鲡上的最新研究表明[11],精子激活后,细胞内的 Ca2+浓度增加。夏牙鲆精子头部一般含有2~5个线粒体,在激活过程中,精子内源性 Ca2+含量和状态变化目前还不是很清楚。
4 结论
本研究结果表明,渗透压是夏牙鲆精子激活的决定性因素; 在相似渗透压下,与NaCl和KCl相比,葡萄糖可以显著提高激活后的运动率; 而在较高的可激活渗透压条件下,外源 Ca2+使激活后的精子运动率降低; 夏牙鲆精子最适激活pH为7.0~7.5,且对pH的变化较为敏感。
参考文献:
[1]雷霁霖.海水鱼类养殖理论与技术[M].北京: 中国农业出版社,2005,482-484.Lei Jilin.Marine fish culture theory and technology[M].Beijing: China Agriculture Press,2005,482-484.
[2]Wilson-Leedy J G,Kanuga M K,Ingermann R L.Influence of osmolality and ions on the activation and characteristics of zebrafish sperm motility[J].Theriogenology,2009,71(7): 1054-1062.
[3]Orfao L H,Nascimento A F,Correa F M,et al.Extender composition,osmolality and cryoprotectant effects on the motility of sperm in the Brazilian endangered species Brycon opalinus(Characiformes)[J].Aquaculture,2011,311(1-4): 241-247.
[4]Zilli L,Schiavone R,Storelli C,et al.Molecular mechanisms determining sperm motility initiation in two sparids(Sparus aurata and Lithognathus mormyrus)[J].Biol Reprod,2008,79(2): 356-366.
[5]Baynes S M,Scott A P,Dawson A P.Rainbow trout,salmo gairanerii spermatozoa-effects of cations and PH on motility[J].J Fish Biol,1981,19(3): 259-267.
[6]Billard R.Effects of coelomic and seminal fluids and various saline diluents on the fertilizing ability of spermatozoa in the rainbow trout,Salmo gairdneri[J].J Reprod Fertil,1983,68(1): 77-84.
[7]Yanagimachi R,Cherr G N,Pillai M C,et al.Factors controlling sperm entry into the micropyles of salmonid and herring eggs[J].Dev Growth Differ,1992,34(4):447-461.
[8]Kirichok Y,Navarro B,Clapham D E.Whole-cell patch-clamp measurements of spermatozoa reveal an alkaline-activated Ca2+channel[J].Nature,2006,439(7077):737-740.
[9]Lishko P V,Botchkina I L,Kirichok Y.Progesterone activates the principal Ca2+channel of human sperm[J].Nature,2011,471(7338): 387-391.
[10]Strünker T,Goodwin N,Brenker C,et al.The CatSper channel mediates progesterone-induced Ca2+influx in human sperm[J].Nature,2011,471(7338): 382-386.
[11]Gallego V,Martínez-Pastor F,Mazzeo I,et al.Intracellular changes in Ca2+,K+and pH after sperm motility activation in the European eel(Anguilla anguilla): Preliminary results[J].Aquaculture,2014,418: 155-158.
[12]张莲蕾.真鲷胚胎超低温损伤机理研究[D].青岛:中国科学院海洋研究所,2009.Zhang Lianlei.Studies on cryoinjury mechanism in red seabream(Pagrus major)embryo cryopreservation[D].Qingdao: Institute of Oceanology,Chinese Academy of Sciences,2009.
[13]刘鉴毅,甘芳,危起伟,等.几种不同浓度的离子及单糖对中华鲟精子活力的影响[J].水生生物学报,2007,31(6): 849-854.Liu Jianyi,Gan Fang,Wei Qiwei,et al.Effects of different concentration of irons and monosaccharides on sperm motility of Chinese sturgeon(Acipenser sinensis)[J].Acta Hydro Biologica Sinica,2007,31(6): 849-854.
[14]李胜忠,郭焱,蔡林钢,等.Na+、葡萄糖、果糖对凹目白鲑精子活力的影响[J].动物学杂志,2005,40(4):82-85.Li Shengzhong,Guo Yan,Cai Lingang,et al.Effects of Na+,glucose and fructose on sperm mobility in Coregonus autumnalis[J].Chinese Journal of Zoology 2005,40(4): 82-85.
[15]Gardiner D M.Utlisation of extracellular glucose by spermatozoa of two viviparous fishes[J].Comp Biochem Phys A,1978,59(2): 165-168.
[16]Bondarenko O,Dzyuba B,Cosson J,et al.The role of Ca2+and Na+membrane transport in brook trout(Salvelinus fontinalis)spermatozoa motility[J].Fish Physiol Biochem,2014,40(5): 1417-1421.
[17]Mannowetz N,Wandernoth P M,Wennemuth G.Glucose is a pH-dependent motor for sperm beat frequency during early activation[J].Plos One,2012,7(7): 1-15.
[18]王芳,岳兴建,谢碧文,等.pH、葡萄糖及金属离子对翘嘴红鲌精子激活等级的影响[J].宜宾学院学报,2011,11(12): 81-84.Wang Fang,Yue Xingjian,Xie Biwen,et al.Effects of pH,glucose and metal ions on sperm activation level of Erythroculter ilishaeformis[J].Journal of Yibin University,2012,11(12): 81-84.
[19]徐革锋,李永发,王炳谦,等.不同 pH人工精浆对性逆转金鳟雄鱼精子活力的影响[J].上海水产大学学报,2008,17(6): 647-654.Xu Gefeng,Li Yongfa,Wang Bingqian,et al.Influence of different pHs artificial seminal plasmaon sperm motility of sex-reversed male golden rainbowtrout[J].Journal of Shanghai Fisher Ies University,2008,17(6):647-653.
[20]刘鉴毅,黄晓荣,章龙珍,等.盐度、温度和pH对2种篮子鱼精子活性的影响[J].海洋渔业,2014,36(6):523-528.Liu Jianyi,Huang Xiaorong,Zhang Longzhen,et al.Effects of salinity,temperature and pH on spermatozoa motility in two kinds of rabbitfish[J].Marine Fisheries,2014,36(6): 523-528.
[21]徐永江,王妍妍,陈学周,等.环境因子对圆斑星鲽精子活力的影响[J].渔业科学进展,2013,34(4): 21-26.Xu Yongjiang,Wang Yanyan,Chen Xuezhou,et al.Influence of environmental factors on sperm activity of verasper variegatus[J].Progress in Fishery Sciences,2013,34(4): 21-26.
[22]Morita M,Okuno M,Susilo E S,et al.Changes in sperm motility in response to osmolality/Ca2+in three Indonesian fresh water teleosts: Goby(Oxyeleotris marmorata),Java carp(Puntius javanicus),and catfish(Clarias batrachus)[J].Comp Biochem Phys A,2006,143(3): 361-367.
(本文编辑: 谭雪静)
Effects of osmolality,pH,glucose,and ion solutions on sperm motility of the summer flounder Paralichthys dentatus
WANG Xue-ying1,2,XU Shi-hong1,LIU Qing-hua1,LI Jun1
(1.Key Laboratory of Experimental Marine Biology,Institute of Oceanology,Chinese Academy of Sciences,Qingdao 266071,China; 2.University of Chinese Academy of Sciences,Beijing 100049,China)
Received: Mar.5,2015
Key words:Paralichthys dentatus; sperm; osmolality; pH; motility
Abstract:In the present study,we evaluated the effects of osmolality,pH,glucose,and ion solutions on the sperm motility of summer flounder(Paralichthys dentatus)using a computer-assisted sperm analysis system.According to the results,the moderate osmolality for sperm activation was 581-1260 mosm/kg under the osmolality ranges as follows: among group A(581-650 mosm/kg),B(762-877 mosm/kg),C(931-1060 mosm/kg),and D(1117-1180 mosm/kg).The glucose solution had an advantage over NaCl and KCl on sperm motility.Under high osmolality(1091-1180 mosm/kg),sperm motility significantly varied in EGTA400,CaCl2400,and artificial seawater without Ca2+.The optimum pH for the sperm activation of summer flounder was 7-7.5.In conclusion,the present study indicated that osmolality is the most pronounced factor influencing the sperm activation of summer flounder.Additionally,glucose,exogenous Ca2+,and pH influence sperm motility to different degrees.
中图分类号:Q256
文献标识码:A
文章编号:1000-3096(2016)03-0040-07
doi:10.11759//hykx20150305003
收稿日期:2015-03-05; 修回日期: 2015-04-03
基金项目:国家自然科学基金项目(31572602,31472264); 鲆鲽类产业技术体系(nycytx-50); 海洋药源生物种质资源库建设(12PYY001SF08);现代生态海洋农业科技创新(KSC2-EW-B-3); 中国科学院 STS项目(KFJ-EW-STS-060); 国家水产种质资源平台
作者简介:王学颖(1985-06),女,河北保定人,博士研究生,主要从事海水鱼类生殖细胞发育研究,E-mail: haiyangshengya@126.com; 李军,通信作者,研究员,E-mail: junli@qdio.ac.cn; 刘清华,通信作者,副研究员,E-mail: qinghualiu@qdio.ac.cn
