中耳胆脂瘤动物模型的建立及研究进展
2016-07-11王晓丽谢淑敏刘伟任基浩谢鼎华中南大学湘雅二医院耳鼻咽喉头颈外科中南大学耳科研究所长沙400中南大学湘雅医院耳鼻咽喉头颈外科长沙40008
王晓丽 谢淑敏 刘伟 任基浩 谢鼎华中南大学湘雅二医院耳鼻咽喉头颈外科,中南大学耳科研究所(长沙400)中南大学湘雅医院耳鼻咽喉头颈外科(长沙40008)
中耳胆脂瘤动物模型的建立及研究进展
王晓丽1谢淑敏2刘伟1任基浩1谢鼎华1
1中南大学湘雅二医院耳鼻咽喉头颈外科,中南大学耳科研究所(长沙410011)2中南大学湘雅医院耳鼻咽喉头颈外科(长沙410008)
【摘要】中耳胆脂瘤发病机理至今尚未明确,且目前尚无一种药物能够有效地治疗中耳胆脂瘤。动物模型是研究中耳胆脂瘤的发病机制及防治方法的重要工具。常见的胆脂瘤动物模型建立方法有外耳道结扎方法、咽鼓管封闭方法、中耳化学试剂注射模型、自体皮肤鼓室移植+绿脓杆菌注射模型和活体电穿孔基因转染法等,本文对上述5种胆脂瘤动物模型的建立方法与特征进行综述,以期为研究中耳胆脂瘤的发病机制(内陷囊袋学说、上皮移行学说、基底细胞层过度增生学说)及防治方法提供一个良好的实验参考。
【关键词】胆脂瘤;中耳;动物模型
Conflict of interest:The authors declare no conflict of interest with regard to this publication.
Foundation:National natural science foundation of China(NO:81400457)
中耳胆脂瘤(cholesteatoma of middle ear,本研究特指后天性胆脂瘤,参照《2012年中耳炎临床分类和手术分型指南》[1])是一种位于中耳乳突腔内的囊性结构,具有过度增殖性、迁移侵袭性、复发性等临床特征。该病病理特点主要表现为复层鳞状上皮侵入中耳腔内,形成囊袋,并异常增殖,从而导致过度角化的鳞状上皮脱落堆积,逐步扩展并累及周围组织与结构,可引起严重的骨质吸收破坏从而导致耳聋、前庭功能障碍、面神经麻痹及颅内外并发症,甚至威胁到患者的生命[2,3]。其发病机制尚不清楚,主要有四种假说:内陷囊袋学说、上皮移行学说、基底细胞层过度增生学说及化生学说[4,5]。目前尚无一种药物能够有效地治疗中耳胆脂瘤,手术切除仍然是临床上治疗该病的唯一选择,但其术后易复发且常需要多次手术的特点一直困扰着广大耳鼻咽喉科医生。因此,研究其发病机理以指导临床药物治疗,即经外耳道-鼓膜途径局部应用药物来预防与治疗中耳胆脂瘤,或作为术后防止其复发的辅助用药成为治疗该病的迫切任务。
动物模型在中耳胆脂瘤发病机制研究中具有重要价值[6,7]。常用的实验动物主要有蒙古沙鼠、长爪沙鼠、豚鼠、毛丝鼠及大鼠等。其中,沙鼠胆脂瘤模型的应用最为广泛,这是因为沙鼠是目前已知的除了人类外唯一可自发形成耳胆脂瘤的动物,且沙鼠具有与人类相似的中耳粘膜超微结构,其胆脂瘤的侵袭破坏方式亦与人类非常相似[3]。常见的胆脂瘤动物模型建立方法有外耳道结扎方法、咽鼓管封闭方法、中耳化学试剂注射模型、自体皮肤鼓室移植+绿脓杆菌注射模型和活体电穿孔基因转染法等,本文针对这些造模方法进行综述。
1 外耳道结扎方法
该方法常采用蒙古沙鼠或长爪沙鼠为造模动物,简单易行。Chole RA等[8]研究发现沙鼠随着年龄增长可自发形成耳胆脂瘤,其比率高达45.7%。沙鼠外耳道结扎具体步骤为[9]:选取2-6月大的蒙古沙鼠和长爪沙鼠,戊巴比妥(60mg/kg)腹腔内注射麻醉后,做耳后切口,用4-0丝线将外耳道结扎。结扎后定期观察中耳腔及鼓膜形态,结果发现在结扎后2个月时,所有结扎耳鼓膜外侧面均可观察到角蛋白碎屑堆积,部分鼓膜向鼓室内侧面移位;结扎后3个月时,所有受检耳均出现早期胆脂瘤;9个月时可观察到胆脂瘤增大进入听泡,16个月后大部分胆脂瘤充满听泡,部分甚至破坏颅底骨质进入颅中窝或颅后窝。细菌感染在胆脂瘤发生发展中起重要作用,为了研究细菌感染在沙鼠胆脂瘤发生发展中的作用,Chole RA等[10]将沙鼠双侧外耳道结扎造模,一侧耳作为实验组,结扎前先向外耳道内注入铜绿假单胞菌(P.aeruginosa,PA);对侧耳作为对照组,结扎前仅向外耳道内注入无菌PBS液。6周后,处死动物行显微CT扫描评估胆脂瘤体积大小及骨质破坏程度。该研究结果显示:实验组胆脂瘤(PA感染胆脂瘤)较对照组胆脂瘤(无PA感染胆脂瘤)生长速度显著增快,同时胆脂瘤体积及骨质破坏范围显著增大。值得注意的是,PA感染胆脂瘤造模所需时间大大缩短,仅需要6周,且造模成功率达到100%。此外,Chole RA等[9]利用该模型发现PA野生型菌株(可形成生物膜)和生物膜缺陷型菌株所形成胆脂瘤的侵袭破坏能力无明显差异。
为了研究外耳道结扎造模法胆脂瘤角质形成细胞的来源,即究竟是鼓膜来源还是外耳道来源,日本学者Yamamoto-Fukuda T等[12]设计了一种新的模型,即局部杂合模型(local hybrid ear model),通过原位PCR技术放大靶基因来观察细胞局部的基因复制情况,从而判断造模胆脂瘤上皮细胞的来源。该方法具体如下:实验组将公蒙古沙鼠的鼓膜松弛部完全移除,然后取母鼠相应位置的鼓膜移植到公鼠的鼓膜缺如处,然后结扎该组“杂合模型”鼠的外耳道;对照组直接结扎正常公鼠和母鼠外耳道,两组胆脂瘤的发生率均为100%。作者通过观察胆脂瘤细胞染色体是XY型或是XX型来分析细胞的来源,并采用原位PCR技术观察沙鼠X染色体相关的磷酸甘油酸激酶1(pgk-1)基因的表达。该研究发现:公鼠胆脂瘤上皮细胞核中观测到1个pgk-1位点,母鼠中有1个或者2个,而杂合耳模型组观测到的不只有1个位点的还有2个位点的,且其比例与母鼠的几乎相同。该研究结果表明:杂合鼠模型中所有胆脂瘤细胞都有XX染色体表达,有效证明了该模型中胆脂瘤上皮细胞来自鼓膜,而不是中耳上皮细胞或外耳道皮肤。
外耳道结扎造模法简单易行,造模成功率相对较高,该造模方法形成的胆脂瘤理论上为外耳道胆脂瘤,但因所形成的胆脂瘤细胞及生物学性质和人类胆脂瘤相似度较高,且研究发现胆脂瘤上皮细胞来自于鼓膜,并压迫鼓膜向鼓室内侧面移位,进而破坏听泡等结构,所以常被用于中耳胆脂瘤的实验研究。国外众多学者利用该模型对胆脂瘤的发病机制及治疗进行了深入研究。Park K等[13,14]应用该造模法成功建立沙鼠胆脂瘤模型,并检测细胞增殖标记物PCNA、CK13/16在胆脂瘤上皮中的表达情况,结果显示PCNA、CK13/16在胆脂瘤上皮中的表达显著增高,表明沙鼠胆脂瘤上皮细胞处于高度增殖状态。Park K等[14]在成功建立沙鼠双耳胆脂瘤模型基础上,实验组耳采用经耳道清除角质碎屑及外耳道灌注氧氟沙星滴耳液,对照组耳不做任何处理,然后检测两组胆脂瘤上皮细胞PCNA和CK13/16的表达,结果发现实验组胆脂瘤上皮细胞PCNA和CK13/16的表达较对照组明显减低,即实验组胆脂瘤的增殖能力受到抑制。Nageris BI等[15]通过外耳道结扎法建立蒙古沙鼠胆脂瘤模型,按照向外耳道所灌注的药物将动物分为3组:实验组1为维生素A灌注组;实验组2为Cortisporin灌注组(Cortisporin为一种滴耳剂,其主要成分为氢化可的松、新霉素和硫酸多粘菌素B);实验组3为无干预对照组。结扎后9个月时检测3组动物胆脂瘤形成情况并对胆脂瘤大小和破坏范围分级。结果发现3组动物胆脂瘤发生率分别为65%,60%,100%,其中实验组1和实验组3、实验组2和实验组3胆脂瘤发生率差异具有统计学意义。该实验结果表明经外耳道局部灌注药物(维生素A和Cortisporin)可以降低实验沙鼠胆脂瘤发生率。PLC-γ1是细胞增殖相关信号通路中的关键因子。Park K等[14]结扎蒙古沙鼠外耳道建立胆脂瘤模型,应用免疫组化法和Western Blot法检测胆脂瘤上皮、外耳道深部皮肤及耳后正常皮肤中PLC-γ1的表达量,结果发现胆脂瘤上皮中PLC-γ1表达显著增高。该实验表明PLC-γ1在实验沙鼠胆脂瘤上皮细胞过度增殖中发挥了重要作用。
2 咽鼓管封闭法
咽鼓管功能障碍引起鼓室内负压及鼓膜松弛部内陷囊袋形成,加之鼓膜和外耳道上皮因慢性炎症影响而丧失自洁能力,此种情况有利于胆脂瘤形成并侵入中耳腔,这是后天原发性胆脂瘤形成的理论基础。早在1986年,Wolfman DE和Chole RA[17]就通过电烧灼沙鼠鼻咽部封闭双侧咽鼓管咽口成功建立了沙鼠胆脂瘤模型。咽鼓管咽口封闭的具体步骤为:选取6-10周龄的蒙古沙鼠,耳显微镜检查所有沙鼠外耳道及鼓膜均正常,戊巴比妥钠(1.2μg/g)腹腔内注射实施麻醉,通过软腭中线插入电烧灼器头,分别左右旋转以接触鼻咽侧壁,烧灼封闭咽鼓管咽口(沙鼠咽鼓管咽口在硬腭与软腭交界处后方5mm左右)。结果发现:术后2周时,8只受检耳均出现中耳浆液渗出及不同程度鼓膜内陷;术后4周时,8只受检耳有4只出现中耳积液、内陷囊袋及胆脂瘤形成;术后8周时,8只受检耳有5只出现中耳积液,4只耳形成胆脂瘤,其中1只耳胆脂瘤完全充满鼓室;术后16周时,8只受检耳有6只形成胆脂瘤。
咽鼓管封闭造模法为后天原发性胆脂瘤的发生机制-内陷囊袋学说提供了实验依据,但其操作上相对较难,造模成功率也较外耳道结扎法低。Kim HJ等[18,19]通过电烧灼封闭沙鼠咽鼓管咽口建立沙鼠胆脂瘤模型,并动态观察了胆脂瘤形成和发展过程,将该过程分为四期:第一期,鼓膜松弛部和紧张部轻度内陷,部分可伴有中耳积液;第二期,鼓膜松弛部内陷囊袋形成伴有中耳积液,听骨链被囊袋部分包绕;第三期,内陷囊袋内角质蛋白堆积,胆脂瘤形成并伴有邻近骨质(听骨链和鼓室盾板)吸收;第四期,鼓膜被胆脂瘤压迫向内侧移位和鼓室内侧壁相贴,伴有显著骨质破坏。Wilmoth JG[20]电烧灼封闭沙鼠咽鼓管咽口,检测实验耳和对照耳鼓膜中炎症因子TNF-alpha和MMP的含量,结果发现TNF-alpha和MMP表达量随着胆脂瘤形成和发展过程不断增加,和上述分期呈现相关性,该实验表明炎症因子TNF-alpha和MMP在沙鼠胆脂瘤发生发展过程中可能起到了重要作用。
3 中耳化学试剂注射模型
该方法常采用豚鼠、大鼠、蒙古沙鼠和毛丝鼠等为造模动物,通过向动物中耳腔注入化学试剂引起炎症反应进而形成胆脂瘤。炎症刺激引起鼓膜与外耳道鳞状上皮经鼓膜穿孔处迁移侵入中耳腔是后天性中耳胆脂瘤发病机制中的“上皮移行学说”。实验研究证实丙二醇(propylene glycol,PG)和中耳腔粘膜接触后可引起显著的炎症反应[21],因此常被用于胆脂瘤动物模型建立。具体操作方法如下:选取体重400-680g的成年健康毛丝鼠,术前经耳显微镜及声导抗检查排除鼓膜穿孔及中耳感染等情况。盐酸氯胺酮(30mg/kg)肌注实施麻醉,在听泡表面做一个小切口,分离皮肤、皮下组织及骨膜,手术电钻在听泡表面钻开一个小孔进入听泡,可吸收线缝合切口。然后定期细针经骨质缺损区穿刺进入听泡,缓慢注入丙二醇。Vassalli L等[22]向毛丝鼠中耳腔注入不同浓度的丙二醇(10%,50%,90%),发现随着浓度增加,胆脂瘤发生率提高,浓度达到90%时胆脂瘤发生率可达到100%。
此外,学者们还常使用乳胶生物膜、胶原和滑石粉等外源性刺激物来建立中耳胆脂瘤模型。Massu⁃da和Oliveira等[23]向鼓膜穿孔的大鼠中耳腔置入天然乳胶生物膜,发现置入乳胶生物膜组大鼠的中耳腔存在显著的炎症反应,胆脂瘤形成率高达90%,且在光镜下可以观察到外耳道鳞状上皮向中耳腔迁移过程;而未放置乳胶生物膜组大鼠的中耳腔未见炎症反应及胆脂瘤形成。依据实验结果,Massuda和Oliveira认为乳胶生物膜作为一种刺激物可以引起大鼠中耳腔化脓性炎症,而炎症反应过程中所释放出来的细胞因子可以诱发外耳道鳞状上皮经鼓膜穿孔处迁移进入中耳腔,从而形成胆脂瘤。Hueb等[24]经穿孔鼓膜向毛丝鼠鼓室置入一种外源性刺激物-胶原可以诱发中耳胆脂瘤形成。胶原置入鼓室后约12周即被重吸收,此时胆脂瘤形成率仅20%,此后随着实验时间延长,胆脂瘤形成率不断增加,胶原置入鼓室后约22周时胆脂瘤的形成率达到了80%。据此,Hueb等认为外源性刺激物引起实验动物中耳胆脂瘤形成的根本原因是这些刺激物所导致的中耳腔持续的炎症反应。
中耳化学试剂注射造模法操作较简单,造模成功率相对较高,国外众多学者利用该模型对胆脂瘤的发病机制及治疗进行了深入研究。Antunes ML等[25]将浓度为100%的丙二醇注入豚鼠双侧听泡建立胆脂瘤模型,右侧外耳道局部灌注反式维甲酸溶液作为实验组,左侧外耳道局部灌注生理盐水作为对照组,6周后处死动物取颞骨行石蜡包埋切片,结果发现实验组耳胆脂瘤发生率为30%,而对照组胆脂瘤发生率高达75%,两者差异有显著统计学意义(P= 0.0104),该实验表明外耳道局部灌注反式维甲酸可有效抑制丙二醇诱导产生的胆脂瘤。Sennaroglu L等[26]将浓度为50%的丙二醇混合液(含有0.2ml丙二醇、0.1ml庆大霉素和0.1ml强的松龙)注入大鼠左侧听泡作为实验组,同时将丙二醇混合液(含有0.2ml丙二醇、0.1ml庆大霉素和0.1ml生理盐水)注入大鼠右侧听泡作为对照组,2个月后处死动物取颞骨行石蜡包埋切片,观察两组中耳炎症反应情况及胆脂瘤发生率,结果发现实验组广泛性炎症发生率为18%,而对照组广泛性炎症发生率高达78%,两者差异具有显著统计学意义(P<0.001);实验组中耳胆脂瘤的发生率为0,而对照组中耳胆脂瘤的发生率为28%,,两者差异具有显著统计学意义(P<0.001)。该实验表明大鼠中耳腔局部使用强的松龙可以抑制丙二醇引起的中耳炎症反应,进而抑制胆脂瘤形成。
4 自体皮肤鼓室移植+绿脓杆菌注射模型
炎症刺激引起鼓膜与外耳道鳞状上皮经鼓膜穿孔处迁移侵入中耳腔是后天性中耳胆脂瘤发病机制中的“上皮移行学说”,即为该造模方法的理论基础。研究表明:约85%的中耳胆脂瘤可以培养出细菌生长,其中最常见的病原菌为绿脓杆菌[27]。Zhang等[28]通过向小鼠鼓室内移植自体外耳道皮肤并注射绿脓杆菌悬液成功建立了中耳胆脂瘤动物模型。具体操作方法如下:采用6-8周龄雌性C57BL/ 6(野生型)小鼠建模。模型建造前,所有实验小鼠需先行耳显微镜检查外耳道及鼓膜、耳CT扫描及ABR检查,均正常者入组。水合氯醛0.01ml/g体重麻醉后在耳显微镜下划开左侧鼓膜(前下象限),将鼓膜游离缘卷入鼓室,再取0.5×1×1mm大小的外耳道皮肤,经穿孔塞入鼓室,然后向鼓室注射5ul含菌量100CFU的绿脓杆菌悬液(ATCC19660菌株)。术后6周耳显微镜检查发现胆脂瘤造模成功率高达92%,HE切片证实小鼠听泡内形成了由复层鳞状上皮覆盖的囊腔,并存在明显的角化脱屑堆积。此外,炎症因子TNF-α,IL-1β和IL-6的表达也明显上调。
5 活体电穿孔基因转染法
活体电穿孔法(in vivo electroporation)是将外源基因通过电场作用,导入动物目标组织或器官的方法,该方法可有效地导入外源基因,效率很高。中耳胆脂瘤上皮组织中角质细胞生长因子(keratinocyte growth factor,KGF)的表达量较正常外耳道皮肤组织显著增高,其在胆脂瘤上皮高度增殖和角化中发挥了重要作用[29]。Yamamoto-Fukuda T等[30]应用活体电穿孔法向SD大鼠外耳道上皮细胞转染hKGF cDNA,免疫荧光法检测发现绝大部分外耳道上皮细胞及部分上皮下间质细胞可成功检测到标签蛋白Flag表达,Western blot法检测发现KGF蛋白表达量较对照组明显增高;与此同时,转染了hKGF cDNA的外耳道上皮细胞增殖能力显著增强,表现为细胞增殖核抗原PCNA表达显著增高。其中,在连续转染5次(每4天转染1次)造模完毕后1周行耳内镜检查及颞骨组织形态学观察,结果发现hKGF cDNA转染组中耳胆脂瘤发生率高达88.9%(9只耳中有8只耳可观察到中耳胆脂瘤形成),而对照组则无胆脂瘤形成,两组差异具有显著统计学意义(P=0.0006)。形态学检查发现该胆脂瘤模型是以鼓膜表面形成过度角化的复层鳞状上皮并过度增殖为特征,最终形成角蛋白珠(keratin pearl)。该模型类似于咽鼓管封闭法所形成的内陷囊袋胆脂瘤,随着角质蛋白堆积,胆脂瘤形成并侵入听泡伴有邻近骨质吸收。作者认为该模型中耳胆脂瘤的发生机制可能是:外耳道上皮间质细胞持续性释放KGF,KGF和鼓膜表面鳞状上皮细胞膜上的受体KGFR结合,从而激活细胞内相关信号通路,最终导致鼓膜表面鳞状上皮的过度增殖和角化。为了验证KGF在该胆脂瘤模型中的关键作用,Yamamoto-Fukuda T在完成SD大鼠外耳道上皮细胞hKGF cDNA转染后,采用2mM SU5402(选择性KGFR抑制剂)溶液滴耳,每天滴入50μl,连续用5天,结果发现SU5402溶液滴耳可以抑制胆脂瘤形成,5只耳无1例形成胆脂瘤[31]。该实验表明了KGF/ KGFR信号通路在中耳胆脂瘤发生发展中起到了关键性作用,阻断该通路可以抑制中耳胆脂瘤的发生,进而为经外耳道-鼓膜途径局部用药治疗胆脂瘤带来了希望。
综上,动物模型在中耳胆脂瘤发病机制研究中具有重要价值,常见的胆脂瘤动物模型建立方法有外耳道结扎方法、咽鼓管封闭方法、中耳化学试剂注射模型、自体皮肤鼓室移植+绿脓杆菌注射模型和活体电穿孔基因转染法等,对上述各种造模方法进行了综述和比较(表1),期待在今后的研究工作中找到更佳的中耳胆脂瘤动物模型,为研究中耳胆脂瘤的发病机制及防治方法提供一个良好的实验平台。
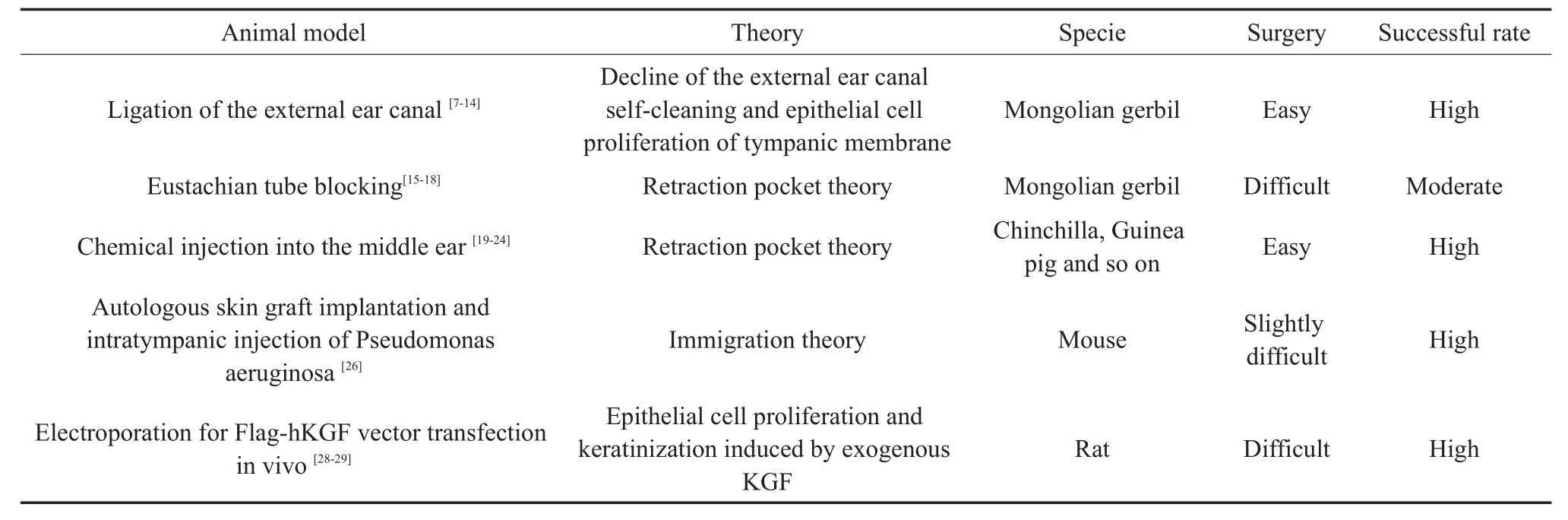
表1 胆脂瘤动物模型不同造模方法间的比较Table 1 Comparison among different cholesteatoma animal models
参考文献
1中华医学会耳鼻咽喉科学分会,中华耳鼻咽喉头颈外科杂志编委会.中耳炎临床分类和手术分型指南(2012).中华耳鼻咽喉头颈外科杂志,2013,48(1):5.Chinese Medical Association of Otorhinolaryngology,Editorial com⁃mittee of Chinese Journal of Otorhinolaryngology Head and Neck Surgery.The guidelines for clinical and surgical classification of oti⁃tis media(2012).Chinese Journal of Otorhinolaryngology Head and Neck Surgery,2013,48(1):5.
2Louw L.Acquired cholesteatoma pathogenesis:stepwise explana⁃tions.J Laryngol Otol.2010,124(6):587-593.
3Kuo CL.Etiopathogenesis of acquired cholesteatoma:prominent the⁃ories and recent advances in biomolecular research.Laryngo⁃scope.2015,125(1):234-240.
4廖军,林昶.中耳胆脂瘤的可能发病机制[J].中华耳科学,2015,13 (2):362-365.Jun Liao,Chang Lin.The possible pathogenesis of middle ear choles⁃teatoma[J].Chinese Journal of Otology,2015,13(2):362-365.
5韩正理,张官萍.中耳胆脂瘤发病机制及分子生物学基础[J].中华耳科学,2007,5(2):168-170.Zhengli Han,Guanping Zhang.The pathogenesis and moleculer biol⁃ogy basic of middle ear cholesteatoma[J].Chinese Journal of Otolo⁃gy,2007,5(2):168-170.
6Park MK,Lee BD.Development of animal models of otitis media.Korean J Audiol.2013,17(1):9-12.
7Yamamoto-Fukuda T,Takahashi H,Koji T.Animal models of mid⁃dle ear cholesteatoma.J Biomed Biotechnol.2011,2011:394241.
8Chole RA,Henry KR,McGinn MD.Cholesteatoma:spontaneous oc⁃currence in the Mongolian gerbil Meriones unguiculatis.Am J Otol.1981,2(3):204-210.
9McGinn MD,Chole RA,Henry KR.Cholesteatoma.Experimental in⁃duction in the Mongolian Gerbil,Meriones Unguiculaus.Acta Otolar⁃yngol.1982,93(1-2):61-67.
10Jung JY,Lee DH,Wang EW,et al.P.aeruginosa infection increas⁃es morbidity in experimental cholesteatomas.Laryngoscope.2011,121(11):2449-2454.
11Chole RA,Gagnon PM,Vogel JP.Inactivation of specific Pseudomo⁃nas aeruginosa biofilm factors does not alter virulence in infected cholesteatomas.Otol Neurotol.2014;35(9):1585-1591.
12Yamamoto-Fukuda T,Hishikawa Y,Shibata Y,et al.Pathogenesis of middle ear cholesteatoma:a new model of experimentally induced cholesteatoma in Mongolian gerbils.Am J Pathol.2010,176(6):2602-2606.
13Park K,Park HJ,Chun YM.Immunohistochemical study on prolifer⁃ative activity of experimental cholesteatoma.Eur Arch Otorhinolar⁃yngol.2001,258(3):101-105.
14Park K,Choung YH,Chun YM,et al.Reversibility of experimental cholesteatoma epithelium using Mongolian gerbils.Acta Otolaryn⁃ gol.2005,125(5):540-546.
15Nageris BI,Grushko I,Feinmesser R.Cholesteatoma prevention by local treatment with vitamin A.Otol Neurotol.2001,22(5):576-578.
16Park K,Chun YM,Lee DH.Expression of phospholipase C-gamma1 in experimental cholesteatoma using Mongolian gerbils.Acta Otolar⁃yngol.2001,121(4):477-480.
17Wolfman DE,Chole RA.Experimental retraction pocket cholesteato⁃ma.Ann Otol Rhinol Laryngol.1986,95(6 Pt 1):639-644.
18Kim HJ,Chole RA.Experimental models of aural cholesteatomas in Mongoliangerbils.Ann Otol Rhinol Laryngol.1998,107(2):129-134.
19Kim HJ,Tinling SP,Chole RA.Expression patterns of cytokeratins in retraction pocket cholesteatomas.Laryngoscope.2001,111(6):1032-1036.
20Wilmoth JG,Schultz GS,Antonelli PJ.Matrix metalloproteinases in a gerbil cholesteatoma model.Otolaryngol Head Neck Surg.2003,129(4):402-407.
21MasakiM,WrightCG,LeeDH,etal.Experimentalcholesteatoma.Epider⁃malingrowththroughtympanicmembranefollowingmiddleearapplica⁃tionofpropyleneglycol.ActaOtolaryngol.1989,108(1-2):113-121.
22Vassalli L,Harris DM,Gradini R,et al.Propylene glycol-induced cholesteatoma in chinchilla middle ears.Am J Otolaryngol.1988,9 (4):180-188.
23Massuda ET,Oliveira JA.A new experimental model of acquired cholesteatoma.Laryngoscope.2005,115(3):481-485.
24Hueb MM,Goycoolea MV,Muchow D,et al.In search of missing links in otology.III.Development of a new animal model for choles⁃teatoma[J].Laryn- goscope.1993,103(7):774-784.
25Antunes ML,Fukuda Y,Penido Nde O,et al.Effect of trans-retinoic acid in the inhibition of cholesteatoma in guinea pigs.Braz J Otorhi⁃nolaryngol.2008,74(1):53-60.
26Sennaroglu L,Ozkul A,Gedikoglu G,et al.Effect of intratympanic steroid application on the development of experimental cholesteato⁃ma.Laryngoscope.1998,108(4 Pt 1):543-547.
27Brook I.Aerobic and anaerobic bacteriology of cholesteatoma.La⁃ryngoscope.1981,91(2):250-253.
28Si Y,Chen YB,Chen QX,et al.Autologous meatal skin graft implan⁃tation and intratympanic injection of Pseudomonas aeruginosa:a new experimental mouse model of acquired middle ear cholesteato⁃ma.ORL J Otorhinolaryngol Relat Spec.2013,75(5):274-281.
29Yamamoto-Fukuda T,Aoki D,Hishikawa Y,et al.Possible involve⁃ment of keratinocyte growth factor and its receptor in enhanced epi⁃thelial-cell proliferation and acquired recurrence of middle-ear cho⁃lesteatoma.Lab Invest.2003,83(1):123-136.
30Yamamoto-Fukuda T,Akiyama N,Shibata Y,et al.In vivo over-ex⁃pression of KGF mimic human middle ear cholesteatoma.Eur Arch Otorhinolaryngol.2015,272(10):2689-2696.
31Yamamoto-Fukuda T,Akiyama N,Shibata Y,et al.KGFR as a pos⁃sible therapeutic target in middle ear cholesteatoma.Acta Otolaryn⁃gol.2014,134(11):1121-1127.
·疑难病例讨论·
Establishment of animal models of middle ear cholesteatoma and relevant research
WANG Xiaoli1,XIE Shumin2,LIU Wei1,REN Jihao1,XIE Dinghua1
1 Department of Otolaryngology Head and Neck Surgery,Xiangya Second Hospital,Central South University;Central South University Institute of Otology,Changsha,410011 2 Department of Otolaryngology-Head and Neck Surgery,The Xiangya Hospital of Central South University,Changsha,Hunan Province,China(410008).Corresponding author:LIU WeiEmail:lw-007@163.com
【Abstract】The pathogenesis of middle ear cholesteatoma remains unclear and there is no effective nonsurgical therapy.Animal models are very important for studying pathogenesis,prevention and treatment of middle ear cholesteatoma.Common animal models involve ligation of the external ear canal,eustachian tube blocking,chemical injection into the middle ear,autologous skin graft implantation plus intratympanic injection of Pseudomonas aeruginosa,and in vivo electroporation for Flag-hKGF vector transfection.In this paper,we reviewed current animal models of middle ear cholesteatoma in order to provide an experimental basis for further study of the pathogenesis(e.g.retraction pocket theory,immigration theory,basal cell hyperplasia theory),prevention and treatment of middle ear cholesteatoma.
【Key words】Cholesteatoma;Middle ear;Animal model
【中图分类号】R764.2
【文献标识码】A
【文章编号】1672-2922(2016)03-431-5
DOI:10.3969 / j.issn.1672-2922.2016.03.024
基金项目:国家自然科学基金(项目批准号:81400457)
作者简介:王晓丽,硕士研究生,住院医师,研究方向:耳科学
通讯作者:刘伟,Email:lw-007@163.com
收稿日期:(2015-10-10审核人:翟所强)
