梨小食心虫普通气味结合蛋白2(GmolGOBP2)cDNA的克隆与原核表达
2016-07-02张国辉仵均祥
张国辉,仵均祥
(1 西北农林科技大学 植物保护学院 植保资源与病虫害治理教育部重点实验室,应用昆虫学重点实验室,陕西 杨凌 712100;2 长江大学 农学院 昆虫研究所,湿地生态与农业利用教育部工程研究中心,湖北 荆州 434025)
梨小食心虫普通气味结合蛋白2(GmolGOBP2)cDNA的克隆与原核表达
张国辉1,2,仵均祥1
(1 西北农林科技大学 植物保护学院 植保资源与病虫害治理教育部重点实验室,应用昆虫学重点实验室,陕西 杨凌 712100;2 长江大学 农学院 昆虫研究所,湿地生态与农业利用教育部工程研究中心,湖北 荆州 434025)
[摘要]【目的】 克隆梨小食心虫(Grapholita molesta)普通气味结合蛋白2 (GmolGOBP2)的全长cDNA序列并进行原核表达, 为研究该蛋白在梨小食心虫化学感受系统中的作用奠定基础。【方法】 利用RT-PCR和RACE技术克隆GmolGOBP2的全长cDNA序列,并使用原核表达载体pET-32a在大肠杆菌BL21(DE3)中进行表达,用SDS-PAGE和Western blot检测其表达情况。【结果】 GmolGOBP2的cDNA全长序列为 637 bp(GenBank登录号:JN857940),开放性阅读框长度为483 bp,编码161个氨基酸残基,成熟蛋白分子质量为15.98 ku,等电点为4.85。GmolGOBP2预测蛋白的N末端具20个氨基酸残基组成的信号肽序列,并且氨基酸序列中具有6个保守半胱氨酸的典型气味结合蛋白家族标志。将GmolGOBP2编码序列重组到表达载体pET-32a中,转入大肠杆菌BL21(DE3)进行原核表达,SDS-PAGE和Western blot检测结果显示,梨小食心虫普通气味结合蛋白基因在大肠杆菌中成功地表达出分子质量约为32 ku的融合蛋白,与预测的融合蛋白分子质量大小一致。【结论】 克隆并原核表达了GmolGOBP2 的cDNA序列,可用于研究该蛋白分子结构及其在化学感受系统中的功能。
[关键词]梨小食心虫;普通气味结合蛋白2;分子克隆;原核表达
昆虫的嗅觉系统与其生存和繁殖息息相关[1]。昆虫通过嗅觉系统捕获周围环境中的化学信号,如各种气味信息素,并以此作为寻找配偶、食物、产卵场所以及躲避天敌和其他威胁的信息来源[2]。触角是昆虫重要的嗅觉器官,昆虫触角上化学感受器淋巴液中的气味结合蛋白(odorant binding proteins,OBPs),被认为是传递外界气味信息素并将其通过淋巴液送到嗅觉神经元,进而引发嗅觉神经冲动的主要蛋白[3]。气味结合蛋白首次发现于蛾类昆虫触角中[4],目前已在多种昆虫中发现有气味结合蛋白的存在[5-7]。在鳞翅目昆虫中气味结合蛋白分为2类,即信息素结合蛋白(pheromone-binding proteins,PBPs)和普通气味结合蛋白(general odorant binding proteins,GOBPs)[8-9]。信息素结合蛋白多在雄虫触角中特异性表达,与感受性信息素有关,其氨基酸序列在不同昆虫种间保守性较差[8]。普通气味结合蛋白分为普通气味结合蛋白1和普通气味结合蛋白2两类[8],其在昆虫两性触角中表达量基本相同,且氨基酸序列在不同昆虫种间保守性较高。到目前为止,普通气味结合蛋白的基因已从不同种昆虫中克隆出来[9-11]。起初由于普通气味结合蛋白能够结合寄主植物产生的气味分子,而被认为其用以识别寄主挥发物[12]。但后续的研究证实,多种异源表达的昆虫普通气味结合蛋白不仅能够结合寄主挥发物,而且对昆虫自身性信息素组分也表现出很强的结合能力[13-16]。因此,普通气味结合蛋白是昆虫化学通信过程中的重要功能蛋白。
梨小食心虫是一种严重危害桃、梨等多种果树的世界性重要害虫,在我国和其他许多国家或地区猖獗发生,对果业生产造成了严重危害。目前,生产上主要依靠果实套袋和化学防治,但前者费工、费时,且随劳动力价格的上涨已面临严峻的挑战;化学防治则因该虫钻蛀危害,隐蔽性强而杀虫效果较差。鉴于此,研发经济高效的梨小食心虫防治新技术已成为生产中亟待解决的问题。本研究利用RT-PCR和RACE技术克隆GmolGOBP2的全长cDNA序列,并使用原核表达载体pET-32a在大肠杆菌BL21(DE3)中进行表达,以期为深入研究梨小食心虫成虫嗅觉识别系统中GOBP2的功能以及研发梨小食心虫的新型行为调节剂奠定基础。
1材料与方法
1.1供试昆虫
梨小食心虫(Grapholitamolesta)由西北农林科技大学植物保护学院农业害虫综合治理研究室提供。幼虫期饲喂人工饲料[17],成虫期饲喂10%蜂蜜水。饲养条件:温度(24±0.5) ℃、相对湿度(70±10)%、光周期为15 h(光)/9 h(暗)。
1.2方法
1.2.1梨小食心虫触角总RNA的提取及cDNA的合成取梨小食心虫成虫触角50根,用液氮研磨后,按照RNApure Reagent(北京庄盟)说明书提取总RNA,参照PrimeScript RT Reagent Kit (TaKaRa) 说明书反转录获得第一链cDNA。
1.2.2梨小食心虫GOBP2 cDNA序列的克隆比较GenBank中已报道的昆虫GOBP的cDNA序列,设计扩增GOBP2同源片段的简并引物GOBP-c1和GOBP-c2(表1)。PCR反应条件:94 ℃ 3 min; 94 ℃ 30 s,50 ℃ 30 s,72 ℃ 60 s,35个循环;最后72 ℃延伸10 min。PCR产物经琼脂糖凝胶回收试剂盒(北京天根)纯化后,连入pGEM-T Easy载体(Promega),将阳性克隆送至南京金斯瑞生物科技有限公司测序。根据获得的梨小食心虫普通气味结合蛋白2基因片段设计5′和3′ RACE引物GOBP2-3′outer、GOBP2-3′inner和GOBP2-5′outer、GOBP2-5′inner(表1)。按照RACE试剂盒(TaKaRa)说明书扩增5′和3′端的cDNA。然后将5′和3′端的RCR产物割胶回收纯化,连入pGEM-T Easy载体,送样测序,将获得的片段进行拼接获得GOBP2的全长cDNA序列。
为了核实5′和3′的扩增片段源自同一基因,设计了1对特异性验证引物GOBP2-full1和GOBP2-full2(表1),PCR扩增产物经琼脂糖凝胶电泳检测后测序,并与拼接的GOBP2全长cDNA序列进行比较。
1.2.3序列分析使用在线工具BLAST(http://www.ncbi.nlm.nih.gov/BLAST)分析序列相似性,用在线软件SingalP(http://www.cbs.dtu.dk/services/SignalP/)进行信号肽预测;使用在线软件Expasy(http://www.expasy.ch/cgi-bin/pi_tool)进行蛋白基本理化特征鉴定。
1.2.4表达载体的构建根据梨小食心虫GOBP2的ORF序列设计1对去信号肽的特异性引物GOBP2-ex1和 GOBP2-ex2(表1),为了便于将目的基因亚克隆到表达载体上,在引物中设计了酶切位点(以下划线表示),其中在正向引物设计了BamHⅠ酶切位点,反向引物设计了Hind Ⅲ 酶切位点。PCR产物回收纯化后连入pGEM-T Easy 载体,蓝白斑筛选阳性转化子,将双酶切鉴定正确的转化子送样测序。将测序正确的重组质粒经BamHⅠ和Hind Ⅲ酶切,回收相应大小的片段。将回收的DNA片段与经同样双酶切的表达质粒pET-32a(+)混合,构建重组表达载体pET/GomlGOBP2,然后转化克隆菌株DH5α,提取质粒经PCR检测和双酶切鉴定后测序。测序正确的表达载体用于后续原核表达。
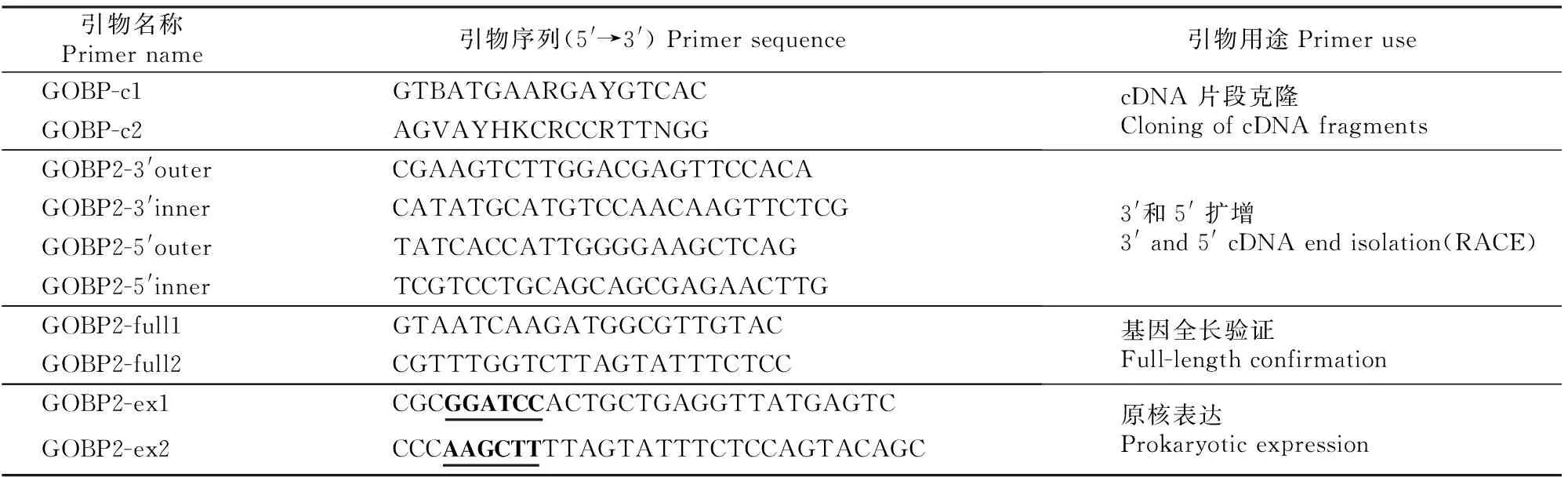
表 1 研究所用引物及其序列
1.2.5梨小食心虫GOBP2在原核细胞中的表达将测序正确的表达载体转化大肠杆菌BL21(DE3)感受态细胞,选取双酶切鉴定正确的阳性单克隆于4 mL LB培养基(含100 μg/mL 氨苄青霉素)中培养过夜后,然后按体积分数1% 接种量在37 ℃下继续培养,振荡培养至OD600达到0.6左右,加IPTG至终浓度为0.5 mmol/L,28 ℃、200 r/min继续诱导5 h。收集菌液,12 000 r/min离心5 min,去除上清。加入100 μL 1×SDS凝胶加样缓冲液后振荡悬浮菌体,煮沸10 min后电泳分析表达情况。
1.2.6融合蛋白可溶性检测将诱导后菌液超声波破碎,4 ℃、12 000 r/min离心10 min,分别收集上清和沉淀进行SDS-PAGE检测。
1.2.7Western blot检测首先将蛋白从SDS-PAGE胶上转移到PVDF膜上,然后用封闭液(TBST+5%脱脂奶粉)封闭过夜;接着与鼠抗6×His单抗室温反应1 h,用TBST洗膜5次;加入使用TBST稀释的辣根过氧化物酶标记的羊抗鼠二抗,室温反应1 h, 用TBST洗膜5次;最后将PVDF膜置于显色液中显色至条带清晰,将膜放入蒸馏水中终止显色,拍照。
2结果与分析
2.1梨小食心虫GOBP2的克隆与序列分析
以梨小食心虫触角cDNA第一链为模板,用简并引物进行PCR扩增,获得240 bpGOBP2片段。根据得到的基因片段,设计特异性引物,采用RACE 技术获得梨小食心虫GOBP2的全长cDNA序列。序列测定结果表明,该序列全长为636 bp,开放性阅读框长度为483 bp,编码161个氨基酸残基(图1)。该预测蛋白的N末端具20个氨基酸残基组成的信号肽序列,成熟蛋白预测分子质量为15.98 ku,等电点为4.85。该蛋白具有气味结合蛋白的典型特征,为酸性小分子蛋白,且氨基酸序列中含有6个保守半胱氨酸残基(图1)。为了核实5′和3′端的扩增片段源自于同一基因,设计了1对特异性引物(GOBP2-full1,GOBP2-full2)加以验证,经琼脂糖凝胶电泳检测到1条特异性条带(图2),测序发现其与拼接序列一致,从而证实5′和3′扩增片段源自同一基因。

图 1梨小食心虫GOBP2 cDNA及其推导的氨基酸序列
“*”表示终止子;下划线表示蛋白的信号肽序列;方框为6个保守的半胱氨酸
Fig.1cDNA sequence and deduced amino acid sequence of GmolGOBP2
The stop codon is shown with “*”;Signal peptide of GmolGOBP2 is underlined;Conservative Cys sites are indicated by boxes
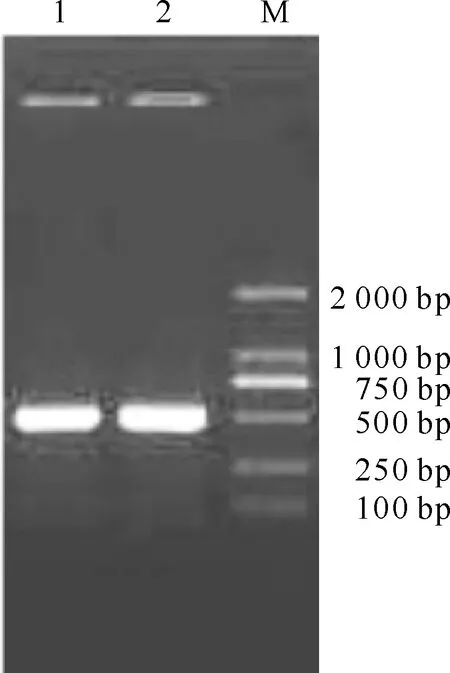
图 2 梨小食心虫GOBP2的PCR扩增
2.2梨小食心虫GOBP2在大肠杆菌中的表达
将构建成功的GmolGOBP2与硫氧还原蛋白(thioredoxin,Trx)及六聚组氨酸(6×His)的融合表达载体pET/GomlGOBP2转化工程菌BL21(ED3),经IPTG诱导后,SDS-PAGE电泳分析显示,产生了1条32 ku左右的特异性蛋白条带,IPTG诱导的含表达载体pET-32a(+)的BL21菌株在相应位置无条带产生,而是产生了22 ku左右的条带(图3)。
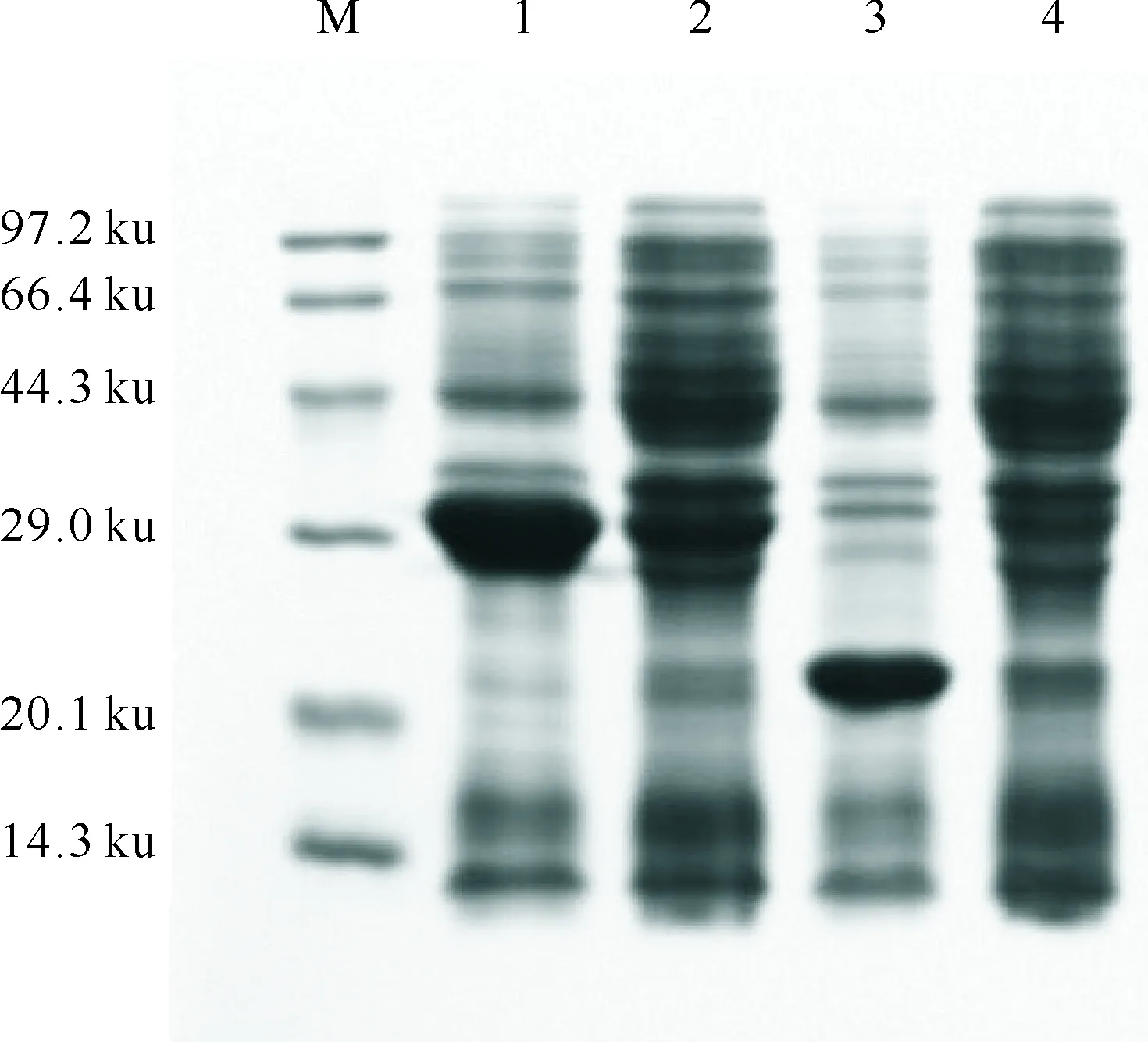
图 3 pET/GmolGOBP2表达产物的SDS-PAGE
融合蛋白可溶性的SDS-PAGE电泳检测表明,目的蛋白主要在包涵体中表达(图4)。以鼠抗6×His单抗为一抗、辣根过氧化物酶标记的羊抗鼠为二抗进行Western blot分析,结果表明,经IPTG诱导产生的32 ku的蛋白条带与6×His抗体发生很强的交叉反应,表明融合蛋白得到表达(图4)。
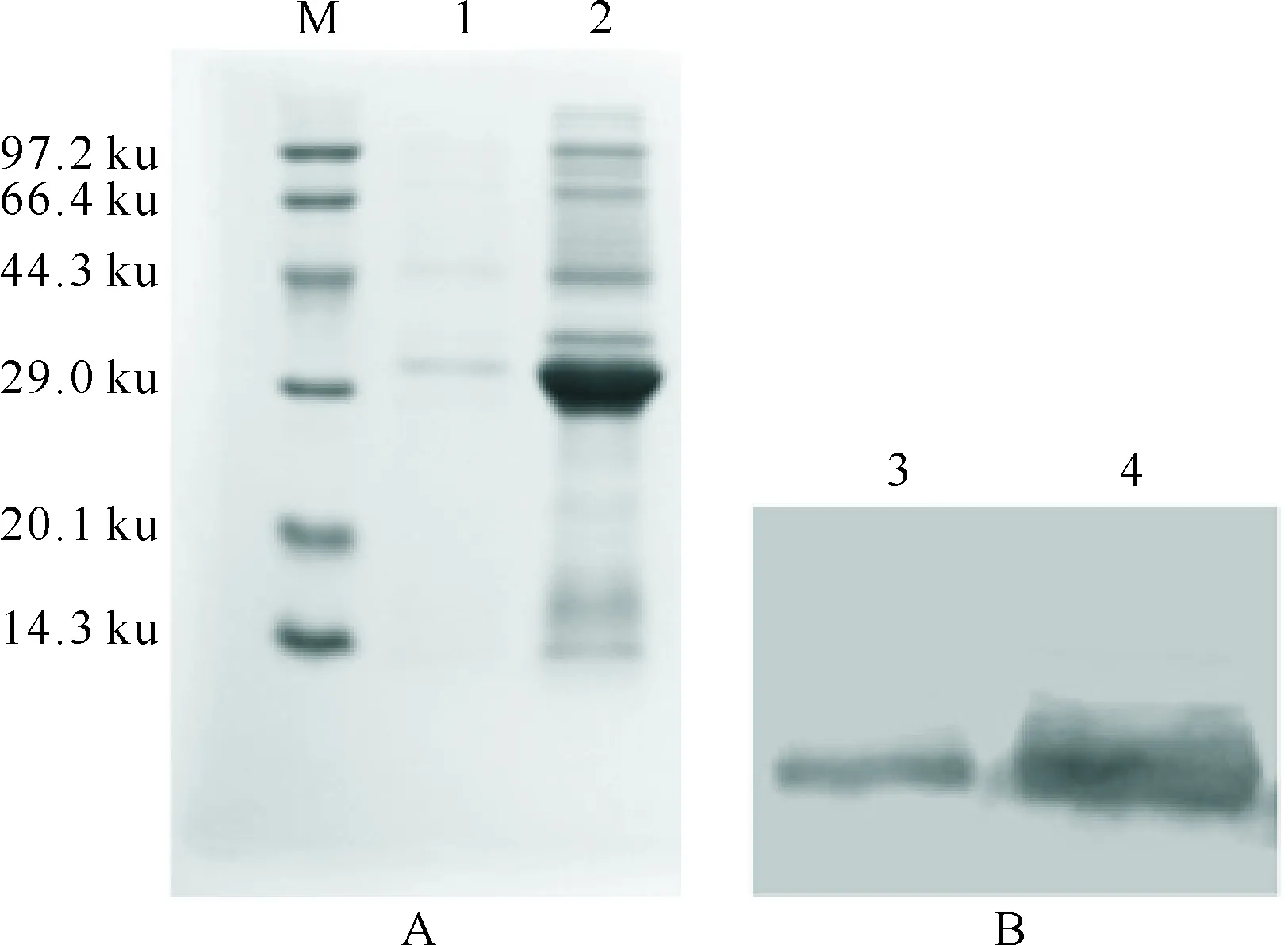
图 4 pET/GmolGOBP2融合蛋白的可溶性检测(A)及
3讨论
本研究克隆了编码梨小食心虫普通气味结合蛋白2的cDNA全长序列,即GmolGOBP2,其所推测的成熟蛋白氨基酸序列具备昆虫气味结合蛋白家族的典型标志:(1)具有酸性等电点的小分子量水溶性蛋白;(2)具有信号肽的分泌蛋白;(3)氨基酸序列中均含有6个保守半胱氨酸残基[18]。梨小食心虫普通气味结合蛋白基因的克隆为鳞翅目昆虫气味结合蛋白家族增添了新的成员,这为后续研究该目昆虫气味结合蛋白的进化关系及结构功能提供了新的参考依据。
梨小食心虫普通气味结合蛋白2所推导的氨基酸序列,可以为阐释该蛋白的生理功能提供一定的理论依据,但仅仅依靠对其氨基酸序列的分析,显然无法揭示其功能。在生物工程各项技术中,基因异源表达技术是用来分析基因功能的一项基础研究。因此,要了解梨小食心虫普通气味结合蛋白和化学感受蛋白基因的生理功能,就有必要对其进行异源表达。
昆虫能感受环境中的气味信息素,并依此作为寻偶、觅食及定位产卵场所的信息来源[2]。而昆虫感器中的气味结合蛋白与脂溶性的气味物质结合,是昆虫专一性识别外界气味信息物质的第一步生化反应[19],对于昆虫与外界进行信息交流具有重要意义。因此气味结合蛋白的研究已在多目昆虫中广泛开展,如鳞翅目[20]、双翅目[5]、直翅目[6]、鞘翅目[21]、等翅目[7]、膜翅目[22]和半翅目[23]等。本研究克隆了梨小食心虫GmolGOBP2,并将GmolGOBP2与硫氧还蛋白(thioredoxin,Trx)融合,在大肠杆菌BL21(DE3)中表达了带有6×His纯化标签的蛋白。Trx的存在提高了GmolGOBP2的表达量和可溶性,这为GmolGOBP2的大量表达以及研究该基因编码蛋白的空间结构和生理功能奠定了良好的基础。
[参考文献]
[1]Field L M,Pickett J A,Wadhams L J.Molecular studies in insect olfaction [J].Insect Mol Biol,2000,9:545-551.
[2]Schneider D.Insect olfaction:deciphering system for chemical messages [J].Science,1969,163:1031-1037.
[3]Krieger J,Breer H.Olfactory reception in invertebrates [J].Science,1999,286:720-723.
[4]Vogt R G,Riddiford L M.Pheromone binding and inactivation by moth antennae [J].Nature,1981,293:161-163.
[5]Ozaki M,Morisaki K,Idei W,et al.A putative lipophilic stimulant carrier protein commonly found in the taste and olfactory systems:a unique member of the pheromone-binding protein superfamily [J].European Journal of Biochemistry,1995,230:298-308.
[6]Ban L,Scaloni A,D′ambrosio C,et al.Biochemical characterization and bacterial expression of an odorant-binding protein fromLocustamigratoria[J].Cellular and Molecular Life Sciences,2003,60:390-400.
[7]Ishida Y,Chiang V P,Haverty M I,et al.Odorant-binding proteins from a primitive termite [J].Journal of Chemical Ecology,2002,28:1887-1893.
[8]Vogt R G,Prestwich G D,Lerner M R.Odorant-binding protein subfamilies associate with distinct classes of olfactory receptor neurons in insects [J].Journal of Neurobiology,1991, 22:74-84.
[9]Vogt R G,Robert R,Lerner M R.Molecular cloning and sequencing of general odorant-binding proteins GOBP1 and GOBP2 from the tobacco hawk mothManducasexta:comparisons with other insect OBPs and their signal peptides [J].Journal of Neurobiology,1991,17:2972-2984.
[10]Wang G R,Wu K M,Guo Y Y.Cloning,expression and immunocytochemical localization of a general odorant-binding protein gene fromHelicoverpaarmigera(Hübner) [J].Insect Biochemistry and Molecular Biology,2003,33:115-124.
[11]Calvello M,Brandazzaa A,Navarrinia A,et al.Expression of odorant-binding proteins and chemosensory proteins in someHymenoptera[J].Insect Biochemistry and Molecular Biology,2005,35:297-307.
[12]Priesner E.Progress in the analysis of pheromone receptor sy-stems [J].Annales De Zoologie Ecologie Animale,1979,11:533-546.
[13]Liu Z,Vidal D M,Syed Z,et al.Pheromone binding to general odorant-binding proteins from the navel orange worm [J].Journal of Chemical Ecology,2010,36(7):787-794.
[14]He X L,Tzotzos G,Woodcock C,et al.Binding of the general odorant binding protein ofBombyxmoriBmorGOBP2 to the moth sex pheromone components [J].Journal of Chemical Ecology,2010,36(12):1293-1305.
[15]Zhang S,Zhang Z,Wang H,et al.Molecular characterization,expression pattern,and ligand-binding property of three odorant binding protein genes fromDendrolimustabulaeformis[J].Journal of Chemical Ecology,2014,40(4):396-406.
[16]Liu N Y,Yang K,Liu Y,et al.Two general-odorant binding proteins inSpodopteralituraare differentially tuned to sex pheromones and plant odorants [J].Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology,2015,180:23-31.
[17]杜娟,郭建挺,张亚素,等.温度对梨小食心虫GrapholithamolestaBusck 生长发育及繁殖的影响 [J].西北农业学报,2009,18(6):314-318.
Du J,Guo J T,Zhang Y S,et al.Effect of temperature on development and reproduction ofGrapholithamolesta(Busck) (Lepidoptera:Tortricidae) [J].Acta Agriculturae Boreali-Occidentalis Sinica,2009,18(6):314-318.(in Chinese)
[18]Pelosi P,Zhou J J,Ban L P,et al.Soluble proteins in insect chemical communication [J].Cellular and Molecular Life Sciences,2006,63:1658-1676.
[19]Vogt R G,Rogers M E,Dicken J C,et al.Odorant binding protein diversity and distribution among the insect orders,as indicated by LAP,an OBP-related protein if the true bugLyguslineolaris(Hemiptera,Heteroptera) [J].Chem Senses,1999,24:481-195.
[20]Xiu W M,Dong S L.Molecular characterization of two pheromone binding proteins and quantitative analysis of their expression in the beet armyworm,SpodopteraexiguaHübner [J].Journal of Chemical Ecology,2007,33:947-961.
[21]Nagnan-Le Meillour P,Francois M C,Jacquin-Joly E.Identification and molecular cloning of putative odorant-binding proteins from the American palm weevil,RhynchophoruspalmarumL. [J].Journal of Chemical Ecology,2004,30:1213-1223.
[22]Lu D G,Li X R,Liu X X,et al.Identification and molecular cloning of putative odorant-binding proteins and chemosensory protein from the bethylid wasp,SclerodermaguaniXiao et Wu [J].Journal of Chemical Ecology,2007,33:1359-1375.
[23]Gu S H,Wang S P,Zhang X Y,et al.Identification and tissue distribution of odorant binding protein genes in the Lucerne plant bugAdelphocorislineolatus(Goeze) [J].Insect Biochemistry and Molecular Biology,2011,41:254-263.
Cloning and prokaryotic expression of general odorant binding protein 2 cDNA from oriental fruit moth,Grapholitamolesta
ZHANG Guo-hui1,2,WU Jun-xiang1
(1KeyLaboratoryofPlantProtectionResourcesandPestManagement,MinistryofEducation,KeyLaboratoryofAppliedEntomology,andCollegeofPlantProtection,NorthwestA&FUniversity,Yangling,Shaanxi712100,China;2EngineeringResearchCenterofEcologyandAgricultrualUseofWetland,MinistryofEducation,InstituteofEntomology,AgriculturalCollege,YangtzeUniversity,Jingzhou,Hubei434025,China)
Abstract:【Objective】 Cloning and prokaryotic expression of a novel cDNA encoding the general odorant binding protein 2 (GOBP2) from the oriental fruit moth Grapholita molesta was conducted.【Method】 The full-length cDNA encoding GOBP2 isolated from Grapholita molesta by reverse transcription-polymerase chain reaction (RT-PCR) and rapid amplification of cDNA ends-PCR (RACE-PCR) was named as GmolGOBP2.It was then constructed into the expression vector pET-32a and expressed in Escherichia coli BL21 (DE3).【Result】 The full length cDNA of GmolGOBP2 was 637 bp (GenBank accession no.JN857940),containing a 483 bp open reading frame with 161 amino acids.The deduced molecular weight (MW) was 15.98 ku and the PI was 4.85.Protein signature analysis indicated that the deduced GmolGOBP2 contained an N-terminal signal sequence of 20 amino acids.The GmolGOBP2 was then constructed into the expression vector pET-32a and expressed in Escherichia coli BL21 (DE3) after induction with IPTG.SDS-PAGE and Western blot analysis showed the molecular weight of the recombinant GmolGOBP2 was about 32 ku,in consistence with the predicted result.【Conclusion】 GmolGOBP2 was cloned and expressed in prokaryotic expression system,which was helpful for further studies on its molecular structure and function in the olfactory system.
Key words:Grapholita molesta;general odorant binding protein 2;molecular cloning;prokaryotic expression
DOI:网络出版时间:2016-05-0314:0510.13207/j.cnki.jnwafu.2016.06.016
[收稿日期]2014-11-07
[基金项目]国家自然科学基金项目(31501641,31272043);农业部公益性行业(农业)科研专项(201103024)
[作者简介]张国辉(1983-),男,河北邯郸人,讲师,博士,主要从事昆虫生态与害虫综合治理研究。
[通信作者]仵均祥(1961-),男,陕西凤翔人,教授,博士生导师,主要从事农业昆虫与害虫防治及植物检疫研究。
[中图分类号]S433.4;Q966
[文献标志码]A
[文章编号]1671-9387(2016)06-0111-05
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20160503.1405.032.html
E-mail:zhangguohuiji@163.com
E-mail:junxw@nwsuaf.edu.cn
